多肽HM-3对人非小细胞肺癌裸鼠移植瘤抑制作用研究
程昊冉,王佳艺,吴小东,郝静超,罗燕平,刘 晨,胡加亮,徐寒梅
(中国药科大学,多肽药物创制工程研究中心,江苏 南京 210009)
多肽HM-3对人非小细胞肺癌裸鼠移植瘤抑制作用研究
程昊冉,王佳艺,吴小东,郝静超,罗燕平,刘晨,胡加亮,徐寒梅
(中国药科大学,多肽药物创制工程研究中心,江苏 南京210009)
摘要:目的>检测HM-3类不同血管生成抑制剂治疗人非小细胞肺癌裸鼠移植瘤的药效学,考察血管生成抑制剂与肿瘤微环境的相互作用,为临床确定治疗方案提供参考和依据。方法建立人非小细胞肺癌A549的裸鼠移植瘤模型,以多西他赛(10 mg·kg-1)为阳性对照药物,评价了在肿瘤体积≥300 mm3给予有效、过高剂量HM-3和贝伐单抗对肿瘤生长的抑制作用。结果动物实验表明,肿瘤的体积≥300 mm3给药,阳性对照组多西他赛具有很好的抗肿瘤活性。G2多西他赛(10 mg·kg-1)组的瘤重抑瘤率为60.80%。G3 HM-3(3 mg·kg-1)组、G4 HM-3(48 mg·kg-1)组、G5 Avastin(5 mg·kg-1)组抑瘤效果不佳,瘤重抑瘤率分别为43.60%、-34.80%、44.40%。结论由于受肿瘤生长阶段、肿瘤微环境、作用靶点等影响,血管生成抑制剂HM-3有一定抑制肿瘤生长的效果,但效果不佳。HM-3抑瘤效果在(0~6 mg·kg-1)范围内存在剂量依赖关系。而HM-3(48 mg·kg-1)过高剂量对人非小细胞肺癌A549裸鼠移植瘤无抑制作用,表现促进作用。特殊量效关系提示临床使用血管抑制剂时应注意使用剂量。
关键词:多肽HM-3;非小细胞性肺癌;贝伐单抗;血管生成抑制剂;裸鼠移植瘤模型;肿瘤微环境;多西他赛
肺癌是世界范围内最常见的恶性肿瘤之一,且发病率和死亡率逐年增高。目前中国肺癌发病率也已跃居各种恶性肿瘤的首位[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌最常见的组织类型,占全部肺癌的75%~80%,且5年生存率仅为15%[2-3]。虽然化疗能显著延长患者生存时间,减轻患者症状,改善患者生存质量,但化疗药物能够引起严重的毒副反应,且有效率仅为14%~40%。因此寻找一种新型的治疗手段是目前研究NSCLC的热点。
HM-3是我们课题组自主设计合成的由18个氨基酸组成的新型高效血管生成抑制多肽,具有国家发明专利授权( 发明人: 徐寒梅,专利号:CN1699408)。HM-3能够阻断整合素αvβ3的信号通路,抑制VEGF表达,抑制内皮细胞迁移和新生血管生成,从而达到抑制肿瘤生长的效果。以整合素为靶点的抗肿瘤药物的研发已成为当前肿瘤研究的热点[4]。贝伐单抗(商品名Avastin)是美国Genentech开发的VEGF-A的人源化鼠单克隆抗体,通过抑制血管内皮生长因子(VEGF)的生物学功能发挥作用[5]。2006年,贝伐单抗被FDA批准与化药联合作为治疗非鳞状非小细胞肺癌的一线治疗药物[6]。多西他赛为半合成的紫杉醇类抗肿瘤药物,具有周期特异性。多西他赛是FDA批准的治疗非小细胞肺癌的一线和二线标准治疗药物。前期研究证明,HM-3对新生血管生成的抑制作用在一定范围内存在剂量依赖关系。随着药物浓度的增大,药效明显增加,超过范围量效关系不显著[7]。本文研究了影响HM-3类血管抑制剂类药物药效的因素,为血管抑制剂应用于临床提供指导。
1材料与仪器
1.1实验动物和细胞株
SPF级BALB/c裸小鼠,由常州卡文斯实验动物有限公司提供。实验动物质量合格证许可证号:SCXK(苏)2011-0003,合格证号:201400728。28~42 d日龄,体质量18~20 g;♂,每组动物数:每组6只,阴性对照组加倍。人非小细胞肺癌A549细胞由实验室保存,已在体外传代3~15代。所有动物实验均符合动物伦理委员会标准。
1.2主要药物与试剂
DMEM培养基(Life technologies公司);胰蛋白酶(Biosharp公司);胎牛血清(浙江天杭生物科技有限公司);青霉素、链霉素(Generay Biotech公司);HM-3(本课题组,批号:P140522);多西他赛(江苏恒瑞制药有限公司,批号:13062812);生理盐水(山东鲁抗辰欣药业有限公司,批号:1207117102 ); 苹果酸苏尼替尼(大连美仑生物技术有限公司,批号:50511);贝伐单抗注射液(Roche Pharma,批号:H0129B07)。
2方法
2.1A549人非小细胞肺癌细胞的培养
复苏A549细胞,用含10% FBS的DMEM培养基, 置于37 ℃,5% CO2培养箱内,饱和湿度培养。2 d传代1次。用倒置显微镜观察细胞呈贴壁生长,刚复苏的细胞生长略受影响,传代1~2次细胞状态逐渐恢复正常。
2.2A549人非小细胞肺癌细胞裸鼠皮下移植瘤模型的建立
将非小细胞肺癌A549细胞株进行传代培养,取对数生长期细胞,0.25%胰酶消化,含血清的培养基终止消化,机械吹打成单细胞悬液,离心,弃上清。用无血清培养基重悬细胞,细胞计数,将细胞悬液接种于右侧腋窝皮下。接种量为每只裸鼠5×106个细胞,每只接种 0.1 mL。密切观察裸鼠状态,5~7 d左右裸鼠皮下可触及出现白色结节,用游标卡尺测量裸鼠移植瘤直径,14~21 d后待移植瘤体积生长至300 mm3左右时,挑选生长状态良好且肿瘤大小均一性较好的荷瘤裸鼠47只,随机分成5组,实验组每组6只,阴性对照组11只。具体给药方案如Tab 1。给药期间,观察并记录裸鼠状态,测量裸鼠体重,用游标卡尺测量瘤体积大小,体重和瘤体积每隔1天测量1次。d 22时,用颈椎脱臼法处死裸鼠,剥离瘤块,称重并计算抑瘤率,并将瘤组织进行免疫组化染色。
2.3给药方案
随机分为G1阴性对照(生理盐水)、G2多西他赛(10 mg·kg-1)、G3 HM-3有效剂量(3 mg·kg-1)组、G4 HM-3过高剂量(48 mg·kg-1)组、G5 Avastin(5 mg·kg-1)组。给药方案如表所示(Tab 1)。

Tab 1 Dosage regimen
剂量设置:多西他赛(10 mg·kg-1)、贝伐单抗(5 mg·kg-1)剂量由临床上药物有效剂量通过人与小鼠剂量换算公式计算得来;HM-3为国家1.1类新药,现已进入一期临床。前期本课题组已探索HM-3的敏感瘤株和药物体内实验的安全有效范围,并探索了对超安全范围的促生长和促转移剂量。因此确定HM-3有效剂量(3 mg·kg-1)及 HM-3过高剂量(48 mg·kg-1)为给药组剂量[8]。
2.4肿瘤测量及疗效评价方法
2.4.1肿瘤体积及体积相对抑制率肿瘤体积(tumor volume,TV)的计算公式为:TV=1/2×a×b2,其中a、b分别表示肿瘤的长径和短径,即长和宽。根据测量的结果计算出相对肿瘤体积(relative tumor volume,RTV),计算公式为:RTV=Vt/V0。其中V0为分笼给药时(即d0)测量所得肿瘤体积,Vt为每1次测量时的肿瘤体积。抗肿瘤活性的评价指标为相对肿瘤增殖率T/C/%,计算公式如下:T/C/%=TRTV/CRTV×100%,TRTV:治疗组RTV;CRTV:阴性对照组RTV。根据《细胞毒类抗肿瘤药物非临床评价的技术指导原则》,评价标准为T/C>40%为无效;T/C≤40%,并经统计学处理与阴性对照组相比P<0.05为有效。
肿瘤体积抑制率/%=(阴性对照组平均体积-给药组平均体积)/阴性对照组平均体积×100%。每2 d测一次肿瘤体积,根据体积抑制率可动态观察各给药组的抑瘤效果。
2.4.2肿瘤瘤重及抑瘤率瘤重抑瘤率/%=(阴性对照组平均瘤重-给药组平均瘤重) /阴性对照组平均瘤重×100%。给药21 d后,治疗完成后,裸鼠手术剖瘤,肿瘤称重。计算瘤重抑瘤率。
2.4.3裸鼠体重和存活情况每2 d测1次裸鼠体重,详细观察并记录裸鼠体重变化情况和生长状态,旨在检测药物的毒副作用。
2.5免疫组化检测
给药完成后,脱椎处死裸鼠,剖瘤。每组取2~3个样本,所有瘤组织均经中性甲醛固定、脱水、常规石蜡包埋组织、切片、pH 6.0柠檬酸抗原修复缓冲液高温抗原修复、BSA封闭,一抗(CD31)4 ℃过夜,二抗37 ℃孵育、DAB显色、苏木精复染细胞核、常规梯度乙醇脱水,最后中性树胶脱水封片。显微镜镜检观察肿瘤组织中微血管密度(MVD)。微血管密度的计数:肿瘤组织中的微血管定位在血管内皮细胞的细胞膜和细胞质,呈棕黄色,阳性定位在血管内皮细胞的细胞膜和细胞质,根据Weidner法[9]进行MVD计数,首先在低倍镜(×100)下观察整张切片,选3个微血管数最多的区域即“热点”,肿瘤内硬化区及肿瘤交界处软组织内的微血管不计数对象,在每个区域中计数一个高倍镜(×40)下的微血管数,取其平均值作为此样本的MVD值。任何一个被染为棕黄色的阳性内皮细胞或内皮细胞簇与相邻的血管、肿瘤细胞或其他结缔组织界限分开清楚,都被认为是一个能够计数的微血管,管腔大于8个细胞或带有较厚肌层的血管不计数[10]。
2.6统计学处理

3结果
3.1肿瘤体积及体积相对抑制率
根据肿瘤体积变化情况看(Fig 1),治疗后7 d各组肿瘤体积开始不同程度的增长。肿瘤体积变化及体积抑制率见Fig 1A、1B,22 d剖瘤时所测的体积中,G1阴性组肿瘤体积为(2858.4±294.3) mm3; G2(多西他赛10 mg·kg-1)、G3(HM-3 3 mg·kg-1)、G4(HM-3 48 mg·kg-1)、G5(Avastin 5 mg·kg-1)的肿瘤体积分别为(1123.5 ±109.7)mm3、(1595.1±200.8)mm3、(3774.1±283.9)mm3、(1907.6±317.7)mm3。与阴性组相比,G2、G4组肿瘤体积差异有显著性(P<0.01);根据Fig 1B中的肿瘤体积动态抑制率变化看,G2组在7~21 d期间的抑瘤率比较明显,在给药后期尤其明显。
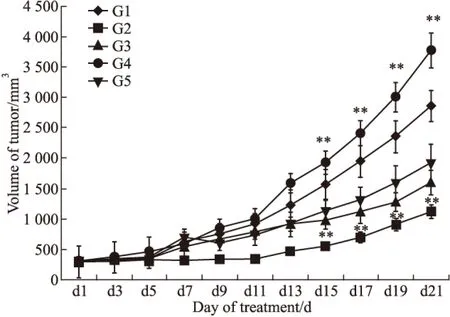
Fig 1A Tumor volume
G1:normal saline;G2:Docetaxel(10 mg·kg-1);G3:HM-3(3 mg·kg-1);G4:HM-3(48 mg·kg-1);G5:Avastin(5 mg·kg-1);**P<0.01vscontrol
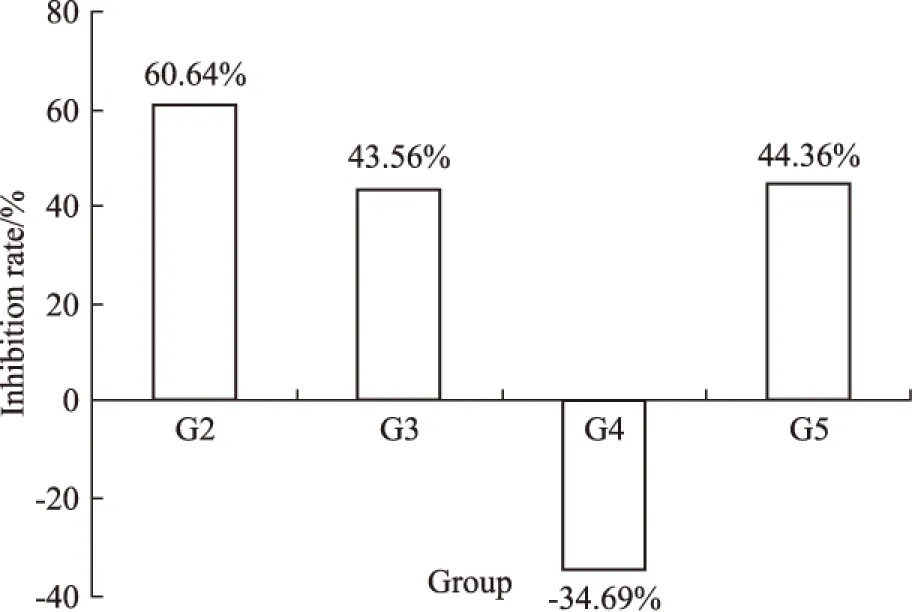
Fig 1B Inhibition rate on d 21 according to tumor volume
G1:Normal saline;G2:Docetaxel(10 mg·kg-1);G3:HM-3(3 mg·kg-1;G4:HM-3(48 mg·kg-1;G5:Avastin(5 mg·kg-1)
根据(Fig 2)的肿瘤体积相对增殖率变化看,G2(多西他赛10 mg·kg-1)组在7~21 d期间的T/C(%)值下降明显,在给药后期尤其明显。T/C(%)值为37.24%。T/C(%)≤40%,并经统计学处理与阴性对照组相比P<0.05。
3.2肿瘤瘤重及抑瘤率
G1阴性组瘤重为(2.50±0.12) g,多西他赛(10 mg·kg-1)组瘤重为(0.98±0.14)g,明显小于阴性组(P<0.01)。据瘤重计算出的抑瘤率见Tab 2,其中G2多西他赛(10 mg·kg-1)组的抑瘤率是60.80%,G3 HM-3(有效剂量)3 mg·kg-1和G4 HM-3(过高剂量)48 mg·kg-1抑瘤率分别是43.60%和-34.80%。 贝伐单抗(5 mg·kg-1)组的抑瘤率是44.40%。
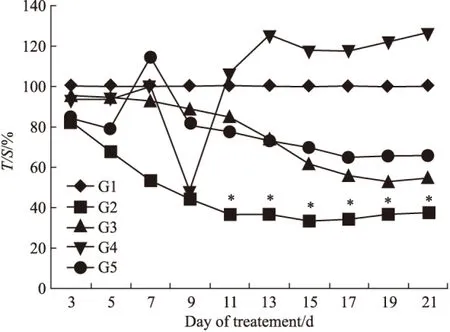
Fig 2 Relative cell proliferation rate T/C(%)
G1: Normal saline;G2: Docetaxel (10 mg·kg-1);G3:HM-3(3 mg·kg-1;G4:HM-3(48 mg·kg-1)*P<0.05vscontrol

Fig 3 Therapeutic effects of antiangiogenic agents on mice
G1: Normal saline;G2:Docetaxel(10 mg·kg-1);G3:HM-3(3 mg·kg-1);G4:HM-3(48 mg·kg-1;G5:Avastin(5 mg·kg-1)
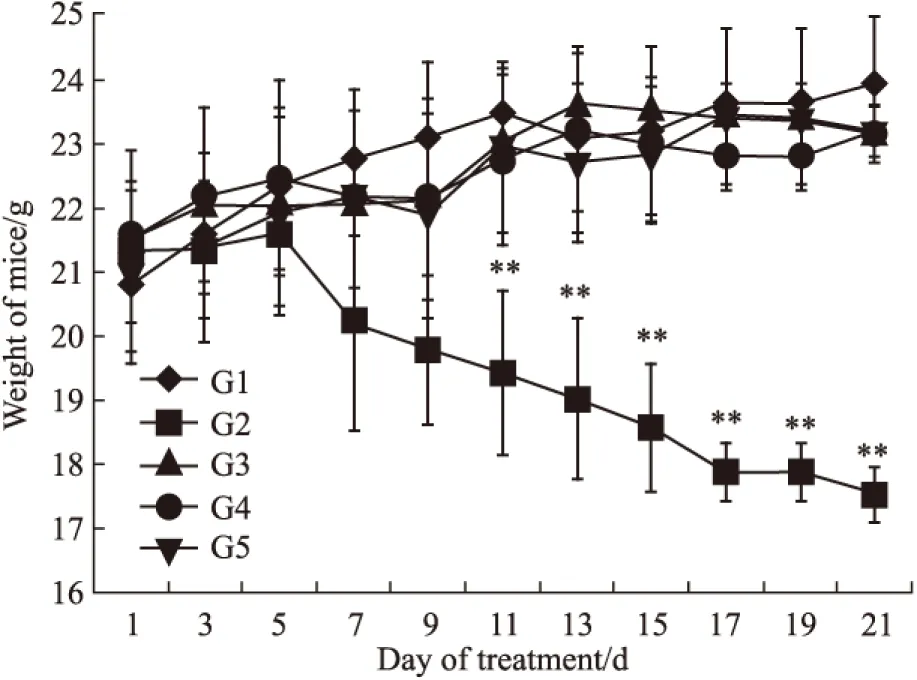
Fig 4 Weight of mice
G1: Normal saline;G2:Docetaxel(10 mg·kg-1);G3:HM-3(3 mg·kg-1);G4:HM-3(48 mg·kg-1;G5:Avastin(5 mg·kg-1);**P<0.01vscontrol
3.3裸鼠体重变化及存活情况
体重情况(Fig 4),阳性组多西他赛组给药后,裸鼠体重有大幅度下降,与阴性组比较差异有统计学意义(P<0.01)。表明化药多西他赛毒副作用明显;多肽HM-3(有效剂量)组、HM-3(过高剂量)组、Avastin组的裸鼠体重与阴性组的相比,无明显影响。说明多肽HM-3和Avastin的毒性较低。从动物存活情况看,各组动物全部存活。
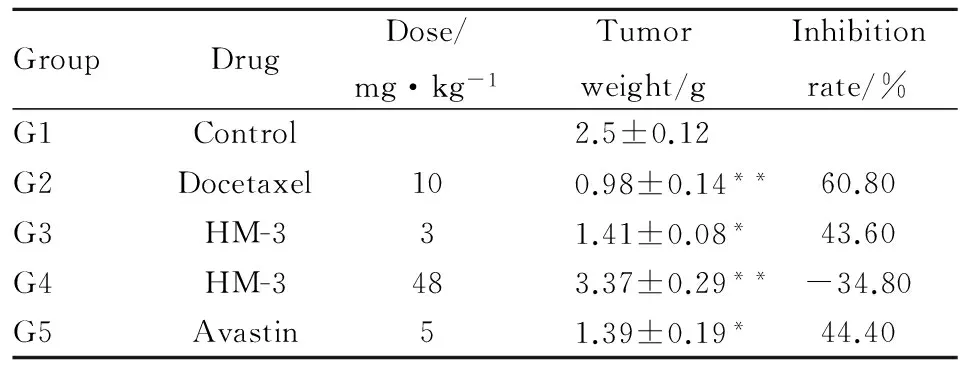
Tab 2 Tumor weight and inhibition rate
*P<0.05,**P<0.01vsControl group
3.4免疫组化染色
如Tab 3、Fig 5所示,阴性组MVD为(29.43±5.42),HM-3(3 mg·kg-1)和HM-3(48 mg·kg-1)MVD分别为(25.16±3.22)和(34.26±2.46),与阴性组对比,差异具有显著性,证明HM-3在有效剂量下对肿瘤新生血管有抑制作用。过高剂量HM-3组微血管密度高于阴性组,证明过高剂量HM-3无抑制血管作用。多西他赛(10 mg·kg-1)组MVD为(20.33±3.13)。
4讨论
1971年,Folkman等首先提出肿瘤生长与血管新生密切相关的概念。近年来研究发现,肿瘤血管新生对其生长、浸润和转移有重要意义,并且大部分肿瘤预后与血管新生有关[11]。血管生成抑制剂类药物与传统化疗药物相比,具有毒副作用低、高效、抗肿瘤谱广、靶向性强和不易产生耐药性等优点。通过抑制肿瘤血管新生的形成,并且切断肿瘤血供而使肿瘤组织因缺氧而被破坏,抑制肿瘤细胞的增殖和转移,血管生成抑制剂类药物在多学科治疗NSCLC领域具有广阔的前景。HM-3是具有整合素亲和性的一种新型高效血管生成抑制多肽,本课题组探索了其与传统化药联用的抗肿瘤药效活性,试验建立多种癌症的裸鼠移植瘤模型,根据临床前抗肿瘤药效学方法评价联合用药的抑瘤作用。实验结果显示,与单独用药相比,联合用药组的抑瘤效果更好。实验证明,HM-3与化药联合用药后,不但能增加疗效,同时也能减少化药的使用剂量,从而减少毒副作用[12]。
本课题组前期进行了人非小细胞肺癌A549裸鼠移植瘤体积<100 mm3时,给予HM-3类型不同血管生成抑制剂类药物的药效学研究。药效学结果显示,阳性对照多西他赛组对人非小细胞肺癌A549裸鼠移植瘤生长的抑制率为83.63%,多肽HM-3有效剂量组 (3 mg·kg-1)的抑制率为71.62%,Avastin组的抑制率为76.05%。HM-3过高剂量组(48 mg·kg-1) 时,对人非小细胞肺癌A549裸鼠移植瘤的生长无抑制作用,甚至出现促进作用。说明肿瘤初期阶段给予HM-3类血管生成抑制剂类药物抑瘤效果良好[13]。本试验探讨了人非小细胞肺癌A549裸鼠移植瘤体积≥300 mm3时,HM-3类血管生成抑制剂类药物的药效学研究。结果显示,阳性对照多西他赛组有很好的抗肿瘤活性,与阴性组比较,差异具有显著性(P<0.01)。整合素阻断剂HM-3有效剂量(3 mg·kg-1)组和单抗Avastin(5 mg·kg-1)组,由于给药时肿瘤体积较大,血管生成抑制剂类药物抑瘤效果不明显,HM-3过高剂量(48 mg·kg-1)甚至促进肿瘤生长。说明在给予HM-3类血管生成抑制剂类药物治疗时,最佳的介入治疗时期和合理给药剂量很重要。

Tab 3 Microvessel density(CD31)
Microvessel density(CD31),G1:Normal saline;G2:Docetaxel(10 mg·kg-1);G3:HM-3(3 mg·kg-1);G4:HM-3(48 mg·kg-1);G5:Avastin(5 mg·kg-1).*P<0.05,**P<0.01vsG1
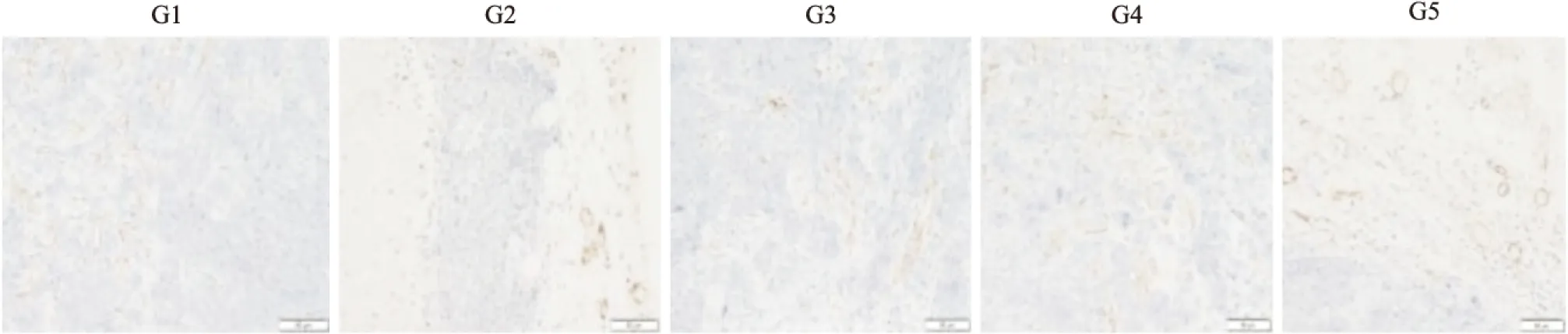
Fig 5 Microvasculature of each histological grade by CD 31 immunostaining(×200)
G1:Normal saline;G2:Docetaxel(10 mg·kg-1);G3:HM-3(3 mg·kg-1);G4:HM-3(48 mg·kg-1);G5:Avastin(5 mg·kg-1)
综合分析实验结果,Avastin体现出了一定的抑瘤效果,这与药物介入的阶段有关。前期实验表明,在肿瘤体积小于100 mm3时给药,Avastin的抑瘤效果较好。Avastin在肿瘤体积大于300 mm3时给药,此时肿瘤内部生长缓慢,只有肿瘤外部血管丰富,还继续生长,所以Avastin只能有效抑制肿瘤外部的生长,不能体现出较高的抑瘤效果。多肽HM-3作为整合素阻断剂类抗肿瘤多肽,前期研究结果显示,HM-3抑瘤效果在(0~6 mg·kg-1)范围内存在剂量依赖关系。而HM-3(48 mg·kg-1)过高剂量对人非小细胞肺癌A549裸鼠移植瘤无抑制作用,甚至出现促进作用,这也与免疫组化结果相吻合(Fig 5)。HM-3特殊的量效关系与其作用机制是相关的,HM-3是多靶点的分子,可作用于整合素的信号通路,对VEGF信号通路也有影响。动物体内的各种信号通路是处于一个平衡状态下的,当有效剂量药物介入动物体内时,可改变动物体内的平衡状态;当药物浓度过高时,动物体内会出现调节机制,“补偿”药物的作用结果,甚至会出现相反的作用,因此HM-3的抑瘤效果不呈现剂量依赖性。本研究的结果表明,HM-3类血管抑制剂与化药比较作用机制不相同,单独使用或与化药联合使用都可减少化药的毒副作用。另外使用血管生成抑制剂类药物抗肿瘤时,还要受到动物品系、瘤株、肿瘤体积和介入时间等多种因素影响,尤其是剂量与药效的关系有时不呈线性关系,因此临床上使用这些药物时,必须确定上述影响因素,才能保证安全用药。
(致谢:本实验在中国药科大学多肽药物创制工程研究中心完成。感谢导师徐寒梅教授为本实验提供充足的资金支持和整体的思路指导;感谢胡加亮老师的精心指导;感谢赵长宏、何俊劲、郝静超、王佳艺、吴晓东同学的尽心协助。)
参考文献:
[1]沈红兵, 俞顺章. 我国肺癌流行现状及其预防对策[J]. 中国肿瘤, 2004,13(5):283-5.
[1]Shen H B, Yu S Z. Epidemiological status of lung cancer in China and atrategies for prevention[J].ChinaCanc, 2004, 13(5):283-5.
[2]Walkers, Updates in non-small cell lung cancer[J].ChinJOncolNurs, 2008, 22(4):587-96.
[3]石远凯, 牛奕. 美国国家综合癌症网非小细胞肺癌治疗指南2007年第一版介绍[J]. 中华肿瘤杂志, 2007, 29(10): 799-800.
[3]Shi Y K, Niu Y. National comprehensive cancer network treatment guidelines for non-small cell lung cancer in 2007 introduced the first edition[J].ChinJOncol, 2007, 29(10): 799-800.
[4]Han J Y, Kim H S, Lee S H, et al. Immunohistochemical expression of integrins and extracellular matrix proteins in non-small cell lung cancer: correlation with lymph node metastasis[J].LungCancer, 2003, 41(1): 65-70.
[5]Cox D, Brennan M, Moran N. Integrins as therapeutic targets: lessons and opportunities[J].NatRevDrugDiscov, 2010, 9(10):804-20.
[6]Gerber H P, Ferrara N. Pharmacology of bevacizumab as monotherapy or in combination with cytotoxic therapy in preclinical studies[J].CancerRes, 2005, 65(3):671-80.
[7]Xu H M, Pan L, Ren Y L, et al. RGD-Modified angiogenesis inhibitor HM-3 dose : Dual function during cancer treatment[J].BioconjugateChem, 2011, 22(7): 1386-93.
[8]张晓娟,任印玲,徐寒梅. 整合素阻断多肽HM-3体外抑制新生血管的研究[J]. 药物生物技术,2012,19(02):129-33.
[8]Zhang X J,Ren Y L,Xu H M. HM-3 inhibiting angiogenesisinvitro[J].PharmBiotechnol,2012, 19(02):129-33.
[9]Weidner N, Semple J P, Welch W R, et al. Tumor angiogenesis and metastas is correlation in invasive breast carcinoma[J].NEnglJMed, 1991,324(1):1-8.
[10]白丽淼,黄晓峰,徐寒梅.人结肠癌HT-29移植瘤不同生长阶段微血管密度及相关因子的表达研究[J]. 中国药理学通报, 2014, 30(6):796-800.
[10]Bai L M, Huang X F, Xu H M. Investigation of microvessel density and related factors expression for xenografts tumor of HT29 cells in nude mice at different growth stage[J].ChinPharmacolBull, 2014, 30(6):796-800.
[11]Folkman J. Anti-angiogenesis: new concept for therapy of solid tumors[J].AnnSurg, 1972, 175: 409-16.
[12]王佳艺,何俊劲,郝静超,等.多肽AP25与多西他赛联合用药对人乳腺癌裸鼠移植瘤的抑制活性研究[J]. 中国药理学通报, 2015, 31(9):1233-8.
[12]Wang J Y, He J J, Hao J C, et al. Antitumor effects of combined use of peptide AP25 and docetaxel against breast cancer[J].ChinPharmacolBull, 2015, 31(9): 1233-8.
[13]何俊劲,王佳艺,郝静超,等. 多肽mPEG-SC-(20k)-HM-3联合奥沙利铂对人肝癌细胞SMMC-7721裸鼠移植瘤的抑制作用[J]. 中国药科大学学报, 2015, 46(4): 476-80.
[13]He J J, Wang J Y, Hao J C, et al. Antitumor effect of peptide mPEG-SC20k-HM-3 and oxaliplatin combination against human hepatocellular carcinoma SMMC7721 in nude mice[J]JChinPharmUniv, 2015, 46(4): 476-80.
Antitumor effects of peptide HM-3 against non-small cell lung cancer xenografts in nude mice
CHENG Hao-Ran, WANG Jia-Yi, WU Xiao-Dong,HAO Jing-Chao, LUO Yan-Ping, LIU Chen, HU Jia-Liang, XU Han-mei
(TheEngineeringResearchCenterofPeptideDrugDiscoveryandDevelopment,ChinaPharmaceuticalUniversity,Nanjing210009,China)
Abstract:AimsTo evaluate the pharmacodynamic efficacy of different types of antiangiogenic agents as HM-3 on a non-small cell lung cancer xenografts tumor model . To explore the interaction between the antiangiogenic agents and the tumor microenvironment, and to offer suggestions for clinical therapy. MethodsThe non-small cell lung carcinoma xenograft model was established in Balb/c nude mice. The model mice were treated with Docetaxel(10 mg·kg-1) as the positive control. The mice were parallelly treated with, HM-3 at the doses of 3 mg·kg-1and 48 mg·kg-1and, Avastin(5 mg·kg-1). The parameters include tumor volume, tumor weight and immunohistochemical analysis.ResultAnimal experiments showed that docetaxel had good anti-tumor activity. Tumor growth inhibition by tumor weight of G2 docetaxel(10 mg·kg-1) group was 60.80%. Tumor growth inhibition by tumor weight of G3 HM-3(3 mg·kg-1) group, G4 HM-3(48 mg·kg-1) group , G4 Avastin(5 mg·kg-1) group, were 43.60%, -34.80%, 44.40%, respectively.ConclusionThe antigiogenic effect is affected by tumor growth stage, tumor microenvironment and their working mechanisms. Angiogenesis inhibitors HM-3 has a certain effect of inhibiting tumor growth, but to little avail. HM-3 shows on inhibitory effect in a dose-dependent manner at the doses of 0~6 mg·kg-1. HM-3 at a high dose of 48 mg·kg-1has no inhibitory but promoting effects on human non-small cell lung carcinoma A549 xenografts in nude mice . Special dose-effect relationship indicates that dosage should be paid attention to in the clinical use of blood vessel inhibitors.
Key words:peptide HM-3; non-small cell lung cancer; Avastin; angiogenesis inhibitor; xenografts in nude mice; tumor microenvironment; docetaxel
收稿日期:2016-02-23,修回日期:2016-03-10
基金项目:国家高技术研究发展计划(863计划)资助项目(No.SQ2011SF11B02030)
作者简介:程昊冉(1990-),女,硕士生,研究方向:肿瘤药理学,E-mail:hrcheng1887@163.com;
doi:10.3969/j.issn.1001-1978.2016.06.014
文献标志码:A
文章编号:1001-1978(2016)06-0806-06
中国图书分类号:R-332;R364.3;R734.205.3;R977.6; R979.1
网络出版时间:2016-5-25 15:39网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160525.1539.028.html
徐寒梅(1966-),女,博士,教授,博士生导师,研究方向:抗肿瘤新药研究开发,通讯作者,E-mail:13913925346@126.com

