设计VEGF的G四链体诱导结肠癌细胞凋亡的研究
王 爽 张毅强 兰晓瑜 程牛亮 李美宁(山西医科大学生物化学与分子生物学教研室,山西 太原 030001)
设计VEGF的G四链体诱导结肠癌细胞凋亡的研究
王 爽 张毅强 兰晓瑜 程牛亮 李美宁*
(山西医科大学生物化学与分子生物学教研室,山西 太原 030001)
【摘要】目的 pu22寡核苷酸序列作用于VEGF基因使VEGF启动子区形成G-四链体,干扰VEGF基因的表达从而促进HCT116细胞和SW480细胞的凋亡。方法 设计合成的pu22和mutpu22摄取到细胞后,在pu22不同浓度作用下,通过实时定量PCR实验检测VEGF基因的表达情况,利用免疫印迹实验检测VEGF蛋白表达水平;通过细胞凋亡实验检测两种结肠癌细胞凋亡的情况。结果 荧光实时定量PCR与免疫印迹实验结果显示处理组的两种结肠癌细胞株HCT116与SW480用8 μL/L的PU22处理48 h后VEGF的表达最低,其相对表达值均显著低于正常细胞组及空白对照组。细胞凋亡实验结果表明两种细胞处理组凋亡率均大于相应的正常组与对照组。结论 寡核苷酸序列PU22对杀伤结肠癌细胞起着显著的作用。
【关键词】VEGF;G-四链体;pu22
结直肠癌是我国常见的恶性肿瘤之一。抑制血管生成是阻遏肿瘤生长的一种策略,Vegf是控制血管生成的主要基因之一。本实验设计了针对VEGF启动子区域的G四链体PU22,在结肠癌细胞摄取PU22后检测VEGF基因RNA和蛋白质的表达,分析细胞增殖和凋亡的情况,从而探讨PU22对VEGF基因表达的影响与结肠癌增殖与凋亡的关系,研究PU22对结肠癌细胞的影响。为寻找结肠癌新药的研发和治疗方法奠定了实验基础。
1 材料与方法
1.1 PU22与mutPU22:PU22序列5'-CGGGGCGGGCCGGGGGCGGGG T-3'[1-5],mutPU22序列5'-CGAGTCGCGCCGAGTGCGAGAT-3'。人工合成的PU22与mutPU22用培养基溶解,95 ℃煮沸5 min,-20 ℃保存。
1.2 分析细胞摄取寡核苷酸PU22实验:用8 mmol/L带有FITC荧光的PU22作用已经爬好片的细胞中,培养72 h后取出去上清,依次进行固定,染色,封片,照相,结果分析。
1.3 荧光实时定量PCR分析:用TriZol法提取经不同处理的细胞总RNA,将其反转录成CDNA,进行荧光实时定量PCR。

图1 2种细胞摄取PU22的情况

图2 实时定量检测PU22作用前后结肠癌细胞VEGF基因RNA表达情况
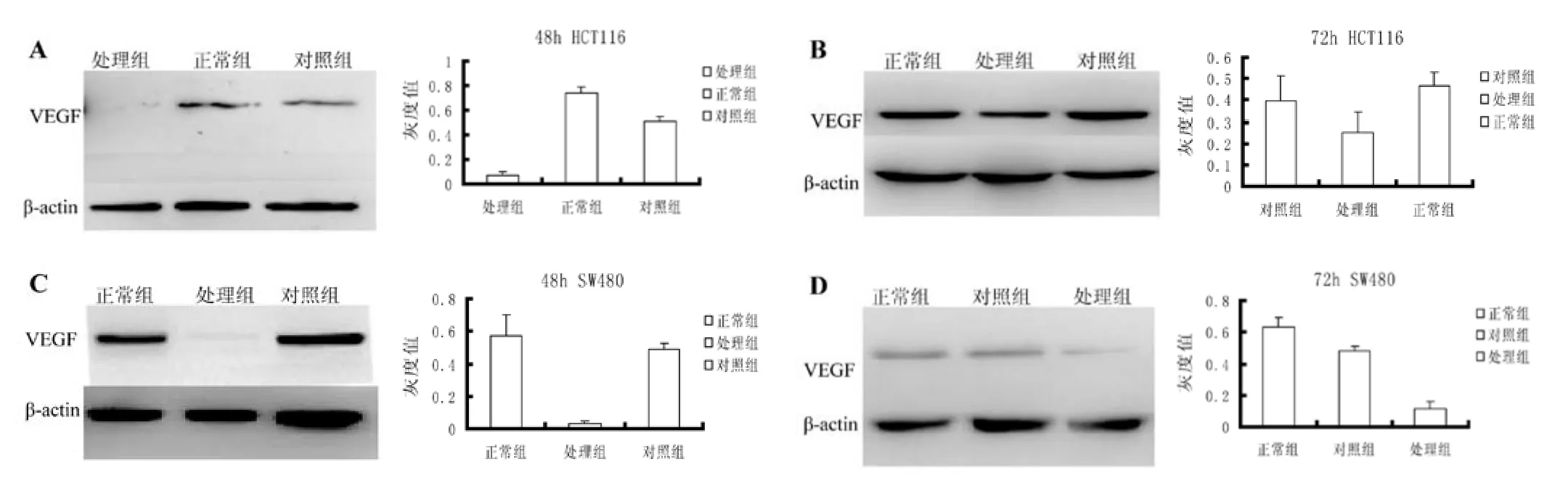
图3 Western blotting检测经不同条件作用后结肠癌细胞VEGF蛋白表达情况

图4 PU22作用48 h后结肠癌细胞凋亡情况
1.4 western blotting分析:不同处理的细胞,提取细胞总蛋白。后测量蛋白浓度。将所提的蛋白依次进行聚丙烯酰胺凝胶电泳、转膜、封闭、免疫学反应、显影与结果分析。
1.5 流式细胞仪(FCM)检测细胞凋亡:通过PU22作用后的细胞去培养液,收集细胞,过滤细胞,1000rpm离心5 min,去多余上清,混匀细胞,5 μL Annexin V-FITC和10 μL 20 μg/mL的碘化丙锭溶液,混匀后室温避光孵育20 min,加250 μL PBS,流式细胞仪分析。
2 结 果
2.1 人工合成的PU22被摄入人结肠癌细胞中:见图1显示,图1中蓝色荧光为细胞核所在的位置。用带有绿色荧光标记的PU22处理细胞72 h后观察结果。结果表明HCT116和SW480细胞内可观察到绿色荧光,且摄取率为90%以上。说明细胞可以高效地摄取寡核苷酸PU22。
2.2 PU22抑制结肠癌细胞VEGF基因RNA表达:PU22作用后结肠癌细胞中VEGF的RNA表达情况,用荧光实时定量PCR技术检测。本实验分为正常组(细胞未经过处理)、mut组(细胞用mutPU22处理)、6 μL/L组(细胞用6 μL/L PU22处理)、8 μL/L组(细胞用8 μL/L PU22处理)、10 μL/L组(细胞用10 μL/L PU22处理)。将正常组细胞的VEGF的RNA表达量设为1。实验结果显示人结肠癌细胞株HCT116和SW480经不同浓度PU22作用后细胞中VEGF基因RNA的表达量皆有降低,其中作用最明显的浓度为8 μL/L,最佳时间为48 h。而经mutPU22作用的细胞中VEGF基因RNA的表达无明显变化,无统计学差异(P>0.05)。见图2。
2.3 PU22抑制结肠癌细胞VEGF基因蛋白表达比较:PU22作用后结肠癌细胞中VEGF的蛋白表达情况用Western blotting技术检测。本实验将8 μL/L PU22处理过细胞设为处理组;未经处理过的细胞设为正常组;用mutPU22处理过的细胞设为对照组。结果表明人结肠癌细胞株HCT116和SW480经不同条件作用后,细胞中VEGF蛋白的表达量皆有降低,且皆有统计学差异。48 h SW480蛋白表达量降低最显著。见图3。
2.4 PU22作用48 h后促进结肠癌细胞凋亡:Annexin V-FITC/PI法检测细胞在不同条件下处理48 h后细胞凋亡情况。见图4显示,HCT116细胞的处理组、正常组、对照组,其细胞凋亡率分别为42.46%、11.06%、28.78%。其中处理组细胞凋亡率大于正常组和对照组。SW480细胞的处理组、正常组、对照组,其细胞凋亡率分别为69.14%、14.31%、32.95%。其中处理组细胞凋亡率大于正常组和对照组。结果表明PU22促进HCT116与SW480细胞凋亡。
3 讨 论
结直肠癌是消化系统常见的恶性肿瘤之一。在世界癌症研究基金会报告(WCRF/AICR 2007)[6]中,大肠癌的发病率居恶性肿瘤的第3位,其病死率在全世界排名第2位[7]。因此结肠癌的治疗方法的研究已成为肿瘤研究的重要课题。
VEGF是癌症中强效的促进血管生长因子,肿瘤细胞通过VEGF诱导血管生成,使其提供充分的氧气和营养物质[8]。近年来通过抑制VEGF从而达到杀伤结肠癌细胞的研究很多,如节律卡培他滨也是通过调节VEGF基因从而达到抗肿瘤的作用[9]。然而节律卡培他滨作用人体时易产生骨髓抑制、消化系统反应和手足综合征等不良反应。G-四链体是一种指依靠鸟嘌呤连接起来的四链DNA螺旋结构。由于癌细胞分裂非常迅速,染色体容易出现缺失,所以G-四链体分子可能唯一存在于癌细胞中。如果这样的话,G-四链体的任何癌症治疗都不会伤害健康细胞,这为癌症治疗开起了的新的研究与治疗的方向。
VEGF等几种癌症相关基因的启动子内含有一个能够形成G-四链体的核酸酶超敏感区域[11]。我们研究显示,体外寡核苷酸链形成的G-四链体也可以下调VEGF基因,从而诱导结肠癌细胞凋亡。确定结肠癌细胞摄取PU22寡核苷酸后,我们研究发现,用PU22处理过的SW480和HCT116细胞,其RNA与蛋白表达量皆低于正常组与对照组,且最佳浓度为8 μL/L最佳作用时间为48 h,HCT116细胞VEGF基因的抑制率低于SW480细胞,出现此现象的原因可能由于PU22浓度过高或作用时间长从而诱导细胞分泌大量的解G-四链体的解旋酶,HCT116细胞的恶性程度比SW480高等原因产生的。PU22作用SW480和HCT116细胞48 h后,两种细胞处理组凋亡率皆大于相应的正常组与对照组。表明PU22可以通过抑制VEGF基因,达到提高细胞凋亡的作用。
本研究是将体外合成的寡核苷酸PU22形成的G-四链体摄入结肠癌细胞内,促进细胞内VEGF基因的启动子中PU22序列形成G-四链体,抑制VEGF基因的表达,从而促使结肠癌细胞凋亡,抑制结肠癌细胞的生长与增殖。综上所述,本研究可以选择性的杀伤结肠癌细胞,为治疗结肠癌带来了一个新希望。本实验为结肠癌新药材的研发和治疗提供了新的手段。
参考文献
[1]Agrawal P,Hatzakis E,Guo K,et al.Solution structure of the major G-quadruplex formed in the human VEGF promoter in K+: insights into loop interactions of the parallel G-quadruplexes[J]. Nucleic Acids Res,2013,41(22):10584-10592.
[2]Sun D,Guo K,Rusche JJ,et al.Facilitation of a structural transition in the polypurine/polypyrimidine tract within the proximal promoter region of the human VEGF gene by the presence of potassium and G-quadruplex-interactive agents[J].Nucleic Acids Res,2005,33(18): 6070-6080.
[3]Sun D,Guo K,Shin YJ.Evidence of the formation of G-quadruplex structures in the promoter region of the human vascular endothelial growth factor gene[J].Nucleic Acids Res,2011,39(4):1256-1265.
[4]Biff1 G,Tannahill D,Balasubramanian S.Quantitative visualization of DNA G-quadruplex structures in human cells[J].Nat Chemistry,2013,5(3):182-186.
[5]Marusic M,Rakesh NV,Wengel J,et al.G-rich VEGF aptamer with locked and unlocked nucleic acid modifcations exhibits a unique G-quadruplex fold[J].Nucleic Acids Res,2013,41(20):9524-9536.
[6]Wiseman M.The second World Cancer Research Fund/American Institute for Cancer Research expert report.Food,nutrition,physical activity,and the prevention of cancer:a global perspective[J].Proc Nutr Soc,2008,67(3):253-256.
[7]Siegel R,Ward E,Brawley O,et al.Cancer statistics,2011:The impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J].CA Cancer J Clin,2011,61(4):212-236.
[8]Carmeliet P.VEGF as a key mediator of angiogenesis in cancer[J]. Oncology,2005,69(3):4-10.
[9]Rak J,Mitsuhashi Y,Bayko L.Mutant ras Oncogenes Upregulate VEGF/VPF Expression:Implications for Induction and Inhibition of Tumor Angiogenesis[J].Cancer Res,1995,55(20):4575-4580.
[10]Huppert JL,Balasubramanian S.G-quadruplexes in promoters throughout the human genome[J].Nucleic Acids Res,2007,35(2):406-413.
[11]Bochman ML,Paeschke K,et al.DNA secondary structures: stability and function of G quadruplex structures[J].Reviews,2012,13(11):770-780.
· 临床研究 ·
中图分类号:R735.3+5
文献标识码:B
文章编号:1671-8194(2016)13-0039-03
基金项目:山西省青年科技基金(2011021035-1)

