两个品种马骨髓基因表达谱分析
赵一萍,张宇宏,李 蓓,黄金龙,白东义,赵启南,乌尼尔夫,杨丽华,吴 敬,乌云达来,芒 来
两个品种马骨髓基因表达谱分析
赵一萍,张宇宏,李 蓓,黄金龙,白东义,赵启南,乌尼尔夫,杨丽华,吴 敬,乌云达来,芒 来*
(内蒙古农业大学动物科学学院,内蒙古自治区蒙古马遗传资源保护及马产业工程实验室,呼和浩特010018)
摘 要:为了寻找不同品种马骨髓之间的差异表达基因,本研究构建了蒙古马-骨髓和纯血马-骨髓基因表达谱文库,经Illumina Miseq高通量测序,分别获得了7 219 956和7 116 170个有效reads;两个文库映射到11、8和1号染色体的reads最多,而映射到29、30和31号染色体的reads最少;两个文库共筛出318个差异表达基因,其中与免疫相关的基因有21个。GO功能富集分析结果表明差异表达基因与转运、细胞间信号传导、生物学过程和细胞质等有关;KEGG通路富集分析结果表明,差异最大的显著富集KEGG条目为神经系统。这些结果为研究马匹抗病力的遗传和免疫机理等提供基础数据。
关键词:马;骨髓;表达谱;差异基因
蒙古马(Mongolian horse)是我国乃至世界著名的地方品种之一,具有抗病力强,持久力好,抗严寒、耐粗饲等优点,能够适应恶劣的气候及粗放的饲养条件,可以识别毒草而不中毒,除寄生虫病和外伤,很少发生内科疾病[1]。蒙古马具有的这些优良性状与其长期生活的环境和遗传因素有着直接的关系。对于某一性状的研究,可以通过与此性状相关的组织器官入手,研究与该性状相关的候选基因或者筛选出与该性状相关的基因[2-3]。
骨髓(Bone marrow)包括红骨髓和黄骨髓,红骨髓可以制造红细胞、血小板和各种白细胞;血小板具有止血作用,白细胞能够杀灭与抑制细菌、病毒等各种病原体。因此,骨髓对于维持机体正常的新陈代谢、生理生化功能和免疫力均非常重要。国内外,对于骨髓在免疫功能方面的研究,通常是通过研究骨髓所产生的各种造血干细胞,以及与这些细胞有关的免疫因子。通过诱导、变性、损伤等方式,研究免疫应答反应以及相关元件的变化情况[4]。
随着高通量测序技术的不断发展,科学研究逐步进入了基因组和后基因组时代[5]。高通量测序技术是DNA测序发展历程的一个里程碑,为遗传信息的揭示和基因表达调控等基础生物学的研究提供了重要的数据信息[6]。对于马匹采用高通量测序技术的报道多见于通过肌肉组织中基因的表达对运动进行研究[7-9],在骨髓组织上未见报道。本试验通过Illumina测序技术对马骨髓进行基因表达分析,为研究马匹抗病力的遗传基础和免疫机理等提供数据基础。
1 材料与方法
1.1 试验动物
蒙古马长期群牧饲养,能适应恶劣的气候及粗放的饲养条件;纯血马长期处在高度人工饲养环境中,对环境条件要求较为严格,对恶劣环境条件的适应性较差。本试验分别从内蒙古自治区包头市达茂旗、锡林浩特市镶黄旗随机选取3匹蒙古马(公马,幼驹)和从内蒙古自治区马业协会成吉思汗御马苑(鄂尔多斯市伊金霍洛旗红碱淖尔纯种马繁育基地)选取1匹纯血马(公马,幼驹)进行屠宰。屠宰过程中,立即采集骨髓组织,将新鲜的组织样置于液氮中迅速冷冻,之后置于-80℃冰箱中保存,用于后续试验。
1.2 总RNA提取和检测
按照天根公司RNAprep pure Tissue Kit试剂盒提取骨髓总RNA。用1.0%的琼脂糖凝胶电泳检测提取各组织样品的总RNA质量;用酶标仪测定其OD260nm/OD280nm值为1.8~2.1,说明RNA样品纯度较好。
1.3 文库制备和测序
通过mRNA纯化并片段化,双链cDNA合成,DNA双末端修复,3′端引入“A”碱基,以及富集DNA片段等过程构建测序文库,使用Agilent 2100 对PCR富集片段进行质量控制,验证DNA文库的片段大小及分布。对多样品DNA文库进行均一化至10nmol·L-1后等体积混合。由上海派森诺生物科技有限公司提供测序。
1.4 数据处理及分析
经Illumina Miseq测序得到的原始图像数据文件经碱基识别分析转化为序列数据(RawDate reads),对RawDate reads按照序列碱基平均质量>Q30,前50bp N<1,总N<3的标准进行过滤得到Clean-Data reads。使用Bowtie/Tophat软件将序列(reads)Map到马的参考基因组上,确定reads在基因组各染色体上的分布情况。提取GO、KEGG等数据库中基因注释,获得每条基因在不同类型数据库中的注释信息。统计每个基因Map到马的参考基因组的reads数目并计算RPKM值(Reads per kilo bases per million reads),同时Map到马的参考基因组的reads数据通过DESeq软件进行标准化并进行差异表达及其显著性(P-value/FDR)分析。
1.5 基因表达谱数据可靠性验证
参照GenBank中马β-actin基因、UCHL1、LOC100065720、LOC100049872、CXCL10、LOC100053963、CCL3、DRB、C7基因,利用引物设计软件Primer 3.0,同时结合Oligo 6.0软件进行分析,设计特异的实时荧光定量RT-PCR(RT-qPCR)引物。所设计的引物序列片段大小如表1所示,由英潍捷基(上海)贸易有限公司合成。
蒙古马与纯血马骨髓总RNA利用TaKaRa公司Prime Script RT Master Mix(Perfect Real Time)反转录试剂盒合成cDNA第一链。利用TaKaRa公司SYBR?Rremix Ex TaqTMⅡ(Perfect Real Time)试剂在Agilent MX3000P实时荧光定量PCR仪上采用SYBR greenⅠ荧光染料进行实时荧光定量PCR反应。最佳反应条件:95℃30s,X ℃30s,72℃20s,进行40个循环。X为退火温度,退火温度分别为60.0℃(β-actin、LOC100049872、C7基因)、62.0℃(UCHL1、LOC100065720、CXCL10、LOC100053963、CCL3基因)、56℃(DRB基因)。PCR过程中,阴性对照用1μL灭菌水代替cDNA样品。每个样品进行3个重复。荧光定量PCR反应的特异性由熔解曲线判定,定量的结果是由Ct值计算得出,以β-actin基因作为内参基因,采用2-△△Ct定量分析方法对数据进行处理。

表1 马β-actin基因和免疫相关基因RT-qPCR扩增引物的序列Table 1 The primers for RT-qPCR of horseβ-actin and immune-related genes
2 结 果
2.1 测序文库的建立
2.1.1 总RNA质量检测 从蒙古马与纯血马的骨髓组织中提取总RNA,琼脂糖凝胶电泳检测28S和18SrRNA条带清晰、完整、无降解(图略);紫外分光光度计检测结果:OD260nm/OD280nm值为1.8~2.1,OD260nm/OD230nm≥2.0,总RNA浓度不低于250ng·μL-1,样品总量不低于50μg,电泳检测28S∶18S>1.2。以上检测结果表明,RNA样品无降解,浓度达到建库要求。
2.1.2 cDNA文库质量检测 对PCR产物进行1.5%琼脂糖凝胶电泳,根据100bp Marker选择需要的区域(200~400bp);用凝胶回收试剂盒将所切的片段回收,并利用1.5%琼脂糖凝胶电泳进行检测(图略)。
2.2 测序数据处理和分析
2.2.1 Map到基因组分析结果 本试验构建了纯血马-骨髓和蒙古马-骨髓2个表达谱文库。经Illumina Miseq测序,分别获得原始数据197 909 140 bp和198 869 008bp。将这些原始数据进行过滤,获得CleanData数据分别为185 020 420bp和187 718 856bp;去除低质量序列后,得到可供进行转录组拼接的序列reads数分别为7 116 170和7 219 956,分别占总reads数的93.49%和94.39%。数据过滤的结果为有效Reads>90%,说明样品和测序质量较高。2个文库注释为专一位置的reads数目分别为6 307 565条(91.33%)和6 342 209条(91.12%);分别有4 166 758条和4 100 890条reads Map在基因组上,注释率分别为60.34%和58.92%。2个文库中Map在外显子区的reads分别为51.61%和48.74%,Map在基因区间的reads分别为39.66%和41.08%(表2)。Map到基因上的reads约为60%,Map到外显子上的reads数目约为50%,结果正常。

表2 马骨髓表达谱文库RNA测序信息Table 2 The RNA sequencing information of the expression profile libraries of horse-bone marrow
2.2.2 Map到染色体分析结果 高通量测序得到的数据映射到染色体上,所得结果如图1所示。检测的两个文库Map到第11、8和1号染色体的reads最多,而Map到第29、30和31号染色体的reads最少。这与两个文库Uniq Mapped Read数目的多少有一定关系。

图1 马骨髓表达谱文库在染色体的分布Fig.1 The distribution of the expression profile libraries on chromosomes of horse-bone marrow tissues
2.3 基因表达谱分析
2.3.1 差异表达基因分析结果 对蒙古马-骨髓与纯血马-骨髓表达谱文库进行比较,差异表达分析按照2-fold和P-value进行判断,对两个文库标准化后的数值进行分析,共筛出318个差异表达基因。与纯血马-骨髓相比较,蒙古马-骨髓表达量显著上调的基因有241个,表达量显著下调的基因有77个,其中有21个差异表达基因与免疫相关(在蒙古马-骨髓中上调的基因为16个,下调的基因为5个)(表3)。

表3 差异表达基因统计结果Table 3 The statistical results of differentially expressed genes
2.3.2 差异表达基因GO富集分析结果 蒙古马-骨髓与纯血马-骨髓差异基因GO功能分析,注释到生物学过程(Biological process)类别中的差异表达基因有1 217个,注释到细胞组分(Cellularcomponent)类别中的差异表达基因有869个,注释到分子功能(Molecular function)类别中的差异表达基因有397个。在生物学过程类别中,生物学过程(Biological process)中的差异表达基因最多为136个,其次为转运(Transport)中的差异表达基因为86个,在生物合成过程(Biosynthetic process)、细胞氮代谢过程(Cellular nitrogen compound metabolic process)、信号转导(Signal transduction)、解剖结构发展(Anatomical structure development)中的差异表达基因分别为64、63、63和62个;在细胞组分类别中,细胞(Cell)中的差异表达基因最多为190个,其次胞内(Intracellular)中的差异表达基因为163个,在细胞器(Organelle)、细胞成分(Cellular component)、质膜(Plasma membrane)中分别为133、115和108个差异表达基因;在分子功能类别中,归类到分子功能(Molecular function)的差异表达基因最多为228个,其次离子结合(Ion binding)为104个差异表达基因(图2)。
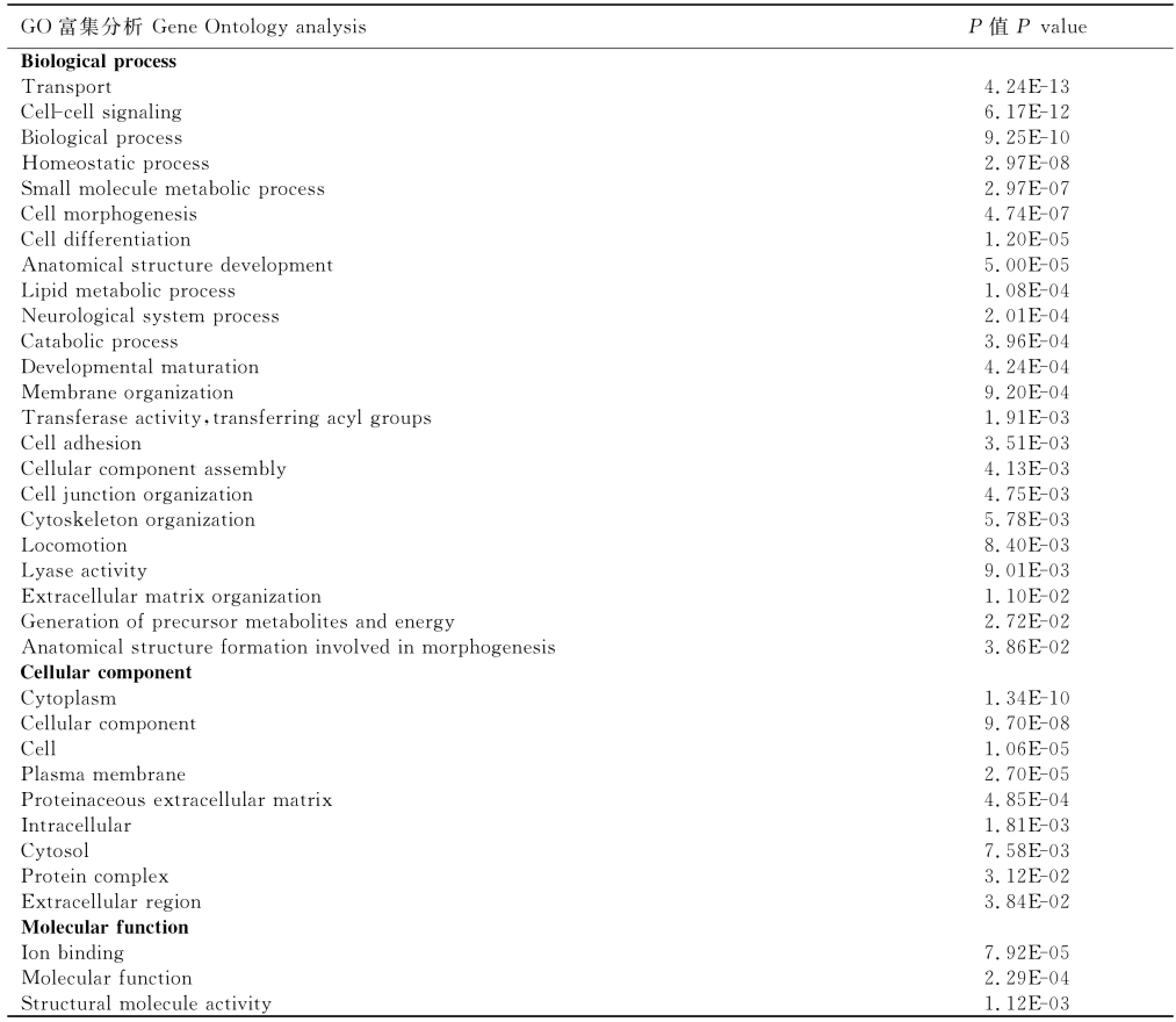
表4 蒙古马-骨髓与纯血马-骨髓差异表达基因GO富集分析(通过GO富集检验)Table 4 The Gene Ontology analysis of differentially expressed genes in Mongolian horse-bone marrow and Thoroughbred-bone marrow
两个文库通过GO富集检验(P<0.05)的差异表达基因所对应的GO条目为显著富集的GO条目,见表4。在生物学过程(Biological process)类别中,显著富集的GO条目包括转运(Transport)、细胞间信号传导(Cell-cell signaling)、生物学过程(Biological process)、内环境平衡过程(Homeostatic process)、小分子代谢过程(Small molecule metabolic process)、细胞形态(Cell morphogenesis)等;在细胞组分(Cellular component)类别中,包括细胞质(Cytoplasm)、细胞成分(Cellular component)、细胞(Cell)、质膜(Plasma membrane)等;在分子功能(Molecular function)类别中,包括离子结合(Ion binding)、分子功能(Molecular function)、结构分子活性(Structural molecule activity)。然而,免疫系统过程并没有通过GO富集检验。
2.3.3 差异表达基因KEGG富集分析结果 对蒙古马-骨髓与纯血马-骨髓差异表达基因进行KEGG富集分析,注释到神经系统(Nervous system)途径的差异表达基因最多为40个,其次,注释到传染病(Infectious diseases)和消化系统(Digestive system)途径的差异表达基因为35和31个,但传染病途径没有通过KEGG显著富集分析,免疫系统也没有通过KEGG显著富集分析(表5)。差异最大的KEGG条目为消化系统。

表5 蒙古马-骨髓与纯血马-骨髓差异表达基因KEGG富集分析Table 5 The Kyoto Encyclopedia of Genes and Genomes analysis of differentially expressed genes in Mongolian horse-bone marrow and Thoroughbred-bone marrow
2.3.4 基因表达谱数据可靠性验证 为了验证高通量测序结果,选取与免疫相关的8个基因,采用实时荧光定量PCR进行测定。从图3可知,这些基因通过RT-qPCR验证得到的相对表达量和RNA测序得到的相对表达量的趋势相同,采用高通量测序得到蒙古马-骨髓中上调和下调基因在RT-qPCR中得到同样的结果,说明高通量测序的基因表达量是可靠的,可以进行后续试验分析。
3 讨 论
家马(Domestic horse)的染色体为64条(2n)[9],已公布马匹的全基因组序列是一匹纯血马母马[10],所以,现可以获得1~31号常染色体和X号染色体[11]。构建的两个文库Map到染色体上的趋势基本一致,均在11、8和1号染色体的reads较多,而29、30和31号染色体的reads比较少,这与马匹每条染色体分布的基因数目趋势基本相同。相比纯血马,蒙古马在除8、11、26号和X染色体外,在其他染色体上Map的基因数都略比纯血马高,这可能是由于蒙古马的Uniq Mapped Read比纯血马的要略微高些的缘故。另外,本试验获得的一些基因Map不到染色体,这可能是因为试验选择的马匹都是公马,而现在Y染色体上的基因信息没有公布。

图2 蒙古马-骨髓与纯血马-骨髓差异表达基因GO富集分析Fig.2 The Gene Ontology analysis of differentially expressed genes in Mongolian horse-bone marrow and Thoroughbredbone marrow
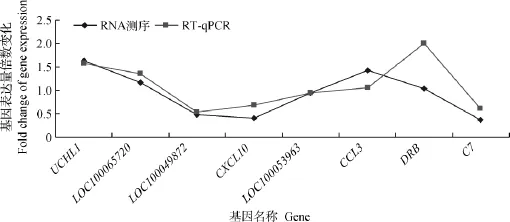
图3 免疫相关基因RNA测序和RT-qPCR相对表达量的比较Fig.3 The comparison of RNA sequencing and RT-qPCR relative expression for immune-related genes
本试验对构建的两个文库进行比较,共筛出318个差异表达基因;与纯血马-骨髓比较,蒙古马-骨髓表达量显著上调的差异表达基因有241个,表达量显著下调的差异表达基因有77个,其中有21个差异表达基因与免疫相关。不同品种相同组织之间是存在一定差异的,之前在不同品种鸡的胸肌组织[12]、猪的脂肪组织[13]、猪的背最长肌[14-15]等研究中也充分体现。
蒙古马-骨髓与纯血马-骨髓差异表达基因GO功能分析,注释到生物学过程类别中的差异表达基因最多,生物学过程、转运、生物合成过程、细胞氮代谢过程、信号转导、小分子代谢、分解代谢过程、免疫系统过程等,差异基因在这些过程中表达说明骨髓所行使的机能,活跃在细胞的分子代谢、信号转导等方面,这一系列的生理生化过程对机体正常功能运行起到了调控作用。差异基因在细胞功能类别中注释的最少,包括分子功能、DNA结合、离子结合、结构分子活性细胞骨架蛋白结合等,这说明在长期的进化过程中,同一基因在不同生物体内的作用是固定的。从显著富集GO条目的程度来看,生物过程、细胞成分、分子功能均有条目通过GO富集检验(P<0.05),但是免疫系统并没有通过GO富集检验。这可能是因为基因表达水平都是通过读段计数来估计的,转录本较长或表达水平较高的基因拥有更多的读段,因此更容易被多数统计方法识别为差异表达基因[16],这种偏好可能对后续分析带来影响。以GO类别富集分析来说,这种偏好将导致长基因占主导功能的类别更容易被识别为富集的功能。另外,差异表达基因GO富集分析结果显示,很多通过富集检验的GO条目均与信号转导、小分子代谢、细胞分化、转运等有关,而免疫应答反应也常常与这些功能有着直接或间接的联系,因此可以侧面反映蒙古马与纯血马的骨髓在免疫方面的作用。
蒙古马-骨髓与纯血马-骨髓差异基因KEGG富集分析,注释到神经系统的差异基因最多,其次为传染病和消化系统。纯血马灵敏、易调教、性格温顺,对疾病的易感性高,而蒙古马则表现为悍威强、不易驯服、耐寒耐粗饲抗病力强,而神经系统与训练调教有密切的关系。由于纯血马是人工舍饲喂养,蒙古马长期处于粗犷的自然环境中,以牧草为生,饲料结构随着四季的变化而变化,因此不论是从生长环境还是饲料结构来说,两个品种马均不相同,对疾病抵抗的能力和消化系统均存在差异。
4 结 论
本研究利用Illumina Miseq高通量测序平台对蒙古马-骨髓和纯血马-骨髓基因表达谱文库进行了测序,分别获得了7 219 956和7 116 170个有效reads。两个文库共筛出318个差异表达基因,其中有21个差异基因与免疫相关(在蒙古马-骨髓中上调的基因有16个,下调的基因有5个)。对差异表达基因进行了GO功能注释和KEGG通路富集分析,发现它们在神经系统和消化系统中有着重要的作用。高通量RNA-Seq提供了马骨髓基因表达谱信息,为研究相关基因在骨髓中所起的作用提供了基础数据和参考。
参考文献(References):
[1] 中国畜禽遗传资源委员会.中国畜禽遗传资源志-马驴驼志[M].北京:中国农业出版社,2011.Chinese Domestic Animal Genetic Resources Commit-tee.Animal genetic resources in China-horse donkeys camels[M].Beijing:China Agriculture Press,2011.(in Chinese)
[2] YU K,SHU G,YUAN F,et al.Fatty acid and transcriptome profiling of longissimus dorsi muscles between pig breeds differing in meat quality[J].Int J Biol Sci,2013,9(1):108-118.
[3] ZHAO S,HULSEGGE B,HARDERS F L,et al.Functional analysis of inter-individual transcriptome differential expression in pig longissimus muscle[J].J Anim Breed Genet,2013,130(1):72-78.
[4] EZEH P C,LAUER F T,MACKENZIE D,et al.Arsenite selectively inhibits mouse bone marrow lymphoid progenitor cell development in vivo and in vitro and suppresses humoral immunity in vivo[J].PLoS One,2014,9(4):e93920.
[5] PAN Q,SHAI O,LEE L J,et al.Deep surveying of alternative splicing complexity in the human transcriptome by high-throughput sequencing[J].Nat Genet,2008,40(12):1413-1415.
[6] 王兴春,杨致荣,王 敏,等.高通量测序技术及其应用[J].中国生物工程杂志,2012,32(1):109-114.WANG X C,YANG Z R,WANG M,et al.Highthroughput sequencing technology and its application [J].China Biotechnology,2012,32(1):109-114.(in Chinese)
[7] PARK K D,PARK J,KO J,et al.Whole transcriptome analyses of six thoroughbred horses before and after exercise using RNA-Seq[J].BMC Genomics,2012,13:473.
[8] MCGIVNEY B A,MCGETTIGAN P A,BROWNE J A,et al.Characterization of the equine skeletal muscle transcriptome identifies novel functional responses to exercise training[J].BMC Genomics,2010,11:398.
[9] 芒 来.马在中国[M].香港:香港文化出版社,2009.MANG L.Horse in China[M].Hongkong:Hongkong Culture Press,2009.(in Chinese)
[10] WADE C M,GIULOTTO E,SIGURDSSON S.Genome sequence,comparative analysis,and population genetics of the domestic horse[J].Science,2009,326 (5954):865-867.
[11] 杨 虹,马月辉,李 蓓,等.马基因组研究进展[J].遗传,2010,32(3):211-218.YANG H,MA Y H,LI P,et al.Progress on horse genome project[J].Hereditas,2010,32(3):211-218.(in Chinese)
[12] 刘武艺.两个品种鸡胸肌不同发育阶段全基因组表达谱的系统分析[D].北京:中国农业大学,2010.LIU W Y.Systematic analysis of the global gene expression profiles in breast muscle tissues of two chicken breeds at different developmental stages[D].Beijing:China Agricultural University,2010.(in Chinese)
[13] LI X J,YANG H,LI G X,et al.Transcriptome profile analysis of porcine adipose tissue by high-throughput sequencing[J].Anim Genet,2012,43(2):144-152.
[14] 辉 钱.利用表达谱芯片技术研究中外猪种不同时期肌肉组织中的表达差异基因[D].武汉:华中农业大学,2012.HUI Q.Microarray analysis of skeletal muscle at four stages in yorkshire and meishan pigs[D].Wuhan:Huazhong Agricultural University,2012.(in Chinese)
[15] 张冬杰,刘 娣,汪 亮,等.民猪和大白猪背最长肌差异表达基因的筛选与注释[J].畜牧兽医学报,2013,44(2):181-187.ZHANG D J,LIU D,WANG L,et al.Screen and annotation of different expression genes in Min pig and Yorkshire pig Longissimus dorsi muscle[J].Acta Veterinaria et Zootechnica Sinica,2013,44(2):181-187.(in Chinese)
[16] OSHLACK A,WAKEFIELD M J.Transcript length bias in RNA-seq data confounds systems biology[J].Biol Direct,2009,4:14.
(编辑 郭云雁)
Analysis of Gene Expression Profile of Bone Marrow in Two Horse Breeds
ZHAO Yi-ping,ZHANG Yu-hong,LI Bei,HUANG Jin-long,BAI Dong-yi,ZHAO Qi-nan,SHIRAIGO Wunierfu,YANG Li-hua,WU Jing,BAO Wuyundalai,DUGARJAVIIN Mang-lai*
(Inner Mongolia Mongolian Horse Genetic Resources Protection and Industrial Engineering Laboratory,College of Animal Science,Inner Mongolia Agricultural University,Hohhot 010018,China)
Abstract:To investigate the differential genes expression of bone marrow between different horse breeds,expression profiling libraries of Mongolian Horse-bone marrow and Thoroughbred-bone marrow were constructed.We obtained 7 219 956and 7 116 170useful reads by the Illumina Miseq sequencing,respectively.The most of reads in the 2expression profiling libraries were maped on chromosome 11,chromosome 8and chromosome 1,and the least of reads were maped on chromosome 29,chromosome 30and chromosome 31.318differentially expressed genes were found in 2expression profiling libraries,including 21immune-related genes.The Gene Ontology analysis showed that the differentially expressed genes were related to transport,cell-cell signaling,biological process and cytoplasm,etc.The Kyoto Encyclopedia of Genes and Genomes analysis indicated that nervous system was the most differentiated KEGG term.These results will provide data basis for further studies on the horses disease resistance and immune mechanism.
Key words:horse;bone marrow;expression profiles;differential genes
中图分类号:S821.2
文献标志码:A
文章编号:0366-6964(2016)05-0922-09
doi:10.11843/j.issn.0366-6964.2016.05.008
收稿日期:2015-05-04
基金项目:内蒙古自治区科技厅重点实验室建设项目(20130902);内蒙古自治区科技厅应用技术研究与开发项目(20140172);内蒙古自治区自然科学基金项目(2015BS0316)
作者简介:赵一萍(1984-),女,满族,河北高碑店人,博士,助理研究员,主要从事马遗传育种与繁殖研究,E-mail:yipingzhao@imau.edu.cn
*通信作者:芒 来,教授,博士生导师,主要从事马属动物种质资源创新与遗传改良研究,Tel:0471-4316151,E-mail:dmanglai@163.com

