自制组织微阵列仪及其在肝癌分子病理研究中的应用
袁玲,董福禄,季,陆锦标,陈苗苗,季菊玲,王爱婷,鄂群,Δ
(1.江苏省靖江人民医院 内科,江苏 靖江 214500;2.南通大学医学院 基础医学研究室,江苏 南通 226001;3.江苏省靖江人民医院 普外科,江苏 靖江 214500;4.南通大学医学院 病理学系,江苏 南通 226001)
自制组织微阵列仪及其在肝癌分子病理研究中的应用
袁玲1,董福禄2,季3,陆锦标4,陈苗苗2,季菊玲4,王爱婷2,鄂群2,4Δ
(1.江苏省靖江人民医院 内科,江苏 靖江 214500;2.南通大学医学院 基础医学研究室,江苏 南通 226001;3.江苏省靖江人民医院 普外科,江苏 靖江 214500;4.南通大学医学院 病理学系,江苏 南通 226001)
目的 自主研发制备一种新型的结构合理、使用方便的石蜡组织微阵列手动装置,以解决现有的石蜡组织芯片工具由于结构、组合等原因在实验、研究工作中存在使用不便等问题。方法 自主研发制备石蜡组织微阵列手动装置,并利用此装置将62例肝癌组织及匹配的癌旁组织标本制备组织芯片,并对其进行HE染色及AFP、CD34、Ki67和HIF alpha等蛋白质的免疫组织化学实验,分析肝癌组织及癌旁组织的表达差异性。结果 对自制组织芯片进行多种蛋白的免疫组织化学检测和分子病理分析结果显示,染色清晰完整;统计分析显示,Ki67和HIF alpha在肝癌组织中的表达量显著高于癌旁组织(P=0.0003,P=0.0144),与文献的报道一致。结论 本文自制组织微阵列仪具有较高的实用价值,是生物化学药物分子机制和病理研究应用的有效工具。
组织微阵列仪;组织芯片;肝癌;免疫组织化学
组织芯片(tissue chip,TC),又称组织微阵列( tissue microarray, TMA)[1], 是将数十、数百个乃至上千个小的组织标本按照一定的规律有序排列在某一个固相载体上而成,其目的是为了研究同一种基因或同一种蛋白质分子在不同的组织或细胞中的表达状况。具有体积小、高通量、大样本、高效率、误差小,可实现自动化和微型化及可与其他生物技术相结合的特点[2]。组织芯片是由Barrifora等[3]在1986年最早提出的;其后,Kononen等[4]于1998年在 Nature Medicine杂志发表组织芯片论文,并首次成功运用组织芯片技术研究6种基因在乳腺癌组织中的表达情况,证实了该技术的实用价值,并宣告组织芯片概念的诞生。在如今的生物医学研究中,组织芯片技术已经在癌症研究中广泛应用,是生物化学药物分子机制和病理研究应用的有效工具[5-8]。现有的石蜡组织芯片工具,由于结构、组合等原因,在实验、研究工作中存在使用不便等问题,为了改善这些不便之处,本实验利用自制组织微阵列仪制作肝癌及癌旁样本组织芯片,并对多种蛋白质的表达进行免疫组织化学分子病理研究。
1 材料与方法
1.1 样本 本实验所用石蜡标本取自2000年~2010年在江苏省南通地区多家医院接受肝细胞肝癌手术切除的患者62例。患者入选标准包括:①原发性肝癌并采用根治性手术切除;②病理确诊为肝细胞肝癌;③术前未接受任何相关抗肿瘤治疗。
1.2 方法
1.2.1 通用组织微阵列仪制备[9]:石蜡组织微阵列手动装置包括;石蜡组织微阵列定位版和实验支架;芯棒;取样针;熔合板;多功能框和芯片种植平面检测板。石蜡组织微阵列定位板与实验支架活动式安装匹配,上述部件放置于一个盒体中,所述实验支架为C型轨道型金属件。
石蜡组织微阵列定位版周边标记有自然数字及相对应的英文字母,用作对呈正三角形阵列和正方形阵列排列孔阵列中的孔进行二维定位;石蜡组织微阵列定位版的另一面标有“石蜡组织微阵列定位板”等字样。版的两侧中央有U 型凹槽,是实验支架的嵌入固定部位;一侧版面的四角有缺口式入槽口。
芯棒为粗段短而细段长的形式,粗段与细段的长度比例为1:5~1:6,细段不锈钢圆柱体Φ <石蜡组织微阵列定位版上的孔径;粗段不锈钢圆柱体长约为4~6 mm,其Φ >石蜡组织微阵列定位版上的孔径;芯棒的细段插入石蜡组织微阵列定位版上的孔,组成芯棒阵列(芯棒的细段和粗段);芯棒一体两端的圆柱体段均可为铸造受体石蜡芯片芯穴的部位。另设有多功能框及与其匹配在恒温室进行熔合操作的熔合板。
取样针为两用双钻头取样针:为一根有铜套的不锈钢毛细管,其两端管口呈圆周锯齿状或刀刃样锐口,可用于对石蜡组织块和人体或动物组织的固定标本进行取样;管口呈齿形相似大小一致的圆周锯齿口,有4~7个锯齿状凸;或锐利刀刃样的管口;是钻取石蜡组织和人体或动物等生物组织样品的关键部位;取样针不锈钢毛细管体外有固定联体的铜套管,其表面有波浪样凸凹纹理,是旋转取样针进行取样的手持工作面;铜套管表面一端有间隙疏密有致的粗细浅凹槽,是与取样针柄的圆端平面Φ 标识有相同意义的特定标识。读数从铜套端第一粗凹起;有细凹槽时,读数以细凹槽为准,精确到0.1 mm;无细凹槽时,则以粗凹槽为准,读数精确到1 mm。粗凹槽间距10 mm,粗凹数量代表毫米数量单位;细凹位于两粗凹间,代表0.1毫米数量单位,其位于两粗凹间的位置代表0.1毫米倍数的读数精确单位。如;粗凹槽(仅有)2条时,读数为Φ=2 mm;共有3条粗凹槽标识时,并有细凹槽位于第二与第三条粗凹槽的(中央)1/2处,此时读数Φ=2.5 mm;取样针芯杆匹配于取样针管内,为用于辅助取样针管推出供体样本石蜡芯的不锈钢圆柱体。一端为针尖,是推出样本石蜡芯的部位。另一端为铜柄,铜柄端的圆平面有Φ和数字标识(与铜套管表面的凹槽代表的Φ读数相同);从针芯尖起与不锈钢取样针管等长的针芯杆表面位置起始(向针尖方),有10条窄凹痕,间隔/窄凹痕=1 mm,为取样时取样深度的度量标识;在针芯杆铜柄端与针芯杆的连接口嵌有嵌有环形的橡胶样垫圈,其Φ ≥取样针管口,起保护取样针管口的作用。
熔合板,为一块薄的金属材料板,承置安放多功能框,是石蜡组织微阵列芯片坯在恒温台或恒温室进行熔合操作的中介平台。
多功能框,为一呈距形的无底不锈钢金属框,框分成上口部与下口部,上口部内侧的四周边有与通用型组织包埋盒吻合的直角凹,是支架安置通用型组织包埋盒的接口和进行石蜡组织微阵列芯片包埋的区域;下口部的四周壁呈斜坡梯形,其底口与熔合板和检测板接合匹配使用,是执行石蜡组织微阵列芯片空穴坯的铸模、芯片的种植、芯片切片面的观测校正和芯片熔合的区域。
芯片种植平面检测板,是一种透明非金属材料板,衬托于多功能框下口部匹配使用时,可检测芯片种植质量,即;所有已种植的芯片是否到达同一平面(亦称切片平面)。
1.2.2 通用组织微阵列仪制备组织芯片流程:通用组织微阵列仪制备组织芯片流程见图1。

图1 通用组织微阵列仪制备组织芯片流程Fig.1 Process of general tissue microarray instrument for preparing tissue microarray
制备空穴微阵列模块:①将微组织阵列定位版插入实验支架;②在定位版表面敷设薄纸,按预设阵列插入芯棒;③加热芯棒阵列(用芯片仪熔合包埋组合件的暖风机);④用铸模框框住芯棒阵列;⑤将芯棒阵列置于石蜡组织芯片制备机流蜡咀下灌注石蜡;⑥待石蜡冷凝后,去除浮蜡并退出芯棒;⑦充分冷却后退出空穴微阵列模块,修整后待用。
取样与种植:①将待用供体石蜡组织块37 ℃~42 ℃预热;②用取样针钻取样品;并种植于微阵列模块空穴(23 ℃~4 ℃,可在冷冻台上进行);③将种植完毕的芯片模块移置到透明检测板上待修整。
检查及调整空穴中芯片阵列(芯片熔合前处理):①透过检测板观察并调整芯片至同一水平面(可提高得片率);②将芯片模块移置到芯片熔合板上,再平放到芯片熔合室中进行芯片熔合。
芯片熔合与包埋(涉及芯片仪熔合包埋组合件熔合室冷冻台和流蜡包埋功能):①(30 min左右)密切观察至芯穴中蜡芯溶融而芯穴/管壁不溶(为最佳)时中止熔合;②小心平稳取出微阵列芯片模块待石蜡冷凝;③待芯穴中蜡芯完全凝固后,即加盖包埋盒并快速灌注包埋石蜡;④移出充分冷却后,即退出石蜡组织芯片块并修整待用。
1.2.3 免疫组织化学染色步骤:石蜡切片脱蜡,酒精梯度水化;用PBS冲洗3次,每次3 min;pH6.0柠檬酸缓冲液热修复10~15 min;3%过氧化氢室温下孵育10 min,以阻断内源性过氧化物酶的活性;PBS冲洗3次,每次3 min。除去PBS液,滴加第一抗体(AFP,兔多克隆抗体,1:100倍稀释;CD43,鼠单克隆抗体,1:100倍稀释;HIF-1,鼠单克隆抗体,1:100倍稀释;KI67,鼠单克隆抗体,1:100倍稀释),室温下孵育60 min后4 ℃过夜;PBS冲洗3次,每次3 min。除去PBS液,每张切片加1滴或50 uL酶标广谱第二抗体,室温下孵育10~15 min。PBS冲洗3次,每次3 min。除去PBS液,滴加新鲜配制的DAB溶液(酶底物显色剂),显微镜下观察;自来水冲洗,蒸馏水洗后苏木素复染;自来水冲洗,0.3%盐酸酒精分化;自来水冲洗返蓝;切片经过梯度酒精脱水干燥,二甲苯透明,中性树胶封固。
1.2.4 结果判定:根据空白、阳性和阴性对照的显色情况,在确定无假阳性和假阴性的前提下,以细胞膜或细胞浆染成棕黄及棕褐色为阳性。将按照其染色强度判为:无着色(0分),浅黄(1分),棕黄(2分)及棕褐色(3分);按照阳性信号比例判为:阴性(0分),1%~24%(1分),25%~49%(2分),50%~74%(3分) 75%~100%(4分)。总体评分值为染色强度×阳性信号比例。
1.3 统计学方法 应用SPSS 13.0软件进行数据处理,2组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 肝癌手术标本组织芯片制备质量和普通HE染色病理分型 本次实验共成功制备肝癌组织芯片1枚,其中包含62例肝癌组织及其癌旁组织和2列正常肝脏组织标本。组织芯片经过切片后仍然排列整齐,层次分明,厚薄均匀,对比明显,未出现漂移,且芯片具有较好的完整性,见图2。
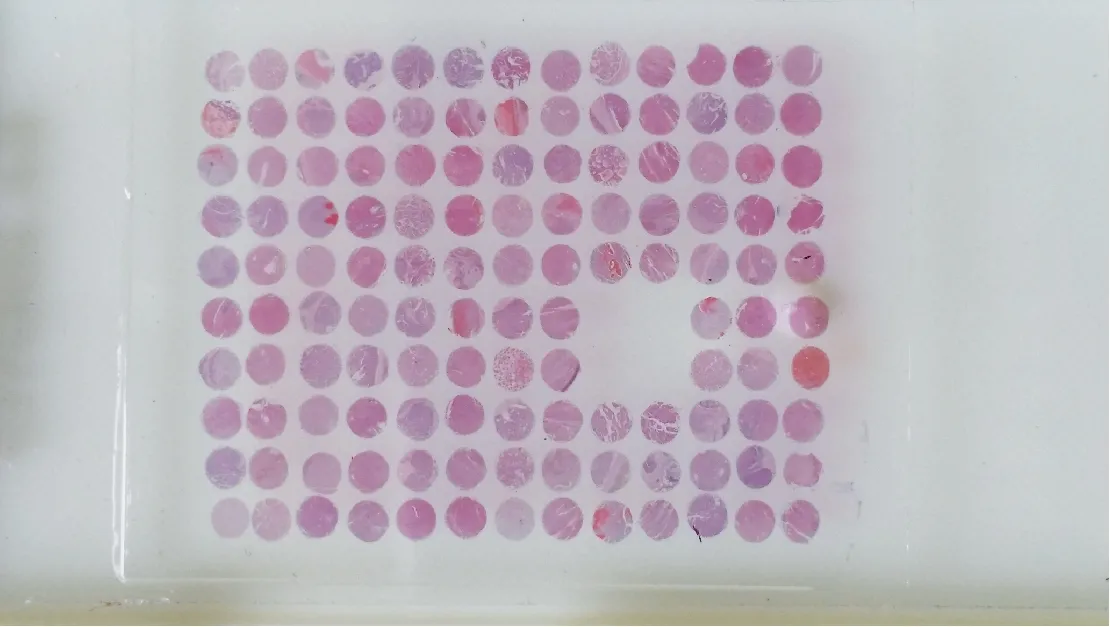
图2 肝癌组织芯片HE染色Fig.2 HE staining for hepatocellular carcinoma tissue microarray
2.2 肝癌手术标本组织芯片免疫组化染色 利用构建的组织芯片,首先检测了 AFP和CD34两种蛋白在肝癌及其癌旁组织中的表达情况。镜下对2种蛋白染色观察可见,阳性信号清晰可辨,染色定位于细胞膜及细胞质,且AFP和CD34在肝癌的肿瘤组织中均有广泛表达,见图3。可见,通过自制组织微阵列仪制作的组织芯片可以高通量得到完整清晰的免疫组织化学结果。
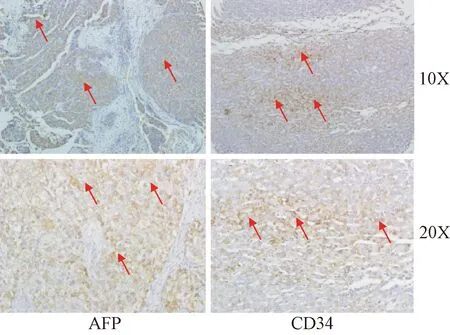
图3 肝癌组织芯片AFP和CD34免疫组化染色结果Fig.3 Immunohistochemical staining of AFP and CD34 in tissue microarray of hepatocellular carcinoma
2.3 肝癌手术标本组织芯片免疫组化染色结果分析 利用自主制备的肝癌组织芯片,对细胞增殖指标Ki67和细胞缺氧指标HIF alpha进行了免疫组化检测,并且对62例实验结果进行统计分析。统计结果显示,细胞增殖指标Ki67和细胞缺氧指标HIF alpha在肝癌组织中的表达都显著高于癌旁组织(P=0.0003,P=0.0144),见图4。
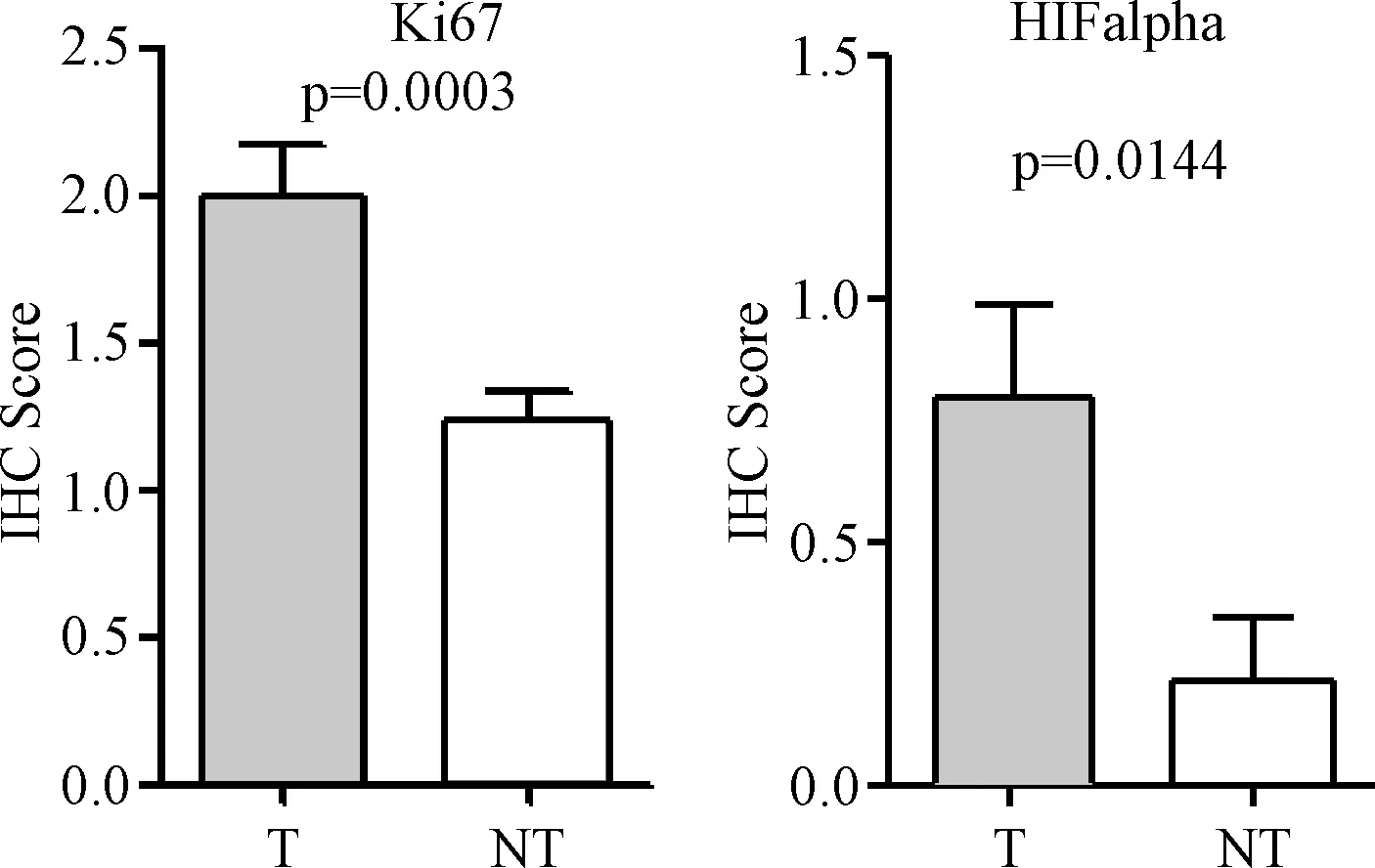
图4 肝癌及癌旁组织芯片Ki67和HIF alpha免疫组织化学染色结果统计T: 肝癌组织, NT: 癌旁组织Fig.4 Statistical analysis of immunohistochemical staining of AFP and CD34 in tissue microarray of hepatocellular carcinoma and adjacent tissuesT: HCC tumor tissues; NT: HCC adjacent tissues
3 讨论
组织芯片的原理是:将采集的几十到上千个的圆柱形小组织样本整齐的排放到另一个空白蜡块中制成组织芯片蜡块。然后对其进行切片;再将切片转移到载玻片上而制成组织芯片。之后,用制好的组织芯片可进行HE染色、组织化学、荧光原位杂交、免疫组织化学等一系列检测。组织芯片是将基因、蛋白表达水平检测与组织形态学有机地结合起来,克服了传统分子病理学技术和病理组织学技术操作复杂、工作效率低等缺点,可同时对几十甚至几百个样品同时进行检测,大大提高了工作效率[10-11]。现有的石蜡组织芯片工具,由于结构、组合等原因,在实验、研究工作中存在使用不便等问题。我们自主研发了一种石蜡组织微阵列手动装置,包括;多功能框、石蜡组织微阵列定位板、实验支架、芯棒、取样针,熔合板和芯片种植平面检测板,其中石蜡组织微阵列定位版与支架活动式安装匹配。
为了证实自主研发石蜡组织微阵列手动装置的有效性及准确性,我们使用自制的肝癌及癌旁组织芯片对Ki67,HIFalpha,NF-κB和p65等多种蛋白进行免疫组织化学分析,并对部分结果进行统计。Ki67是一种在增殖细胞中表达的核蛋白,与细胞的周期密切相关,覆盖于除G0期外的各细胞周期,其表达水平反映了肿瘤细胞的增殖状况[12]。本实验结果与之前报道实验结果相似[13-14]:在肝癌组织芯片样品中,Ki67免疫组化指数显著高于癌旁组织芯片样品组,说明肝癌的发生发展需要细胞的大量增殖。而肿瘤细胞的快速增殖,必然需要消耗大量的能量和氧气,进而导致肿瘤细胞处于缺氧状态中,而低氧诱导因子HIF alpha是肿瘤在低氧环境下调控的关键因子,所以我们对HIF alpha的表达水平进行了免疫组织化学检测。与大量研究报道一致[15-16],本实验结果显示在肝癌组织芯片样品中HIF alpha的表达水平显著高于癌旁组织,说明肝癌组织需要上调HIF alpha的表达水平来适应低氧环境。
综上所述,本文利用自主设计的石蜡组织微阵列手动装置成功制备肝癌及癌旁组织芯片。对自制组织芯片进行多种蛋白的免疫组织化学检测和分子病理分析,染色结果清晰完整,并且对结果进行统计分析发现与大量报道具有高度的一致性,说明自制组织微阵列仪具有较高的实用价值,是生物化学药物分子机制和病理研究应用的有效工具。
[1] Kallioniemi OP, Wagner U, Kononen J,et al. Tissue microarray technology for high-throughput molecular profiling of cancer[J]. Hum Mol Genet, 2001,10(7):657-662.
[2] Gillett CE, Springall RJ, Barnes DM,et al. Multiple tissue core arrays in histopathology research: a validation study[J]. J Pathol,2000,192(4):549-553.
[3] Battifora H. The multitumor (sausage) tissue block: novel method for immunohistochemical antibody testing[J]. Lab Invest,1986, 55(2):244-248.
[4] Kononen J,Bubendorf L,Kallioniemi A,et al. Tissue microarrays for high-throughput molecular profiling of tumor specimens[J]. Nat Med,1998,4(4):844-847.
[5] Dancau AM, Simon R, Mirlacher M,et al. Tissue Microarrays[J]. Methods Mol Biol,2016,1381:53-65.
[6] Dolled-Filhart MP,Gustavson MD. Tissue microarrays and quantitative tissue-based image analysis as a tool for oncology biomarker and diagnostic development[J]. Expert Opin Med Diagn,2012,6(6):569-583.
[7] Kramer MW, Merseburger AS, Hennenlotter J,et al. Tissue microarrays in clinical urology—technical considerations[J]. Scand J Urol Nephrol,2007,41(6):478-484.
[8] Al Kuraya K, Simon R,Sauter G. Tissue microarrays for high-throughput molecular pathology[J]. Ann Saudi Med,2004,24(3):169-174.
[9] 鄂群.石蜡组织微阵列手动装置[P].中国, 201120482637.0, 2012-08-01.
[10] Dhir R. Tissue microarrays: an overview[J]. Methods Mol Biol,2008,441:91-103.
[11] Henshall S. Tissue microarrays[J]. J Mammary Gland Biol Neoplasia ,2003,8(3):347-358.
[12] Keshgegian AA, Cnaan A. Proliferation markers in breast carcinoma. Mitotic figure count, S-phase fraction, proliferating cell nuclear antigen, Ki-67 and MIB-1[J]. Am J Clin Pathol,1995,104(1):42-49.
[13] Schmilovitz-Weiss H,Tobar A,Halpern M.et al. Tissue expression of squamous cellular carcinoma antigen and Ki67 in hepatocellular carcinoma-correlation with prognosis: a historical prospective study[J]. Diagn Pathol,2011,6:121.
[14] Cheah PL, Looi LM, Nazarina AR,et al. Association of Ki67 with raised transaminases in hepatocellular carcinoma[J].Malays J Pathol,2008,30(2):103-107.
[15] Ambade A,Satishchandran A,Saha B,et al. Hepatocellular carcinoma is accelerated by NASH involving M2 macrophage polarization mediated by hif-1alphainduced IL-10[J].Oncoimmunology,2016,26(5):e1221557.
[16] Yang SL,Liu LP,Jiang JX,et al. The correlation of expression levels of HIF-1alpha and HIF-2alpha in hepatocellular carcinoma with capsular invasion, portal vein tumor thrombi and patients’ clinical outcome[J]. Jpn J Clin Oncol,2014,44(2): 159-167.
(编校:吴茜)
Self-developed tissue microarray instrument and its application in hepatocellular carcinoma
YUAN Ling1†, DING Fu-lu2†, JI Yong3, LU Jin-biao4, CHEN Miao-miao2, JI Ju-ling4, WANG Ai-ting2, E Qun2,4Δ
(1.Department of Medicine, Jingjiang People’s Hospital, Jingjiang 214500, China; 2.Center for Basic Medical Research, Nantong University School of Medicine, Nantong 226001 China; 3.Department of Surgery, Jingjiang People’s Hospital,Jingjiang 214500, China; 4.Department of Pathology, Nantong University School of Medicine, Nantong 226001, China)
ObjectiveTo make a novel paraffin wax tissue microarray manual device with reasonable structure and handy function,and resolve the inconvenience showed in the usages of existing paraffin tissue microarray tools due to its unreasonable structure, combination and so on in the research work.MethodsA novel paraffin wax tissue microarray manual device was made, and 62 cases of hepatocellular carcinoma (HCC) and adjacent tissue array was prepared, then the tissue array was stained by H&E, also AFP, CD34, Ki67 and HIF alpha by immunohistochemistry.ResultsThe HCC and adjacent tissue microarray was successfully prepared by self-developed paraffin tissue microarray device. The result of staining is very clear and convenient for molecular pathology analysis. Statistical analysis showed that Ki67 and HIF alpha expression in HCC tissues was significantly higher than that in adjacent tissues (P=0.0003,P=0.0144), consistent with reports.ConclusionThis self-developed tissue microarray manual device with high practical value is an effective tool for the study of the molecular mechanism of biochemical drugs and pathology.
tissue microarrays; tissue microarray instruments; Hepatocellular carcinoma; Immunohistochemistry
10.3969/j.issn.1005-1678.2016.12.006
袁玲,女,硕士,副主任医师,研究方向:病毒性肝炎,E-mail:1015726785@qq.com;董福禄,共同第一作者,男,讲师,博士,研究方向:肿瘤生物学,E-mail:dongfulu@ntu.edu.cn;鄂群,通信作者,男,本科,高级实验师,研究方向:肿瘤病理,E-mail:nestle@ntu.edu.cn。
R33
A

