DC-SIGN诱导的信号通路在HIV-1前病毒活化中的作用
李杰,靳昌忠,程林芳,刘福民,吴南屏Δ
(1.温州医科大学附属第二医院 感染内科,浙江 温州 325027;2.浙江大学医学院附属第一医院传染病诊治国家重点实验室,浙江 杭州 310003)
DC-SIGN诱导的信号通路在HIV-1前病毒活化中的作用
李杰1,靳昌忠2,程林芳2,刘福民2,吴南屏2Δ
(1.温州医科大学附属第二医院 感染内科,浙江 温州 325027;2.浙江大学医学院附属第一医院传染病诊治国家重点实验室,浙江 杭州 310003)
目的 研究HIV-1 gp120蛋白与DC-SIGN结合对HIV-1前病毒的活化作用及其信号通路机制。方法 将DC-SIGN表达质粒和HIV-1 5’末端重复序列(5’LTR)报告质粒转染293T细胞,以HIV-1 gp120蛋白、野生型HIV-1、VSV-G-pNL4.3假病毒分别刺激,检测HIV-1 5’LTR的活性。慢性感染HIV-1的CEM-Bru 细胞转染DC-SIGN表达质粒,以HIV-1 gp120蛋白刺激, 检测HIV-1 Tat mRNA和HIV-1 p24蛋白表达水平。特异性抑制ERK、P38 和NF-κB信号通路,再用gp120刺激DC-SIGN(+)CEM-Bru 细胞,检测HIV-1前病毒的活化。结果 在DC-SIGN(+) 293T细胞中,HIV-1 5’LTR可以被HIV-1 gp120激活。HIV-1 gp120蛋白及DC-SIGN刺激DC-SIGN(+) CEM-Bru后,HIV-1 Tat mRNA和HIV-1 p24蛋白表达水平明显升高,提示其早期和晚期HIV-1前病毒复制,用抗体阻断DC-SIGN可抑制潜伏HIV-1活化。HIV-1 gp120/DC-SIGN通过NF-κB信号通路在激活潜伏HIV-1前病毒。结论 HIV-1 gp120可通过结合DC-SIGN激活NF-κB信号通路介导HIV-1前病毒活化。
HIV-1;DC-SIGN;病毒潜伏;信号通路;NF-κB
高效抗逆转录病毒治疗(highly active anti-retroviral treatment,HAART)是目前治疗艾滋病(acquired immunodeficiency syndrome,AIDS)的唯一有效的手段,但仅使患者外周血病毒载量降至目前检测不到的水平,不能完全清除病毒,患者体内仍有低水平的病毒复制[1]。其主要原因是HIV-1可以在特定的靶细胞内基因沉默,形成潜伏性感染,不表达任何特征性蛋白,难以检测和识别[2-4]。一旦停止药物治疗,病毒会迅速反弹,这是目前HIV-1难以在体内被完全清除的一个重要原因[4]。HIV-1的主要潜伏储藏库是静息CD4+T淋巴细胞,此外,淋巴结中的树突状细胞(dendritic cells,DCs)细胞也被认为是HIV-1的储藏库[5]。作为粘膜中首先抵御HIV-1的固有免疫细胞,在HIV-1的感染、传染以及病毒本身长期存活有至关重要的作用[6-8],因此,清除DCs储藏库是根治艾滋病的重要手段之一。
树突状细胞特异性细胞间黏附分子-3-非整合素(Dendritic cell-specific intercellular adhesion molecule-3-grabbing non-integrin,DC-SIGN)是一种表达于DCs表面的C型凝集素,与1型人类免疫缺陷病毒糖蛋白120(human immune deficiency virus-1 glycoprotein 120,HIV-1 gp120)有高亲和力,在外周循环中捕获HIV-1,并促进靶细胞感染[9-10]。DC-SIGN识别多种病原体,包括1型人类免疫缺陷病毒(human immune deficiency virus-1,HIV-1),并诱导多种信号通,如胞外信号调节激酶(extracellular signal-related kinase,ERK)和活化B细胞的核因子κB轻链增强子(nuclear factor kappa-light-chain-enhancer of activated B cells,NF-κB)信号通路,从而调节各种细胞因子分泌和免疫反应[11]。潜伏性HIV-1再活化涉及多个信号通路,例如ERK和NF-κB信号通路[12-13]。HIV-1再活化及DC-SIGN信号传递均涉及上述信号通路,因此我们推测DC-SIGN诱导的信号通路可能参与HIV-1前病毒活化。
1 材料与方法
1.1 材料
1.1.1 试剂:293T细胞购自ATCC,HIV-1慢性感染的CEM-SS细胞(感染了HIV-1Bru)及HIV-1毒株(HXB2)和VSV-G-pNL4.3假病毒由上海巴斯德研究所周Paul教授赠送。荧光素酶报告质粒pGL-3/Basic、内对照质粒pRL-TK和双荧光素酶活性检测试剂盒均购自Promega公司。荧光定量PCR检测试剂盒购自TAKARA公司,重组HIV-1 gp120蛋白、HIV-1 p24 ELISA检测试剂盒购自R&D公司,抗DC-SIGN单克隆抗体、抗CCR5单克隆抗体、NF-κB、p38 MAPK和MEK1/2及其磷酸化抗体购自Abcam公司。NF-κB抑制剂Helenalin、p38 MAPK信号通路阻断剂SB202190、MEK1/2抑制剂PD98059购自Merck公司,使用浓度分别为1 μM(Helenalin)、5 μM(SB202190)、50 μM(PD98059)。
1.1.2 仪器:ABI-2720 PCR仪(美国ABI公司),电热恒温水槽JXH-308D(广州市金铉映电子科技开发有限公司),凝胶成像系统Gel DocTM XR(美国BIO-RAD),GloMax96微孔板发光检测仪E6501(美国Promega公司);Amaxa Nucleofector电转仪Nucleofector II Manual(德国lonza公司),BD流式细胞仪FACSAria III(美国BD公司),Western bloting仪器(Bio-Rad Mini-PROTEAN Tetra 1658001,美国BD公司)。
1.2 方法
1.2.1 质粒的构建及细胞转染:从健康人外周血和HIV-1培养细胞中提取全基因组DNA作为模板,用表1中所示引物进行PCR扩增DC-SIGN和HIV-15’LTR基因片段,表格中下划线为酶切识别点。所用反应体系为:模板1 μL,10 mM引物各2 μL,2×PCR混合液25 μL,加去离子水至50 μL,反应条件均为:94 ℃ 3 min,94 ℃ 30 s,55 ℃ 1 min,72 ℃ 1 min,30个循环,72 ℃延伸10 min。将测序正确的DC-SIGN和HIV-1 5’LTR PCR片段分别用Bam HI/Xba I和Mlu I/Xho I双酶处理,得到相应的酶切片段,分别克隆入pCDNA3.1(+)真核表达质粒和pGL-3荧光素酶报告质粒的BamHI/XbaI和MluI/XhoI酶切位点之间,得到DC-SIGN的真核表达质粒和HIV-1 5’LTR的荧光素酶报告质粒。将两种质粒通过电转染的方法转染进培养好的293T细胞,将DC-SIGN的真核表达质粒电转染至HIV-1慢性感染的CEM-SS细胞。使用Amaxa Nucleofector电转仪电转,所用细胞量为6×106,质粒用量为0.3 μg,pRL-TK质粒为0.03 μg。将转染或未转染DC-SIGN质粒的293T细胞及CEM-SS细胞在以下试验中按需设为对照组。
DC-SIGN F:5’-CTCGGATCCATGAGTGACTCCAAGGAAC-3’
DC-SIGN R:5’-GCTCTAGATGAAGTTCTGCTACGCAGGA-3’
HIV-1 5’LTR F:5’-TATTACGCGTTGGAAGGGCTAATTTGGTC-3’
HIV-1 5’LTR R:5’-GTGCTCGAGTGCTAGA-GATTTTCCACACT-3’
HIV-1 Tat F:5’-ATGGCAGGAAGAAGCGGAG-3’
HIV-1 Tat R:5’-ATTCCTTCGGGCCTGTCG-3’
GAPDH F:5’-CCATGTTCGTCATGGGTGTG-3’
GAPDH R:5’-GGTGCTAAGCAGTTGGTGGTG-3’
限制酶识别点:BamHI:GGATCC;XbaI:TCTAGA;MluI:ACGCGT;XhoI:CTCGAG
1.2.2 荧光素酶活性检测:将转染了质粒的293T细胞分别用10 μg/mL的HIV-1 gp120蛋白、2倍TCID50的HIV-1毒株和VSV-G-pNL4.3假病毒(不表达HIV-1包膜蛋白,gp120蛋白阴性)刺激,以单独转染HIV-1 5’LTR荧光素酶报告质粒的293T细胞做对照,48 h后检测荧光素酶活性。用双荧光素酶活性检测试剂盒,在GloMax96微孔板发光检测仪上检测荧光素酶活性,按照试剂盒说明书和仪器使用说明书进行操作。
1.2.3 HIV-1复制检测:将转染好DC-SIGN真核表达质粒的HIV-1慢性感染的CEM-SS细胞用HIV-1 gp120蛋白刺激24h,浓度为10 μg/mL。提取细胞中的总RNA,采用PrimeScipt逆转试剂盒(PrimeScriptTMRT reagent Kit RR037A,TaKaRa)和SYBR Green定量检测试剂(SYBR Premix Ex Taq RR420A,TaKaRa)进行逆转录和实时荧光定量PCR反应,检测HIV-1 Tat mRNA表达水平,以GAPDH作为内参,所用引物见表1所示。采用R&D公司HIV-1 p24蛋白ELISA检测试剂盒检测HIV-1 p24蛋白的表达水平,按照说明书所述步骤操作。
1.2.4 流式细胞术检测:将收取的细胞用PBS缓冲液清洗2遍,每管加入10 μL,25~50 μg/mL DC-SIGN一抗孵育1 h,用PBS缓冲液清洗2遍,加入兔抗鼠荧光二抗ALEX488孵育1 h,再用PBS缓冲液清洗2遍,用BD流式细胞仪检测。
1.2.5 Western blot检测:将收取的细胞用细胞裂解液裂解,测定蛋白浓度后,按照每孔相同蛋白量上样,进行SDS-聚丙烯酰胺凝胶电泳,将分离后的蛋白质转移到硝化纤维素膜上,用5%的脱脂牛奶封闭后,加入1~2 μg/mL的鼠抗人DC-SIGN一抗孵育4 ℃过夜,用HRP标记的羊抗鼠二抗孵育2 h后进行显色曝光。提取的胞浆蛋白和核蛋白同法检测,同时检测β-Actin和Tubulin作为包浆蛋白和核蛋白的参照。
1.3 统计学方法 采用SPSS 15.0软件进行分析,所有细胞培养和荧光素酶检测数据均来自3次以上独立试验,荧光素酶活性以相对于内对照质粒pRL-TK的倍数表示,分组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 DC-SIGN诱导HIV-1 5’LTR激活 转染了DC-SIGN质粒的293T细胞株可以高水平表达DC-SIGN,见图1A。相对于DC-SIGN(-)293T细胞株(对照组),HIV-1 gp120和野生型HIV-1可提高DC-SIGN(+)的293T细胞株HIV-1 5’LTR分子的活性(前者刺激前平均荧光素酶活性为8.16(1.31,刺激后为59.83±7.31;后者刺激前平均荧光素酶活性为6.16±1.31,刺激后为42.13±6.82,差异具有统计学意义(P<0.05),而VSV-G-pNL4.3假病毒(不表达gp120)刺激前平均荧光素酶活性为1.67±1.02,刺激后为2.96±1.87不能激活HIV-1 5’LTR分子,见图1B。通过特异性阻断gp120或野生型HIV-1同DC-SIGN结合后,发现HIV-1 5’LTR不能被gp120或野生型HIV-1激活(前者gp120组刺激前平均荧光素酶活性为7.52±1.55,刺激后为10.62±2.12;后者野生型HIV-1组刺激前平均荧光素酶活性为4.36±0.31,刺激后为12.52±2.35),见图1C。
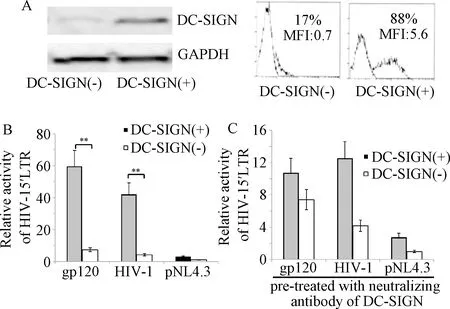
图1 DC-SGIN诱导的HIV-15’LTR活化A:转染或不转染表达DC-SIGN质粒于293T细胞株(Actin作为内参;MFI:平均荧光强度);B:转染表达HIV-1 5’LTR质粒的293T细胞株,分别被gp120、野生型HIV-1(HXB2)和VSV-G-pNL4.3刺激;C:用特异性DC-SIGN中和性抗体预处理各组293T细胞株后,分别gp120、野生型HIV-1(HXB2)和VSV-G-pNL4.3刺激,其转染质粒表达的HIV-1 5 ’LTR活化对比DC-SIGN(+):转染了表达DC-SIGN质粒的293T细胞株;DC-SIGN(-):未转染DC-SIGN表达质粒的293T细胞株**P<0.01,与DC-SIGN(-)组对比Fig.1 DC-SGIN induced HIV-15’LTR activationA:transfected or non-transfected 293T cell line expressing DC-SIGN plasmid in 293T cell line (Actin as internal reference; MFI: mean fluorescence intensity); B: transfected 293T cell line expressing HIV-1 5’LTR plasmid was transfected with gp120, HIV-1 (HXB2) and VSV-G-pNL4.3, respectively; C:After pretreatment of 293T cells with specific DC-SIGN neutralizing antibody, gp120, wild-type HIV-1 and VSV- G-pNL4.3 stimulated its transfected plasmid to express the HIV-1 5 ’LTR activating contrast DC-SIGN(+): 293T cell line expressing DC-SIGN plasmid was transfected;DC-SIGN(-): 293T cell line not transfected with DC-SIGN expression plasmid;**P<0.01, compared with DC-SIGN(-) group
2.2 DC-SIGN诱导的HIV-1前病毒重活化作用 HIV-1 gp120蛋白刺激转染DC-SIGN表达质粒的CEM-SS细胞后,HIV-1早期活化指标Tat mRNA的表达水平和晚期活化指标p24蛋白的表达水平均显著升高[Tat mRNA表达水平,DC-SIGN(+)mock组为(9.31±1.10)%,DC-SIGN(+)+gp120组为(28.55(5.53)%;p24蛋白表达水平DC-SIGN(+)mock组为(0.41(0.11)log(1/trans),DC-SIGN(+)+gp120组为(2.35±0.75)log(1/trans),(P<0.01),见图2A。
图2B为对HIV-1 p24蛋白水平的影响,表明存在HIV-1的完整复制;而未转染DC-SIGN的CEM-SS细胞两个指标表水平均无显著升高[Tat mRNA表达水平,DC-SIGN(-)mock组为(7.41±1.11)%,DC-SIGN(-)+gp120组为(16.22±1.51)%,p24蛋白表达水平DC-SIGN(-)mock组为(0.46±0.13)log(1/trans),DC-SIGN(-)+gp120组为(1.26±0.21)log(1/trans)];用抗体阻断DC-SIGN与HIV-1 gp120蛋白的结合以后,HIV-1的复制显著降低[Tat mRNA 表达水平DC-SIGN(+)+gp120组为(28.55±5.53)%,DC-SIGN(+)+DC-SIGN抑制剂+gp120组(18.45±2.83)%,p24表达水平DC-SIGN(+)+gp120组为(2.35±0.75)log(1/trans),DC-SIGN(+)+DC-SIGN抑制剂+gp120组为(1.35±0.21)log(1/trans)],表明HIV-1的激活是由DC-SIGN介导的;用CCR5抗体阻断CCR5与HIV-1 gp120蛋白的结合以后,再用HIV-1 gp120蛋白刺激,发现HIV-1的复制仍然可以被显著激活[Tat mRNA于mock DC-SIGN(+)组为(9.31±1.10)%,DC-SIGN(+)+gp120+CCR5抑制剂组为(25.21±3.31)%,HIV-1 p24于mock DC-SIGN(+)组0.41±0.09(1/trans),DC-SIGN(+)+gp120+CCR5抑制剂组为(2.12±0.21)log(1/trans)],(P<0.01),病毒复制水平与未阻断CCR5细胞相比无显著差异。
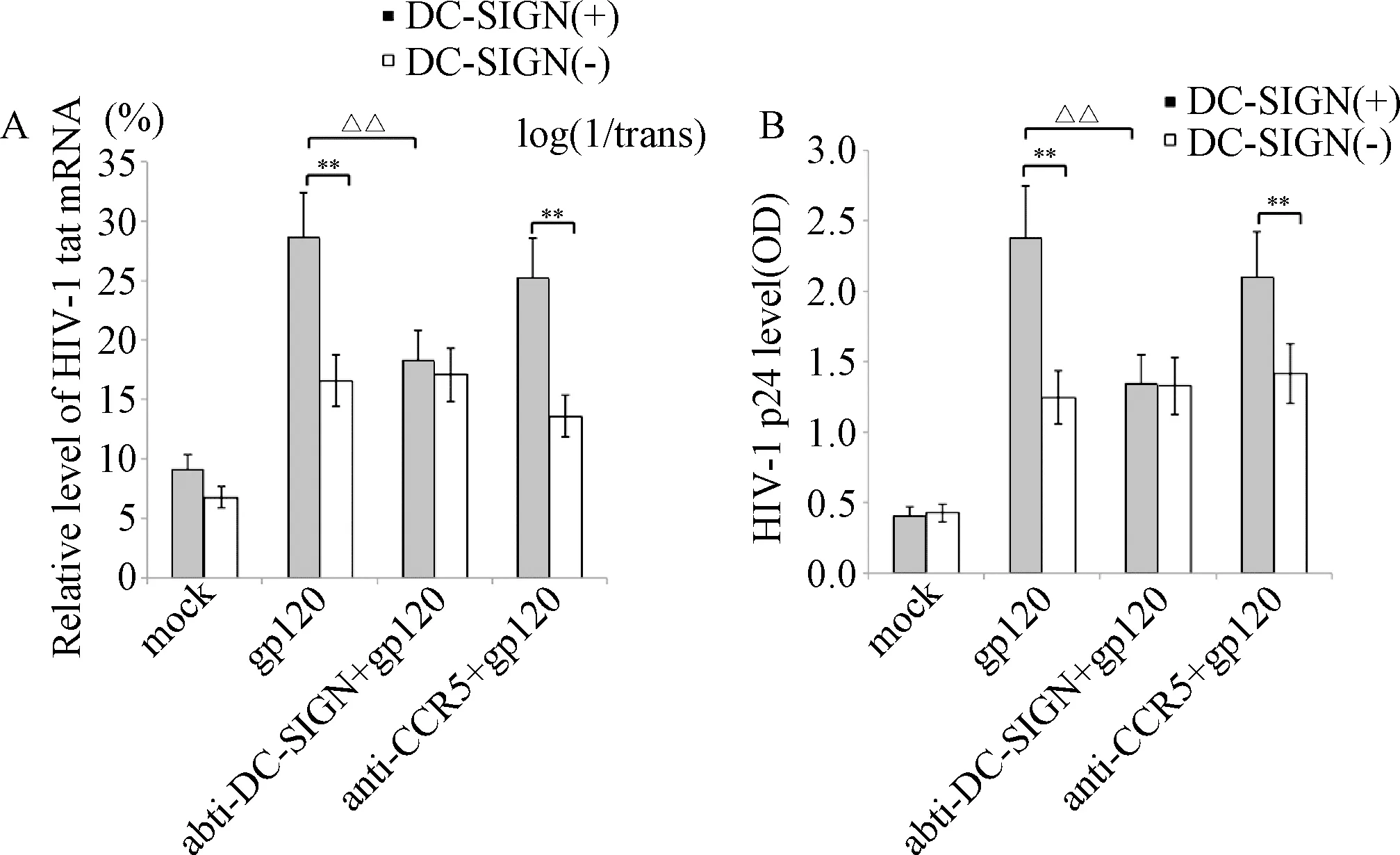
图2 DC-SIGN信号通路对HIV-1前病毒的活化作用A:对HIV-1 tat mRNA相对表达水平的影响,以GAPDH作为内参;B:对HIV-1 p24蛋白水平的影响**P<0.01,与DC-SIGN(-)+gp120组或DC-SIGN(-)+gp120+CCR5抑制剂组比较;△△P<0.01,与DC-SIGN(+)+gp120+ DC-SIGN抑制剂组比较Fig.2 Activation of HIV-1 provirus by DC-SIGN signaling pathwayA:on the relative expression of HIV-1 tat mRNA, GAPDH as the internal reference;B:on HIV-1 p24 protein levels**P<0.01, compared with DC-SIGN(-)+gp120 group or compared with DC-SIGN(-)+gp120 group+CCR5 inhibitor;△△P<0.01, compared with DC-SIGN(+)+gp120+DC-SIGN inhibitor group
2.3 DC-SIGN介导HIV-1前病毒重活化的信号通路机制 DC-SIGN介导的信号通路主要包括ERK、p38 MAPK和NF-κB等信号通路,先用3种信号通路的阻断剂处理HIV-1慢性感染的CEM-SS细胞(转染DC-SIGN质粒),再用gp120刺激。HIV-1慢性感染的CEM-SS细胞为mock组(对照组,设定值1),其它分组见图3A、3B,检测各分组Tat mRNA、HIV-1 p24表达水平,结果见图3A,对HIV-1 tat mRNA相对表达水平的影响。
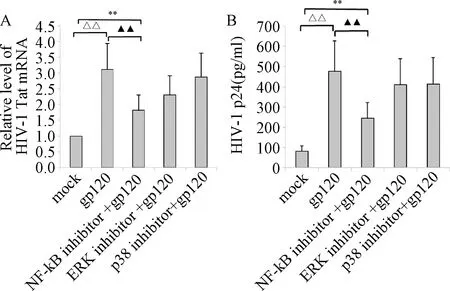
图3 不同信号通路阻断剂对DC-SIGN诱导的HIV-1前病毒活化的影响**P<0.01,与DC-SIGN(-)组相比;△△P<0.01,与加gp120组比较;▲▲P<0.01,与加gp120及NF-κB抑制剂组相比Fig.3 Effects of Different Signal Pathway Blockers on Activation of HIV-1 Previrus by DC-SIGN**P<0.01, compared with DC-SIGN(-) group;△△P<0.01, compared with gp120 group;▲▲P<0.01, compared with NF-kB inhibitor+gp120 group
NF-κB信号通路阻断剂能够显著阻断DC-SIGN介导的HIV-1前病毒活化,包括早期复制和晚期复制(P<0.05),其它信号通路阻断剂效果不明显[mock组、gp120组、NF-κB抑制剂+gp120组、ERK抑制剂+gp120组、p38抑制剂+gp120组的HIV-1 Tat mRNA及p24表达水平分别为1.03±0.01、3.11±1.01、1.82±0.55、2.35±0.73、2.83±0.75;(82±21)、(490±181)、(253±83)、(429±125)、(433±126)pg/mL]。进一步检测gp120刺激DC-SIGN介导的信号通路蛋白活化情况,发现gp120刺激DC-SIGN可以引起磷酸化NF-κB p65蛋白的显著升高(P<0.05),其它信号通路蛋白磷酸化不明显,表明NF-κB信号通路被激活,见图4。
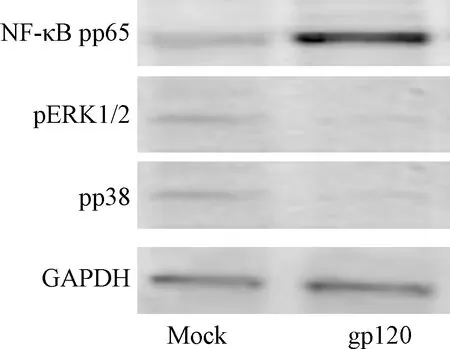
图4 gp120刺激DC-SIGN介导的信号通路蛋白磷酸化Fig.4 Gp120 stimulates DC-SIGN mediated phosphorylation of signaling pathways
3 讨论
目前清除HIV-1感染者体内潜伏感染的细胞的方法多数是利用激活剂诱导静息CD4+T细胞活化,例如促细胞分裂剂、细胞因子/趋化因子、抗CD45RO抗毒素等;或者通过上调基因表达的药物来促进病毒基因的复制,如组蛋白脱乙酰酶(HDAC)抑制剂[14]。然而这些治疗方法缺乏特异性,会引起很强的副作用[15]。此外,这些研究主要是针对静息CD4+T细胞中前病毒的活化,目前对于DCs中前病毒的活化机制研究甚少。HIV-1对DC等髓系细胞的感染率很低,DCs储藏库数量更是有限,缺乏DCs细胞系和研究模型,这些因素可能是导致DCs储藏库研究较少的原因[16]。本研究采用了HIV-1慢性感染细胞CEM-SS细胞转染DC-SIGN表达质粒作为DCs模型。
非HIV病原体的协同感染可能是一种影响HIV复制的重要的外在因素[17],DCs表达的DC-SIGN可结合多种病原体,包括HIV-1 gp120,然后可能通过诱导Raf-1参与的NF-κB亚单位p65和MEK/ERK的磷酸化,进而引起免疫应答[18]。DC-SIGN诱导的信号通路是否可以激活HIV-1前病毒尚不清楚。本研究发现HIV-1 gp120与DC-SIGN结合后可诱导HIV-1 5’LTR的活化以及前病毒的复制,并且是通过gp120与DC-SIGN结合实现的,排除了其它病原体成分及CCR5等其它受体的可能性。
进一步研究发现,HIV-1 gp120与DC-SIGN结合后通过诱导NF-κB信号通路来激活HIV-1前病毒,NF-κB信号通路阻断剂可以阻断HIV-1前病毒的活化和复制。NF-κB信号通路同时在DC-SIGN的表达中有重要作用。多项研究发现IL-4通过多种信号通路,包括ERK, JAK-STAT和NF-κB等信号通路,促进DC-SIGN表达[19]。此外,DC-SIGN的表达水平可被多种微生物调节,其机制可能也是通过微生物感染引起的免疫应答和NF-κB信号通路活化实现的。假设DC-SIGN的表达和潜伏性HIV-1的再活化可被共同的信号通路诱导,比如NF-κB信号通路。当HIV-1前病毒再次活化,DC-SIGN表达也会上调,后者可促进HIV-1复制和感染。DC-SIGN诱导NF-κB信号通路,从而活化DCs储存库中HIV-1前病毒活。但从HIV-1感染和传播方面看,DC-SIGN的表达和潜伏HIV再活化之间关联密切,两者形成恶性循环。这可能是部分HAART治疗艾滋病患者存在HIV-1持续低水平复制和耐药的原因之一。
综上所述,本研究发现HIV-1通过gp120蛋白与DC-SIGN结合,引起NF-κB信号通路的活化,进而诱导HIV-1前病毒的复制。这种活化机制在维持DCs储藏库中的作用有待进一步研究,为制定清除HIV-1储藏库的策略提供思路。
[1] Coiras M,Lopez-Huertas MR,Alcami J.HIV-1 latency and eradication of long-term viral reservoirs[J].Discov Med,2010,9(46):185-191.
[2] Sharkey M,Triques K,Kuritzkes DR,et al.In vivo evidence for instability of episomal human immunodeficiency virus type 1 cDNA[J].J Virol,2005,79(8):5203-5210.
[3] Marsden MD,Zack JA.Establishment and maintenance of HIV latency:model systems and opportunities for intervention[J].Future Virol,2010,5(1):97-109.
[4] Pace MJ,Agosto L,Graf EH,et al.HIV reservoirs and latency models[J].Virology,2011,411(2):344-354.
[5] Guler SK,Gunes N,Cokal BG,et al.Tuberculous ventriculitis as a relapse following central nervous system tuberculoma[J].Neurol Sci,2015,36(1):167-169.
[6] Gallastegui E,Millan-Zambrano G,Terme JM,et al.Chromatin reassembly factors are involved in transcriptional interference promoting HIV latency[J].J Virol,2011,85(7):3187-3202.
[7] Margolis DM.Histone deacetylase inhibitors and HIV latency[J].Curr Opin HIV AIDS,2011,6(1):25-29.
[8] Hakre S,Chavez L,Shirakawa K,et al.Epigenetic regulation of HIV latency[J].Curr Opin HIV AIDS,2011,6(1):19-24.
[9] Yang X,Chen Y,Gabuzda D.ERK MAP kinase links cytokine signals to activation of latent HIV-1 infection by stimulating a cooperative interaction of AP-1 and NF-kappaB[J].J Biol Chem,1999,274(39):27981-27988.
[10] Geijtenbeek TB,Kwon DS,Torensma R,et al.DC-SIGN,a dendritic cell-specific HIV-1-binding protein that enhances trans-infection of T cells[J].Cell,2000,100(5):587-597.
[11] McGreal EP,Miller JL,Gordon S.Ligand recognition by antigen-presenting cell C-type lectin receptors[J].Curr Opin Immunol,2005,17(1):18-24.
[12] Perkins ND,Edwards NL,Duckett CS,et al.A cooperative interaction between NF-kappa B and Sp1 is required for HIV-1 enhancer activation[J].EMBO J,1993,12(9):3551-3558.
[13] Peterlin BM,Trono D.Hide,shield and strike back:how HIV-infected cells avoid immune eradication[J].Nat Rev Immunol,2003,3(2):97-107.
[14] Redel L,Le Douce V,Cherrier T,Marban C,Janossy A,Aunis D,Van Lint C,et al.HIV-1 regulation of latency in the monocyte-macrophage lineage and in CD4+ T lymphocytes[J].J Leukoc Biol,2010,87:575-588.
[15] Shang HT,Ding JW,Yu SY,Wu T,Zhang QL,Liang FJ.Progress and challenges in the use of latent HIV-1 reactivating agents[J].Acta Pharmacol Sin,2015;36(8):908-916.
[16] van der Sluis RM,van Montfort T,Pollakis G,Sanders RW,Speijer D,Berkhout B,Jeeninga RE.Dendritic cell-induced activation of latent HIV-1 provirus in actively proliferating primary T lymphocytes[J].PLoS Pathog,2013,9:e1003259.
[17] Blanchard A,Montagnier L,Gougeon ML.Influence of microbial infections on the progression of HIV disease[J].Trends Microbiol,1997,5(8):326-331.
[18] den Dunnen J,Gringhuis SI,Geijtenbeek TB.Innate signaling by the C-type lectin DC-SIGN dictates immune responses[J].Cancer Immunol Immunother,2009,58(7):1149-1157.
[19] Jin C,Wu L,Li J,Fang M,Cheng L,Wu N.Multiple signaling pathways are involved in the interleukine-4 regulated expression of DC-SIGN in THP-1 cell line[J].J Biomed Biotechnol,2012,2012:357-360.
(编校:师维康)
Role of DC-SIGN induced signaling pathway in the activation of HIV-1 virus
LI jie1, JIN Chang-zhong2, CHENG Lin-fang2, LIU Fu-min2, WU Nan-ping2Δ
(1.Department of Infectious Disease, The Second Affiliated Hospitlal (Yuying Children’s Hospital) of Wenzhou Medical University, Wenzhou 325027 China; 2.State Key Laboratory for Diagnosis and Treatment of Infectious Diseases, the First Affiliated Hospital, College of Medicine of Zhejiang University, Hangzhou 310003, China)
ObjectiveTo explore the mechanism of latent human immunodeficiency ciency virus type 1 (HIV-1) infection is unclear, especially in dendritic cells (DC). We hypothesized that DC-specific intercellular adhesion molecule-3-grabbing non-integrin (DC-SIGN) binds with HIV-1 may activate HIV-1 provirus.MethodsWe generated a model by transfecting 293T cells with a DC-SIGN expression plasmid and a HIV-1 5’ long terminal repeat (LTR) reporter plasmid, and then stimulated the 293T cells with HIV-1 gp120 protein, wild-type HIV-1 and VSV-G-pNL4.3 pseudotype virus (without gp120 protein). CEM-Bru cells were transfected with the DC-SIGN expression plasmid and stimulated by HIV-1 gp120 protein. Then HIV-1 replication was detected. The involvement of the ERK, p38 and NF-κB pathways signaling in this response were determined by inhibiting the pathways specifically and detecting the phosphorylation of the signaling kinase.ResultsThe HIV-1 5’ LTR was reactivated by HIV-1 gp120 in DC-SIGN-expressing 293T cells. After HIV-1 gp120 protein stimulation of the mold of CEM-Bru cells, the increasing expression of HIV-1 Tat mRNA and HIV-1 p24,which implies early and late HIV-1 provirus replication was reactivated by the HIV-1 gp120/DC-SIGN stimulation. HIV-1 gp120/DC-SIGN stimulation reactivates latent HIV-1 provirus via the NF-κB signal pathway.ConclusionHIV-1 gp120/DC-SIGN stimulation reactivates latent HIV-1 provirus via the NF-κB signal pathway.
HIV-1; DC-SIGN; viral latency; signaling pathways; NF-κB
10.3969/j.issn.1005-1678.2016.12.010
国家自然科学基金(81402726);浙江省公益性技术应用研究计划(2015C33183)
李杰,男,硕士,住院医师,研究方向:感染肝病,E-mail:jaly1111@126.com;吴南屏,通信作者,女,教授,博士生导师,研究方向:干扰素调控宿主限制因子SAMHD1表达的机制及其在HIV-1感染固有免疫应答中的作用,E-mail:flwnp2013@163.com。
R322.2+5;R512.91
A

