进口南美白对虾亲虾急性肝胰腺坏死病的检测分析
张 娜,王津津,谢艳辉,于 力,李家侨,刘 莹(. 湛江出入境检验检疫局,广东湛江 54000;. 深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳 58045)
进口南美白对虾亲虾急性肝胰腺坏死病的检测分析
张娜1,王津津2,谢艳辉1,于力2,李家侨1,刘莹2
(1. 湛江出入境检验检疫局,广东湛江524000;2. 深圳出入境检验检疫局动植物检验检疫技术中心,广东深圳518045)
摘要 :急性肝胰腺坏死病(AHPND)是一种新发疫病,对对虾养殖业损失巨大。其病原是携带毒素质粒基因的副溶血弧菌,但具体致病机制仍不清楚。本研究利用国外报道的毒素质粒基因特异性引物,对一批进境南美白对虾亲虾进行了AHPND检测。因其PCR的扩增结果与国外所报道的基因片段一致,初步认定为AHPND阳性。本文对此次检测的结果和过程进行了分析,为我国AHPND的检测提供了分析数据。
关健词:急性肝胰腺坏死;早期死亡综合症;毒素质粒;PCR扩增
2009年我国首次暴发急性肝胰腺坏死病(AHPND)[1],最初被称为早死综合症(EMS)。近几年来,很多国内外学者针对AHPND病原做了很多研究[2-8]。目前的研究资料表明,AHPND病原是一种特异的常见革兰氏阴性菌——嗜盐的副溶血性弧菌。其主要致病原因是由于副溶血性弧菌携带了PVA-1毒素质粒。到目前为止,其致病机制仍不清楚。鉴于该病的危害巨大,目前世界动物卫生组织(OIE)已将其列入水生动物疫病法定报告名录。
本研究利用针对毒素质粒基因的引物,对一批进境南美白对虾亲虾进行了检测,发现亲虾致病性AHPND菌株感染阳性。此次检测为我国AHPND检测方法的建立和监控工作提供了重要资料。
1 材料与方法
1.1材料
1.1.1试验材料。随机采集广东省湛江地区对虾养殖场亲虾3尾。rTaq 反应酶、dNTP、DNA 分子量标准物 DL2000、琼脂糖,均为大连宝生物(TaKaRa)工程有限公司产品。
1.1.2主要仪器设备。PCR扩增仪(美国ABI 公司)、凝胶成像仪(德国Biometra公司)、高速冷冻离心机(Eppendorf centrifuge 5417R)、电泳仪(DYY-8C,北京市六一仪器厂)。
1.2方法
1.2.1样品处理。对进境南美白对虾亲虾活体3尾,取肝胰腺,按1∶10的比例放入1.5% NaCl的TSB培养基中,30 ℃,250 r/m,振荡培养5~6 h。震荡结束后,取菌液放入1.5 mL离心管中,3 000 r/m,离心5 min,弃上清,加PBS悬浮,按照核酸抽提试剂盒的操作提取DNA。
1.2.2PCR扩增初筛。使用质粒引物AP3:F:5'-ATGAGTAACAATATAAAACATGAAAC-3';R:5'-GTGGTAATAGATTGTACAGAA-3'。反应体系为:10 PCR buffer(Mg2+Plus)2.5 μL,AP3上下游引物各(10 μmol/L)1 μL,dNTP(10 mM)2 μL,TaqDNA聚合酶0.5 μL,提抽物5 μL,加水补至25 μL。按照以下程序进行扩增:94 ℃5 min,然后进行32次循环(94 ℃ 30 s,53 ℃ 30 s,72 ℃ 40 s),72 ℃ 5 min,4 ℃ 保温。
1.2.3nested-PCR扩增。质粒AP4-1引物:F1:5'-ATG AGT AAC AAT ATA AAA CAT GAA AC-3';R1:5'-ACG ATT TCG ACG TTC CCC AA-3'。 质粒AP4-2引物:F2:5'-TTG AGA ATA CGG GAC GTG GG-3';R2:5'-GTT AGT CAT GTG AGC ACC TTC-3'。反应体系为:10 PCR buffer(Mg2+Plus) 2.5 μL,AP4-1上下游引物各(10 μmol/L)1 μL,dNTP(10 mM)2 μL,TaqDNA聚合酶0.5 μL,提抽物5 μL,加水补至25 μL。按照以下程序进行扩增:94 ℃ 2 min;然后进行30次循环(94 ℃ 30 s,55 ℃ 30 s,72 ℃ 90s),72 ℃ 2 min;4 ℃ 保温。取第一步的PCR产物,进行第二步nested-PCR。反应体系为:10 PCR buffer(Mg2+Plus)2.5 μL,AP4-2上下游引物各(10 μmol/L)1 μL,dNTP(10 mM)2 μL,TaqDNA聚合酶0.5 μL,第一步PCR产物2 μL,加水补至25 μL。按照以下程序进行扩增:94 ℃ 2 min;然后进行25次循环(94 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s),72℃ 2min;4 ℃ 保温。
1.2.4质粒毒素基因PCR扩增。Pir VP A引物:F:5'- ATG AGT AAC AAT ATA AAA CAT G-3';R:5'- TTA GTG GTA ATA GAT TGT ACA G-3'。Pir VP B引物:F:5'- GAG CCA GAT ATT GAA AAC ATT TGG-3';R:5'- CCA CGC AGC GAG TTC TGT AAT GTA-3'。VpPirA-284引物:F:5'- TGA CTA TTC TCA CGA TTG GAC TG-3';R:5'- CAC GAC TAG CGC CAT TGT TA-3'。VpPirB-392 引物:F:5'-TGA TGA AGT GAT GGG TGC TC-3';R:5'- TGT AAG CGC CGT TTA ACT CA-3'。每个引物的扩增反应体系分别为:10 PCR buffer(Mg2+Plus)2.5 μL,各引物的上下游引物各(10 μmol/L)1 μL,dNTP(10 mM)2 μL,TaqDNA聚合酶0.5 μL,提抽物5 μL,加水补至25 μL。按照以下程序进行扩增:94 ℃ 5 min;然后进行30次循环(94 ℃ 30 s,60 ℃ 30 s,72 ℃ 60 s),72 ℃ 2 min;4 ℃ 保温。
1.2.5扩增产物测序与序列同源性比对。PCR扩增条带经上海英骏生物技术有限公司测序,测序结果分别与NCBI基因序列库进行比对。
1.2.6不同保存条件下的组织和菌液PCR扩增实验比对。肝胰腺组织、肝胰腺增菌液和PBS菌液悬浮液分别在-20 ℃、4 ℃和25 ℃条件下保存3天。同时对保存在25 ℃条件下的增菌液用TSB反复增菌5次,分别同时用AP3特异性引物进行PCR扩增,操作如1.2.3。
1.2.7致病性副溶血弧菌的分离培养。在进行1.2.1样品处理的同时,取肝胰腺组织在TSA、TCBS和弧菌特异性显色培养基中划板,37 ℃,培养20~24 h,挑取单菌落扩大培养,再PCR扩增。在进行1.2.1获得肝胰腺组织增菌液之后,取增菌液划板培养。
2 结果
2.1PCR扩增初筛结果
以南美白对虾亲虾肝胰腺增菌液的DNA为模板,进行AP3引物扩增,产物经1%的琼脂糖凝胶电泳分析,结果显示一条大小约为333 bp的特异性目的条带,与预计的大小一致(图1)。
采用SPSS 18.0统计学软件对数据进行处理,计数资料以例数(n)、百分数(%)表示,采用x2检验;计量资料以“ ±s”表示,采用t检验,以P<0.05为差异有统计学意义。
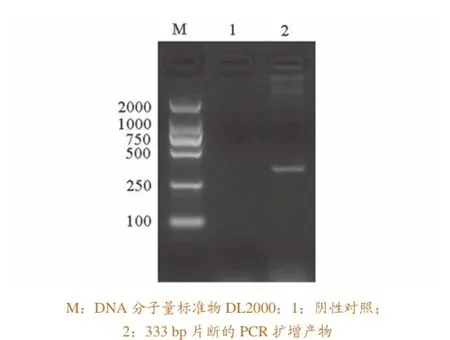
图1 AP3引物扩增PCR产物电泳分析
2.2nested-PCR扩增
以AP4引物进行nest-PCR扩增,产物经1%的琼脂糖凝胶电泳分析。结果显示,第一步PCR扩增产物1 269 bp,第二步PCR扩增产物230 bp,与预计的大小一致(图2)。

图2 AP4引物扩增PCR产物电泳分析
2.3质粒毒素基因PCR扩增
分 别 用PirVPA、PirVPB、VpPirA-284、Vp-PirB-392 引物进行PCR扩增,产物经1%的琼脂糖凝胶电泳分析,结果与预计的大小一致(图3)。
2.4扩增产物测序与序列同源性比对
PCR扩增条带经上海英骏生物技术有限公司测序,测序结果分别与NCBI中基因序列比对。本文扩增的阳性所有片断都与Lee 等[9]所得到的序列有99.9%的同源性,结果一致。
2.5致病性副溶血弧菌的分离培养
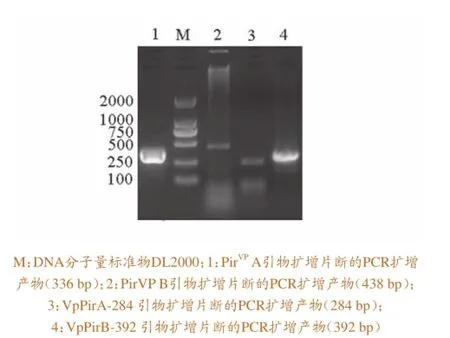
图3 质粒毒素引物扩增PCR产物电泳分析
同样,用肝胰腺的增菌液划板培养后,随即挑取30个TCBS上特异性绿色菌落和显色培养基中呈弧菌特征的粉色菌落,进行PCR扩增,结果为阴性。
检测结果表明,所挑取的这些单菌落都没有携带特异性致病基因,不是致病性副溶血弧菌菌株。
3 讨论
2013年,Tran等[4]提出AHPND病原是一种特异的常见革兰氏阴性菌株——嗜盐性副溶血弧菌。通过一些未知的致病机制,这一菌株成为致病性菌株,从而诱导感染对虾出现AHPND的特征性症状。Lightner[10]指出所有致病的副溶性弧菌中都包含一种-89序列基因,这可能是引发病害的关键序列。因为它能够改变DNA序列基因的位置,引发基因突变,从而诱发病变。
有研究表明,即使AHPND引起HP细胞大量脱落而进入HP管中,但是在病变位置没有发现任何细菌[11]。这些发现引发一些观点,即Tran等提出的AHPND独特的病理学特征是由分泌毒素引起,即可肉眼观察到的坏死病变是由一些未知毒素引起的,从而推测AHPND特异性症状由PIRAVP 和PIRBVP两个分泌型毒素引起,并且这两种蛋白都是由质粒PVA1编码的[2,11-12]。
Lee 等[9]进而对2株AHPND致病菌株纯化的质粒进行测序(3HP和M1-1),测序结果显示两个菌株都含有一个70 kbp大小的质粒,两个PVA1的序列同源性达到98%~99%。这个AHPND相关质粒被命名为PVA1。此质粒上带有与光杆菌同源的昆虫相关的毒素(“Photorhabdus insectrelatedPir toxins,PirA and PirB)[12]。在自然缺乏或是基因删除此Pir毒素的试验中,致病株明显失去致病能力,所以副溶血弧菌的Pir毒素是引起AHPND的关键。然而PVA1质粒是如何进入对虾体内的,目前尚不太清楚。
经过序列比对,本研究扩增的所有阳性片断都与Lee等所得到的序列有99.9%的同源性,结果一致,说明本研究采用的阳性菌株检测方法与Lee等所提出的检测方法可以相互对应,可以用毒素质粒基因进行病原检测。
本研究在进行肝胰腺菌株和增菌液划板培养时,所挑取的TCBS和显色培养基中的共60个单菌落都不是致病性副溶性弧菌菌株。这提示非致病性副溶血弧菌在肝胰腺中广泛和大量存在,与致病性副溶血弧菌菌株一起存活。
本研究对肝胰腺组织不进行增菌培养而直接抽提DNA进行PCR扩增。结果发现,直接进行组织抽提没有检出阳性,与增菌后的菌液PCR检测结果相比,敏感性非常低,所以在病原检测时应选择肝胰腺增菌后的菌液。
OIE在《水生动物疾病诊断手册》关于AHPND一章的征求意见稿中,曾提出只有需要分离出菌株后,才能确诊为阳性;随后2016年2月又改为需要进行感染实验,以确认致病因果关系。本研究认为这两种要求均不具有可操作性。首先,副溶血弧菌广泛存在于环境中,将增菌液或组织匀浆液涂布于平板培养后,能挑选到携带质粒的单菌落的概率很小,而且AHPND肝胰腺增菌混合液在反复增菌后,PCR扩增不出阳性条带,样品中的优势菌可能在反复增菌过程中逐渐取代了AHPND致病毒菌,使得毒素基因很难再被检测到。其次,关于感染实验,需要使用SPF级别的敏感宿主南美白对虾或斑节对虾,需要具备一定级别的实验室条件和设备,可操作性低。因此,本研究认为只要获得了含有携带毒素质粒的混合菌液,结合PCR和测序比对,就能确认为AHPND阳性。
Kongrueng等[13]从泰国南部发现了几株具有血清学相似性AHPND副溶血弧菌,它们的脉冲场凝胶电泳图谱密切相似。由此他们推断,这些菌株可能都起源于一个单一的克隆,但目前仍缺乏说服力。因为这些菌株都来自于单一的地理区域,缺乏地理多样性。而在其它报道中[14],也都是从一个区域的养殖场样品中分离出不同的AHPND致病株。PVA1 质粒来源于单一的副溶血弧菌菌株,还是来源于不同的菌株,目前还不清楚。若想有效解决这个问题,必须使AHPND致病菌株具有广泛的地理多样性。本次检测可以为国内外AHPND病原检测提供很好的经验,为今后的AHPND的病原检测提供重要的检验依据。
参考文献:
[1] NACA-FAO. Quarterly Aquatic Animal Disease Report (Asia and Pacific Region)[R]. Bangkok:NACA-FAO,2011.
[2] Tran L,Nunan L M,Renman R M,et al. Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp[J]. Dis Aquat Organ, 2013,105(1):45-55.
[3] Sirikharin R,Taengchaiyaphum S,Sritunya K,et al. A new and improved PCR method for detection of AHPND bacteria[EB/OL].(2014-06-18)[2016-04-10].http:// www. enaca.org/modules/news/article.php?Article-id=2030.
[4] Soto R S A,Gomez G B,Lozano O R,et al. Field and experimental evidence of Vibrioparahaemolyticus as the causative agent of acute hepatopancreatic necrosis disease of culture shrimp (Litopenaeus vannamei) in northwesten Mexico. Appl.Environ[J].Microbiol, 2015,81:1-11.
[5] Sritunyalucksana K,Dangtip S,Sauguanrut P,et al. A twotube,nested PCR detection method for AHPND bacteria[EB/ OL].(2015-10-02)[2016-04-10]. http:// www.enaca.org/ modules/news/article.php?Article-id=2030.
[6] Tinwongger S,Proespraiwong P,Thawonsuwan J,etal.Development of PCR diagnosis method for shrimp acute hepatopancreatic necrosis disease 1(AHPND)strain of Vibrio parahaemolyticus[J].Fish Pathol,2014,49:159-164.
[7] Tran L,Nunan L M,Renman R M,et al. Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp[J]. Dis. Aquat. Org,2013,105:45-55.
[8] Yang Y T,Chen L T,Lee C T,et al. Draft Genome Sequences of Four Strains of Vivrio parahaemolyticus,Three of which Cause Early Mortality Syndrome/Acute Hepatopancreatic Necrosis Disease in Shrimp in China and Thailand[J].Genome Announcements,2014,2(5):1-2.
[9] Lee C T,Chen I t,Yang Y T,et al. The opportunistic marine pathogen Vibrio parahaemolyticus becomes virulent by acquiring a plasmid that expresses a deadly toxin[J]. Proc Natl Acad Sci U S A,2015,112(34):10798-10803.
[10]. Lightner D V,Redman R M,Pantoja C R,et al. Tran L Early mortality syndrome affects shrimp in Asia[J]. Global Aquaculture Advocate,2012,15:40.
[11] Nunan L, Lightner D, Pantoja C,et al. Detection of acute hepatopancreatic necrosis disease (AHPND)in Mexico[J]. Dis Aquat Organ.,2014,111(1):81-86.
[12] Han J E,Tang F F J,Lightner D V. Photorhabdus insect related(Pir)toxin like genes in a plasmid of Vibrio parahaemolyticus,the causative agent of acute hepatopancreatic necrosis disease(AHPND)of shrimp[J]. Dis.Aquat.Org.,2015,113:33-40.
[13] Kongrueng J,Yingkajorn M,Bunpa S,et al. Characterization of Vibrio parahaemolyticus causing acute hepatopancreatic necrosis disease in southern Thailand[J]. J Fish Dis,2014,38(11):957-966. doi:10.1111/jfd.12308.
[14]Joshi J,Srisala J,Truong V H,et al. Variation in Vibrio parahaemolyticus isolates from a single Thai shrimp farm experiencing an outbreak of acute hepatopancreatic necrosis disease (AHPND)[J]. Aquaculture,2014(428/429):297-302. doi:10.1016/j.aquaculture.2014.03.030.
(责任编辑:朱迪国)
Analysis on the Test Result of Acute Hepatopancreatic Necrosis Disease from Imported Penaeus vannamei Broodstock
Zhang Na1,Wang Jinjin2,Xie Yanhui1,Yu Li2,Li Jiaqiao1,Liu Ying2
(1. Zhanjiang Entry-Exit Inspection and Quarantine Bureau,Zhanjiang,Guangdong 524000;2. Animal and Plant Inspection and Quarantine Technology Center,Shenzhen Entry-Exit Inspection and Quarantine Bureau,Shenzhen,Guangdong 518045)
Abstract:Acute hepatopancreatic necrosis disease(AHPND)is an emerging disease causing enormous loss to shrimp aquaculture. The pathogen is a kind of Vibrio parahaemolyticus with plasmid of toxin,but its detailed pathogenic mechanism is still unclear. The primers targeting toxin plasmid were used to detect AHPND from a batch of imported Penaeus vannamei broodstock in this study. The PCR results showed that the same sized band confirmed AHPND was positive. Analysis on the results and processes of performance provided important data for AHPND detection in China.
Key words:AHPND;EMS;toxin plasmid;PCR amplification
中图分类号:S945.4
文献标识码:B
文章编号:1005-944X(2016)07-0090-05
DOI:10.3969/j.issn.1005-944X.2016.07.027
基金项目:国家质检总局科技计划项目(2010IK007)

