MicroRNA-19a/b与胃癌增殖、凋亡及临床病理特征的关系*
王 芳,王鹓臻,王晶晶,何 芳
(宁夏医科大学总医院消化内科,银川 750004)
·论 著·
MicroRNA-19a/b与胃癌增殖、凋亡及临床病理特征的关系*
王 芳,王鹓臻,王晶晶,何 芳△
(宁夏医科大学总医院消化内科,银川 750004)
目的 探讨microRNA-19a/b(miR-19a/b)对人胃癌细胞的增殖和凋亡的影响及可能机制,并研究miR-19a/b的表达量与胃癌临床病理特征的关系。方法 建立稳定过表达miR-19a/b的SGC7901细胞系,以MTT比色法及平板克隆形成实验检测转染miR-19a/b后细胞增殖变化、 Annexin V- FITC/PI双染法检测细胞凋亡变化,Western blot检测ERK、p-ERK、AKT、p-AKT及PTEN的蛋白表达变化,实时定量PCR方法检测分析miR-19a/b与胃癌组织分化程度、TNM分期及淋巴结转移的关系。结果 在SGC7901细胞中过表达miR-19a/b后产生以下效应: 细胞增殖能力增加,MTT实验显示转染miR-19a及miR-19b后检测72 h的细胞增殖能力与对照组相比分别增加2.2倍和1.6倍,平板克隆实验显示转染miR-19a及miR-19b后细胞的克隆形成能力与对照组相比分别增加3.6倍和3.0倍;细胞凋亡减少,转染miR-19a及miR-19b后细胞的凋亡能力与对照组相比分别降低53%和33%,与对照组相比, p-AKT、p-ERK蛋白表达水平增加,PTEN蛋白表达水平降低,差异具有统计学意义(P<0.05)。在58例胃癌组织标本检测中,miR-19a/b的miRNA表达水平与年龄、性别、分化程度无关(P>0.05),而与TMN分期、淋巴结转移成负相关(P<0.05)。结论 miR-19a/b可促进胃癌细胞增殖、抑制细胞凋亡,且与胃癌的TMN分期、淋巴结转移呈负相关。
胃肿瘤;细胞凋亡;细胞增殖;病理学;miR-19a/b
胃癌是全球常见的第二大肿瘤,我国每年新发病例约40万例,占世界总发病例数的42%[1-2]。由于胃癌及癌前病变的症状具有隐匿性和无特异性,因此多数患者通过临床症状就诊时多为中晚期,治疗效果和预后较差。若能显著提高早期诊断的特异性,将极大提高患者的生存率和预后。目前已发现的血清肿瘤标志物对胃癌的诊断意义有限,因此继续探寻敏感性及特异度兼有的胃癌标志物对于提高胃癌的早期诊断率、改善胃癌患者预后具有非常重要的意义。通过上调人胃癌细胞SGC7901中miR-19a/b的表达,观察胃癌细胞增殖、凋亡变化,以及对AKT、p-AKT、ERK、P-ERK及PTEN蛋白表达变化,进一步探讨miR-19a/b在SGC7901细胞中的增殖和凋亡的作用机制及与胃癌临床病理特征的关系。
1 材料与方法
1.1 材料
1.1.1 胃癌细胞SGC7901引自北京军事医学科学院,由宁夏医科大学总医院实验室保存,RPMI-1640培养基及胎牛血清(Hyclone公司),hsa-miR-19a、hsa-miR-19b及has-miR-NC(上海吉凯基因化学技术有限公司)、聚凝胺(Santa公司)、Trizol及RT-PCR相关试剂(大连TaKaRa公司),引物由南京金斯瑞生物科技有限公司合成,FITC-annexin V/PI凋亡试剂盒(美国BD),四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO,美国Sigma公司),AKT、p-AKT、ERK、p-ERK、PTEN抗体[赛俊通(上海)生物试剂有限公司]。
1.1.2 石蜡病理标本 选择有电话随访的、在宁夏医科大学总医院住院行手术治疗的胃癌患者的癌组织及癌旁组织石蜡病理标本,患者术前均未接受过放疗或化疗,术后病理证实为胃癌。
1.2 方法
1.2.1 细胞培养 人胃癌细胞SGC7901接种于含10%胎牛血清的RPMI-1640培养基,置于37 ℃、饱和湿度、5% CO2培养箱中传代培养,收集对数生长期的细胞进行实验。
1.2.2 细胞转染及鉴定 将SGC7901细胞接种于6孔培养板,每孔接种细胞1×105个。在37 ℃ CO2培养箱中孵育过夜后吸净培养基,PBS冲洗3次,每孔加入无血清培养基0.5 mL、8 μg/mL的聚凝胺、2 μL慢病毒包被的hsa-miR -19a(miR-19a组)、has-miR-19b(miR-19b组)或空白载体(NC组),孵育4~6 h后每孔再加入含血清的培养基2.5 mL继续孵育,转染后72 h荧光显微镜下观察GFP发光情况。
1.2.3 实时荧光定量RT-PCR检测 转染后72 h收集转染细胞,检测转染细胞miR-19a/b的表达以验证转染效果;细胞转染后按照Trizol说明书提取总RNA,以特异性引物为模板,应用PrimeScript RT reagent Kit催化合成cDNA。应用SYBR Premix Ex TaqⅡ进行实时定量PCR,以cDNA为模板进行PCR扩增。根据Hsa-miR-19的基因信息,设计引物(1)miR-19a:5′-TGT GCA AAT CTA TGC AAA ACT GA-3′;(2)miR-19b:5′-TGT GCA AAT CCA TGC AAA ACT GA-3′;U6为内参,进行归一化。样品目的基因的相对表达率(Relative Expression,RQ)采用△△CT方法计算。
1.2.4 细胞增殖能力的检测 (1)MTT法检测各组细胞的增殖活性:将对数生长期的稳定转染细胞接种于96孔培养板中,分别在24、48、72 h每孔加入MTT 20 μL (5 mg/mL),置37 ℃,5% CO2培养箱继续培养,4 h后取出培养板,弃上清液,每孔加150 μL DMSO溶解甲瓒蓝紫色颗粒,振荡10 min,酶联免疫检测仪检测波长为490 nm的吸光度值(A值)。每组设6个平行孔,取均值绘制细胞生长曲线。(2)平板克隆形成实验:对数生长期的转染细胞以胰酶消化成单细胞悬液,每孔200个接种于6孔板中,静止培养2周,肉眼可见的克隆时终止培养,磷酸盐缓冲液(PBS)清洗后加甲醇1 min,吉姆萨液染色。
1.2.5 流式细胞仪检测细胞凋亡率 流式细胞仪检测细胞凋亡按Annexin V- FITC/PI凋亡试剂盒说明书操作。各组细胞加入5-FU(终浓度为15 μg/mL),37 ℃、5% CO2培养箱中继续培养48 h,PBS洗涤3次,加入0.5 mL结合缓冲液重悬细胞,再加入6 μL FITC- Annexin V和20 μL PI,室温避光孵育15 min,离心弃上清液,加入300 μL结合缓冲液,流式细胞仪检测凋亡率,计数1×104个细胞。实验重复3次。
1.2.6 蛋白质免疫印迹法(Western blot) 检测各组细胞AKT、p-AKT、ERK、p-ERK及PTEN的表达变化。将细胞裂解提取总蛋白,进行10%聚丙烯酰胺凝胶电泳(SDS-PAGE),并转至硝酸纤维素膜上,常规封闭、一抗孵育过夜,后孵育二抗,用化学发光法显色,凝胶成像系统采集成像。目的蛋白相对表达量=目的条带的灰度值/同一样本内参的灰度值。
2 结 果
2.1 稳定过表示miR-19a/b的SGC7901细胞系的建立 慢病毒包被的含荧光蛋白(GFP)的hsa-miR-19a、hsa-miR-19b及空白载体hsa-miR-NC分别感染亲本细胞SGC7901,荧光显微镜下观察发现慢病毒载体在表达特定miRNA的同时表达绿色荧光蛋白(图1)。
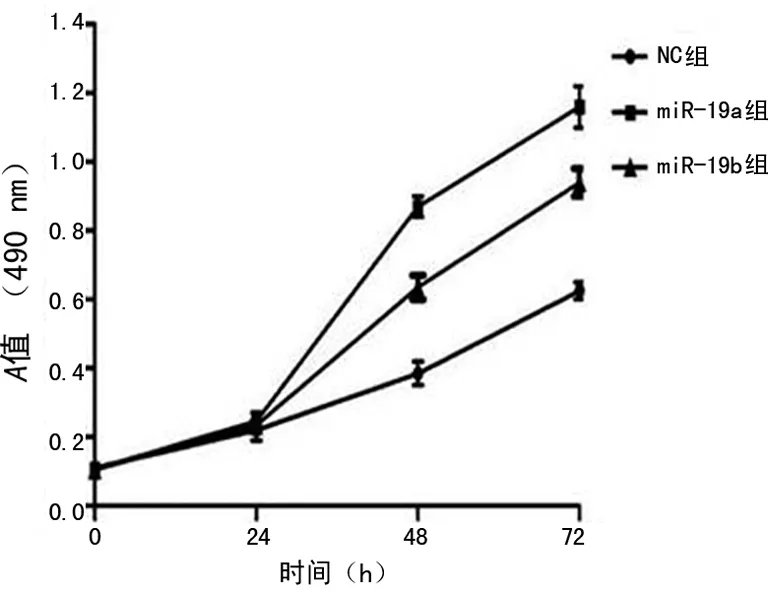
图3 MTT法检测不同时间段各组细胞增殖能力变化
2.2 RT-PCR检测转染miR-19a/b后miRNA的表达变化 各组细胞转染miR-19a/b后提取总RNA,采用Real-time- PCR定量检测miR-l9a/b表达情况。结果显示,稳定转染miR-19a/b的细胞miRNA表达量与NC相比明显上调,转染后72 h时检测miR-19a的miRNA水平较对照组增加12.5倍,miR-19b的miRNA水平较对照组增加15.0倍,差异有统计学意义(P<0.05),见图2。
2.3 MTT检测细胞生长曲线 24、48、72 h分别检测miR-19a/b细胞的增殖能力,结果显示转染miR-19a及miR-19b后细胞的增殖能力比NC组明显增高,72 h转染miR-19a及miR-19b后细胞的增殖能力比NC组分别增加2.2倍和1.6倍,差异具有统计学意义(P<0.05,图3)。
2.4 平板克隆形成实验 稳定转染miR-19a/b后形成的克隆数明显高于NC组,转染miR-19a及miR-19b后细胞的克隆数与NC组相比分别增加3.6倍和3.0倍,差异具有统计学意义(P<0.05,图4)。
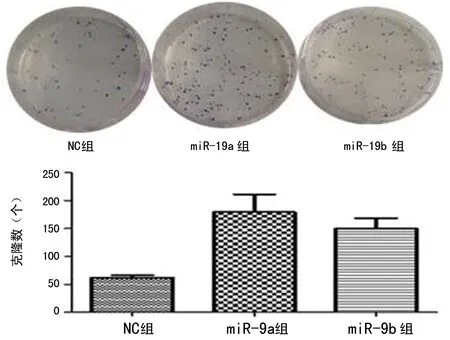
图4 平板克隆形成实验检测miR-19a/b组与NC组相比细胞增殖能力变化
2.5 流式细胞仪检测细胞凋亡结果 各组细胞加入5-FU(15 μg/mL)48 h以后检测细胞凋亡率,转染miR-19a及miR-19b后细胞的凋亡能力与NC组相比分别降低53%和33%,其差异有统计学意义(P<0.05),见图5。

图5 miR-19a/b组与NC相比细胞凋亡情况
2.6 Western blot检测结果 miR-19a/b组与NC组相比PTEN蛋白水平明显降低,p-AKT、p-ERK蛋白水平明显增加,见图6。
2.7 58例胃癌与癌旁组织标本中检测miR-19a/b的表达 结果显示miR-19a/b在癌组织中的表达明显高于癌旁组织,miR-19a在癌组织的表达量是癌旁组织表达量的3.6倍,miR-19b在癌组织的表达量是癌旁组织表达量的4.5倍,其差异有统计学意义(P<0.05),见图7。
2.8 58例胃癌组织中miR-19a/b的表达与临床病理特征的关系 结果显示miR-19a/b的表达与年龄、性别、分化程度无关,与TNM分期、淋巴结转移呈负相关,见表1。
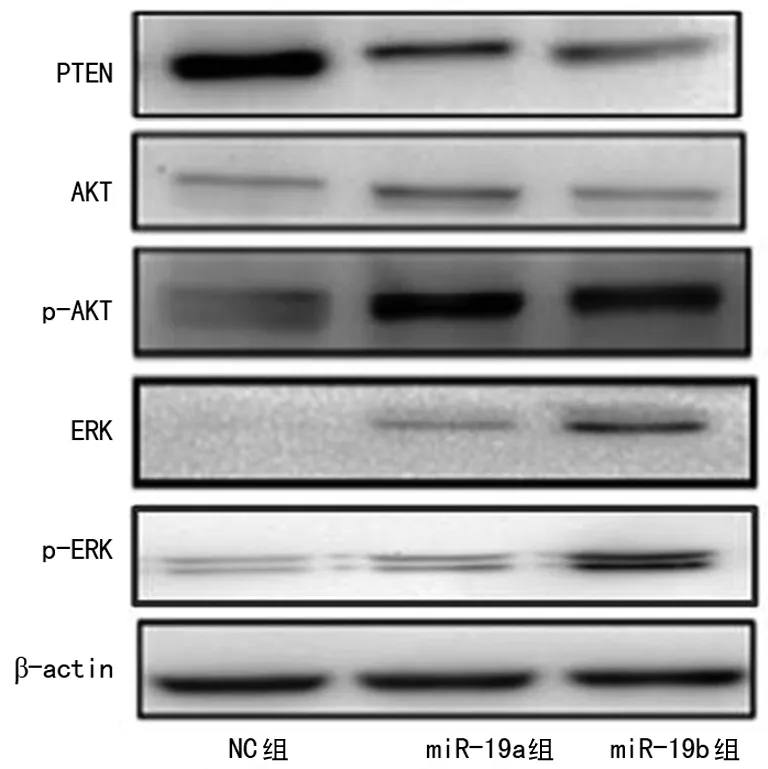
图6 miR-19a/b组与NC的PTEN、AKT、p-AKT、ERK及p-ERK的蛋白表达变化
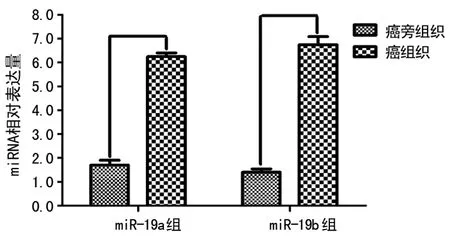
图7 miR-19a/b在胃癌和癌旁组织中的表达差异
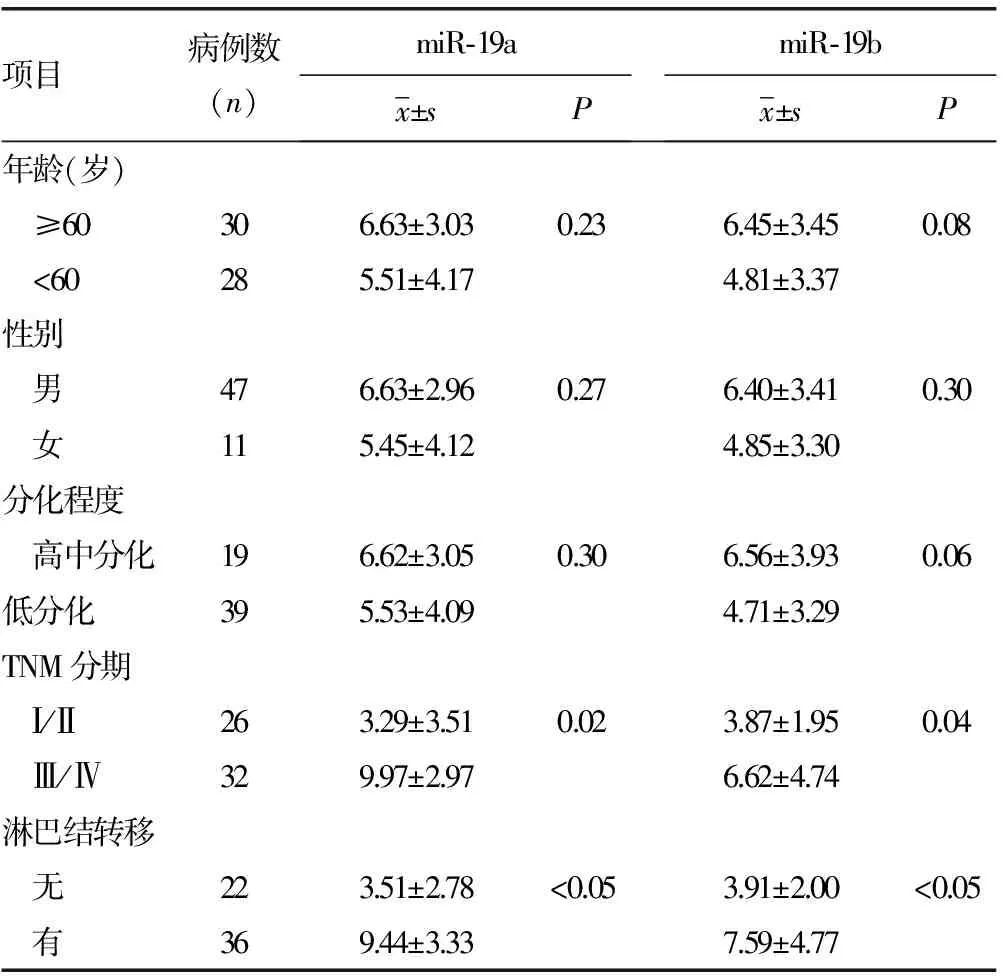
表1 胃癌组织中miR-19a/b的表达与临床病理特征的关系
3 讨 论
miRNAs作为一种新的调节分子不仅参与生物的生长发育等多种生命过程,也可作为一种新的致癌基因或抑癌基因参与肿瘤的发生、发展,影响肿瘤患者的预后。miRNA的相关研究为胃癌等肿瘤的基因诊断、治疗提供了新靶点。
miR-17-92基因簇为一种典型的含有多顺反子启动子的高度保守的基因簇,位于人染色体13q31.3处[3],产生miR-17-5p、miR-18a、miR-19a、miR-20a、miR-19b-1、miR-92-1共6个成熟的miRNAs。根据基因簇成员间种子序列的不同,可将其成员分为3个家族,其中miR-19家族包括miR-19a和miR-19b。
研究发现miR-17-92与肿瘤关系密切,具有癌基因和抑癌基因双重功能。miR-17-92在多种恶性肿瘤如胃癌、肺癌、乳腺癌、结肠癌等中过度表达[4-5],作为致癌基因诱导肿瘤的发生。有相关文献报道,miR-17-92在肺癌尤以进展期非小细胞肺癌中显著上调,可能通过抑制PTEN和PGE2这两个肿瘤抑制基因发挥癌基因的作用[6]。最近有报道,miR-17-92基因簇的成分miR-20a和miR-17在乳腺肿瘤中低水平表达,可能起到抑癌基因的作用[7],这提示miR-17-92可作为肿瘤治疗的新靶点。
miR-19a/b是miR-17-92基因簇中最重要的致癌miRNAs。Zhang等[8]发现,miR-19a/b负性调控靶基因的表达,与乳腺癌细胞株侵袭迁移能力呈负相关,可作为评估乳腺癌恶性程度的重要标志。Takakura等[9]发现,miR-19靶向于PTEN发挥对甲状腺癌的促增殖作用。Ye等[10]研究发现,miR-19在急性T淋巴细胞白血病中表达上调,可能作为癌基因发挥作用。本研究发现上调miR-19a/b的表达,细胞增殖能力明显增加,细胞凋亡率降低,结果表明miR-19a/b对胃癌细胞的增殖和凋亡有调控作用,起到癌基因的作用。
PTEN是第一个被发现的具有磷酸酶活性的抑癌基因,调节细胞的增殖、分化、凋亡和物质代谢[11-12],大多实体瘤中存在PTEN基因的突变或缺失[13-15],被认为是一种重要的抑癌基因。如PTEN基因发生突变或缺失其抑癌功能将会减弱甚至丧失,最终导致肿瘤的发生、发展。对miRNAs的进一步研究发现很多的miRNAs通过靶向于PTEN而影响肿瘤细胞的增殖、凋亡、转移、侵袭和耐药等。Liang等[16]报道miR-19a/b通过靶向于PTEN调节乳腺癌的多药耐药。Meng等[17]报道miR-21通过靶向于PTEN而影响肝细胞的生长发育,最终诱导肝癌发生。Huse等[18]报道了在胶质瘤患者中miR-216表达明显上调,并伴有PTEN明显下调。Yang等[19]报道卵巢癌细胞中miR-214低表达,且抑制PTEN的表达。
文献报道PTEN可负向调控包括AKT及ERK信号通路在内的多种细胞内信号传导通路,从而调节细胞的生长、发育及抑制肿瘤细胞增殖、黏附、转移。AKT是丝/苏氨酸蛋白激酶,PI3K/AKT信号转导通路是重要的“凋亡抑制”通路[20]。AKT的过度活化可以调节多种下游底物,参与调节细胞的生长、发育、分化、分裂等多种生理过程,是细胞内信号转导的枢纽分子之一。胞外信号调节激酶(ERK)是RAS/RAF/MEK/ERK信号通路的重要成分,活化的ERK(P-ERK)作用于其下游底物,促进多种癌基因及细胞周期调节相关基因的转录与表达,参与多种肿瘤的发生发展。
本实验表明,SGC7901细胞转染miR-19a/b后p-AKT、p-ERK的表达水平增加,PTEN表达水平降低,可能机制为miR-19a/b负向调控PTEN基因的表达,导致p-AKT及p-ERK的信号通路异常激活[21-22],使细胞异常增殖及恶性转化,并促进肿瘤浸润、转移。
对58例石蜡包埋胃癌组织及相应癌旁组织中miR-19a/b的表达检测发现miR-19a/b在胃癌组织中过表达。在分析miR-19a/b表达与临床病理特征关系时,发现miR-19a/b的miRNA表达水平与年龄、性别、分化程度无关,与胃癌患者的临床分期、淋巴结转移有相关性(P<0.05),进一步证明了miR-19是成瘤基因,可能在胃癌发生、发展中起到癌基因的作用。
本研究发现,miR-19a/b通过PTEN/AKT/ERK通路促进胃癌细胞增殖,降低细胞凋亡;通过临床组织标本检测发现miR-19a/b与胃癌临床分期及转移密切相关。以上实验表明miR-19a/b有望成为胃癌治疗的一个潜在干预靶点,并可为诊断和基因治疗提供依据,为开发新的抗肿瘤药物及指导临床治疗提供新的思路。
[1]Archie V,Kauh J,Jones DV,et al.Gastric cancer:standards for the 21st century[J].Crit Rev Oncol Hematol,2006,57(2):123-131.
[2]邹文斌,李兆申.中国胃癌发病率及死亡率研究进展[J].中国实用内科杂志,2014,4(4):408-415.
[3]Ota A,Tagawa H,Karnan S,et al.Identification and characterization of a novel gene,C13orf25,as a target for 13q31-q32 amplification in malignant lymphoma[J].Cancer Res,2004,64(9):3087-3095.
[4]Petrocca F,Visone R,Onelli MR,et al.E2F1-regulated microRNAs impair TGFbeta-dependent cell-cycle arrest and apoptosis in gastric cancer[J].Cancer Cell,2008,13(3):272-286.
[5]Volinia S,Calin GA,Liu CG,et al.A microRNA expression signature of human solid tumors defines cancer gene targets[J].Proc Natl Acad Sci U S A,2006,103(7):2257-2261.
[6]Krysan K,Kusko R,Grogan T,et al.PGE2-driven expression of c-Myc and oncomiR-17-92 contributes to apoptosis resistance in NSCLC[J].Mol Cancer Res,2014,12(5):765-774.
[7]Hayashita Y,Osada H,Tatematsu Y,et al.A polycistronic microRNA cluster,miR-17-92,is overexpressed in human lung cancers and enhances cell proliferation[J].Cancer Res,2005,65(21):9628-9632.
[8]Zhang X,Yu H,Lou JR,et al.MicroRNA-19 (miR-19) regulates tissue factor expression in breast cancer cells[J].J Biol Chem,2011,286(2):1429-1435.
[9]Takakura S,Mitsutake N,Nakashima M,et al.Oncogenic role of miR-17-92 cluster in anaplastic thyroid cancer cells[J].Cancer Sci,2008,99(6):1147-1154.
[10]Ye H,Liu X,Lv M,et al.MicroRNA and transcription factor co- regulatory network analysis reveals miR-19 inhibits CYLD in T-cell acute lymphoblastic leukemia[J].Nucleic Acids Res,2012,40(12):5201-5214.
[11]Maehama T.PTEN:its deregulation and tumorigenesis[J].Biol Pharm Bull,2007,30(9):1624-1627.
[12]薛鹏,周翡,李宁,等.胃癌中PTEN和p-AKT蛋白的表达及其临床意义与预后分析[J].肿瘤,2012,32(4):281-285.
[13]Kolasa IK,RembiszewskaA,Janiec-Jankowska A,et al.PTEN mutation expression and LOH at its locus in ovarian carcinomas[J].Relation to TP53,K-RAS and BRCA1 mutations.Gynecol Oncol,2006,103(2):692-697.
[14]Zhu L,Loo WT,Louis WC.PTEN and VEGF:possible predictors for sentinel lymph node micro-metastasis in breast cancer[J].Biomed Pharmacother,2007,61(9):558-561.
[15]Schmitz M,Grignard G,Margue C,et al.Complete loss of PTEN expression as a possible early prognostic marker for prostate cancer metastasis[J].Int J Cancer,2007,120(6):1284-1292.
[16]Liang Z,Li Y,Huang K,et al.Regulation of miR-19 to breast cancer chemoresistance through targeting PTEN[J].Pharm Res,2011,28(12):3091-3100.
[17]Meng F,Henson R,Wehbe-Janek H,et al.MicroRNA-21 regulates expression of the PTEN tumor suppressor gene in human hepatocellular cancer[J].Gastroenterology,2007,133(2):647-658.
[18]Huse JT,Brennan C,Hambardzumyan D,et al.The PTEN-regulating microRNA miR-26a is amplified in high-grade glioma and facilitates gliomagenesis in vivo[J].Genes Dev,2009,23(11):1327-1337.
[19]Yang H,Kong W,He L,et al.MicroRNA expression profiling in human ovarian cancer:miR-214 induces cell survival and cisplatin resistance by targeting PTEN[J].Cancer Res,2008,68(2):425-433.
[20]黄秀兰,崔国辉,周克元.PI3K-Akt信号通路与肿瘤细胞凋亡关系的研究进展[J].癌症,2008,27(3):331-336.
[21]Wu H,Goel V,Haluska FG.PTEN signaling pathways in melanoma[J].Oncogene,2003,22(20):3113-3122.
[22]Maehama T,Dixon JE.The tumor suppressor,PTEN/MMAC1,dephosphorylates the lipid second messenger,phosphatidylinositol 3,4,5-trisphosphate[J].J Biol Chem,1998,273(22):13375-13378.
The relation between microRNA-19a/b and proliferation,apoptosis and clinicopathological features of gastric cancer*
WangFang,WangWanzhen,WangJingjing,HeFang△
(DepartmentofGastroenterology,GeneralHospitalofNingxiaMedicalUniversity,Yinchuan,Ningxia750004,China)
Objective To explore the effects of miR-19a/b on proliferation,apoptosis of gastric cancer cells and elucidate its possible mechanism by infecting the human gastric adenocarcinoma cell line SGC7901.Then investigate the relation between the levels of miR-19a/b and the clinicopathological featrues of gastric cancer.Methods The stable cells which expressed miR-19a/b were stabled.The changes of cellular growth activity were detected by MTT and colony formation assay and the apoptosis were detected by flow cytometry.The expression of AKT,p-AKT,ERK,p-ERK and PTEN were examined by Western blot.By using Real-Time quantitative PCR,the expression of miR-19a/b were evaluated in gastric cancer tissues.To analyze the relationship of the miR-19a/b in degree of differentiation,lymph node metastasis,TNM stage in gastric cancer tissues.Results The miR-19a/b expression in stable cell lines were significantly increased much than that of the control group(P<0.05)by using RT-PCR.Ectopic miR-19a/b expression in SGC7901 cell could produce the following effects:the proliferation increased(P<0.05),the cell apoptosis decreased.And the Expression of the protein expressions of p-AKT and p-ERK upregulated,the expression of PTEN down regulated in miR-19a/b infected group than those in miR-NC group.Also we found that the expression of miR-19a or miR-19b in gastric cancer patients did not correlate with age,gender or cell differentiation,but correlated with TNM stage and lymph node metastatic in gastric cancer tissues.Conclusion We find that the expression of miR-19a/b are over-expressed in gastric cancer tissues,miR-19a/b up-regulation can promote the cellular proliferation and reduce apoptosis.The present study demonstrates that there is a close relationship between the levels of miR-19a/b and TNM stage and lymph node metastatic in the gastric cancer.Our date study suggests that miR-19a/b would be an effective clinical parameter to indicate the malignance of gastric cancer.
stomach neoplasms;apoptosis;cell proliferation;pathology;miR-19a/b
10.3969/j.issn.1671-8348.2016.34.001
宁夏医科大学青年项目基金(XQ201334)。 作者简介:王芳(1979-),副主任医师,硕士,主要从事消化道肿瘤。△
,E-mail:blue0708@163.com。
R735.2
A
1671-8348(2016)34-4753-04
2016-07-18
2016-09-06)

