Claudin-1胞外片段Cldn-153~80的作用在乳腺癌转移机制中的研究*
彭亚琪, 蔡瑜娇,江恩来,孙立华
(第三军医大学新桥医院普通外科,重庆 400037)
Claudin-1胞外片段Cldn-153~80的作用在乳腺癌转移机制中的研究*
彭亚琪, 蔡瑜娇△,江恩来,孙立华
(第三军医大学新桥医院普通外科,重庆 400037)
目的 观察Claudin-1在乳腺癌组织中的表达与临床病理特征的关系,探讨Claudin-1的胞外区Cldn-153~80片段在乳腺癌转移中的作用机制。方法 (1)应用免疫组织化学技术检测108例乳腺癌标本中 Claudin-1的表达情况,并分析其与乳腺癌淋巴结转移、TNM 分期和分子分型间的关系;(2)在乳腺癌细胞株中掺入Cldn-153~80片段,应用Western blot技术检测紧密连接蛋白Claudin-1、Claudin-2的表达。结果 (1)以是否淋巴结转移、临床分期、分子分型等病理特征为依据分组中,Claudin-1的表达强度在淋巴结转移组(χ2=6.279,P=0.012)、TNM分期Ⅲ、Ⅳ期(χ2=7.419,P=0.024)及分子分型为Her-2过表达型(χ2=10.830,P=0.013)组中显著降低,差异有统计学意义;(2) Cldn-153~80片段的掺入可导致乳腺癌细胞中紧密连接蛋白Claudin-1及Claudin-2的表达下降,在转移性高的乳腺癌细胞株MDA-MB-231中,这种抑制作用更为显著。结论 紧密连接蛋白 Claudin-1的表达降低与乳腺癌的进展和转移密切相关,而Cldn-153~80片段通过调控紧密连接蛋白的表达在乳腺癌细胞侵袭、转移过程中发挥重要作用。
乳腺肿瘤;淋巴转移;Claudin-1;转移机制;胞外片段;Cldn-153~80
乳腺癌的发病率在女性癌症谱中位居首位,作为影响女性生存期及生存质量的主要疾病已被人们所共识。在乳腺癌的诊疗中,控制疾病的远处转移被认为是影响患者生存期及生存质量的关键。紧密连接是上皮细胞间连接的主要形式,它的结构与功能的破坏与乳腺癌的转移息息相关。在正常乳腺组织中,Claudins蛋白家族参与构成了上皮细胞间的紧密连接,维持细胞极性、黏附性,控制细胞的增殖及迁移[1-2]。而在乳腺发生癌转移的过程中,紧密连接的结构与功能显著破坏,导致细胞极性、黏附性破坏,细胞的增殖及迁移能力增强[2],有利于乳腺癌细胞的侵袭和转移。其中,Claudin-1蛋白在维持上皮细胞紧密连接的结构和功能中至关重要[3]。本研究收集了临床乳腺癌标本108例,通过观察乳腺癌组织中Claudin-1的表达与病理特征的关系,探讨其胞外区Cldn-153~80片段在乳腺癌转移中的作用机制。
1 资料与方法
1.1 一般资料 收集本院2013年9月至2015年12月乳腺癌手术的大体标本108例,术后均病理证实为浸润性乳腺癌。标本均为女性,年龄27~74岁。分别为浸润性导管癌98例,浸润性小叶癌5例,髓样癌1例,小管癌2例,腺样囊性癌1例,黏液腺癌1例。根据乳腺癌分子分型,管腔上皮A(Luminal A)型24例,管腔上皮B(Luminal B)型45例,Her-2过表达型14例,三阴型25例。根据TNM分期,Ⅰ期13例,Ⅱ期62例,Ⅲ期32例,Ⅳ期1例。其中,有淋巴结转移59例,无淋巴结转移49例。所有患者均未行术前放疗、化疗及内分泌治疗。标本均经10%中性福尔马林溶液处理后包埋固定。人类乳腺癌细胞MDA-MB-231、MCF-7由第三军医大学第二附属医院普通外科实验室提供。
1.2 主要试剂与仪器 Claudin-1 抗体(Abcam公司1∶1 000)。Claudin-2 抗体(Abcam公司1∶500)。Cldn-153~80(Ac-SCVSQSTGQIQCKV-Phe-DSLLNLSSTLQAT-NH2)由上海生工生物工程有限公司合成。
1.3 方法
1.3.1 标本收集 收集108例临床乳腺癌大体标本并作数据分析,以年龄、是否淋巴结转移、TNM分期、分子分型等特征分组。
1.3.2 免疫组织化学 将临床乳腺癌病理组织石蜡包埋,作4 μm切片,60 ℃下拷片1 h,脱蜡及复水;过氧化氢清除内源性过氧化物酶活性;微波抗原修复;山羊血清蛋白阻断非特异性染色;滴加一抗(4 ℃,过夜);滴加二抗(37 ℃,20 min);滴加链霉素亲和素-生物素并进行亲和孵育(37 ℃,30 min);DAB显色。用PBS液作阴性对照。结果评定:无背景着色情况下,细胞出现黄色颗粒者为阳性。计算高倍镜下(×400)阳性细胞百分数并赋予分值:≤ 5%为0分;6%~25%为1分;26%~50%为2分;51%~75%为3分;>75%为4分。观察着色强度并赋予分值:无着色为0分;着浅黄色为1分;着黄色为2分;着棕黄色为3分。两者相乘:0分为(-);1~4分为(+);5~8分为(++);9~12分为(+++)。每张切片由两名高年资病理科医师进行独立评分后取平均值作为该病例最终评分:将评分(-)~(+)设为低表达;评分(++)~(+++)设为高表达。
1.3.3 掺入Cldn-153~80片段 将MDA-MB-231、MCF-7细胞株进行细胞培养,加入200 μmol/L浓度的Cldn-153~80小肽段,24 h, 4 ℃下孵育过夜;平衡盐溶液、BS3交联液洗涤,室温孵育1 h;提取全细胞的总蛋白。
1.3.4 Western blot 取等量样品上样并进行电泳及转膜;室温下封闭1 h,切膜;加入相应抗体,Claudin-1(小鼠 1∶1 000),Claudin-2(小鼠 1∶5 000),β-actin(小鼠 1∶5 000)购自Abcam公司;4 ℃下孵育过夜,然后1×TBST漂洗3次,每次10 min,加入二抗(Claudin-1抗鼠1∶3 000、Claudin-2抗鼠1∶3 000、actin抗鼠 1∶10 000),室温下摇床孵育 2 h,用1×TBST漂洗3遍,每次30 min;经 BioRad显影,通过凝胶分析系统分析蛋白的表达。
1.4 统计学处理 所有统计处理在SPSS 13.0软件上完成。计数资料用χ2检验,实验结果差异分析采用Studentt-test。以P<0.05为差异有统计学意义。
2 结 果
2.1 乳腺癌中Claudin-1的表达强度与病理特征的关系 乳腺癌中有淋巴结转移组的Claudin-1表达强度弱于无淋巴转移组(χ2=6.279,P=0.012)。乳腺癌TNM分期中,Ⅰ期和Ⅱ期组之间的Claudin-1表达强度差异无统计学意义,Ⅲ期及Ⅳ期的Claudin-1表达强度明显弱于前者,差异有统计学意义(χ2=7.419,P=0.024)。在乳腺癌不同的分子分型中,仅Her-2过表达型的Claudin-1的表达强度弱于其他3组,差异有统计学意义(χ2=10.830,P=0.013)。见表1、图1。
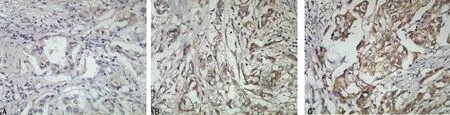
A:Claudin-1表达(+);B:Claudin-1表达(++);C:Claudin-1表达(+++)。
图1 Claudin-1在不同乳腺癌组织中的表达(免疫组织化学,×400)

表1 Claudin-1的表达与乳腺癌病理参数的关系(n)
2.2 Western blot检测紧密连接蛋白的表达 Cldn-153~80片段的掺入,导致乳腺癌细胞株中Claudin-1及Claudin-2蛋白的表达均下调,其中,相对于转移性较低的MCF-7乳腺癌细胞株而言,Claudin-1及Claudin-2蛋白在转移性较高的MDA-MB-231乳腺癌细胞株中的表达显著下调(图2)。
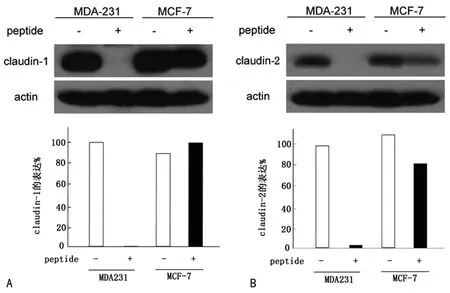
A:Cldn-153~80片段的掺入后乳腺癌细胞中Claudin-1蛋白的表达下降。B:Cldn-153~80掺入后乳腺癌细胞中Claudin-2蛋白的表达下降。
图2 掺入Cldn-153~80片段导致乳腺癌细胞中Claudin-1、Claudin-2蛋白表达的变化
3 讨 论
乳腺癌的转移常发生在骨骼、肝脏、颅脑和肺部,并成为了该病致死的主要因素[4-5]。乳腺癌在发生转移的过程中,乳腺上皮细胞获得间质细胞的特性,失去典型的上皮细胞黏附性及极性,并被诱导增殖,从而获得迁移能力,诱使肿瘤细胞离开原发部位通过血管和淋巴管向远处转移[6]。乳腺癌细胞的远处转移包含了向细胞外基质及基质层细胞侵袭、入侵循环系统并存活于其中、溢出至靶器官、建立转移器官中的肿瘤微环境及在转移器官中克隆增殖等一系列细胞生物学事件[7]。
紧密连接(tight junctions,TJs)是维持上皮细胞间屏障功能的结构基础,Claudins蛋白、ZO蛋白、E-cadherin蛋白等都是构成紧密连接的重要成分。其中,Claudins家族是维持紧密连接结构的主要跨膜蛋白。而科学家首先发现并命名Claudin-1在维持紧密连接功能和上皮细胞屏障中至关重要[8-9]。
本研究显示,在有淋巴结转移的乳腺癌组织中,Claudin-1的表达显著低于无淋巴结转移组;随着肿瘤TNM期别的延迟,Claudin-1的表达趋于减弱;Her-2过表达型的乳腺癌细胞中该蛋白的表达也有显著性的降低。以上结果表明了Claudin-1低表达的乳腺癌细胞中,其上皮细胞屏障功能的减弱,增加了乳腺癌细胞的侵袭力,导致乳腺癌转移的风险明显增加。最新研究发现,乳腺癌的分子分型中,除具特征性的luminal A、luminal B、Her-2过表达型、三阴性乳腺癌外,Claudin-1低表达型也可望成为具有指导治疗评估预后的新分型[10]。这说明Claudin-1在乳腺癌中的表达状况可望成为判断或预测乳腺癌复发转移的指标之一。大量研究表明,Claudin-1的低表达与乳腺癌的高转移性密切相关,但其中的具体机制尚缺乏进一步研究。
Claudin-1蛋白由两个胞外环(extracellular loop,EL)和细胞内的N-端和C-端组成。这两个EL 区域对TJs的构成及维护有重要意义[11-12]。有研究发现,Claudin-1的两个EL区域可分为3段:Cldn-131~53、Cldn-153~80、Cldn-1146~160[13]。在对肠上皮细胞紧密连接的研究中发现,外源性Cldn153~80可阻断TJs的修复,可导致紧密连接中相关分子如Occludin、JAM、ZO-1等的表达及定位缺失,使TJs功能降低,从而影响紧密连接的结构和功能。作者推测,在乳腺癌发生侵袭、转移的过程中,Cldn153~80可能扮演重要角色。
本研究发现,在高转移性的乳腺癌细胞株MDA-MB-231,和低转移性的MCF-7细胞株中分别掺入外源性Cldn153~80片段,提示Cldn-153~80的掺入导致乳腺癌细胞中Claudin-1及Claudin-2蛋白表达下降,并且相对于转移性较低的MCF-7乳腺癌细胞株而言,该片段的作用是显著抑制转移性高的MDA-MB-231乳腺癌细胞株中Claudin-1及Claudin-2蛋白的表达。
有研究发现,乳腺癌的微环境直接影响乳腺癌的增殖与转移,在乳腺癌微环境中,存在大量的除肿瘤细胞外的细胞成分[14],而这些具有活性的生物大分子正是引导肿瘤细胞增殖、转移的关键介质。本研究显示,外源性Claudin-153~80片段的掺入,使Claudin-1、Claudin-2表达降低,相对于转移性较低的乳腺癌细胞株MCF-7,在高转移性的乳腺癌细胞株MDA-MB-231中,Cldn-153~80片段的作用显著下调了紧密连接蛋白Claudin-1及Claudin-2的表达。因此推断,在乳腺癌发生、发展、转移的过程中,肿瘤微环境中存在Claudin-1的胞外区片段,其中包括Cldn-153~80片段,它的作用可能影响了乳腺上皮细胞紧密连接的结构与功能,使乳腺上皮细胞紧密连接的结构与功能显著破坏,使肿瘤细胞的侵袭力得以增长。本研究提出,紧密连接蛋白Claudin-1的胞外区片段Cldn-153~80可通过抑制紧密连接蛋白Claudin-1及Claudin-2的表达来提高乳腺癌细胞的侵袭力,从而增强乳腺癌的转移性,阐明了Claudin-1的胞外区片段Cldn-153~80在乳腺癌转移机制中可能发挥重要作用,其中机制有待进一步研究。
[1]Martin TA,Jiang WG.Loss of tight junction barrier function and its role in cancer metastasis[J].Biochim Biophys Acta,2009(1788):872-891.
[2]Brennan K,Offiah G,Mcsherry EA,et al.Tight junctions:a barrier to the initiation and progression of breast cancer[J].J Biomed Biotechnol,2010,2010:460607.
[3]Susanne A,Ahlstrom R,Alan SL.Yu[J].Biology of claudins.Am J Physiol Renal Physiol,2008(295):867-876.
[4]Rodríguez-Pinilla SM,Sarrió D,Honrado E,et al.Prognostic significance of basal-like phenotype and fascin expression in node-negative invasive breast carcinomas[J].Clin Cancer Res,2006,12(5):1533-1539.
[5]Chen YC,Sosnoski DM,Mastro AM.Breast cancer metastasis to the bone:Mechanisms of bone loss[J].Breast Cancer Res,2010,12(6):215.
[6]Han HJ,Russo J,Kohwi Y,et al.SATB1 reprogrammes gene expression to promote breast tumour growth and metastasis[J].Nature,2008,452(7184):187-193.
[7]Chambers AF,Groom AC,Macdonald IC.Dissemination and growth of cancer cells in metastatic sites[J].Nat Rev Cancer,2002,2(8):563-572.
[8]Furuse M,Hata M,Furuse K,et al.Claudin-based tight junctions are crucial for the mammalian epidermal barrier:a lesson from claudin-1-deficient mice[J].J Cell Biol,2002,156(6):1099-1111.
[9]Krause G,Winkler L,Piehl C,et al.Structure and function of extracellular claudin domains[J].Ann N Y Acad Sci,2009,1165:34-43.
[10]Mrsny RJ,Brown GT,Gerner-Smidt K,et al.A key claudin extracellular loop domain is critical for epithelial barrier integrity[J].Am J Pathol,2008,172(4):905-915.
[11]Wan H,Winton HL,Soeller C,et al.The transmembrane protein occludin of epithelial tight junctions is a functional target for serine peptidases from faecal pellets of Dermatophagoides pteronyssinus[J].Clin Exp Allergy,2001,31(2):279-294.
[12]Fujita K,Katahira J,Horiguchi Y,et al.Clostridium perfringens enterotoxin binds to the second extracellular loop of claudin-3,a tight junction integral membrane protein[J].FEBS Lett,2000,476(3):258-261.
[13]Sleeman JP,Cremers N.New concepts in breast cancer metastasis:tumor initiating cells and the microenvironment[J].Clin Exp Metastasis,2007,24(8):707-715.
[14]Santisteban M,Reiman JM,Asiedu MK,et al.Immune-induced epithelial to mesenchymal transition in vivo generates breast cancer stem cells[J].Cancer Res,2009,69(7):2887-2895.
A Key Claudin Extracellular Loop Domain is Critical for the metastatic of breast cancer*
PengYaqi,CaiYujiao△,JiangEnlai,SunLihua
(DepartmentofGeneralSurgery,theAffiliatedXinqiaoHospitalofThirdMilitaryMedicalUniversity,Chongqing400037,China)
Objective To investigate the expressions of tight junction protein claudin-1 in breast cancer tissue and the regulation with the domaination of extracellular loop Cldn-153-80.Methods The expressions of Claudin-1 in the breast cancer samples (n=108) were detected by immunohistochemistry technology.The expressions of Claudin-1 and Claudin-2 with the inception of Cldn-153-80were detected by the technology of Western Blot.Results The expression level of Claudin-1 were associated with lymph node metastases,clinical stage and the molecular typing of breast cancer(P<0.05).Besides,the inception of Cldn-153-83lead to a lower expression of Claudin-1 and Claudin-2(P<0.05).Conclusion Claudin-1 shows a decreasing trend in development and metastases of breast cancer,and Cldn-153-80domain of claudin-1 plays a key role in the regulation of TJ function in breast cancer.
breast neoplasms;lymphatic metastasis;Claudin-1;metastatic;extracellular loop;Cldn-153-80
10.3969/j.issn.1671-8348.2016.34.007
重庆市自然科学基金面上项目(cstc2012jjA10078)。作者简介:彭亚琪(1990-),住院医师,硕士,主要从事恶性肿瘤的放化疗与综合治疗。△
,E-mail:cyj760628@163.com。
R737.9
A
1671-8348(2016)34-4772-03
2016-05-18
2016-08-06)

