新型离子液体基功能电解质材料研究
朱奇珍, 陈 楠, 陈人杰, 吴 锋
(北京理工大学 材料学院,北京100081)
青年园地
新型离子液体基功能电解质材料研究
朱奇珍, 陈楠, 陈人杰, 吴锋
(北京理工大学 材料学院,北京100081)
摘要:作为电池的重要组成部分,电解质在很大程度上影响着锂电池的安全性、温度适应性、充放电性能和循环寿命。研究合成了二氟草酸硼酸锂(LiODFB)-N-甲基-N-甲氧基乙基吡咯烷双(三氟磺酰亚胺)(Pyr1,2O1TFSI) /亚硫酸酯电解质,展现出良好的离子传导性、电极相容性和宽工作温度范围,其中LiODFB-Pyr1,2O1TFSI/DMS电解质体系的电导率和锂离子迁移数分别为8.163×10-3S·cm-1,0.28。首次将离子液体基电解质体系的应用温度范围拓展到-40 ℃,使Li/MCMB电池和Li/ LiFePO4电池在-40~60 ℃的工作温度范围内均表现出理想的电化学性能。以Li[N(SO2CF3)2] (LiTFSI)作为锂盐,将三(乙二醇)二甲醚(TEGDME)作为共溶剂,结合离子液体Pyr1,2O1TFSI,制备系列Li/S电池电解质。含LiTFSI-(70wt%)Pyr1,2O1TFSI/ (30wt%)TEGDME电解质的Li/S电池表现出优秀的循环性能和倍率性能,在0.1 C充放电倍率下,首周循环周期放电比容量1 212.8 mAh·g-1,循环100周后仍然维持在693.5 mAh·g-1。在1 C放电倍率下,循环100周放电比容量约为827.3 mAh·g-1,库伦效率达到99%以上。同时,该电解质还具有良好的高温性能,电池在80 ℃仍然可以正常工作,放电容量达1 005.3 mAh·g-1。在总结相关研究工作的基础上,从离子液体/有机共溶剂电解质体系出发,首次半定量对离子液体/共溶剂体系和电化学基本性质间的构效关系进行了深入分析,对未来面向不同应用方向的锂二次电池电解质体系的设计合成具有一定的理论意义和参考价值。
关键词:电解质;离子液体;锂二次电池;电解质体系;半定量
1前言
伴随着化石燃料的燃烧所造成的环境污染和能源衰竭等问题的日益突出,探索新的可再生能源已成为社会发展的重要焦点。锂离子电池因其能量/功率密度高、循环寿命长、环境友好等特点,成为了最富前景的适用于电动汽车或移动电源的能源之一[1-2]。而锂硫电池具有能量密度高,单质硫来源广泛,成本低廉等优势,是锂电池未来发展方向之一[3-4]。然而,锂二次电池的安全性问题[5-6]一直是制约其发展的难题。作为电池的关键组成部分,电解质对电池的安全性,使用温度范围,能量密度,甚至循环寿命都有着非常重要的影响[7-8]。为了满足锂二次电池大规模应用推广的需求,开发高安全性,高离子传导性,宽温度适用范围的电解质体系势在必行。
离子液体具有电化学窗口宽,热稳定性好,难燃等优异特性[9],在锂二次电池电解质材料方面具有很大应用潜力。近年来,有关离子液体作为新型电解质材料应用于电池中的研究工作在世界范围内迅速开展[10-12]。但是,相对于传统有机电解质体系,离子液体电解质还存在粘度高,电导率较低,与一些电极材料相容性不够理想等问题。为了解决这些问题,有研究者在离子液体中引入具有高度柔性的醚氧功能基团来增加总自由体积,通过增强相邻分子之间的传导性以降低粘度,提高电导率[13]。Ferrari S等[10]在咪唑和吡咯烷阳离子中引入醚氧基团,得到了无定型离子液体,提高了离子电导率。具有醚氧基团的胍盐离子液体应用于锂离子电池电解液体系,可以在锂金属表面形成钝化层,改善电池的循环性和充放电效率[14-15]。
为了进一步改善离子液体电解质的性能,将有机改性共溶剂按照适当比例添加到离子液体中,制备离子液体/有机溶剂复合电解质体系。这种复合电解质体系可以综合离子液体和有机溶剂的优点,体系中的离子液体可以为其稳定性和安全性提供保障,同时一定比例的有机溶剂的加入可以降低体系的粘度带来较高的电导率和隔膜浸润性,进而使体系具有更宽的工作温度窗口和更好的电池倍率性能[10,16]。具有适当还原分解电位的有机溶剂有助于负极表面SEI膜的形成,可以提高电解质体系与负极材料的匹配性[17]。亚硫酸酯类化合物具有成膜效果好[18-20],熔点低,粘度低等优点,是一类值得关注的有机共溶剂。此外,醚类溶剂匹配锂硫电极展现出优良的电化学性能[21-22],是目前锂硫电池的研究中应用最为广泛的电解质。Kim 等人[23]在醚类电解质中添加离子液体EMIBeti,通过咪唑阳离子对锂金属表面的保护作用,使电池循环性能得到了改善。Park等人[24]研究了多种离子液体基电解质在锂硫电池中的电化学行为,发现离子液体作为锂硫电池电解质的主要限制因素是其粘度和锂离子迁移数。Shin等人[25]将四(乙二醇)二甲醚与离子液体PYR14TFSI 共混组成的电解质体系应用于锂硫电池中,取得了较好的循环性能和安全性。Wang等人[26]将乙二醇二甲醚添加到离子液体PP13TFSI中制备锂硫电池电解质,展示出良好的循环性能和库伦效率。以上研究表明,离子液体和醚类溶剂的比例在很大程度上决定了混合体系的物理化学性质,进而对锂硫电池的工作性能产生较大的影响。
本研究基于N-甲基-N-甲氧基乙基吡咯烷双(三氟磺酰亚胺)(Pyr1,2O1-TFSI)离子液体,结合不同有机溶剂,制备新型电解质,应用于锂离子电池及锂硫电池之中。首先,以LiODFB作为锂盐,分别采用亚硫酸乙烯酯(ES)、亚硫酸二甲酯(DMS)两种共溶剂,制备Pyr1,2O1-TFSI /亚硫酸酯二元电解质体系,并对其物理化学性能和电化学性能进行系统表征。对电解质体系与锂离子电池正负极材料的兼容性以及宽温带范围(-40~60 ℃)的电池性能进行测试评价。图1列出了Pyr1,2O1TFSI /亚硫酸酯电解质体系中各组分的化学结构式。此外,将三(乙二醇)二甲醚(TEGDME)作为共溶剂,按照不同比例添加于Pyr1,2O1-TFSI中,以Li[N(SO2CF3)2] (LiTFSI)作为锂盐,制备一系列锂硫电池电解质,将其应用到锂硫电池中测试电化学性能。Pyr1,2O1TFSI / TEGDME电解质体系中各组分的化学结构式见图1。最后,将离子液体和共溶剂的按照结构划分,根据前人已报道的实验数据和变化规律,半定量的对比总结其电化学基本性质。
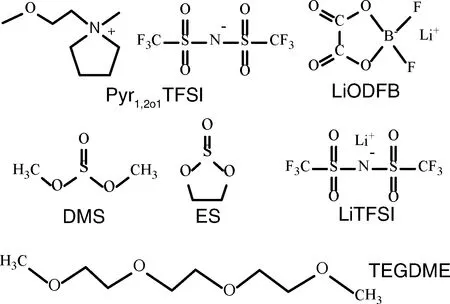
图1 混合电解液体系各组分的分子结构示意图Fig.1 Molecular structures of the mixture components
2实验
2.1电解质样品的制备
Pyr1,2O1TFSI、亚硫酸酯(ES或DMS)(99%)和TEGDME在使用前经过分子筛处理24 h。锂盐LiODFB、LiTFSI在140 ℃下真空干燥12 h。电解质的制备在氩气气氛(H2O<1 ppm, O2<1 ppm)的手套箱中进行。配置方案如表1所示。

表1 离子液体基系列电解质配制方案
2.2电极的制备和电池组装
将锂离子电池活性材料(LiFePO4或MCMB)、导电剂乙炔黑和粘结剂PVDF按照质量分数8∶1∶1混合均匀,添加适量溶剂,将所得浆料均匀涂布于集流体上。所得电极首先在50 ℃下预干燥去除溶剂,然后置于真空干燥箱中以70 ℃真空干燥12 h,最后通过裁片机裁得直径11 mm的圆形极片,称取质量后置于氩气气氛的手套箱中备用。
采用固相合成法制备S/C复合材料:将单质硫与碳纳米管按照质量比1∶1混合,经过充分研磨、混合均匀后,置于反应罐中。将反应罐在155 ℃下加热24 h,自然冷却后得到最终产物含硫量50%的黑色粉末状硫/碳复合材料。将S/C复合材料与导电剂乙炔黑、粘结剂PVDF在定量的溶剂N-甲基-2-吡咯烷酮中按照质量分数比7∶2∶1混合均匀,均匀涂覆在铝箔上。得到的电极在干燥箱内在50 ℃下烘干。将得到的电极裁成直径11 mm圆形极片,置于氩气气氛的手套箱中备用。
原锂电池的装配在充满氩气的手套箱(H2O<1 ppm, O2<1 ppm)中进行。以电极极片作为工作电极,金属锂片作为对电极,选用Celgrad© 2325隔膜,放入CR-2025型纽扣电池毛胚中,添加适量所制备的电解质样品,用压片机压紧得实验用原理电池。
2.3样品的物化性能和电化学性能表征
离子液体的热稳定性以TGA Q5000 V3.15进行热重分析,测试温度范围为室温~500 ℃,升温速率为10 ℃·min-1。电解质体系中的分子结构由美国Nicolet 6700 FTIR红外光谱仪表征,波长测试范围为4 000~400 cm-1。电导率通过CHI660D 电化学工作站,采用电化学阻抗法测试,测试频率105~10 Hz。用稳态电流与电化学阻抗测试联用法测试锂离子迁移数。原理电池的充放电性能采用Land电池测试系统,0.1 C倍率直流充放电测试,MCMB和LiFePO4原理电池的充放电范围分别是2 V~0.005 V和4.2 V~2.5 V;Li/S电池的充放电范围是3 V~1 V。
3结果与讨论
3.1Pyr1,2O1TFSI的热稳定性
离子液体Pyr1,2O1TFSI的TGA曲线图(图2)显示,加热Pyr1,2O1TFSI到300 ℃,没有明显的热量损失,表现出很好的热稳定性,为电解质体系的安全性提供了保障。

图2 Pyr1,2o1TFSI的TGA曲线Fig.2 TGA curve of Pyr1,2O1TFSI
3.2Pyr1,2O1TFSI/亚硫酸酯电解质体系
红外波谱分析对于电解质体系中各组分的微结构研究,明确其作用机制以及构效关系具有重要意义。为了证明醚氧基团对离子液体的影响,对不含醚氧基的离子液体N-甲基-N-丙基吡咯烷双(三氟磺酰亚胺)(Pyr13TFSI) 与Pyr1,2O1TFSI进行红外光谱测试,测试结果如图3a所示。两种离子液体具有一些重叠的特征峰,主要对应着以下基团:硫氧双键的对称(1 132 cm-1)和反对称(1 348 cm-1)伸缩振动、C-F的对称(1 049 cm-1)和反对称(1 173 cm-1)伸缩振动、碳环形变的振动(1 471 cm-1)以及与NH2相邻的CH2的伸缩振动(2 949 cm-1)。受醚氧基团的影响,离子液体Pyr1,2O1TFSI在2 823 cm-1出现了C-O-C基团峰的伸缩振动峰,并且Pyr1,2O1TFSI支链上与O相邻的CH2和CH3基团伸缩振动峰与Pyr13TFSI相比,峰强降低,半峰宽度增大,分别从2 889 cm-1、2 980 cm-1移动到2 902 cm-1、2 999 cm-1。这是因为C-O键键能小于C-C键键能,氧的加入使相邻碳原子的碳氢键键长变短,键能增强,导致相对应的伸缩振动峰向高频移动,发生蓝移。
为了探讨锂盐LiODFB在电解质体系中的溶剂化作用,图3b显示了离子液体Pyr1,2O1TFSI与加入LiODFB和亚硫酸酯后的体系的红外光谱图。
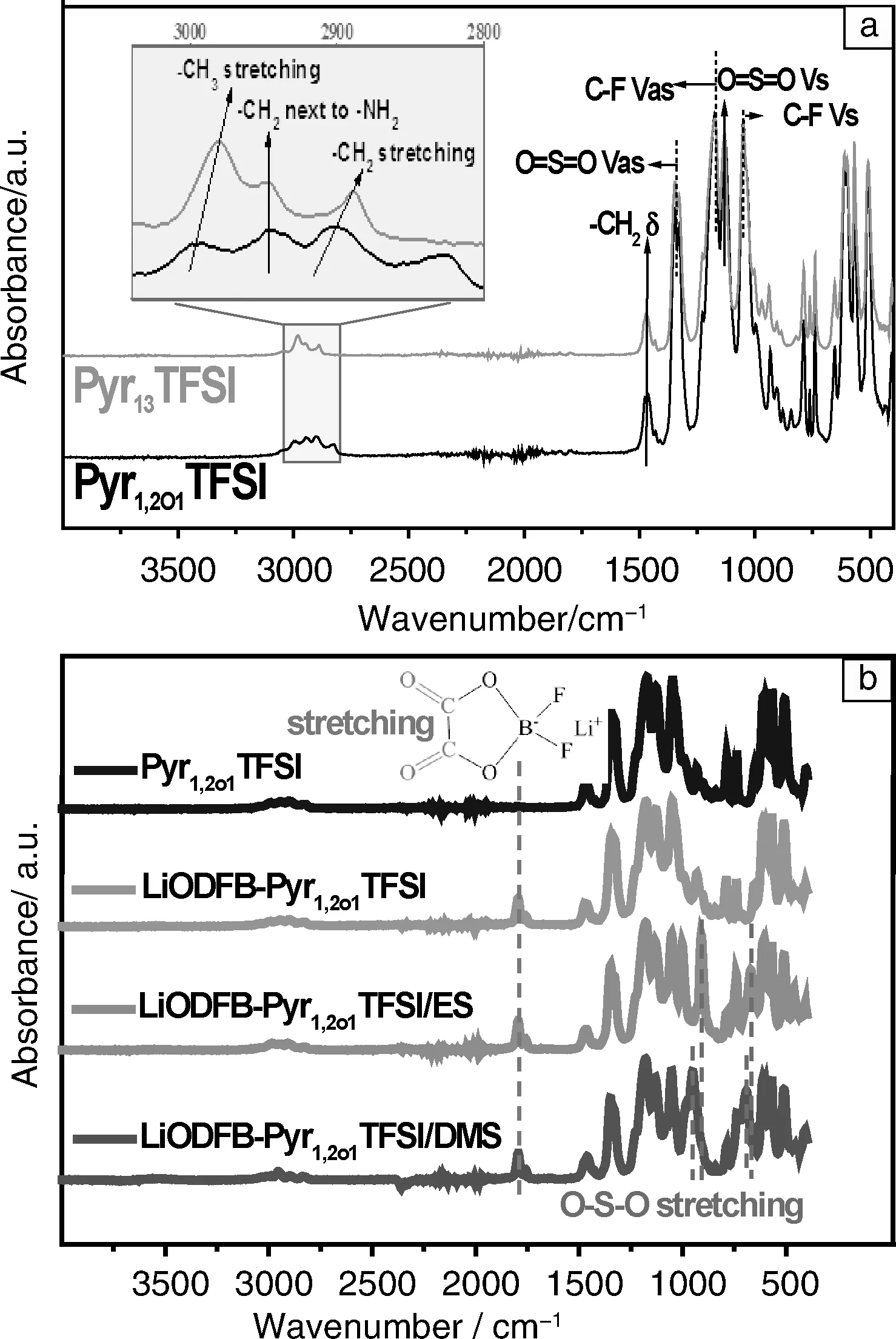
图3 电解液的红外光谱图和特征峰对应的基团:(a) Pyr13TFSI和Pyr1,2O1TFSI;(b) LiODFB-Pyr1,2O1TFSI,LiODFB-Pyr1,2O1TFSI/ES, LiODFB-Pyr1,2O1TFSI/DMS Fig.3 The ATR-FTIR spectra of Pyr13TFSI and Pyr1,2O1TFSI(a) and Pyr1,2O1TFSI with and without LiODFB sulfites(b)
加入锂盐LiODFB后,电解液体系的红外光谱在1 795 cm-1处出现特征峰,对应LiODFB结构中的C=O的伸缩振动。进一步加入亚硫酸酯后,LiODFB与亚硫酸酯发生了溶剂化作用,出现了O-S-O特征峰。由图中可以看出,ES的O-S-O伸缩振动峰位置为910 cm-1和654 cm-1,而DMS的O-S-O伸缩振动峰位置为953 cm-1和692 cm-1,表明锂盐LiODFB和两种亚硫酸酯发生了不同程度的溶剂化作用,使O-S-O的特征峰位置发生了偏移。在链状亚硫酸酯DMS中-SO3基团具有更强的电负性,更易与Li+发生相互作用。当亚硫酸酯中的S=O基团与Li+发生相互作用时,Li+与带负电荷的O原子发生配位作用,S=O键长增加,键能降低,使O-S-O基团键长减小,键能增高,峰值出现在更高频的位置。而受到环的张力影响,ES中-SO3基团的电负性相对较弱,受到Li+影响相对较小,O-S-O基团的特征峰则出现在较低频的位置。以上结果表明,亚硫酸酯的加入增强了LiODFB在体系中的溶剂化作用,其中链状DMS的溶剂化作用更加明显。溶剂化作用的差异意味着LiODFB和不同分子之间的相互作用的强度,致使这些电解质体系表现出不同的物理化学性能。
图4显示了LiODFB-Pyr1,2O1TFSI,LiODFB-Pyr1,2O1TFSI/ES和LiODFB-Pyr1,2O1TFSI/DMS 3种电解液体系在不同温度下的电导率。在测试温度范围内,各体系的电导率都随着温度的升高而增大。此外,亚硫酸酯的加入显著提高了体系的离子电导率。
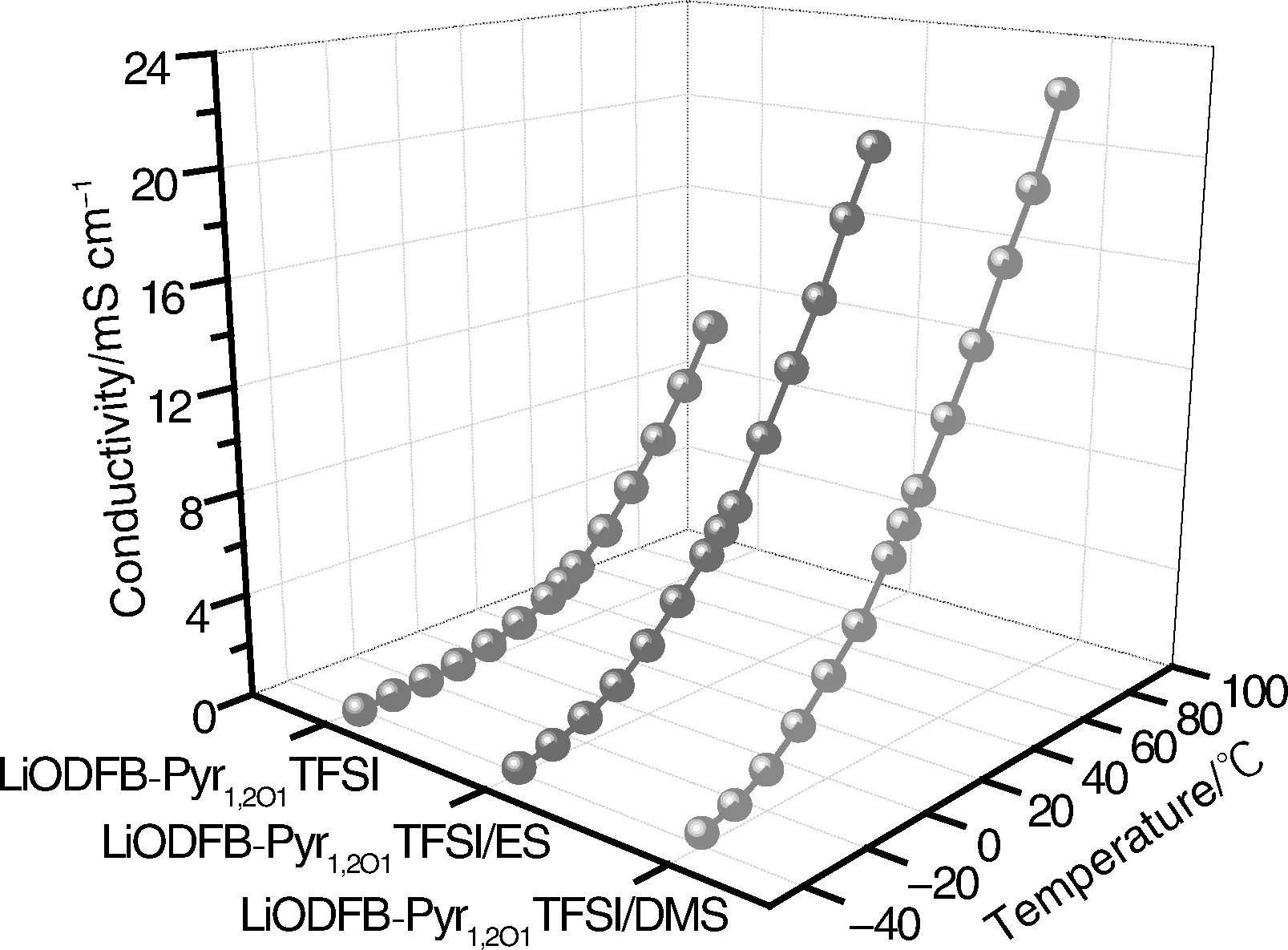
图4 LiODFB-Pyr1,2O1TFSI,LiODFB-Pyr1,2O1TFSI/ES和 LiODFB-Pyr1,2O1TFSI/DMS 3种电解液体系在不同温度下的电导率Fig.4 Conductivities of the LiODFB-Pyr1,2O1TFSI,LiODFB-Pyr1,2O1TFSI/ES and LiODFB-Pyr1,2O1TFSI/DMS electrolytes at various temperatures
未加入亚硫酸酯的LiODFB-Pyr1,2O1TFSI电解质体系的电导率在室温下为1.907×10-3S·cm-1,60 ℃时为6.662×10-3S·cm-1,但是在-40 ℃时仅为5.26×10-6S·cm-1。这一现象说明虽然在离子液体支链中引入醚氧基团降低了它的粘度,阻碍了低温下的结晶过程并且提高了分子极性,但是相比传统有机溶剂电解质,其电导率依然不占优势。尤其是在低温条件下,大多数离子以积聚态存在,抑制了自由离子的运动和转移,导致了电导率的降低。而加入30%亚硫酸酯的LiODFB-Pyr1,2O1TFSI/ES和LiODFB-Pyr1,2O1TFSI/DMS电解质体系的电导率在室温下分别为6.061×10-3S·cm-1,8.163×10-3S·cm-1,分别是未加入亚硫酸酯的电解质体系电导率的3~4倍。在-40 ℃时也可以分别达到2.06×10-4S·cm-1和4.63×10-4S·cm-1,可以满足极低温度下锂离子电池的应用需求。电导率的提高可以归因于:①亚硫酸酯的加入降低了电解液体系的粘度,提高离子迁移速率;②亚硫酸酯的加入提高了电解质的介电常数,提高了锂离子迁移数。其中,含有DMS的电解质比含有ES的电解质在整个测试温度范围内具有更高的电导率,这可能是因为DMS的链状结构使它具有更低的粘度。
锂离子迁移数的大小可以直接影响电池的倍率性能,是评价电解质的重要指标之一。组装“Li/电解质/Li”对称电池体系,采用稳态电流法与电化学阻抗测试联用法测试LiODFB-Pyr1,2O1TFSI,LiODFB-Pyr1,2O1TFSI/ES和LiODFB-Pyr1,2O1TFSI/DMS 3种电解质体系的锂离子迁移数(图5)。对对称电池施加10 mV的恒定电压,产生瞬间初始电流I0,而后逐渐减小,经过1 000 s后电流趋于稳定即稳态电流Is,得到电解液体系的稳态极化曲线,对稳态极化曲线测试前后的电池交流阻抗谱进行测试,测试频率范围是10-2~105Hz。
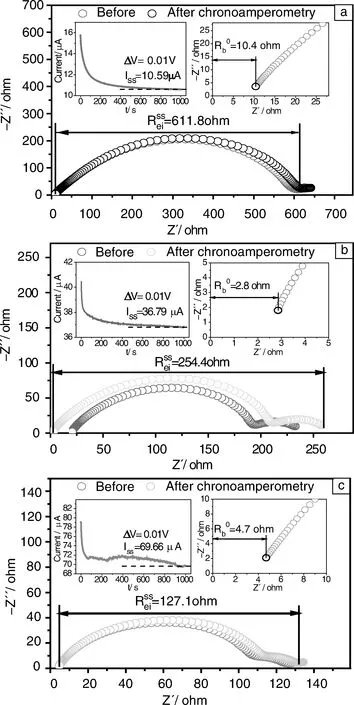
图5 离子液体电解液极化前后的电化学阻抗谱和稳态极化曲线: (a) LiODFB-Pyr1,2O1TFSI,(b) LiODFB-Pyr1,2O1TFSI/ES,(c)LiODFB-Pyr1,2O1TFSI/DMS Fig.5 Nyquist plots and Amperometric i-t curve of ionic liquid electrolyte: (a) LiODFB-Pyr1,2O1TFSI,(b) LiODFB-Pyr1,2O1TFSI/ES,and (c) LiODFB-Pyr1,2O1TFSI/DMS
得到“Li/电解质/Li”电池的稳态极化曲线和极化前后的阻抗谱后,由公式计算锂离子迁移数:
(1)
(2)
由式(1)和式(2)可以得出式(3):
(3)
其中:
Io— 初始态电流(A);
Iss— 稳态电流(A);
ΔV— 极化电压(V);
Rei0— 初始态电极界面电阻(Ω);
Reiss— 稳态时的电极界面电阻(Ω);
Rb0— 初始态接触电阻(Ω)
通过计算得出3种电解质体系的锂离子迁移数。其中,LiODFB-Pyr1,2o1TFSI电解质的锂离子迁移数仅为0.03,这是因为纯离子液体的介电常数较低,对锂盐的溶解度小,体系中的游离离子数目较少。而加入亚硫酸酯后,体系的粘度和介电常数都出现了明显的改善,对锂盐的溶解度增加,使体系更利于离子迁移,从而导致锂离子迁移数的提升。其中,以DMS的影响更为明显,LiODFB-Pyr1,2O1TFSI/DMS电解质体系的锂离子迁移数可达到0.28,接近于常用碳酸酯类电解质的水平。
LiFePO4是锂离子电池的常用电极材料之一,但是其低温性能差的问题是制约其发展的国际难题。以LiODFB-Pyr1,2O1TFSI,LiODFB-Pyr1,2O1TFSI/ES和LiODFB-Pyr1,2O1TFSI/DMS 3种电解质体系匹配LiFePO4电极,进行电化学测试。图6比较了电解质体系LiODFB-Pyr1,2O1TFSI,LiODFB-Pyr1,2O1TFSI/ES和LiODFB-Pyr1,2O1TFSI/DMS应用于Li/ LiFePO4电池中0.1 C下的循环性能。
亚硫酸酯的加入显著降低了电解质的粘度,提高了电解质的电导率和隔膜浸润性,使得电池具有更高的比容量和更好的循环稳定性。匹配未添加亚硫酸酯的LiODFB-Pyr1,2O1TFSI电解质的Li/LiFePO4电池比容量较低,并且随着循环的进行波动较大。而匹配LiODFB-Pyr1,2O1TFSI/ES电解质的Li/LiFePO4电池首次放电容量分别为149.5 mAh·g-1,50周的放电容量分别为143 mAh·g-1,容量保持率达95.7%。匹配LiODFB-Pyr1,2O1TFSI/DMS电解质的Li/ LiFePO4电池首次放电容量分别为153 mAh·g-1,50周的放电容量分别为152.6 mAh·g-1,容量保持率达99.7%。
插图显示了含有3种电解液的Li/ LiFePO4电池首周和第50周的充放电曲线。图中可以看出,LiODFB-Pyr1,2O1TFSI电解质中,Li/LiFePO4电池的首次充放电曲线斜率较大,充放电平台具有很大的电位差。添加亚硫酸酯后,充放电曲线变得非常平直,平台都维持在3.4 V左右,充放电平台的电压差和充放电过程的容量差也显著缩小,说明电池中锂离子的脱嵌变得更加平稳可逆。循环50周后,匹配LiODFB-Pyr1,2O1TFSI电解质的Li/LiFePO4电池充放电曲线显得更加平直,但仍具有较大的电位差和较小的容量。匹配LiODFB-Pyr1,2O1TFSI/ES电解质的电池容量有所降低,而匹配LiODFB-Pyr1,2O1TFSI/DMS电解质的电池充放电曲线几乎没有变化。
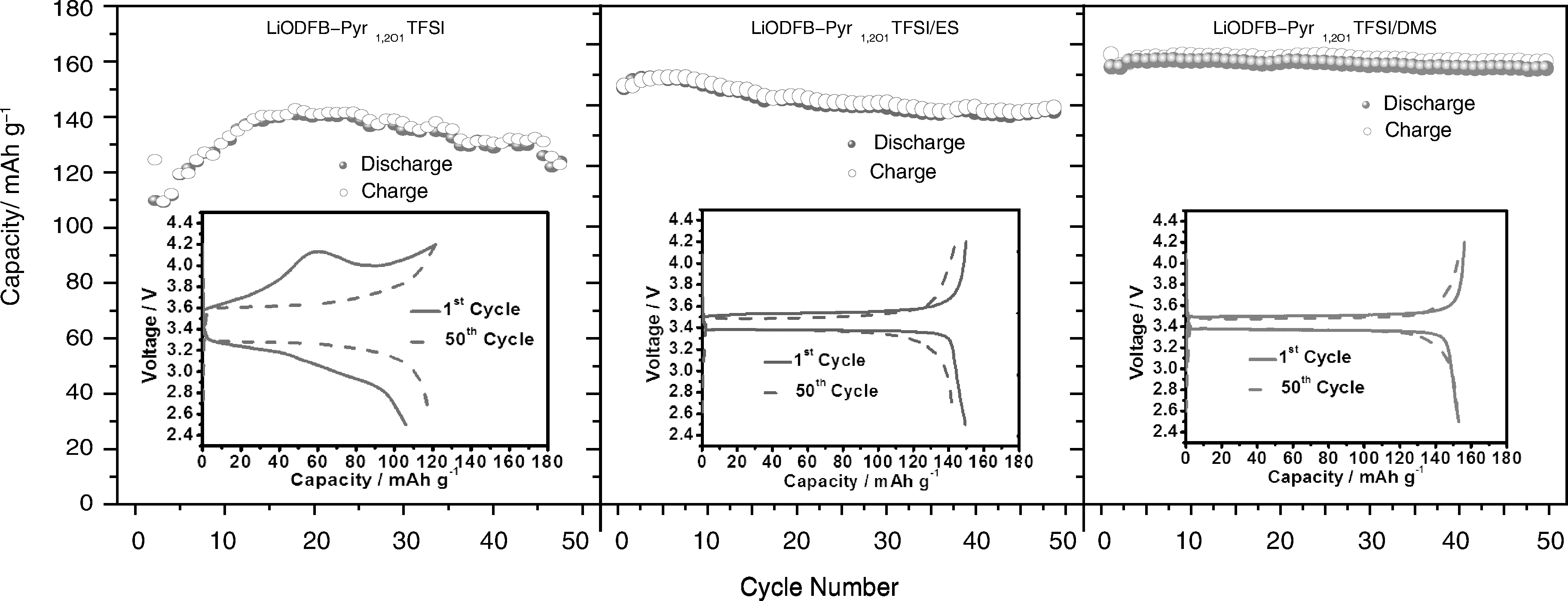
图6 匹配不同电解质的Li/ LiFePO4电池在0.1 C时的循环性能,插图为匹配3种电解质电池的首次和第50次充放电曲线Fig.6 Capacities of Li/ LiFePO4 half-cells containing different electrolytes at 0.1 C. The insets are charge/discharge proles for initial and 50th cycle of Li/LiFePO4 cells
图7显示了匹配LiODFB-Pyr1,2O1TFSI/DMS电解质的Li/LiFePO4, Li/MCMB电池在不同温度环境下的放电/充电曲线,测试温度分别为-40 ℃,-30 ℃,-20 ℃,-10 ℃,0 ℃,25 ℃,40 ℃,60 ℃,充电倍率为0.1 C。插图为各个测试温度下充电过程的平台电压。
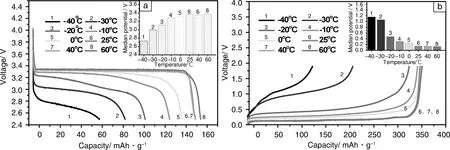
图7 在不同温度下LiODFB-Pyr1,2O1TFSI/DMS匹配Li/LiFePO4电池的放电曲线(a)和Li/MCMB电池的充电曲线(b)Fig.7 Discharge curves of Li/ LiFePO4 (a) and charge curves of Li/MCMB (b) with LiODFB-Pyr1,2O1TFSI/DMS at various temperatures
LiODFB-Pyr1,2O1TFSI/DMS电解质因其低粘度所带来的离子电导率、隔膜浸润性等方面的优势展现了良好的宽温带性能,在-40~60 ℃温度范围内都能表现出正常的放电/充电曲线和平台。在室温到60 ℃的温度区间内电池比容量和充电平台受温度影响较小。匹配该电解质的Li/LiFePO4,Li/MCMB电池分布在0 ℃,-20 ℃下,才显示出电池比容量的显著降低。含LiODFB-Pyr1,2O1TFSI/DMS的Li/LiFePO4电池在60 ℃,室温,-40 ℃下的放电比容量分别为159.9 mAh·g-1,154.8 mAh·g-1,63.2 mAh·g-1,相应的充电平台分别为3.37 V,3.37 V和2.73 V。Li/MCMB电池在室温,-40 ℃下的充电比容量分别为354.2 mAh·g-1,135.1 mAh·g-1,相应的充电平台分别为0.148 V和1.157 V。虽然在极低温度-40 ℃下电池的比容量相比室温下有着明显的降低,但是电池仍然可以正常工作。
3.3Pyr1,2O1TFSI/TEGDME电解质体系
离子液体与Li/S电池电极材料相容性良好。但是,由于离子液体体系的粘度和对聚硫离子的溶解度的限制,导致电池的循环性能较差,容量迅速衰减。为了改善电池性能,将TEGDME作为共溶剂加入到Pyr1,2O1TFSI中,然而,过量的TEGDME会影响离子液体对电池过充的抑制作用。为了明确Pyr1,2O1TFSI/TEGDME电解质的最佳比例,对含有LiTFSI-Pyr1,2O1TFSI/TEGDME系列电解质的Li/S电池的循环稳定性进行测试,结果如图8所示。
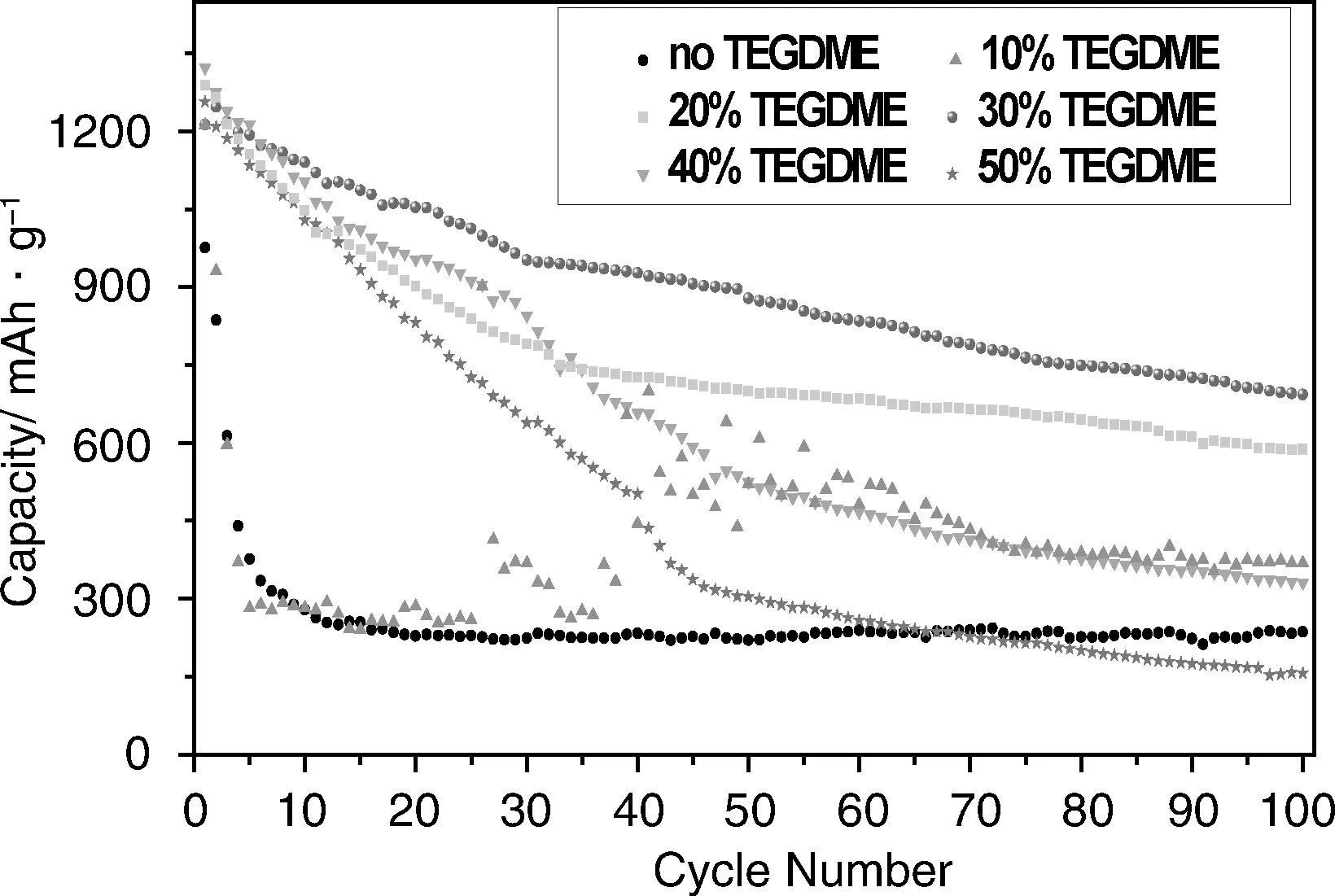
图8 含不同配比的LiTFSI-Pyr1,2O1TFSI/TEGDME电解质的Li/S电池的循环性能Fig.8 Cycle performance of the Li/S cells in LiTFSI-Pyr1,2O1TFSI/ TEGDME electrolyte with different ratios
含LiTFSI-(70wt%)Pyr1,2O1TFSI/(30wt%)TEGDME电解质的Li/S电池表现出优秀的循环性能,首次放电容量为1 212.8 mAh·g-1,循环100周后容量依然保持在693.5 mAh·g-1。相比之下,TEGDME添加量为20%或更低时,电解质体系的粘度问题没有得到有效改善,对聚硫化锂的低溶解度限制了活性物质的利用率,同时使电池界面阻抗较大,所以电池的放电比容量随着TEGDME添加量的减小而降低;而当TEGDME添加量超过40%时,离子液体对电池过充行为的抑制作用受到破坏,长链多硫化物扩散到Li表面还原为短链多硫化物,短链多硫化物又扩散到S/C电极表面氧化为长链多硫化物,发生“飞梭效应”,导致电池容量的迅速衰减。
图9a显示了含LiTFSI-(70wt%)Pyr1,2O1TFSI/(30wt%)TEGDME电解质的Li/S电池1 C充放电倍率下的循环稳定性和库伦效率。在1 C倍率下,Li/S电池的首周放电比容量略有降低,约为886.5 mAh·g-1。经过100周循环,电池的容量保持率达到93.3%,库伦效率为95.3%,展现出良好的倍率性能。
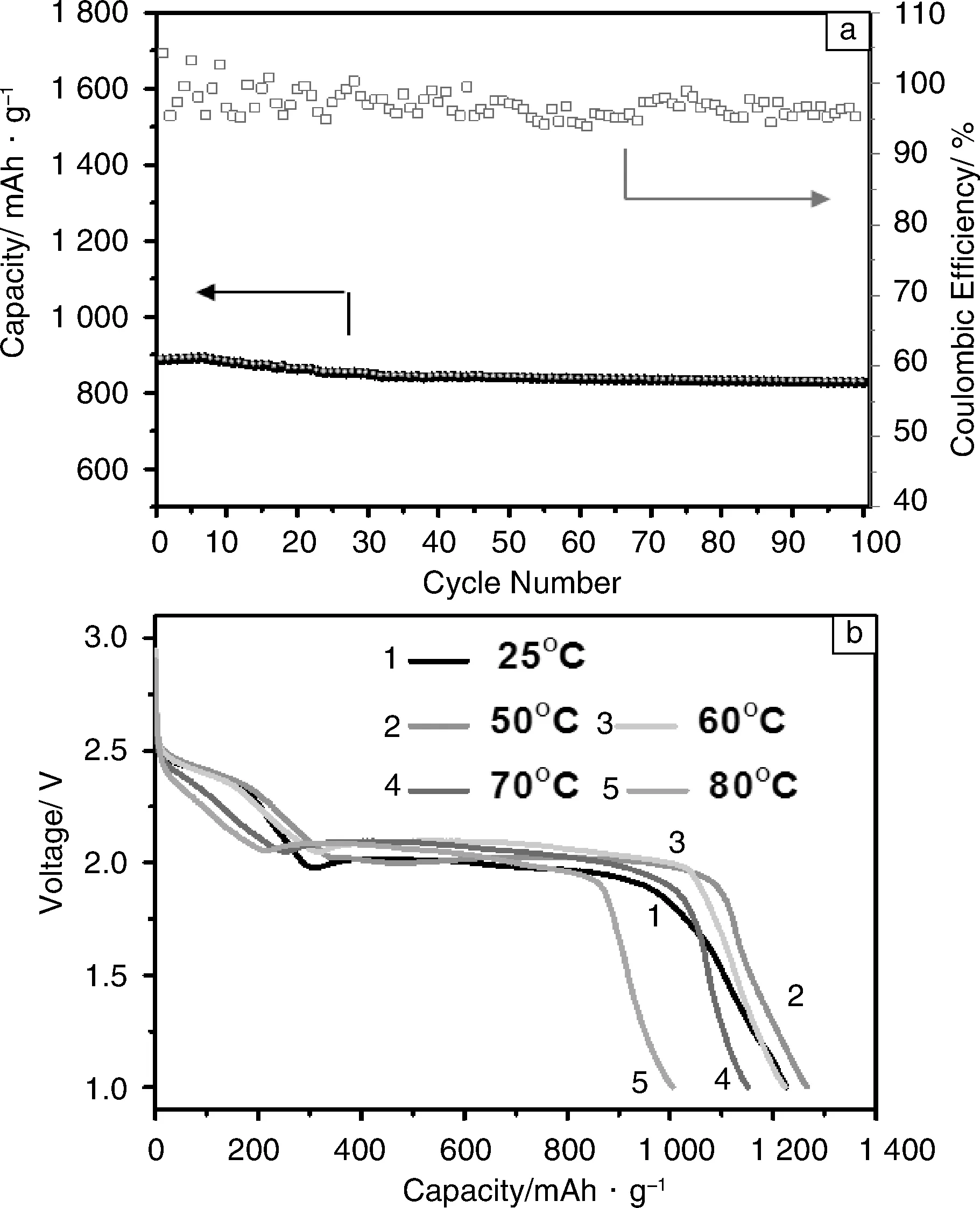
图9 含LiTFSI-(70wt%)Pyr1,2O1TFSI/(30wt%)TEGDME电解质的Li/S电池在1 C倍率下的循环性能和库伦效率(a)和在不同温度下的放电曲线(b)Fig.9 Cycle performance (a) and discharge profiles at various temperatures (b) of the Li/S cells with LiTFSI-(70wt%)Pyr1,2O1TFSI/ (30wt%)TEGDME at 0.1 C
通过离子液体良好的热稳定性改善电池的高温性能,对含LiTFSI-(70wt%)Pyr1,2O1TFSI/(30wt%)TE GDME电解质的Li/S电池在高温下的电池性能进行分析。图9b为含LiTFSI- (70wt%)Pyr1,2o1TFSI/(30wt%)TEGDME电解质的Li/S电池在不同温度下的首次放电曲线,充放电倍率为0.1 C。测试结果显示,在80 ℃下,电池依然可以正常工作,并且表现出优秀的放电性能,首次放电容量可达1 005.3 mAh·g-1。其中50℃时电池的比容量高于室温,这可能是因为随着温度的提高,电解质的电导率随之提高,促进了对活性物质的利用率。温度超过50 ℃后,电池容量随着温度的升高而减小,但是依然表现出平稳的放电平台和良好的比容量。在70 ℃,80 ℃时,电池在2.4 V的放电平台变小,说明长链多硫化物的还原反应受到了温度的影响,导致了容量衰减。测试温度范围内电池的放电平台没有明显变化。
将以上研究成果,结合前人已发表研究中有代表性的锂电池离子液体基电解质体系进行总结归纳,可以发现,有机共溶剂的加入有效改善了电解质的电化学性能,同时适量的有机溶剂并不会损害离子液体电解质的难燃特性。当电解质体系中的离子液体和共溶剂分别是环状结构和链状结构时,电解质兼得两种结构所带来的优点,展现出最全面的性能。此外,当离子液体和共溶剂都为环状或都为链状时,电解质将在某一方面展现出非常优秀的性能,如电化学稳定窗口或电导率。以上猜想将为未来电解质体系的开发设计提供参考和启发。
4结论
本研究从离子液体/有机共溶剂体系出发,设计开发满足不同锂二次电池应用需求的离子液体基电解质。 制备LiODFB-Pyr1,2O1-TFSI/亚硫酸酯新型电解质。实验证明该体系具有高电导率和宽工作温度范围,可以作为一种良好的电解质应用于锂离子电池中。其中,DMS对电解质体系的性能改善更为明显,LiODFB-Pyr1,2O1TFSI/ DMS电解质体系的电导率和锂离子迁移数分别为8.163×10-3S·cm-1,0.28。含该电解质的Li/MCMB电池和Li/ LiFePO4电池在-40 ℃到60 ℃温度范围内都能表现出正常的充电/放电曲线和平台。此外,合成系列离子液体基Li/S电池电解质。其中,LiTFSI-(70wt%) Pyr1,2O1TFSI/(30wt%) TEGDME电解质综合了离子液体和醚类共溶剂的优势,使Li/S电池表现出良好的循环性能和倍率性能。在0.1 C充放电倍率下,循环100周后仍然维持在693.5 mAh·g-1。在1 C放电倍率下,首周放电比容量为886.5 mAh·g-1,经过100周循环,容量保持率达到93.3%,库伦效率为95.3%。此外,该电解质良好的热稳定性,使电池在80 ℃仍然可以正常工作,首次放电容量达1 005.3 mAh·g-1。将离子液体和共溶剂的按照结构划分,对比总结其电化学基本性质:当电解质体系中的离子液体和共溶剂分别是环状结构和链状结构时,电解质兼得两种结构所带来的优点,展现出全面良好的性能。这一结论为以后电解质体系的研究设计提供了参考。
参考文献References
[1]Kang B, Ceder G.Nature[J], 2009, 458: 190-193.
[2]Li H, Wang Z, Chen L,etal.AdvancedMaterials[J], 2009, 21: 4 593-4 607.
[3]Bruce P G, Freunberger S A, Hardwick L J,etal.NatureMaterials[J], 2012, 11: 19-29.
[4]Kim H, Lim H-D, Kim J,etal.JournalofMaterialsChemistryA[J], 2014, 2: 33-47.
[5]Li H, Wang Y, Na H,etal.JournaloftheAmericanChemical
Society[J], 2009, 131. (42): 15 098-15 099.
[6]Luo J Y, Cui W J, He P,etal.NatureChemistry[J], 2010, 2: 760-765.
[7]Hyun S J, Jong H K, Sang Y L.JournalofMaterialsChemistry[J], 2010, 20: 9 180-9 186.
[8]Hirayama M, Ido H, Kim K,etal.JournaloftheAmericanChemicalSociety[J], 2010, 132(43): 15 268-15 276.
[9]Chagnes A, Diaw M, Carré B,etal.JournalofPowerSources[J], 2005, 145(1): 82-88.
[10]Ferrari S, Quartarone E, Tomasi C,etal.JournalofPowerSources[J], 2013, 235: 142-147.
[11]Allen J L, McOwen D W, Delp S A,etal.JournalofPowerSources[J], 2013, 237: 104-111.
[12]Wu F, Tan G, Chen R,etal.AdvancedMaterials[J], 2011, 23(43): 5 081-5 085.
[13]Chen Z, Xue T, Lee J M.TheRoyalSocietyofChemistryAdvances[J], 2012, 2: 10 564-10 574.
[14]Fang S, Tang Y, Tai X,etal.JournalofPowerSources[J], 2011, 196 (3):1 433-1 441.
[15]Jin Y, Fang S, Yang L,etal.JournalofPowerSources[J], 2011, 196(24): 10 658-10 666.
[16]Kim K, Cho Y H, Shin H C.JournalofPowerSources[J], 2013, 225(1): 113-118.
[17]Li X, Yin Z, Li X,etal.Ionics[J], 2014, 20: 795-801.
[18]Chen R, Zhu L, Wu F,etal.JournalofPowerSources[J], 2014, 245: 730-738.
[19]Leggesse E G, Jiang J C.TheJournalofPhysicalChemistryA[J], 2012, 116(45): 11 025-11 033.
[20]Li S Y, Zhao W, Cui X L,etal.ElectrochimicaActa[J], 2013, 91(28): 282-292.
[21]Barchasz C, Lepretre J C, Patoux S,etal.JournaloftheElectrochemicalSociety[J], 2013, 160(3): A430-A436.
[22]Liang X, Wen Z Y, Liu Y,etal.JournalofPowerSources[J], 2012, 206: 409-413.
[23]Kim S, Jung Y, Park S J.JournalofPowerSources[J], 2005, 152: 272-277.
[24]Park J-W, Ueno K, Tachikawa N,etal.TheJournalofPhysicalChemistryC[J], 2013, 117: 20 531-20 541.
[25]Shin H, Cairns E J.JournaloftheElectrochemicalSociety[J], 2008, 155: A368-A373.
[26]Wang L, Byon H R.JournalofPowerSources[J],2013, 236: 207-214.
(编辑盖少飞)
收稿日期:2015-07-15
基金项目:国家自然科学基金委项目(21373028),科技部“973”
通讯作者:陈人杰,男,1976年生,教授,博士生导师,Email:
DOI:10.7502/j.issn.1674-3962.2016.06.08
中图分类号:O646.1
文献标识码:A
文章编号:1674-3962(2016)06-0449-08
Study on Functional Electrolytes Based on Ionic Liquid for Rechargeable Lithium Battery
ZHU Qizhen, CHEN Nan, CHEN Renjie, WU Feng
(School of Material, Beijing Institute of Technology, Beijing 100081, China)
Abstract:As a key component of a battery, electrolyte has a potent influence on its safety, operating temperature, charge/discharge performance and cycle life. Novel electrolytes were prepared based on (N-methoxyethyl-N-methylpyrrolidinium bis (trifluoromethanesulfonyl)-imide, Pyr1,2O1TFSI) and sulfites as co-solvents with lithium difluoro (oxalate) borate (LiODFB) as lithium salt, exhibiting good ion transport, electrode compatibility and wide operating temperature range. The conductivity and Li+ transference number of the LiODFB-Pyr1,2O1TFSI/ DMS electrolyte was 8.163×10-3S·cm-1and 0.28, respectively. The Li/MCMB and Li/ LiFePO4 cells containing this electrolyte had good cycle performance and normal charge curve in the temperature of-40 ℃ to 60 ℃. Moreover, a series of electrolytes for Li/S battery were prepared based on (Pyr1,2O1TFSI) with tris(ethylene glycol) dimethyl ether (TEGDME) as co-solvents in different proportions. LiTFSI was used as lithium salt. Li/S cells with LiTFSI-(70wt%)Pyr1,2O1TFSI/ (30wt%)TEGDME electrolyte exhibited excellent cycle and rate performance, whose capacity was 1 212.8 mAh·g-1in the first cycle and 693.5 mAh·g-1after 100 cycles at current density of 0.1 C, and 827.3 mAh·g-1with the coulombic efficiency of above 99% at current density of 1 C. In addition, the cells showed good high temperature performance which could operate at 80 ℃ with the initial cycle capacity of 1 005.3 mAh·g-1. A summary of representative electrolyte systems of ionic liquid with organic co-solvent for lithium battery and the corresponding characteristics and properties based on the investigations above and the previous studies are illustrated for the first time. It might be proposed to offer a useful starting point to design the mixed electrolyte in lithium batteries.
Key words:electrolyte; ionic liquid; rechargeable lithium battery;electrolytes system;semi-quantitative
计划项目(2015CB251100)
第一作者:朱奇珍,女,1988年生,博士
chenrj@bit.edu.cn

