纳米SiO2亲和吸附剂的制备及性能
邹雪艳,张于涛,王 朋,董 烁,郭静玉,何建英*
(1.河南大学 纳米材料工程研究中心,河南 开封 475004; 2.河南大学 民生学院,河南 开封 475004;3.河南大学 医学院,河南 开封 475004; 4. 河南大学 化学化工学院,河南 开封 475004)
纳米SiO2亲和吸附剂的制备及性能
邹雪艳1,张于涛2,王朋2,董烁3,郭静玉4,何建英4*
(1.河南大学 纳米材料工程研究中心,河南 开封 475004;2.河南大学 民生学院,河南 开封 475004;3.河南大学 医学院,河南 开封 475004;4. 河南大学 化学化工学院,河南 开封 475004)
采用水热法一步合成了巯基纳米二氧化硅(SiO2-SH),随后在其表面修饰亚氨基二乙酸基团(-IDA)得到了SiO2-SH/IDA,利用-SH和-IDA双官能团更多的吸附溶液中的Ni2+,从而得到SiO2-SH/IDA-Ni2+纳米亲和吸附剂. 制备的亲和吸附剂可直接用于六聚组氨酸为标签的(His-tagged)融合蛋白的分离纯化. 利用TEM、FT-IR、TG、SDS-PAGE等大型仪器表征了样品的形貌、结构及亲和分离能力. 结果表明制备的SiO2-SH/IDA-Ni2+纳米亲和吸附剂平均粒径为60 nm,对His-tagged蛋白具有较好的特异性和较低的检测限(约为1.9×10-5mol/L),且该吸附剂再生能力较强,再生3次后对目标蛋白仍具有较好的分离效果.
纳米二氧化硅;功能化;His-tagged;亲和分离
蛋白质作为生物体内的基础物质,于生物体具有极为重要的作用. 为了进一步研究特定蛋白的物理化学性能,首要的就是对该目标蛋白进行分离纯化[1]. 目前蛋白质分离提纯的常规方法有:色谱法、毛细管电泳法、反胶团萃取法、盐析法、层析法、累加进样分离法、超滤技术等[2-5]. 其中亲和层析分离技术是一种成本低廉、选择性好、分离效率高的蛋白质分离手段[6-8]. 它的主要原理是亲和吸附剂的配体分子与目标蛋白进行特异性结合,从而达到分离提纯目标蛋白的目的. 尽管如此,它也存在放大困难、操作繁琐、层析柱易被污染和堵塞等缺点. 近年来将无机微/纳米材料用作亲和沉淀的载体是近年来的研究热点[9-10]. BAE等[11]在SiO2纳米管表面修饰了Au纳米颗粒,再以Au颗粒为桥梁,实现对半胱氨酸(Cys)及含有Cys片段的其它蛋白的分离纯化. XU等[12]在磁性Fe2O3表面偶联多巴胺分子,用于对His-tagged融合蛋白的分离纯化,该磁性纳米颗粒具有高度的专一性,并可回收再利用. 由于这些亲和吸附剂通常只含有只有一种螯合基团,吸附Ni2+能力相对较弱,本文中我们采用生物相容性好的纳米二氧化硅为载体[13-15],以-SH和-IDA双功能化螯合基团为有效基团,可以更多的吸附溶液中的Ni2+,从而更好的分离纯化His-tagged融合蛋白.
1 实验部分
1.1试剂与仪器
巯基丙基三甲氧基硅烷(MPS,95%)购于Alfa-Aesar公司;十六烷基三甲基氯化铵(CTAC,≥98.0%)购于国药集团化学试剂有限公司;亚氨基二乙酸(IDA,≥98%)和三乙醇胺(TEA,≥99.0%),γ-缩水甘油醚氧丙基三甲氧基硅烷(GPTMS,≥97%)均购于阿拉丁公司;氯化镍(NiCl2·6H2O,98%),无水乙醇(C2H5OH,≥99.7%)和氢氧化钠(NaOH,≥96%)均购于天津市科密欧化学试剂有限公司;正硅酸乙酯(TEOS,99%)购于天津市福晨化学试剂厂;浓盐酸(HCl,37%)购于洛阳昊华化学试剂厂.
样品的形貌组成分别使用透射电子显微镜(TEM,日本电子株式会社)、热重分析仪(TG,Merrler-Toledo Instruments公司)、傅立叶变换红外光谱仪(FT-IR,美国尼高力公司)及原子吸收分光光度计(AAS,日本日立公司)进行检测. 捕获的His-tagged蛋白用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳检测(SDS-PAGE,Power PAC 300,郑州宝赛科贸有限公司),稳压电压是70 V,分离电压是120 V.
1.2实验过程
1.2.1合成SiO2-SH样品
取17 mL CTAC于50 mL三口瓶内,加入2.8 mL无水乙醇,室温搅拌10 min;加入1.1 mL TEA,继续搅拌20 min升温至60 ℃,缓慢滴加1.5 mL TEOS和MPS混合液(体积比1∶10),持续反应3 h后转入50 mL高压反应釜中,110 ℃反应48 h,冷至室温后离心洗涤干燥,即得SiO2-SH样品.
1.2.2合成SiO2-SH/IDA样品
取20 mL IDA溶液于三口瓶中,用2 mol/L NaOH溶液调溶液pH至11,冰浴条件下滴加2 mL GPTMS,搅匀后升温至65 ℃反应12 h. 取3 mL上述产物用6 mol/L HCl调溶液pH至2,加入0.1 g SiO2-SH样品,搅匀后升温至90 ℃继续反应3 h. 反应结束后得到的沉淀充分洗涤后即得SiO2-SH/IDA样品,60 ℃烘干后备用.
1.2.3合成SiO2-SH/IDA-Ni2+样品
取50 mL 2 mol/L NiCl2溶液于试管中,加入3 mg SiO2-SH/IDA样品,分散均匀后25℃振荡反应2 h,沉淀充分洗涤后即得SiO2-SH/IDA-Ni2+样品,样品分散在1 mL 25%的乙醇中备用.
1.2.4His-tagged 蛋白的分离方案
将SiO2-SH/IDA-Ni2+样品用破菌buffer(20 mmolL-1Tris-HCl,含0.2 mol·L-1NaCl)洗涤数次后沉淀中直接加入1 000 μL细胞裂解液,于4 ℃摇床上孵育2 h;孵育后的样品用上述破菌 buffer洗涤数次以除去表面物理吸附的蛋白. 随后加入300 μL一定浓度的咪唑进行洗脱,洗脱后的蛋白用于SDS-PAGE分析. 将洗脱后的亲和吸附剂用EDTA和NiCl2溶液处理后,重复以上步骤3次,以检测其再生后分离目标蛋白的能力.
2 结果与讨论
2.1TEM表征分析
图1为SiO2-SH/IDA样品的透射图及粒径分布图. 从图1a、1b可以看出,制备的样品为实心微球,平均粒径为108 nm,分散性好(图1c).
2.2FT-IR表征分析
图2为合成的SiO2-SH(1)和SiO2-SH/IDA(2)样品的FT-IR图. 从图中可以看出,3 428 cm-1为样品表面吸附水的-OH的吸收峰;1 124 cm-1、804 cm-1、694 cm-1处对应SiO2的特征吸收峰:1 124 cm-1归属于Si-O-Si的反对称伸缩吸收峰,804 cm-1为Si-O对称伸缩振动吸收峰;在2 550 cm-1处为-SH的伸缩振动,说明制备的样品表面含有-SH. 从图2曲线2可以看出,2 930 cm-1为-IDA与GPTMS上的亚甲基的伸缩振动峰,694 cm-1为IDA中-NH键的伸缩振动峰,说明-IDA与-SH均修饰在了SiO2的表面[16-17].

图1 制备SiO2-SH/IDA样品的TEM图(a,b)和粒径分布图(c)Fig.1 TEM images (a,b) and size distribution histogram (c) of the prepared SiO2-SH/IDA

图2 制备SiO2-SH (1)和SiO2-SH/IDA (2)样品的FT-IR图Fig.2 FT-IR spectra of the prepared SiO2-SH (1) and SiO2-SH/IDA (2) samples
2.3TG曲线分析
图3为制备SiO2-SH(1)和SiO2-SH/IDA(2)的TG图,从图3中可以看出样品从室温~800 ℃有明显的失重,其中主要的失重出现在220~700 ℃,从曲线1可以看出样品SiO2-SH的失重率约为52.3%,这主要为表面巯基的热分解. 从曲线2可以看出,样品SiO2-SH/IDA的失重率为57.4%,这主要是由于表面修饰的-SH和-IDA基团的热分解所致,说明二氧化硅载体表面具有较高的官能团密度.
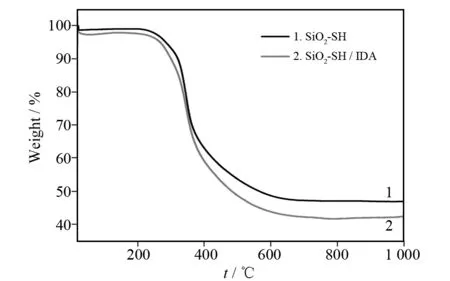
图3 制备SiO2-SH(1)和SiO2-SH/IDA (2)样品的TG曲线Fig.3 TG curves of the prepared SiO2-SH (1) and SiO2-SH/IDA (2) samples
2.4分离蛋白示意图
图4为SiO2-SH/IDA-Ni2+样品的制备以及分离His-tagged TRX融合蛋白的示意图. 首先,采用TEOS与MPS共同水解合成了SiO2-SH纳米微球. 随后在SiO2-SH微球表面修饰-IDA基团形成SiO2-SH/IDA复合微球,然后继续吸附Ni2+形成SiO2-SH/IDA-Ni2+亲和吸附剂. 最后用制备的SiO2-SH/IDA-Ni2+纳米吸附剂直接应用于His-tagged TRX融合蛋白的分离纯化. 文中采用-SH和-IDA长短相间的两种连接臂,一定程度上减小了分离蛋白时的空间位阻,从而可以更好地实现对目标蛋白的亲和分离.

图4 SiO2-SH/IDA-Ni2+样品的制备及其分离His-tagged TRX融合蛋白示意图Fig.4 Synthesis of the SiO2-SH/IDA-Ni2+ sample and separation of His-tagged TRX protein by the prepared sample
2.5SDS-PAGE分析
图5为SiO2-SH/IDA-Ni2+亲和吸附剂在不同咪唑浓度(0.5~3 mol/L)洗脱条件下分离His-tagged蛋白的SDS-PAGE图. 泳道1~2为Marker与混合蛋白,泳道3~6咪唑浓度分别为0.5、1、2及3 mol/L. 从图5中可以看出,随着咪唑洗脱浓度的增加,洗脱目标蛋白的量略有变化,当咪唑浓度为1 mol/L时,洗脱下来目标蛋白已达到最大,且几乎没有杂蛋白. 因此,咪唑的最佳洗脱浓度为1 mol/L.

图5 不同浓度咪唑洗脱条件下SiO2-SH/IDA-Ni2+亲和吸附剂分离His-tagged TRX融合蛋白的SDS-PAGE图Fig.5 SDS-PAGE analysis of purified His-tagged TRX proteins by the prepared SiO2-SH/IDA-Ni2+ adsorbent
为测试制备SiO2-SH/IDA-Ni2+亲和吸附剂对目标蛋白的检测限,我们对不同浓度梯度的His-tagged TRX蛋白进行检测. 图6中泳道1~4为不同His-tagged TRX浓度加入量分离蛋白的SDS-PAGE图:泳道1,1.9×10-4mol/L;泳道2,1.9×10-5mol/L;泳道3,1.9×10-6mol/L;泳道4,1.9×10-7mol/L. 从泳道1~4可以看出,当His-tagged TRX浓度在1.9×10-4~1.9×10-5mol/L时,制备的吸附剂对目标蛋白均有较好的检测效果,而当蛋白浓度低于1.9×10-6mol/L时,该吸附剂不能检测到目标蛋白,说明制备的SiO2-SH/IDA-Ni2+吸附剂对His-tagged TRX蛋白的检测限至少为1.9×10-5mol/L,具有较好的响应效果.
图6 不同梯度的His-tagged TRX蛋白下SiO2-SH/IDA-Ni2+亲和吸附剂分离His-tagged TRX蛋白的电泳图Fig.6 SDS-PAGE of His-tagged TRX protein separated by prepared SiO2-SH/IDA-Ni2+ adsorbent in different concen-tration of His-tagged TRX proteins
为了验证制备SiO2-SH/IDA-Ni2+吸附剂再生后分离His-tagged TRX蛋白的能力,我们采用EDTA和NiCl2溶液对亲和吸附剂进行预处理. 图7为SiO2-SH/IDA-Ni2+吸附剂分离His-tagged TRX蛋白的SDS-PAGE图. 其中,泳道1为Marker,泳道2为混合蛋白,泳道3、4、5分别为第一、二、三次再生后亲和吸附剂对His-tagged TRX蛋白分离的电泳图. 从图7可以看出,再生三次后的微球,仍然对混合蛋白中的His-tagged TRX蛋白有比较高的分离能力,说明制备的SiO2-SH/IDA-Ni2+吸附剂具有较强的再生能力.

图7 SiO2-SH/IDA-Ni2+吸附剂再生后分离His-tagged TRX蛋白的SDS-PAGE图Fig.7 SDS-PAGE analysis of purified His-tagged TRX proteins by the prepared SiO2-SH/IDA-Ni2+ adsorbent for three times
3 结论
利用水热反应合成了巯基纳米二氧化硅(SiO2-SH). 然后在其表面修饰亚氨基二乙酸基团(-IDA),形成了SiO2-SH/IDA双功能团纳米微球,吸附Ni2+后用于His-tagged融合蛋白的特异性分离,该纳米吸附剂对目标蛋白具有较低的检测限及较强的再生能力,具有潜在的市场价值.
[1] 陈华友, 张春霞, 马晓珂, 等. 蛋白质分离纯化策略[J]. 安徽农业科学, 2009, 37(36): 17849-17851.
[2] 牛瑞, 秦胜利. 蛋白质分离纯化技术研究进展[J]. 化工科技市场, 2010, 33(4): 16-18.
[3] LAWRENCE J E, STEWARD G F. Purification of viruses by centrifugation [J]. Manual of Aquatic Viral Ecology, 2010, 17: 166-181.
[4] 喇文军. 蛋白质、蛋白酶以及短肽类的分离提纯技术及应用[J]. 食品工程, 2008(1): 15-18.
[5] 卢忠英, 陈仕学, 姚元勇, 等. 蛋白质分离纯化方法的研究进展[J]. 广州化工, 2015, 43(17): 12-13.
[6] 王莉, 刘道杰, 李连之. 亲和层析在蛋白质研究中的应用进展[J]. 理化检验:化学分册, 2007, 43(6): 515-517.
[7] 孙旭东, 李红旗, 隋洪艳, 等. 金属螯合亲和层析分离蛋白质的研究[J]. 生物工程学报, 2000, 16(4): 495-499.
[8] 王桂珍. 亲和层析技术的研究及应用[D]. 广东: 暨南大学, 2011: 1-16.
[9] 田淑芳, 邹雪艳, 卢海涛, 等. 中空纳米二氧化硅复合微球的制备及其对蛋白的亲和分离[J]. 无机化学学报, 2015, 31(7): 1329-1334.
[10] MOHAPATRA S, PAL D, GHOSH S K, et al. Design of magnetic nanoparticles for purification of His-tagged recombinant proteins [J]. J Nanosci Nanotech, 2007, 79: 3193-3199.
[11] BAE D R, LEE S J, HAN S W, et al. Au-doped magnetic silica nanotube for binding of cysteine-containing proteins [J]. Chem Mater, 2008, 20(12): 3809-3813.
[12] XU C, XU K, GU H, et al. Dopamine as a robust anchor to immobilize functional molecules on the iron oxide shell of magnetic nanoparticles [J]. J Am Chem Soc, 2004, 126 (32): 9938-9939.
[13] 杨宇, 杨小伟, 叶张梅, 等. 用纳米二氧化硅包裹蛋白质的方法探究[C]. 上海市研究生学术论坛暨第三届上海交通大学医(理)工研究室学术论坛, 2012.
[14] 李曦, 刘连利, 王莉莉. 纳米二氧化硅[J]. 无机硅化合物, 2007(4): 7-10.
[15] REHMAN F, RAHIM A, AIROLDI C, et al. Preparation and characterization of glycidyl methacrylate organo bridges grafted mesoporous silica SBA-15 as ibuprofen and mesalamine carrier for controlled release [J]. Mat Sci Eng C, 2016, 59: 970-979.
[16] 吴永慧. 二氧化硅基纳米吸附剂的制备及其亲和分离组氨酸标记蛋白质[D]. 开封: 河南大学特种功能材料重点实验室, 2014: 29-37.
[17] 阮建明, 王亚东, 伍秋美, 等. 单分散球形SiO2的制备及其分散体系的流变性能[J]. 中南大学学报(自然科学版), 2007, 38(5): 825-829.
[责任编辑:刘红玲]
Preparation and properties of nano-SiO2affinity adsorbent
ZOU Xueyan1, ZHANG Yutao2, WANG Peng2, DONG Shuo3, GUO Jingyu4, HE Jianying4*
(1.EngineeringResearchCenterforNanomaterials,HenanUniversity,Kaifeng475004,Henan,China; 2.HenanUniversityMinshengCollege,Kaifeng475004,Henan,China; 3.HenanUniversitySchoolofMedicine,Kaifeng475004,Henan,China; 4.Collegeofchemistryandchemicalengineering,HenanUniversity,Kaifeng475004,Henan,China)
Silica nanospheres (NSs) with thiol group (SiO2-SH) were synthesized by the hydrothermal method. Then the iminodiacetic acid group (-IDA) was modified on the surface of SiO2-SH to obtain SiO2-SH/IDA NSs. Subsequently the Ni2+ions in the solution were adsorbed by both -SH group and -IDA group of SiO2-SH/IDA NSs, which could adsorb more Ni2+on the surface of these NSs to get SiO2-SH/IDA-Ni2+adsorbent. Then the adsorbent was used to separate His-tagged proteins. The morphology, composition and affinity separation properties were detected by TEM, FT-IR, TG and SDS-PAGE. The results show that the average size of the prepared SiO2-SH/IDA-Ni2+adsorbent is about 60 nm, which can separate the His-tagged protein specificly and has lower detection limit (1.9×10-5mol/L) and the better regeneration ability after three times reuse.
nanometer silica; functionalization; His-tagged; affinity separation
1008-1011(2016)04-0482-05
2015-05-15.
国家自然科学基金(21271062), 河南大学民生学院大学生创新创业训练计划项目(MSCXCY2015004).
邹雪艳(1981-), 女, 实验师, 研究方向为复合纳米材料的制备及其对蛋白质的亲和分离.*通讯联系人, E-mail:hjy@henu.edu.cn.
O61
A

