新生大鼠缺氧缺血性脑损伤TLR4表达及与细胞凋亡的关系
梁桂娟,王迎涛,刘艳红,唐成和,关海山郑州人民医院新生儿科,河南郑州45005;中国人民解放军5医院检验中心,河南郑州45004;新乡医学院第一附属医院新生儿科,河南新乡4500
新生大鼠缺氧缺血性脑损伤TLR4表达及与细胞凋亡的关系
梁桂娟1,王迎涛2,刘艳红1,唐成和3,关海山11郑州人民医院新生儿科,河南郑州450053;2中国人民解放军153医院检验中心,河南郑州450042;3新乡医学院第一附属医院新生儿科,河南新乡453003
目的通过检测TLR4在新生大鼠缺氧缺血性脑损伤(HIBD)中表达变化,并与凋亡情况对比,研究TLR4在新生儿缺氧缺血性脑损伤发病机制中的作用,为临床的进一步研究提供客观的实验依据。方法选取80只7 d龄新生健康大鼠,随机分为实验组和对照组各40只。TUNEL法检测脑组织细胞凋亡状况,免疫组化SP法检测TLR4表达变化。结果细胞凋亡缺氧缺血术后6 h阳性率上升,至24 h达到高峰,72 h和7 d表达下降。TlR4实验组于缺氧缺血6 h即出现阳性表达,12 h表达到峰值,24 h无明显变化,72 h和7 d表达下降。实验组与对照组在各时间点比较差异均有统计学意义(P<0.05)。TLR4与细胞凋亡呈正相关(r=0.452)。结论新生大鼠缺氧缺血性脑损伤组织中TLR4高表达,可能促进细胞凋亡发生,在脑损害的形成过程中起到了重要的作用。
新生大鼠;缺氧缺血;脑损伤;TLR4;凋亡
新生儿缺氧缺血性脑病(HIE)是由围生期各种因素引起的部分或完全性缺氧,脑血流量减少或暂停而导致的胎儿和新生儿的脑损伤,多见于足月儿,导致不可逆的脑损伤,是新生儿死亡和继发智力障碍、脑瘫等伤残的主要原因之一,新生儿HIE发病率为(1~80)/1000,在这其中10%~20%在新生儿期死亡,存活的25%~30%可能会留有远期神经发育后遗症,以致严重威胁新生儿的生命健康,给家庭和社会造成了沉重的负担,也使产科和儿科医师面临着极大的压力[1]。缺氧是发病的核心,其中围生期窒息是最主要病因已被广泛接受[2-5],它的发病机制、干预策略和影响远期预后的研究,一直是普遍关注的热点问题。近年来国内外对新生儿缺氧缺血性脑病的基础和临床进行了大量的研究,但目前仍未取得突破性进展,临床上也无特异的治疗方法[6]。因此,致力于新生儿缺氧缺血性脑病的发病机制研究,有着非常重要的临床意义。这次研究通过观察TLR4在新生大鼠缺氧缺血性脑损伤(HIBD)模型中表达变化,并与凋亡情况对比,探讨其在新生儿缺氧缺血性脑损伤发病机制中的作用,为新生儿缺氧缺血性脑病防治提供理论依据。
1 资料与方法
1.1实验对象
研究对象选取80只健康新生7 d龄SD大鼠,无性别选择,体质量12~15 g,完全随机方法分为实验组、对照组各40只;再将2组大鼠随机分为6、12、24、72 h、7 d组,每组8只,分别于大鼠足部贴上标签。
1.2方法与观察指标
参照Rice法[7]7日龄大鼠建立缺氧缺血性脑损伤模型,将实验组大鼠的左侧颈总动脉结扎,并置于8%O2+ 92%N2的氮氧混合器环境2 h,建立实验动物模型。对照组仅分离左侧颈总动脉,不予结扎和缺氧处理。分别于术后6、12、24、72 h和7 d对2组大鼠行心脏灌注,断头取脑制作成石蜡标本,显微镜下观察标本变化情况,TUNEL法检测脑组织细胞凋亡状况,免疫组化SP法检测TLR4表达变化;记录2组大鼠的一般情况、体质量、行为学变化等。
1.3统计学分析
采用SPSS17.0进行统计学处理,全部结果用均数±标准差表示。实验组和对照组差异有无统计学意义采用两独立样本t检验。
2 结果
2.1实验组动物体质量、行为学改变及病理变化
实验组体质量增长明显慢于对照组,有显著差异。缺氧缺血后新生大鼠出现程度不等的行为变化,如躁动不安、全身发绀、四肢强直抽动。HE染色:缺氧缺血后6 h左侧脑神经细胞水肿和少量局灶性坏死;缺血缺氧后18~24 h,左侧皮质脑组织坏死面积逐渐增大,24~48 h可见大面积坏死。72 h可见界限清楚的坏死灶。
2.2细胞凋亡阳性率在脑损伤过程中的表达变化
实验组细胞凋亡阳性表达率随时间变化动态变化,6 h开始表达,此后逐步上升,24 h达到峰值,3 d细胞凋亡阳性率下降。对照组细胞凋亡阳性率各时间点无明显变化。实验组与对照组在6、12、24、72 h、7 d 5个观察时间点比较均有统计学意义(P<0.05,表1)。实验组12 h和24 h相比P>0.05,其余实验组各时间点间两两比较P<0.05。在阴性对照图片中,未见阳性细胞。
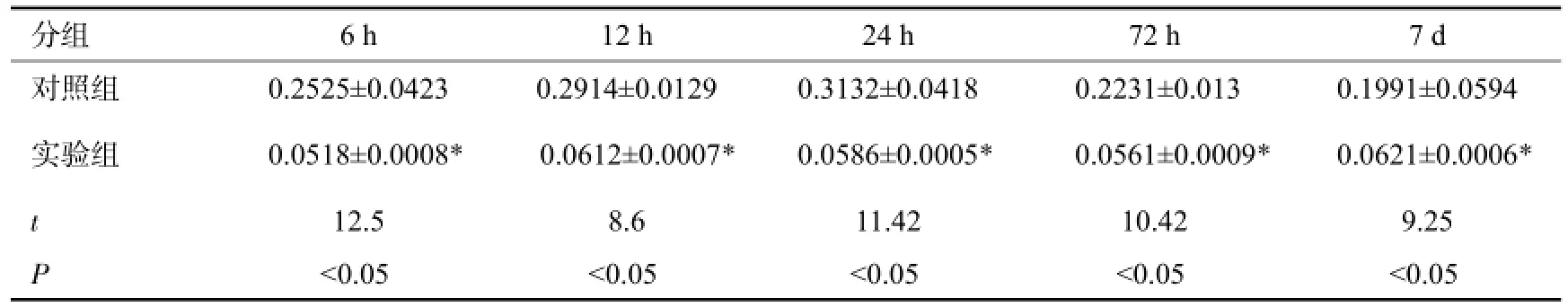
表1 实验组与对照组大脑皮质区凋亡细胞阳性率比较(n=40,x±s)
2.3TLR4的表达变化
实验组和对照组新生大鼠脑组织均可见TLR4的表达,对照组表达量少,且无明显变化。实验组于缺氧缺血后6 h表达开始增加,12 h表达达到高峰,24 h无明显变化,72 h和7 d表达下降,12 h和24 h组间比较无统计学意义(P>0.05),其余组间各时间点比较均有统计学意(P<0.05,表2)。实验组同对照组各个时间点的结果存在显著差异,实验组12 h和24 h相比P>0.05,其余实验组各时间点间两两比较P均<0.05。
2.4TLR4表达水平与其细胞凋亡相关性分析
表2 实验组与对照组大脑皮质TLR4平均光密度(n=40±s)
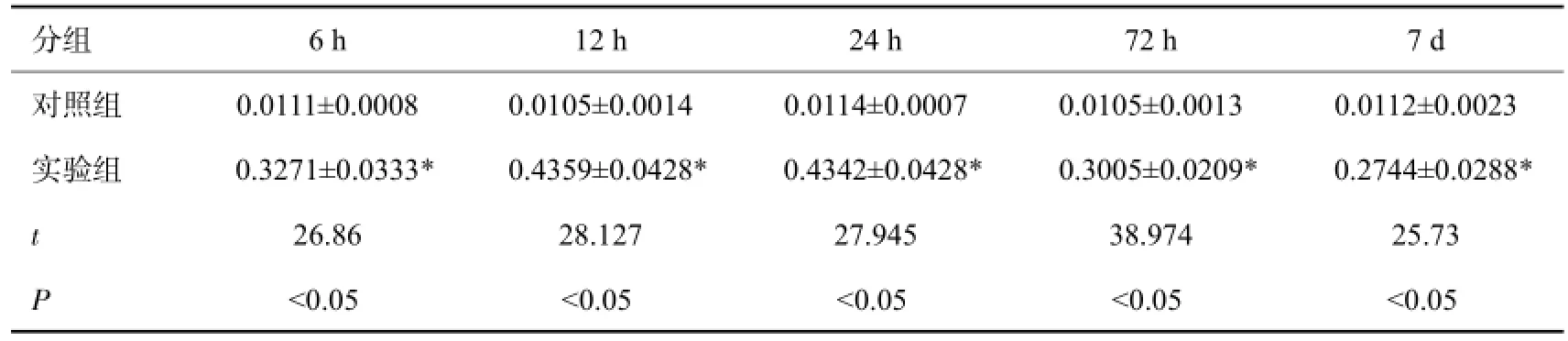
表2 实验组与对照组大脑皮质TLR4平均光密度(n=40±s)
*P>0.05(实验组12 h vs实验组24 h).
分组对照组实验组t P 6 h 0.0111±0.0008 0.3271±0.0333* 26.86 <0.05 12 h 0.0105±0.0014 0.4359±0.0428* 28.127 <0.05 24 h 0.0114±0.0007 0.4342±0.0428* 27.945 <0.05 72 h 0.0105±0.0013 0.3005±0.0209* 38.974 <0.05 7 d 0.0112±0.0023 0.2744±0.0288* 25.73 <0.05
新生大鼠缺氧缺血后大脑皮质内TLR4与凋亡细胞的表达水平呈正相关关系(r=0.452,P<0.01),即在一定时间内(HIBD 24 h内)随TLR4表达的逐渐增多,凋亡细胞的表达也呈现上升趋势;在一定时间内(HIBD 72 h后)随TLR4表达的逐渐减少,凋亡细胞的表达也呈现下降趋势。
3 讨论
新生儿缺氧缺血性脑病发病率为0.2%~0.4%,是新生儿期最常见的脑损伤。重者致患儿死亡,部分可遗留智力低下、脑瘫及癫痫等严重的神经系统损害[8]。1995年首次应用HE染色和DNA电泳方法,在实验性HIBD模型鼠脑皮质、海马、丘脑证明新生大鼠单侧脑缺血缺氧后,在脑组织细胞中发现有凋亡特异性的断裂DNA出现[9]。此实验显示缺氧缺血后6 h可见凋亡细胞,12 h明显增多,24 h达到高峰,72 h凋亡指数下降,与对照组比较各个时间点均有显著差异,与此次实验苏木精-伊红染色所示病理改变的严重程度相对应,这就提示细胞凋亡可能是新生大鼠脑损伤的重要机制之一。
有研究表明促炎症介质的产生和释放是介导细胞凋亡的主要因素之一,可加重缺氧缺血性脑细胞的损伤[10-11],TLRs作为固有免疫反应关键的模式识别受体之一,在诱导炎症反应和炎症介质产生中有着重要作用[12]。其中,TLR4主要表达在小胶质细胞,在神经元及星形胶质细胞中也有表达[13]。当缺氧缺血脑损伤释放大量内源性激活物,TLR4能诱导MyD88依赖和TRIF依赖的两个信号通路,从而触发一系列级联免疫炎症反应,导致炎症反应失控[14]。实验研究发现:TLR4实验组在缺血6 h表达逐渐增强,24 h达到峰值后下降,3~7 d较假手术组仍高表达,其表达规律与国内外研究结果相符[15],提示TLR4作为炎性损伤因子,可能参与了缺氧缺血后脑损伤。且TLR4表达与细胞凋亡达到高峰的时间一致,说明在新生儿缺血缺氧性脑病中由TLR4介导的炎症信号通路的过度激活,可能引起大量与脑损伤密切相关的炎性介质的释放,通过诱导细胞凋亡加重脑组织损伤,这与Jung等[16]用革兰阴性菌的脂多糖激活TLR4信号通路刺激试管内培养的鼠的小胶质细胞,导致细胞凋亡的结果相符,提示TLR4与细胞凋亡之间可能存在关联。因此HIBD后通过阻断TLR4,可能早期阻断凋亡的发生,从而预防HIBD的发生。
[1]段涛,陈超.新生儿缺氧缺血性脑病[J].中华医学杂志,2005,85 (17):1218-20.
[2]Pichiule P,Chavez JC,Schmidt AM,et al.Hypoxia inducible factor-1 mediates neuronal expression of the receptor for advanced glycation end products following hypoxia ischemia[J].Biol Chem, 2007,282(50):36330-40.
[3]中华医学会儿科学分会新生儿学组.新生儿缺氧缺血性脑病诊断标准[J].中国当代儿科杂志,2005,7(2):97-8.
[4]余小河,杨于嘉,王霞,等.高压氧对缺氧缺血性脑损伤新生大鼠内源性神经干细胞和髓鞘的保护作用[J].中国当代儿科杂志,2006,8 (1):33-7.
[5]徐发林,朱长连,王小阳,等.新生小鼠缺氧缺血后p53的表达及其抑制剂对脑损伤的影响[J].中国当代儿科杂志,2006,8(2):137-40.
[6]李熙鸿.我国新生儿缺氧缺血性脑病的诊断及治疗[J].实用儿科临床杂志,2010,25(14):1037-9.
[7]刘仁红,周晓光,肖承佐.新生大鼠HIBD模型的构建与建模成功的签定[N].国际医药卫生导报.2006-12-17(4-7).
[8]Horn AR,Swingler GH,Myer L,et al.Defining hypoxic ischemic encephalopatjy in newbnorn infants:benchmarking in a South African population[J].J Perinat Med,2013,41(2):211-7.
[9]栗红.新生大鼠缺血缺氧性脑损伤NF-κB(P65)的表达及与细胞凋亡的关系[D].太原:山西医科大学,2009.
[10]Jose A,Matthai J,Paul S.Correlation of EEG,CT,and MRI brain with neurological outcome at 12 months in term newborns with hypoxic ischemic encephalopathy[J].J Clin Neonatol,2013,2(3): 125-30.
[11]Iadecola C,Alexander M.Cerebral ischemia and inflammation[J]. Curr Opin Neurol,2001,14(1):89-94.
[12]Zwagerman N,Plumlee C,Guthikonda,et al.Toll-like receptor-4 and cytokine cascade in stroke after exercise[J].Neurol Res,2010,32(2):123-6.
[13]胡晓松,宋海星,刘静,等.缺血预处理对局灶性缺血大鼠脑梗死区周围TLR4及GFAP表达的影响[J].重庆医学,2012,41(29):3076-8,3130.
[14]Guo J,Friedman SL.Toll-like receptor-4 signaling in liver injury and hepatic fibarogenesis[J].Fibrogenesis Tissue Repair,2010(6): 21-3.
[15]Tu XK,Yang WZ,Shi SS,et al.Baicalin inhibits TLR2/4 signaling pathway in rat brain following permanent cerebral ischemia[J]. Inflammation,2011,34(5):463-70.
[16]Jung DY,Lee H,Jung BY,et al.TLR4,but not TLR2,signals autoregulatory apoptosis of cultured microglia:a critical role of IFN-beta as a decision maker[J].J Immunol,2005,174(10): 6467-76.
The correlation between TLR4 expression and apoptosis of hypoxic ischemic brain damage in neonatal rats
LIANG Guijuan1,WANG Yingtao2,LIU Yanhong1,TANG Chenghe3,GUAN Haishan11Department of Neonatology,The People's Hospital of Zhengzhou,Zhengzhou 450053,China;2Laboratory Center of the PLA No.153 Hospital,Zhengzhou 450042,China;3Department of Neonatology,The First Affiliated Hospital of Xinxiang Medical University,Xinxiang 453003,China
Objective To investigate the role of TLR4 in HIBD by observing the change of TLR4 expression and cell apoptosis after hypoxic-ischemic brain damage(HIBD)in a neonatal rat model,and provide an experimental foundation for the futher clinical research.Methods A total of 80 7day postnatal Sprague-Dawley rats were randomly divided into experimental group (n=40)and control group(n=40).The expression of TLR4 was tested by immunohistochemistry,the apoptotic hippocampus cells were tested by TUNEL.Results The cell apoptosis and the expression of TLR4 increased at HI 6 h,and achieved the hightest increases at HI 12 h,and it continued to maintain the high level in HI 24 h,then decreased at HI 72 h、HI7 d group.There were significant differences of positive rate at different times compared with control group(P<0.05).There was a positive correlation between apoptosis and TLR4(r=0.452)in rats with hypoxic-ischemic brain damage.Conclusion TLR4 over expressed in HIBD can promote cell apoptosis,and play an important role in the pathogenesis of HIBD.
neonatal rats;hypoxia-ischemia;brain damage;TLR4;apoptosis
2016-02-01
梁桂娟,E-mail:liangguijuan2008@163.com
唐成和,E-mail:tchexer@126.com

