抑癌基因死亡相关蛋白激酶在肿瘤中的研究进展
姜应传,陈 炳
·讲座与综述·
抑癌基因死亡相关蛋白激酶在肿瘤中的研究进展
姜应传,陈 炳
1995年,以色列学者Deiss及其同事首次发现死亡相关蛋白激酶(DAPK)[1],其编码的蛋白是相对分子质量为16×104的丝氨酸/苏氨酸蛋白激酶[2],是细胞凋亡的一种正调控因子[3]。DAPK及其相关的信号通路在很多疾病中发挥了重要的作用,比如动脉粥样硬化、炎症以及肿瘤。它可以通过激活死亡受体、活化细胞活素类、基质脱附、神经酰胺化等各种方式调节或执行细胞死亡[4]。研究发现,DAPK是一种抑癌基因,因此它及其相关信号通道的研究对于肿瘤的早期诊断及基因靶向治疗有着重要的意义。
1 DAPK的结构
人类DAPK基因全长为4293 bp,位于第9号染色体的q34.1区域。DAPK编码的蛋白是一种复合中心结构的蛋白,由接触反应中心和非接触反应中心构成。接触反应中心是由核心的激酶区和钙离子/钙调蛋白结合区组成,其中后者是最重要的组成部分。钙调蛋白的结合引起的结构变化可以使 DAPK通过结合底物而激活,而丝氨酸308(Ser308)残基的磷酸化可以通过降低其对钙调素的亲和力抑制DAPK的功能。非接触反应中心则是由1个细胞骨架结合区、1个死亡区、2个P-loop环、8个锚蛋白重复序列区和富含丝氨酸的尾部组成[2]。目前已经发现DAPK家族有5个成员,它们的核心激酶区及肌球蛋白轻链激酶却基本相似,但位于C端的死亡区各不相同,被认为与 DAPK的功能有关。DAPK诱导细胞凋亡的精确机制尚不明确。研究表明,C端的死亡区通过参加Fas L及肿瘤坏死因子-(TNF-)诱导的细胞凋亡来介导DAPK的功能。该区如果被敲除,则会下降DAPK诱导细胞凋亡的功能,因此C-端死亡区是其诱导凋亡所必需的[5]。死亡区后是长度为17个氨基酸残基的尾部,可抑制DAPK诱导凋亡的功能[6]。
2 DAPK的调控机制
DAPK在细胞水平拥有多种调控机制。多项研究表明,在转录水平DAPK基因启动子甲基化与其表达的蛋白缺失强烈相关[7]。DAPK启动子拥有一个密集的CpG岛,很多转录因子例如NF B,E2F1和AP1也定位于这些区域的序列。在直肠癌中,有5%~80%的CpG岛发生甲基化,但是至今为止,却没有系统的研究去比较各个不同的CpG岛对蛋白表达的意义。
DAPK的转录可被促炎症转录因子STAT3和Nf B抑制[8]。此外,DAPK 的mRNA表达能够被p53,C/EBP-,HSF1和SMAD等触发[9]。其中C/EBP-的结合取决于IFN的暴露,而SMAD结合到相应的序列则需要TGF-的触发。一般而言,DNA损害都会都可能会引起DAPK的转录反应性上调[10]。最近研究证明,有些miRNA(miR-103,miR-107)结合于DAPK基因3'端的不翻译区。miR-103 和miR-107的高表达与直肠癌的患者的高转移率及低生存率相关,也与DNPK作为转移抑制因子的角色相呼应[11]。通过电子数据库计算机模拟提示有些miRNA也可能在DAPK的调控中发挥作用[10]。尽管如此,在这方面的实验证据还是有所欠缺。
DAPK在翻译后的稳定性由两套不同的细胞内蛋白酶解系统调控:(1)泛素-蛋白酶体体系,其中热休克蛋白70羧基末端相互作用蛋白(CHIP)参与介导DAPK和HSP90复合物的形成。其中,HSP90主要起稳定DAPK水平的作用;而DAPK的锚蛋白重复区与DIP1/ MIB1相结合,可以调节DAPK的多泛素化以及在蛋白酶体的降解[6]。(2)自吞噬细胞/溶酶体体系。由TSC1and TSC2组成的TSC复合体(mTOR)抑制哺乳动物雷帕霉素靶蛋白1的活性。DAPK的死亡区和TSC2的结合会导致2个结果[12]:T SC2基因的磷酸化,TSC复合物的解离和mTOR的活化;TSC2通过一个翻译后的调控机制直接降低DAPK的水平。
3 DAPK与肿瘤
和其他抑癌基因一样,DAPK的功能在多种肿瘤中被抑制。但与传统抑癌基因P53等不同,DAPK在肿瘤中通常是表现为表达缺失而不是突变[2]。DAPK的表达缺失主要源于5'端不翻译区发生甲基化,虽然不太频繁,但它仍然是一个纯合子缺失的结果。超过30种肿瘤被发现发生DAPK基因甲基化,而它们的甲基化率却不尽相同。尽管如此,有学者发现在非小细胞性肺癌的细胞系存在DAPK蛋白的表达和基因超甲基化同时存在的现象[13]。肾癌及慢性淋巴细胞性白血病等肿瘤中也有发现这种现象的出现。这说明在某些肿瘤中存在某种重要的DAPK翻译后的调控机制在调节 DAPK蛋白的表达。由此可见,DAPK基因的甲基化并不意味着DAPK蛋白表达的缺失。
尽管大量的文献支持DAPK是一种抑癌基因,但有些研究却得出相反结论。有学者发现一种小鼠的 DAPK的剪接变异体(DAPK-)能够促进细胞生存[14]。而在人类中,至今仅发现一种DAPK剪接变异体(s-DAPK-1)能够介导全长DAPK蛋白的降解,而它在肿瘤中的作用还不清楚。但是考虑到其他抑癌基因如P53和P73在肿瘤中的积极作用,很可能在肿瘤中存在更多的 DAPK剪接变异体能够中和野生型DAPK的作用从而保护细胞免于凋亡。此外,还有学者发现 DAPK能够在生长因子的作用下反应性地激活哺乳动物雷帕霉素靶蛋白1(mTORC1),促进细胞增殖[15]。Tanaka等[16]发现DAPK是数种子宫癌细胞存活所必须的,而敲除DAPK基因能够增强5-氟尿嘧啶(5-FU)诱导人类子宫内膜癌细胞的凋亡[17]。所有的这些研究表明,在某些组织和基因环境中,DAPK能够产生促细胞生存的作用和促进肿瘤发生过程。
转化生长因子(TGF-b)可以反应性地刺激DAPK的表达和凋亡活性增加。DAPK的表达又可以激活P53的活性,造成DNA的破坏。其他的死亡信号通道,如转化癌基因E2F1和Myc也能够诱导DAPK表达。除了P53、ERK1和ERK2也参与DAPK诱导的凋亡。DAPK能够阻断ERK向细胞核内转运,使其保留在细胞质中,从而阻断ERK生存信号通路。ERK-DAPK轴构成一个正反馈回路,促进细胞凋亡。除此之外,DAPK在细胞生存方面也扮演重要角色,体现在其激活生长因子信号通路及抵抗肿瘤坏死因子(TNF)介导的细胞凋亡。因此,一旦DAPK出现表达缺失,正常的细胞凋亡失去调控,不断增殖,最终可能形成肿瘤。
4 DAPK与肿瘤转移
Inbal等[18]最早发现DAPK和肿瘤转移之间的联系,他们在一个动物模型中发现,来自同一个细胞系的Lewis肺癌细胞克隆中,高转移性的肺癌细胞出现了DAPK的表达缺失;体外试验发现DAPK表达能够增加肿瘤细胞对某些凋亡刺激因子的敏感性。这些发现提示DAPK表达的缺失能够为肿瘤细胞提供生存优势来克服转移进程各个阶段遭遇的阻碍,比如细胞基质粘附的缺失、暴露于死亡刺激因子、对内应力的应答以及面对远处转移的不同微环境。在另外一个结肠癌裸鼠的动物模型中,学者发现DAPK在侵袭/转移的多个步骤中均发挥作用[19]。
基于研究肿瘤患者的临床样本,同样观察到DAPK和肿瘤转移的联系。在多种肿瘤中普遍观察到DAPK的下调,有时候还和肿瘤的转移进程相关。比如,DAPK在肺癌中表达的下调和肿瘤分期及淋巴结侵犯相关[20]。在胃癌中,DAPK启动子的超甲基化和肿瘤分期、淋巴结侵犯情况密切相关[21]。在垂体瘤、泌尿道肿瘤和肝癌中发现DAPK表达的缺失和肿瘤分期及侵袭性相关。
在转移的过程中,肿瘤细胞经常会遇到促氧化环境,这些都能促进肿瘤转移的多方面进程,比如增加细胞活力、侵袭性和血管生成等。DAPK作为一种关键因子,能够增加肿瘤细胞对氧化应激应激细胞死亡的敏感性。此外,DAPK还能阻断踝蛋白(talin)与整合素b1的结合,从而抑制整合素介导的细胞黏附,抑制细胞的移动,抑制肿瘤的发展和转移[22]。不仅如此,DAPK还能调节数种细胞细胞骨架蛋白,例如肌球蛋白轻链II(MLCII),从而平衡细胞的收缩力和黏附力。
5 DAPK与肿瘤治疗
靶向治疗是如今肿瘤治疗研究的一个热点。治疗的靶点应该符合以下几个条件:(1)这个靶点在不同的疾病中表现的状态不同,如基因的突变、表达的水平、翻译后修饰及细胞定位等。(2)这个靶点在疾病中发挥重要的作用,包括维持或推进疾病进展甚至是对常规的治疗起到拮抗作用。对这个靶点的介入能够为患者带来有效的收益。(3)这个靶点是能够药物控制的。某些基因在生物学实验中表现完美却在实际操作时困难重重,如RAS癌基因[23]。一个好的治疗靶点其表达和活性要能够特异性地对外部刺激做出反应。
多项对于 DAPK催化区晶体结构的研究都指向设计出特异锚定DAPK蛋白的小分子的可能性[24]。目前有两种策略激活DAPK:(1)上调DAPK蛋白的表达;(2)对Ser308的自体磷酸化去磷酸化,激活DAPK激酶。目前共有9种试剂能够通过提高mRNA的表达和抑制降解来提高DAPK蛋白的表达,有2种试剂能够通过对 Ser308的去磷酸化来提高DAPK的活性,还有3种试剂则两者都能做到。但是没有一种试剂能够提高DAPK基因的表达。目前也无临床药物能够真正特异地激活DAPK。尽管如此,假如一个药物如甲基化抑制剂对患者的毒性不大且它的治疗效果与激活DAPK相关,它就可以作为一种有效的DAPK激活剂用于临床。因此,需要更多的实验去研究这类药物和DAPK所产生的临床效用。
6 展望
DAPK通过各种途径影响细胞凋亡,在肿瘤发展及转移时亦发挥抑制作用。目前对于DAPK的结构、调控机制以及DAPK在肿瘤中发挥的作用均有了比较深入的研究,但对于利用DAPK作为靶点治疗肿瘤却还没有重大的突破。在今后不断的研究中,或许能够找到更多的线索。
[1]Deiss LP, Feinstein E, Berissi H, et al. Identification of a novel serine/threonine kinase and a novel 15-kD protein as potential mediators of the gamma interferoninducedcell death[J].Genes Dev,1995,9(1):15-30.
[2]游崇登,何勤.抑癌基因DAPK甲基化在血液肿瘤中的研究进展[J].医学综述, 2012,18(7):1040-1042.
[3]Michie AM, McCaiq AM,Nakaqawa R, et al. Death-associated protein kinase (DAPK)and signal transduction: regulation in cancer[J]. FEBS J, 2010, 277(1): 74-80.
[4]向莎丽,陈幸华,张诚.肿瘤抑制基因DAPK:一个新的药物治疗靶点[J].现代生物医学进展,2012,12(1):163-165.
[5]Raveh T,Berissi H,Eisenstein M,et al. Afunctional genetic screen identifies regions at the C-terminal tail and death-domain of death-associated protein kinase that are critical for its proapoptotic activity[J].Proc Natl Acad Sci USA, 2000, 97(4) :1572-1577.
[6]王振宝,潘晓琳,陈少泽,等.抑癌基因DAPK在肿瘤的发生、转移、复发、预后中的作用[J].生命的化学,2008,28(3):295-298.
[7]ChakilamS,gandesiriM,RauTT,etal.Death-associated protein kinase controls STAT3 activ
[8]ChakilamS,gandesiriM,RauTT,etal.Death-associated protein kinase controls STAT3 activity in intestinal epithelial cells[J]. Am J Pathol,2013,182(3):1005-1020.
[9]Gade P, Roy SK, Li H,et al. Critical role for transcription factor C/EBP-beta in regulating the expression of death-associated protein kinase1[J].MolCellBiol,2008,28(8):2528-2548.
[10]Benderska N, Schneider-Stock R. Transcription control of DAPK[J]. Apoptosis, 2014,19(2): 298-305.
[11]Chen HY, Lee YR,Chen RH.The functions and regulations of DAPK in cancer metastasis[J]. Apoptosis,2014,19(2): 364-370.
[12]Gallagher PJ, Blue EK. Post-translational regulation of the cellular levels of DAPK [J]. Apoptosis,2014,19(2): 306-315.
[13]Toyooka S, Toyooka KO, Miyajima K, et,al. Epigenetic down-regulation of deathassociated protein kinase in lung cancers [J]. Clin Cancer Res,2003,9(8):3034-3041.
[14]Jin Y, Blue EK, Dixon S,et al. Identification of a new form of death-associated protein kinase that promotes cell survival[J]. Biol Chem,2001,276(43):39667-39678.
[15]Stevens C, Lin Y, Harrison B, et al. Peptide combinatorial libraries identify TSC2 as a death-associated protein kinase (DAPK) death domain-binding protein and reveal a stimulatory role for DAPK in mTORC1 signaling[J]. Biol Chem,2009, 284(1):334-344.
[16]Tanaka T, Bai T, Yukawa K. Death-associated protein kinase is essential for the survival of various types of uterine cancer cells[J]. Int J Oncol ,2010,37(4):1017-1022.
[17]Tanaka T, Bai T, Yukawa K. Suppressed protein expression of the death-associated protein kinase enhances 5-fluorouracil-sensitivity but not etoposide-sensitivity in human endometrial adenocarcinoma cells [J]. Oncol Rep ,2010,24(5):1401-1405.
[18]Inbal B, Cohen O, Polak-Charcon S,et al. DAP kinase links the control of apoptosis tometastasis[J]. Nature,1997, 390(6656):180-184.
[19]Chen HY, Lin YM, Chung HC,et al. miR-103/107 promote metastasis of colorectal cancer by targeting the metastasis suppressors DAPK and KLF4[J]. Cancer Res, 2012,72(14):3631-3641.
[20]Harden SV, Tokumaru Y, Westra WH, et al. Gene promoter hypermethylation in tumors and lymph nodes of stage I lung cancer patients[J]. Clin Cancer Res, 2003, 9(4):1370-1375.
[21]>Hu SL, Kong XY, Cheng ZD, et al.Promoter methylation of p16, Runx3, DAPK and CHFR genes is frequent in gastric carcinoma[J]. Tumori, 2010, 96(5):726-733.
Kuo JC,Wang WJ,Yao CC,et al. The tumor suppressor DAPK inhibits cell motility by blocking the integrin-mediated polarity pathway[J]. J Cell Biol,2006,172(4):619-631.
[23]Baker NM, Der CJ. Cancer: drug for an 'undruggable' protein[J]. Nature ,2013,497 (7451):577-578.
[24]Okamoto M, Takayama K, Shimizu T, et al. Identification of death-associated protein kinases inhibitors using structure-based virtual screening[J]. J Med Chem, 2009,52(22):7323-7327.
(本文编辑:钟美春)

图1 过表达SIAH1通过上调Bim的表达来诱导乳腺癌细胞的凋亡
林珍,高中辉,周建勤,等.急性硫化氢中毒肺部损伤影像学表现(见正文第801页)
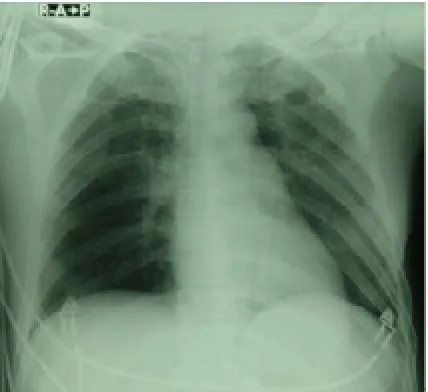
图2 肺纹理增多加重、模糊,肺门阴影扩大增浓。

图3 两肺门增浓,沿增多肺纹理分布斑点状及小片状密度增高影,边缘模糊,并以两肺中下野中内带为主。

图4 两肺内以肺门为中心较广泛分布斑点、小片状,部分融合呈片状影,边缘模糊。
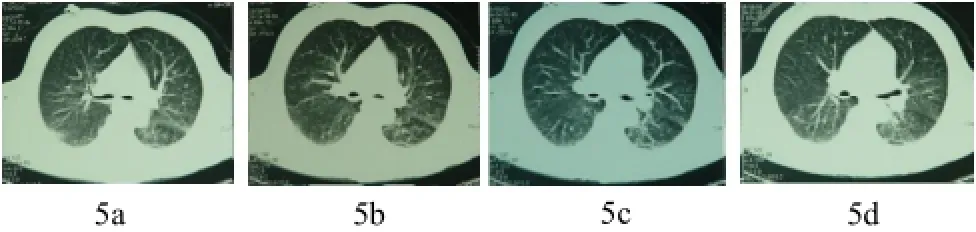
图5 (a~d) 胸部平片阴性,CT扫描发现早期肺水肿改变。
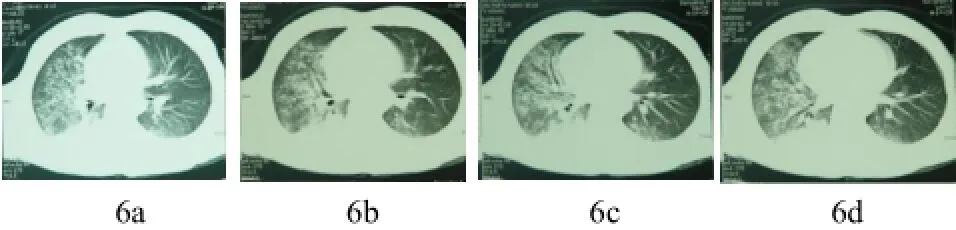
图6 (a~d) 肺水肿改变。
邵畅,齐广伟,过华蕾.伴有假腺样特征的神经鞘瘤临床病理研究(见正文第802页)

图1 肿瘤界限清楚,可见厚的纤维性包膜(HE,×20)

图2 肿瘤内可见大小不等、形状不规则的腺管和囊腔样结构(HE,×20)

图3 高倍镜下囊腔被覆为多层立方或柱状型细胞(HE,×100)
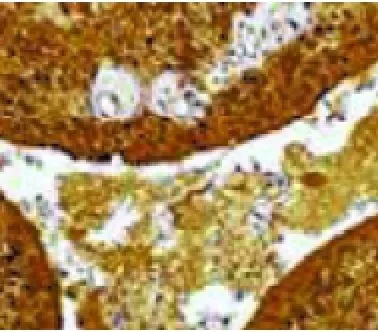
图4 免疫组化染色,梭形细胞和囊腔被覆细胞均弥漫表达S100(EnVision,×40)

图5 免疫组化染色,梭形细胞和囊腔被覆细胞CK均阴性(EnVision,×40)
钱立勇,徐勇飞,邓涛.前列腺穿刺活检标本中泡沫样腺癌的临床病理和免疫组化研究(见正文第808页)

图6 前列腺泡沫样腺癌,瘤细胞具有丰富的浅染色泡沫样胞浆,核固缩,核仁不明显(HE,×200)
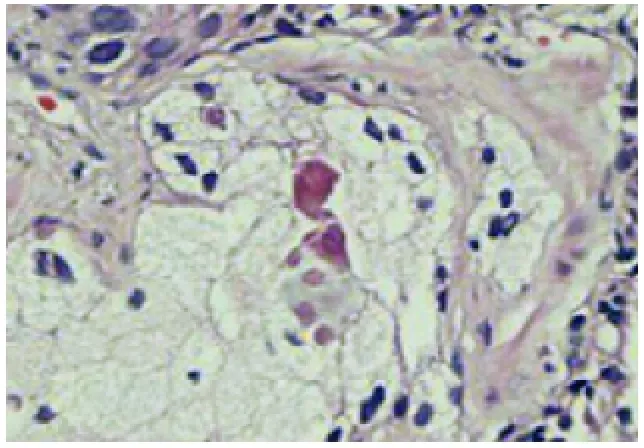
图7 前列腺泡沫样腺癌伴普通型腺癌(HE,×200)

图8 前列腺泡沫样腺癌 Gleason3+3=6 (HE,×100)
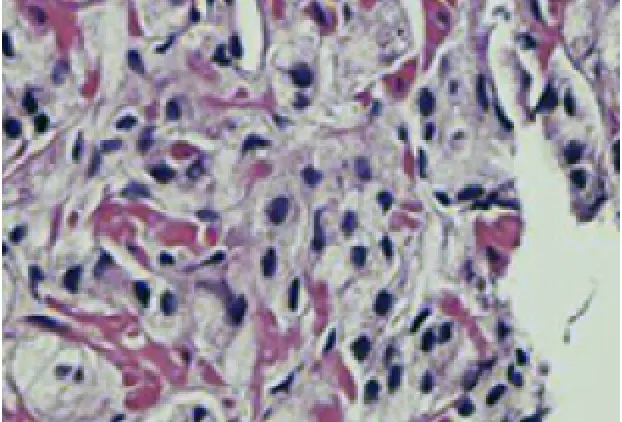
图9 前列腺泡沫样腺癌 Gleason4+4=8 (HE,×100)

图10 前列腺泡沫样腺癌累犯神经(HE,×200)
梅冠炫.肺部肿瘤化疗对癌症患者耐甲氧西林金黄色葡萄球菌的影响(见正文第811页)

图12 每个方形表示1个周期。2例MM患者死于MRSA感染,表示为菱形。
10.3969/j.issn.1671-0800.2016.06.077
R730.2
C
1671-0800(2016)06-0838-03
2016-03-17
舟山市医药卫生科技计划项目(2012B05)
316000浙江省舟山,舟山医院
陈 炳,Email:chenb521myf@163.com

