植物根际促生菌对两种真菌病害病原的抑制作用及其鉴定
孙广正,姚拓,赵桂琴,李建宏,陈龙,刘欢
(甘肃农业大学草业学院, 草业生态系统教育部重点实验室, 甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
植物根际促生菌对两种真菌病害病原的抑制作用及其鉴定
孙广正,姚拓*,赵桂琴,李建宏,陈龙,刘欢
(甘肃农业大学草业学院, 草业生态系统教育部重点实验室, 甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
利用钼蓝比色法、乙炔还原法和高效液相色谱法分别测定了分离自5种植物根际的19株细菌溶磷、固氮和分泌生长素特性;用平板对峙生长法测定了19株细菌对黄瓜枯萎病菌和小麦根腐病菌的抑制作用;结合菌株形态、生理生化反应,利用分子生物学方法鉴定了其中8株优良细菌。结果表明,菌株BacillussubtilisLM4-3固氮酶活性较高[244.88 nmol C2H4/(mL·h)];菌株B.subtilisLHS11-1溶磷能力较强(205.77 mg/L);菌株PGRS-3分泌IAA能力较好(40.78 μg/mL)。5株菌株能够有效拮抗黄瓜枯萎病菌,其中B.subtilisFX2-1抑菌活性较强(活菌抑制率69.07%,发酵液抑制率51.73%)。7株菌株能够有效拮抗小麦根腐病菌,其中B.subtilisFX2-1抑菌活性较强(活菌抑制率 78.17%),B.subtilisLHS11-1发酵液抑制率高达81.52%。其他具有较好促生或拮抗上述两种病原真菌的菌株经鉴定,分别属于蜡样芽孢杆菌(B.cereus,菌株XX1)、短小芽孢杆菌(B.pumilus,菌株F1-4和LX22)、简单芽孢杆菌(B.simplex,菌株XX6)和荧光假单胞杆菌(Pseudomonasfluorescens,菌株XX5)。
PGPR菌;促生特性;黄瓜枯萎病菌;小麦根腐病菌;抑菌作用;鉴定
植物病害是植物在生物或非生物因子影响下,在生理、形态和组织上发生一系列的病理变化,使植物不能正常地生长发育,并出现各种病态,从而影响经济效益的现象[1]。黄瓜枯萎病是由尖孢镰刀菌黄瓜专化型(Fusariumoxysporumf. sp.cucumerinum)引起,是一种世界性的植物维管束病害,其发病程度与土壤中病原微生物累积数量密切相关,研究表明土壤中尖孢镰刀菌数量大于103/g,即可使黄瓜致病[2]。该病是黄瓜连作障碍中最主要的因素之一,近年来有愈来愈严重的趋势,严重影响生产[3]。此外,该菌还引起马铃薯(Solanumtuberosum)、茄子(Solanummelongena)、棉花(Gossypiumhirsutum)等多种农作物病害。小麦根腐病是由麦根腐平脐蠕孢(Bipolarissorokiniana)引起,该病害的发生与土壤、种子带菌量和耕作栽培制度等因素密切相关,能使小麦(Triticumaestivum)减产20%~60%[4]。此外,该菌还能危害禾本科等多种植物,是根部的主要病原之一。目前,黄瓜枯萎病和小麦根腐病防治主要依赖化学农药。然而,长期大量施用化学农药导致农药残留及环境污染,危害人类健康并破坏生态平衡,同时也使病原菌产生了严重的抗药性。因此,探寻可持续控制病害的新途径已经迫在眉睫。
近年来研究表明,植物根际促生菌(plant growth promoting rhizobacteria,PGPR)通过改变土壤中难溶性元素的形态,从而促进植物吸收(如固氮、解磷等),或者合成利于植物生长发育的物质(如生长素等)和间接方式促进植物生长,同时一些菌还能抑制或减轻某些植物病原菌生长和繁殖[5]。近年来,国外学者对PGPR菌用于生物防治的研究很多,取得了许多宝贵成果。但是,我国这方面工作稍显落后,绝大多数工作只限于菌株的分离筛选方面,对于其综合特性的研究还很少。另一方面,分离鉴定优良PGPR菌株,并系统研究其促生抗病特性,对于进一步开发这一宝贵资源也具有重要意义。鉴于此,本研究以分离自5种植物根际的19株菌为原始材料,测定了菌株的溶磷能力、固氮酶活性和分泌生长素特性;研究了细菌对黄瓜枯萎病菌和小麦根腐病菌的抑制作用;鉴定了优良拮抗菌株。以期为农业生产上控制黄瓜枯萎病和小麦根腐病提供新的生物防治资源。
1 材料与方法
1.1材料
细菌:分离自苜蓿(Medicagosativa)、小麦、玉米(Zeamays)、三叶草(Trifoliumpretense)和高原早熟禾(Poaalpigena)根际(表1),由甘肃农业大学草业学院草地微生物实验室提供的19株细菌,菌株代号分别为JM170、JM92、LX191、G、JX59、LX22、LX81、LHS11-1、LM4-3、4N4、P2-1、PGRS-3、XX1、XX2、XX5、XX6、FX1、FX2-1和F1-4。
植物病原真菌:黄瓜枯萎病菌(F.oxysporumf. sp.cucumerinum)和小麦根腐病菌(B.sorokiniana)。
培养基:PDA (potato dextrose agar)[6]、LB (luria bertani)、PKO (pikovskaya)、King’s B和NFM (nitrogen-free medium)[7]。
1.2方法
1.2.1菌株溶磷性能测定点接菌株至PKO培养基,28 ℃培养7 d,观察菌落周围有无溶磷圈,测定菌落直径与溶磷圈直径,定性判断菌株溶磷能力;制备菌株悬浮液(108cfu/mL),接种0.5 mL菌悬液于50 mL PKO液体培养基中,(28 ℃,160 r/min)培养10 d,在4 ℃下离心(10000 r/min) 15 min,用钼蓝比色法测上清液有效磷(P)含量,每菌株3次重复[7]。
1.2.2菌株固氮酶活性测定在15 mL血清瓶中加入5 mL NFM半固体培养基,将菌株分别接于该培养基,以等量的无菌培养液为对照(CK)。28 ℃培养2 d后,用注射器从血清瓶中抽出1 mL气体,同时又注入等量C2H2气体,28 ℃培养2~3 d。然后用微量进样器从该瓶中抽取混合气体50 μL注入气相色谱仪(GC)的进样柱中,从显示屏上观察C2H2、C2H4峰面积。在标准曲线上通过乙烯峰面积得到乙烯量,运用外标法计算固氮酶活性[7],每菌株3个重复。
1.2.3菌株分泌IAA能力测定取30 mL在KB培养基上生长12 d的悬浮液,(4 ℃,10000 r/min)离心10 min,将上清液在冷冻干燥仪中干燥至10 mL,转移至分液漏斗中,pH调至2.8,加入20 mL乙酸乙酯,振荡5 min,两相分层后转移乙酸乙酯层,下层溶液用20 mL乙酸乙酯再提取1次,合并乙酸乙酯层于50 mL磨口烧瓶中。在45 ℃水浴中加热,用旋转蒸发仪真空浓缩,溶于0.6%冰乙酸中,然后定容2 mL,过0.45 μm有机系滤膜,供高效液相色谱仪测定[7]。
1.2.4优良拮抗菌初筛试验时间为2014年3-11月,采用平板对峙法测定细菌对病原真菌的拮抗作用[6]。将病原菌菌饼(直径为6 mm)置于PDA培养基中心,在中心1.8 cm等距离四点接同一细菌(用加液枪将菌液垂直滴加在培养基平面上),25 ℃培养,当对照菌丝在半径为45 mm培养基上长满时,测量真菌距细菌近端的半径。每种组合3个重复,试验重复3次。抑菌率=[(对照菌落直径-处理菌落直径)/对照菌落直径]×100%。并在显微镜下(10×40)观察拮抗菌与真菌菌丝交界处的菌丝,了解拮抗菌对病原菌菌丝形态的影响。
1.2.5优良拮抗菌复筛将初筛得到的拮抗菌制备成无菌发酵液[8]进行复筛。将无菌发酵液与45 ℃左右的PDA培养基按1∶9制成固体培养基,以不含无菌发酵液的(加同样比例的无菌水)PDA平板为对照。在平板中央接病原菌菌饼,25 ℃培养,当对照菌丝在半径为45 mm培养基上长满时,测量菌落直径并计算抑菌率。每个处理3个重复。
1.2.6优良拮抗菌株鉴定对两种病原真菌具有优良抑制作用的菌株LX22、LHS11-1、LM4-3、XX1、XX5、XX6、FX2-1和F1-4进行鉴定。菌株的形态特征观察及生理生化测定参照《伯杰细菌鉴定手册》[9]和《常见细菌系统鉴定手册》[10]。
16S rDNA序列分析:首先对菌株革兰氏染色。然后提取菌株的总DNA。选用细菌通用引物1429R-27F,1429R:5′-GAGAGTTTGATCCTGGCTCAG-3′;27F:5′-CTACGGCTACCTTGTTACGA-3′;50 μL PCR反应体系组成:25 μL预混酶(dNTP,Mg2+,PCR buffer,PCR酶),引物(10 μmol/L)各2 μL,模板2 μL (50 ng/μL),ddH2O 19 μL。反应条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,循环30次,72 ℃再延伸10 min。扩增后,取4 μL的样品在1%的琼脂糖凝胶上(80 V电压)进行电泳,并将检测合格样品送交测序(上海生工生物工程有限公司)。将序列在GenBank中进行相似性分析,用ClustalX 1.8进行多重序列比对,用Mega 5.0中邻接法进行发育树构建,其中枝长代表分歧程度,各枝上的数字表示500次自举(Bootstrap)重抽样分析的支持百分比。
1.3统计方法
采用SPSS 16.0软件进行数据分析,采用Duncan氏新复极差法进行多重比较。
2 结果与分析
2.1菌株促生特性
19株细菌溶磷、固氮及分泌IAA能力见表1,菌株LM4-3固氮酶活性显著好于其他菌株(P<0.05),达到244.88 nmol C2H4/(mL·h);菌株LHS11-1和LX191的溶磷能力显著好于其他菌株(P<0.05),分别达到205.77和205.71 mg/L,两者之间差异不显著(P>0.05);菌株LX191分泌IAA能力显著好于其他菌株(P<0.05),达到40.78 μg/mL。其中,菌株JM92、4N4、P2-1、JM170、LHS11-1和FX2-1兼具溶磷、固氮及分泌IAA特性。
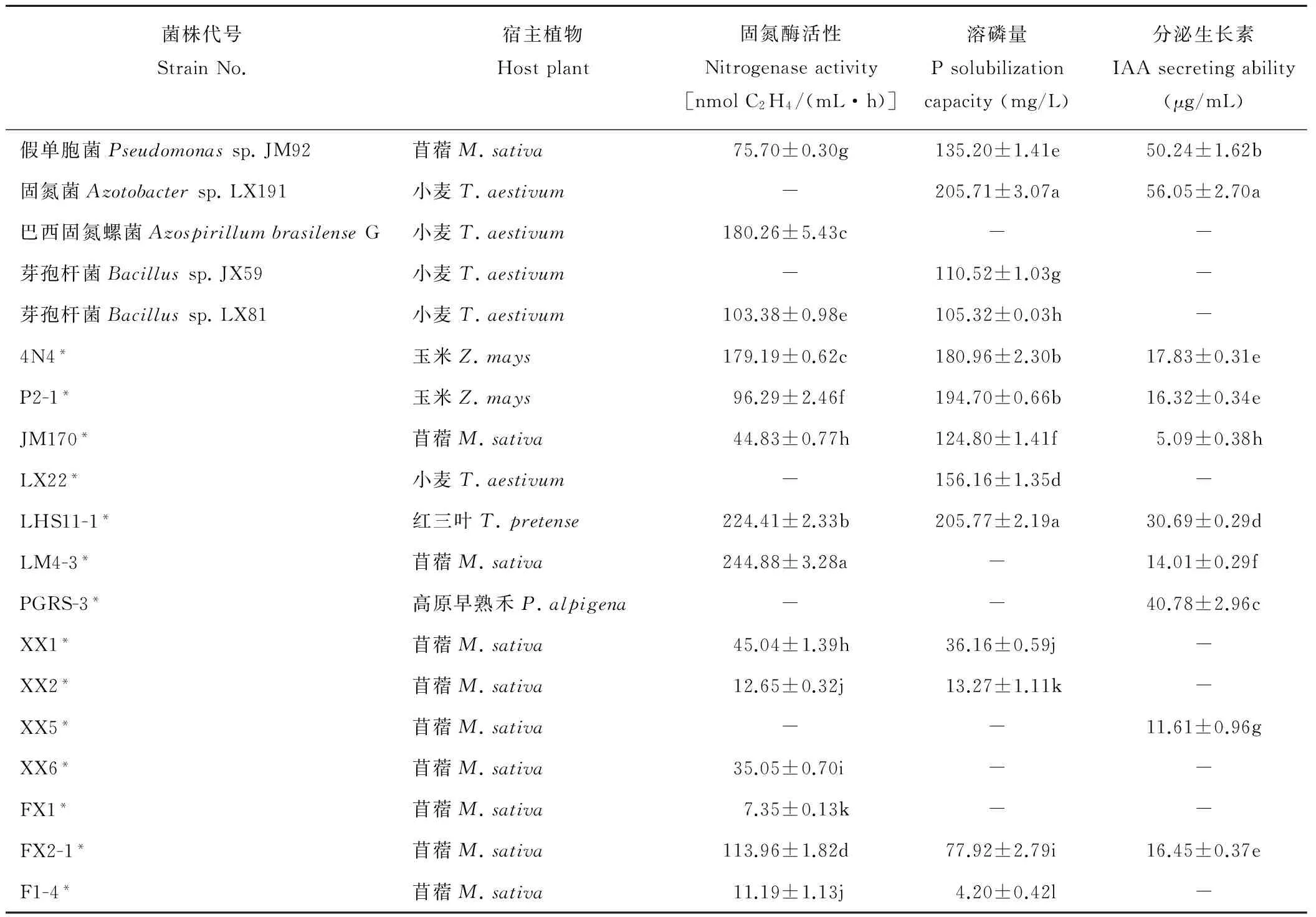
表1 菌株促生特性
注:表中数据为平均值±标准差。同列数据后不同小写字母表示经Duncan氏新复极差法检验差异显著(P<0.05)。“-”表示促生特性微弱,“*”待鉴定。下同。
Note:Values in the Table are mean±SD. Values followed by different lowercase letters in the same column are significantly different atP<0.05 level by Duncan’s new multiple range test. “-” indicates weak growth promoting properties, “*”not identified. The same below.
2.2优良拮抗菌初筛
2.2.1菌株与黄瓜枯萎病菌拮抗培养4 d后,19株细菌中5株对黄瓜枯萎病菌具有抑制作用,菌株LHS11-1和FX2-1的抑菌活性较好,抑制率均大于40% (表2),和其他3株相比,抑菌能力极显著(P<0.01)。5株拮抗菌随着培养天数的增加,抑制率均提高。培养9 d后,FX2-1具有较好的抑菌活性,抑制率达到69.07%。LHS11-1和FX2-1能够明显抑制病原菌菌丝的生长(图1A2),抑菌能力极显著(P<0.01)。培养10 d后,对照菌落在平板上长满(图1A1)。
2.2.2菌株与小麦根腐病菌拮抗在培养3 d后,19株细菌中7株对小麦根腐病菌具有抑制作用,FX2-1的抑菌活性较好,抑制率大于60% (表2),抑菌能力极显著(P<0.01)。在培养7 d后,FX2-1和LHS11-1对小麦根腐病菌的抑制率达到70%以上。FX2-1具有较好的抑菌活性,抑菌能力极显著高于其他6株拮抗菌(P<0.01)。FX2-1和LHS11-1不仅表现出较好的抑菌能力,拮抗菌菌株自身还可以形成较大的菌落(图1B2)。培养8 d后,对照菌落在平板上长满(图1B1)。
2.3优良拮抗菌复筛
2.3.1菌株发酵液与黄瓜枯萎病菌拮抗培养4 d后,LHS11-1和FX2-1发酵液对黄瓜枯萎病菌的抑制率均达17.54%(表3),但两者之间差异不显著(P>0.01)。培养9 d后,FX2-1发酵液抑菌能力较好,抑制率为51.73%,相比其他4种菌差异极显著(P<0.01)。

表2 菌株对两种病原真菌拮抗作用
注:同列不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05)。下同。
Note:Different capital letters mean significant differences atP<0.01; different small letters mean significant differences atP<0.05. The same below.
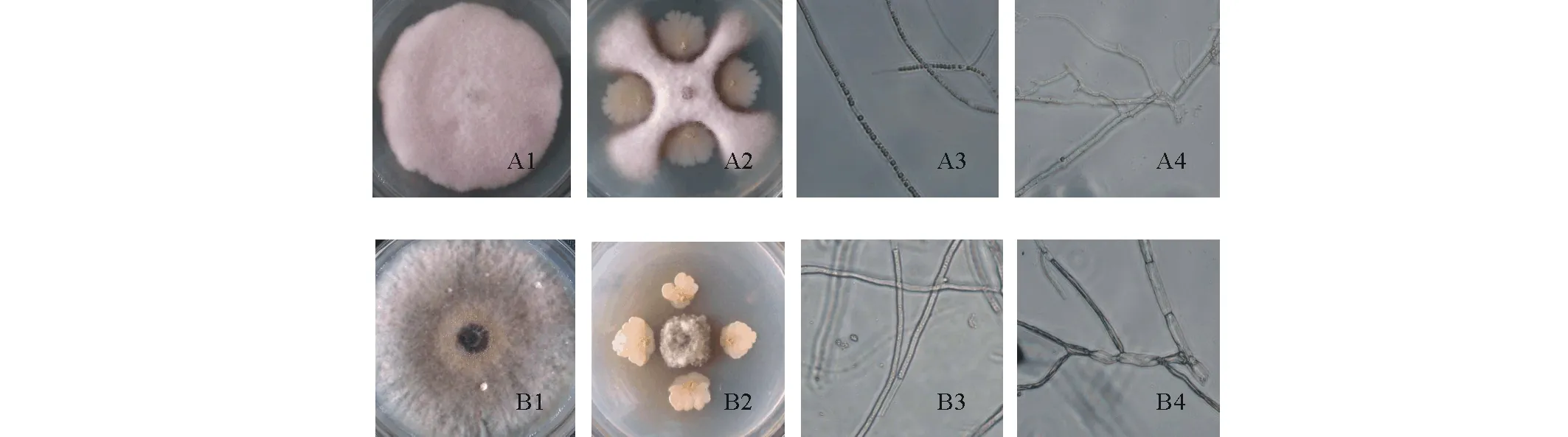
图1 拮抗菌与两种真菌病原平板对峙(部分)Fig.1 The panel confrontation of bio-control strains and two fungous pathogens (part) A:黄瓜枯萎病菌;B:小麦根腐病菌。3~4为光镜照片,放大倍数为10×40。A1:对照;A2:菌株LHS11-1处理;A3:对照,正常菌丝;A4:菌株LHS11-1处理,菌丝弯曲,分枝增多;B1:对照;B2:菌株FX2-1处理;B3:对照,正常菌丝;B4:菌株FX2-1处理,菌丝分枝增多,内陷。A: F. oxysporum f. sp. cucumerinum; B: B. sorokiniana. 3-4 are micrographs made by optical microscope at a magnification of 10×40. A1: CK; A2: Strain LHS11-1 treatment; A3: CK, normal mycelium; A4: Strain LHS11-1 treatment, the bending mycelium, increased branches; B1: CK; B2: Strain FX2-1 treatment; B3: CK, normal mycelium; B4: Strain FX2-1 treatment, increased and retracted mycelium branches.
2.3.2菌株发酵液与小麦根腐病菌拮抗在培养3 d后,LHS11-1和FX2-1的发酵液对小麦根腐病菌有抑制作用,抑制率分别为72.87%和55.81%(表3)。其他细菌的发酵液对小麦根腐病菌几乎没有抑制作用。在培养7 d后,LHS11-1的发酵液抑菌能力较强,抑制率达到81.52%,和其他6种细菌相比,抑制率差异极显著(P<0.01)。LM4-3、XX6和LX22抑菌作用微弱。
2.4拮抗菌对病原菌菌丝生长影响
2.4.1拮抗菌对黄瓜枯萎病菌菌丝生长抑制作用LHS11-1使黄瓜枯萎病菌菌丝分枝增多,扭曲变形,内容物质减少(图1A4)。菌株FX2-1使菌丝发生内陷,细胞内含物质减少。菌株LM4-3、菌株XX1和F1-4使菌丝内容物减少。对照呈均匀丝状,内含物质较多(图1A3)。
2.4.2拮抗菌对小麦根腐病菌菌丝生长抑制作用LHS11-1、LM4-3、XX1、XX6、FX2-1和LX22使小麦根腐病菌的菌丝变粗,发生不同程度的弯曲变形(图1B4)。菌株XX5使菌丝分枝增多,内陷呈枯萎状,细胞内含物质减少。对照菌丝呈均匀丝状,直角分支(图1B3)。
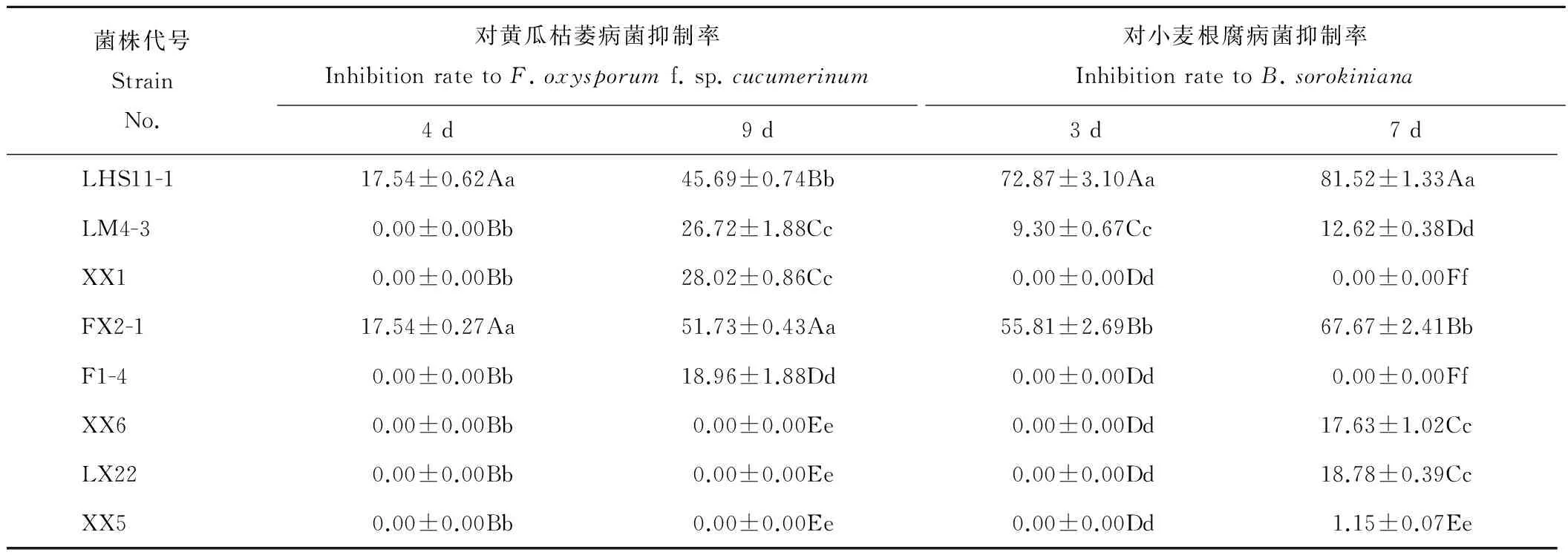
表3 菌株发酵液对两种病原真菌拮抗及抑制率
2.5优良拮抗菌株鉴定
2.5.1菌株形态特征与生理生化特性8株优良拮抗菌中,XX5为革兰氏阴性菌,其余均为革兰氏阳性菌,所有菌株生长速度较快。根据其生理生化特性(表4),参照《伯杰细菌鉴定手册》[9]、《常见细菌系统鉴定手册》[10]以及参考文献[11-12]中的参考菌株,初步确定LHS11-1和FX2-1为枯草芽孢杆菌(B.subtilis),XX1为蜡样芽孢杆菌(B.cereus),LX22、LM4-3和F1-4为短小芽孢杆菌(B.pumilus),XX6为简单芽孢杆菌(B.simplex),XX5为荧光假单胞杆菌(P.fluorescens)。

表4 菌株生理生化特性
+:菌株反应阳性;-:菌株反应阴性;NT:没有测定。+: Strains were positive; -: Strains were negative; NT: No determination.
2.5.216S rDNA序列分析8株细菌PCR产物电泳图如图2,所有菌株的16S rDNA序列全长在1500~2000 bp之间。经Blast相似性分析,选取20个典型菌株的16S rDNA序列进行系统进化分析,结果如图3。综合以上形态学、生理生化和分子生物学结果,确定LHS11-1和FX2-1为枯草芽孢杆菌(B.subtilis)(序列登录号分别为:KR811366和KR811367),XX1为蜡样芽孢杆菌(B.cereus) (登录号:KR811368);LM4-3、F1-4和LX22为短小芽孢杆菌(B.pumilus) (登录号分别为:KR811370、KR811372和KR811374);XX6为简单芽孢杆菌(B.simplex) (登录号:KR811373);XX5为荧光假单胞杆菌(P.fluorescens) (登录号:KR811375)。

图2 菌株16S rDNA PCR扩增产物电泳Fig.2 Electrophoresis of PCR amplification 16S rDNA of tested strains M: DL2000; 1: 菌株Strain LHS11-1; 2: 菌株Strain LM4-3; 3: 菌株Strain F1-4; 4: 菌株Strain XX6; 5: 菌株Strain LX22; 6: 菌株Strain XX5; 7: 菌株Strain FX2-1; 8: 菌株Strain XX1.

图3 菌株16S rDNA序列系统发育树Fig.3 Phylogenetic tree of tested strains based on 16S rDNA sequences
3 讨论
3.1菌株促生特性
通过测定19株细菌的促生特性,发现具有溶磷能力的菌株13株,具有固氮酶活性的菌株14株,能够分泌生长素的菌株10株。兼具3种促生特性的菌株6株,分别是菌株JM92、4N4、P2-1、JM170、LHS11-1和FX2-1。 分离自高原早熟禾的菌株PGRS-3分泌IAA能力较好,达到40.78 μg/mL。连翠飞等[13]研究发现菌株CX-5-2培养120 h产IAA能力较好,达到1.19 μg/mL,但是赤霉素含量达到108.63 μg/mL;分离自苜蓿的菌株LM4-3固氮酶活性较好,达到244.88 nmol C2H4/(mL·h)。王秀呈等[14]分离获得48株内生菌,其中HerbaspirillumseropedicaeDX35固氮酶活性最高,为181.21 nmol C2H4/(mL·h)。14株细菌固氮酶活性差别较大,这可能与采集地点土壤状况、植物种类不同有关;钼蓝比色法定量测定菌株的溶磷能力,溶磷圈与菌落直径大小的比值(D/d)随着时间变化而变化,大多数溶磷菌株的D/d值在第10天时处于稳定状态[15],Chen等[16]发现这与培养基中的磷酸钙和蛋黄卵磷脂含量有关。本研究中溶磷能力较强为分离自红三叶草的菌株LHS11-1,溶磷量达到205.77 μg/mL。顾杰等[17]研究发现3株菌的溶磷能力为41.63,37.76和39.78 μg/mL。由此可见本研究中的菌株促生特性明显好于其他学者研究的菌株,均为PGPR菌,但这些菌株对植物的促生效果有待进一步的验证。
3.2菌株对两种病害病原抑制作用
近年来,农作物复种指数及种植密度持续增加,使土壤养分严重失衡,导致植物病害发生严重,使农业生产造成的经济损失每年达40%~60%,严重地块可达80%以上[18]。利用生物防治已成为学者们的研究重点[19]。卜春亚等[20]从黄瓜根际筛选得到的拮抗菌j-28对黄瓜枯萎病菌的抑菌带达到11.0 mm,具有较强的抑制作用,并且拮抗菌j-28有较广的抑菌谱,对黄瓜灰霉病菌、马铃薯干腐病菌和茄子黄萎病菌等均具有很强的拮抗作用。本试验研究发现拮抗菌LHS11-1和FX2-1拮抗效果明显,对黄瓜枯萎病菌的抑制率分别达到67.38%和69.07%,对小麦根腐病菌的抑制率分别达到71.03%和78.17%。因此,对菌株LHS11-1和FX2-1是否具有较广谱的抑菌性有待进一步研究。
拮抗菌防治植物病害的作用机制主要有营养和空间位点的竞争、分泌抗菌物质、寄生和诱导植物体抗性等。研究发现PGPR在植物幼根表面定殖时能够形成一层均匀的保护层,保护了病原菌的侵染位点,减低了侵染机会[21]。并且通过产生几丁质酶、溶菌酶、木聚糖酶和胞外壳聚糖酶等对土壤中的大分子物质进行降解,在给植物提供营养的同时减少植物病害的发生[22]。赵帅等[23]研究发现HD-087产抗菌物质能造成黄瓜枯萎病病原菌菌丝畸形、分生孢子萌发受抑制,5倍发酵稀释液对孢子萌发的抑制率达72.1%。Chen等[24]研究表明,B.subtilisB579无菌培养液导致黄瓜枯萎病菌菌丝畸形,抑制孢子萌发,B579培养液灌根接种防治效果可达73.6%。本研究主要从拮抗菌分泌抗菌物质及其对真菌菌丝形态的影响角度对拮抗菌抑菌机理进行初步探索,对菌株后续的研究有一定的参考价值。研究发现拮抗菌LHS11-1和FX2-1发酵液对两种病害均有一定的抑制作用,对黄瓜枯萎病菌的抑制率分别为45.69%和51.73%,对小麦根腐病菌的抑制率分别达到81.52%和67.67%。拮抗菌发酵液对黄瓜枯萎病的抑制率较活菌的抑制率降低,可能是活菌抑制由空间位点竞争和抗菌物质等共同起作用。对小麦根腐病菌的抑制率较活菌的抑制率提高,可能是主要通过次生代谢产物起抑制作用。利用光学显微镜对拮抗菌抑菌机理的初步研究发现其对两种土传病害病原菌菌丝具有显著的致畸作用,可以使菌丝发生不同程度的膨大变形,使菌丝内容物释放,最终导致病原菌的细胞壁破裂,菌丝断裂,病原菌消亡。可能是这种畸变作用造成了病原菌菌丝失活,影响了病原菌的生长。对其是否存在其他的拮抗机制有待于进一步的探索研究。
3.3优良拮抗菌株鉴定
16S rDNA序列分析是微生物分类学中重要的方法,通过16S rDNA序列与GenBank数据库中相应序列比较分析,可快速准确地对微生物进行鉴定分类。本试验对8株优良拮抗菌进行形态学观察、生理生化特征初步鉴定,再利用16S rDNA基因测序确定LHS11-1和FX2-1为枯草芽孢杆菌(B.subtilis),LM4-3、F1-4和LX22为短小芽孢杆菌(B.pumilus);XX6为简单芽孢杆菌(B.simplex);XX1为蜡样芽孢杆菌(B.cereus);XX5为荧光假单胞杆菌(P.fluorescens)。国内外大量学者发现芽孢杆菌属和假单胞菌属能够很好地定殖于植物根部,既能促进植物根系生长也能防治一些病害的发生,如Smith等[25]发现蜡样芽孢杆菌(B.cereus) UW85能够定殖于植物根际,并证实了其抑制病害细菌与植物间的相互关系。Ryu等[26]发现B.subtilisGB03诱导拟南芥对盐害的忍耐力,并且该菌株产生的一些挥发性有机物是促使其产生诱导体系忍耐力的决定性物质。
References:
[1]Huang Y, Zhang Z Y, Huang L L,etal. Opinions on definition, analysis of advantages and disadvantages and integrated management of plant diseases. Plant Protection, 2009, 35(1): 97-101.
[2]Lan J L, Su M X, Ge C B,etal. Relativity between the distribution ofFusariumoxysporumand the course of disease of wilt disease of watermelon. Chinese Agricultural Science Bulletin, 2007, 23(1): 302-305.
[3]Zhao S, Du C M, Tian C Y. Current advances in integrated management of cucumber fusarium wilt. Chinese Agricultural Science Bulletin, 2014, 30(7): 254-259.
[4]Hou S Y, Zhang G. Study on the losses of wheat yield and the ELT to wheat root rot. Journal of Northwest Sci-tech University of Agriculture and Forestry, 2002, 30(1): 76-78.
[5]Sun G Z, Yao T, Zhao G Q,etal. Research progress and prospect ofPseudomonasfluorescensin controlling plant diseases. Acta Prataculturae Sinica, 2015, 24(4): 174-190.
[6]Rong L Y, Yao T, Zhao G Q,etal. Screening of siderophore-producing PGPR bacteria and their antagonism against the pathogens. Plant Protection, 2011, 37(1): 59-64.
[7]Hafeez F Y, Malik K A. Manual on Biofertilizer Technology[M]. Pakistan: Nibge, 2000: 132-135.
[8]Chen T C, Lin X H, Li J,etal. Isolation, identification of a bacterium isolate An-ctc-y-1 and its antagonism for plant pathogenic fungus. Acta Agriculturae Boreali-occidentalis Sinica, 2011, 20(7): 41-45.
[9]Buchanan R E, Bergey D H. Bergey’s Manual of Determinative Bacteriology, 8th Chinese edn[M]. Beijing: Chinese Science Press, 1984.
[10]Dong X Z, Cai M Y. Common Bacterial System Identification Manual[M]. Beijing: Chinese Science Press, 2002: 162-166.
[11]Xue D, Huang X D, Jin C X. Highly efficient bioflocculant produced byBacillussimplex. Techniques and Equipment for Environmental Pollution Control, 2012, 6(8): 2897-2902.
[12]Wang C X, Wang D B, Zhou Q. Classification and identification of the plant growth-promoting rhizobacteria (PGPR) in cotton. Journal of Huazhong Agricultural University, 1997, 16(1): 29-32.
[13]Lian C F, Li S Z, Chao C Y,etal. Selection, identification and characterization of antagonistic and phytohormone producing bacterial strain CX-5-2. Acta Phytopathologica Sinica, 2007, 37(2): 197-203.
[14]Wang X C, Cao Y H, Tang X,etal. Rice endogenous nitrogen fixing and growth promoting bacteriumHerbaspirillumseropedicaeDX35. Acta Microbiologica Sinica, 2014, 54(3): 292-298.
[15]Ma W W. Screening Plant Growth Promoting Rhizobacteria (PGPR) from Rhizosphere of Grasses and Establishing their Database Management System[D]. Lanzhou: Gansu Agricultural University, 2014.
[16]Chen Y P, Rekha P D, Arun A B,etal. Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities. Applied Soil Ecology, 2006, 34: 33-41.
[17]Gu J, Meng L Y, Sun L N,etal. Mechanisms of plant growth promotion ofAzotobacterspp. of rice PGPR on rice seedling. Journal of Anhui Agricultural University, 2012, 39(3): 426-429.
[18]Yang X R, Wang X L, Wang M,etal. Inhabiting activity of bio-bacteria B579 to soil-brone disease and its promotion growth effects. Chinese Journal of Biological Control, 2008, 24(Suppl.): 59-61.
[19]Li X L, Li Y Z. Research advances in biological control of soil-borne disease. Acta Prataculturae Sinica, 2015, 24(3): 204-212.
[20]Bu C Y, Jia Y Q, Wang Y N,etal. Oriented screening antagonisticBacillusagainstFusariumoxysporiumf. sp.cucumarinumowen and analysis of character of its antifungal agents. Chinese Agricultural Science Bulletin, 2013, 29(31): 101-107.
[21]Barahona E, Navazo A, Martínez-Granero F,etal.PseudomonasfluorescensF113 mutant with enhanced competitive colonization ability and improved biocontrol activity against fungal root pathogens. Applied and Environmental Microbiology, 2011, 77(15): 5412-5419.
[22]Li J, An D R, Li A R,etal. Isolation, purification, and structural characterization of antibiotic substance fromPseudomonasfluorescensAbIII745-6. Journal of Microbiology, 2008, 28(2): 11-14.
[23]Zhao S, Tian C Y, Shi Y W,etal. Fermentation conditions for the biocontrol strain HD-087 against cucumberFusariumwiltand it’s antibacterial effect. Microbiology China, 2013, 40(5): 802-811.
[24]Chen F, Wang M, Zheng Y,etal. Quantitative changes of plant defense enzymes and phytohormone in biocontrol of cucumberFusariumwiltbyBacillussubtilisB579. World Journal of Microbiology and Biotechnology, 2010, 26(4): 675-684.
[25]Smith C B, Anderson J E, Fischer R L,etal. Stability of green fluorescent protein using luminescence spectroscopy: is GFP applicable to field analysis of contaminants. Environmental Pollution, 2002, 120(3): 517-520.
[26]Ryu C M, Farag M A, Hu C H,etal. Bacterial volatiles induce systemic resistance inArabidopsis. Plant Physiology, 2004, 134: 1017-1026.
[1]黄云, 张中义, 黄丽丽, 等. 植物病害的定义刍议、利弊分析及综合控制. 植物保护, 2009, 35(1): 97-101.
[2]蓝江林, 苏明星, 葛慈斌, 等. 尖孢镰刀菌的分布与西瓜枯萎病病程的相关性. 中国农学通报, 2007, 23(1): 302-305.
[3]赵帅, 杜春梅, 田长彦. 黄瓜枯萎病综合防治研究进展. 中国农学通报, 2014, 30(7): 254-259.
[4]侯生英, 张贵. 小麦根腐病产量损失及经济阈值研究. 西北农林科技大学学报: 自然科学版, 2002, 30(1): 76-78.
[5]孙广正, 姚拓, 赵桂琴, 等. 荧光假单胞菌防治植物病害研究现状与展望. 草业学报, 2015, 24(4): 174-190.
[6]荣良燕, 姚拓, 赵桂琴, 等. 产铁载体PGPR菌筛选及其对病原菌的拮抗作用. 植物保护, 2011, 37(1): 59-64.
[8]陈太春, 林星华, 李晶, 等. 1株An-ctc-y-1细菌分离物的鉴定及其对植物病原真菌的作用.西北农业学报, 2011, 20(7): 41-45.
[10]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2002: 162-166.
[11]薛冬, 黄向东, 靳朝喜. 简单芽孢杆菌产高效微生物絮凝剂. 环境工程学报, 2012, 6(8): 2897-2902.
[12]王春霞, 王道本, 周启. 棉花根际促生菌筛选菌株的分类鉴定. 华中农业大学学报, 1997, 16(1): 29-32.
[13]连翠飞, 李社增, 晁春燕, 等. 产植物激素拮抗细菌CX-5-2的筛选, 鉴定及其特性研究. 植物病理学报, 2007, 37(2): 197-203.
[14]王秀呈, 曹艳花, 唐雪, 等. 水稻内生固氮菌HerbaspirillumseropedicaeDX35的筛选及其促生特性. 微生物学报, 2014, 54(3): 292-298.
[15]马文文. 禾草根际促生菌资源筛选及其数据库管理系统构建[D]. 兰州: 甘肃农业大学, 2014.
[17]顾杰, 孟丽媛, 孙乐妮, 等. 水稻根际固氮菌促生特性评价. 安徽农业大学学报, 2012, 39(3): 426-429.
[18]杨秀荣, 王雪莲, 王敏, 等. 拮抗细菌B579对土传病害的防治效果及促长作用. 中国生物防治, 2008, 24(增刊): 59-61.
[19]李兴龙, 李彦忠. 土传病害生物防治研究进展. 草业学报, 2015, 24(3): 204-212.
[20]卜春亚, 贾玉琦, 王有年, 等. 黄瓜枯萎病拮抗芽孢杆菌的定向筛选及其抑菌活性物质特性分析. 中国农学通报, 2013, 29(31): 101-107.
[23]赵帅, 田长彦, 史应武, 等. 黄瓜枯萎病拮抗菌HD-087产抗菌物质条件的优化及抑菌作用初探. 微生物学通报, 2013, 40(5): 802-811.
An assessment of the level of control of two fungal pathogens by various plant growth promoting rhizobacteria
SUN Guang-Zheng, YAO Tuo*, ZHAO Gui-Qin, LI Jian-Hong, CHEN Long, LIU Huan
CollegeofPrataculturalScience,GansuAgriculturalUniversity,KeyLaboratoryofGrasslandEcosystem,MinistryofEducation,PrataculturalEngineeringLaboratoryofGansuProvince,Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China
The capacity for dissolved phosphorus absorption, the nitrogenase activity and the secretion of auxin of 19 strains of plant growth promoting rhizobacteria (PGPR) acquired from five plant species were tested by molybdenum blue colorimetry, acetylene reduction assay and high performance liquid chromatography, respectively. All 19 strains were tested for ability to antagonize the fungiFusariumoxysporumf. sp.cucumerinumandBipolarissorokiniana, using the panel confrontation method. Strains with antagonistic ability were identified at morphological, physiological biochemical, and molecular levels. It was found thatBacillussubtilisstrain LM4-3 had stronger nitrogenase activity than other tested strains and reached 244.88 nmol C2H4/(mL·h), whileB.subtilisstrain LHS11-1 had the highest dissolved phosphorus absorption capacity (205.77 mg/L), and the strain PGRS-3 had the greatest secretion of auxin, reaching 40.78 μg/mL in the culture medium. Five bacterial strains were found to have antagonistic activity againstF.oxysporumf. sp.cucumerinum, withB.subtilisstrain FX2-1 providing up to 69.07% suppression. and 51.73% of its fermentation solution. Seven bacterial strains could efficiently antagonizeB.sorokiniana, withB.subtilisstrain FX2-1 achieving 78.17%, the fermentation solution ofB.subtilisLHS11-1 rinsed up to 81.52%. Other bacterial species found to have plant growth promoting or to be antagonistic towards the above two pathogenic fungal species includedBacilluscereus,Bacilluspumilus,BacillussimplexandPseudomonasfluorescens.
plant growth promoting rhizobacteria (PGPR); growth characteristics;Fusariumoxysporumf. sp.cucumerinum;Bipolarissorokiniana; antimicrobial activity; identification
10.11686/cyxb2015353http://cyxb.lzu.edu.cn
孙广正, 姚拓, 赵桂琴, 李建宏, 陈龙, 刘欢. 植物根际促生菌对两种真菌病害病原的抑制作用及其鉴定. 草业学报, 2016, 25(8): 154-163.
SUN Guang-Zheng, YAO Tuo, ZHAO Gui-Qin, LI Jian-Hong, CHEN Long, LIU Huan. An assessment of the level of control of two fungal pathogens by various plant growth promoting rhizobacteria. Acta Prataculturae Sinica, 2016, 25(8): 154-163.
2015-07-15;改回日期:2015-10-21
国家自然基金(31360584)和现代农业产业技术体系(CARS-08-C)资助。
孙广正(1988-),男,甘肃庆阳人,在读硕士。E-mail: sunfanfan885@163.com
Corresponding author. E-mail: yaotuo@gsau.edu.cn

