茶多酚对铝致大鼠睾丸支持细胞损伤的拮抗作用研究*
王程强,欧超燕,施文祥,钱 波
(桂林医学院公共卫生学院,广西桂林 541004)
茶多酚对铝致大鼠睾丸支持细胞损伤的拮抗作用研究*
王程强,欧超燕,施文祥,钱波△
(桂林医学院公共卫生学院,广西桂林 541004)
目的探讨茶多酚(TP)对铝暴露大鼠睾丸支持细胞损伤的拮抗作用。方法原代培养大鼠睾丸支持细胞。将细胞分为0 μmol/L AlCl3(对照组)、400 μmol/L AlCl3(铝暴露组)、40 μg/mL TP +400 μmol/L AlCl3组(低剂量拮抗组)、160 μg/mL茶多酚+400 μmol/L AlCl3组(高剂量拮抗组),各组用相应的药物处理24 h。四甲基偶氮唑盐(MTT)法检测各组细胞的生长活性;逆转录-聚合酶链反应(RT-PCR)检测抑制素B(INHB)mRNA的表达。结果与对照组比较,铝暴露组的细胞活性、INHB mRNA表达均明显下降,差异有统计学意义(P<0.05)。与铝暴露组比较,低剂量拮抗组、高剂量拮抗组能够明显提高细胞活性,差别具有统计学意义(P<0.05)。与铝暴露组比较,高剂量拮抗组能够明显提高INHB mRNA表达,差异有统计学意义(P<0.05)。结论高剂量TP能够拮抗铝对大鼠睾丸支持细胞的损伤。
茶多酚;三氯化铝;睾丸支持细胞;抑制素B
铝在环境中和人类的生活中广泛存在,且能够在人体里逐渐蓄积,其毒性主要表现为神经系统的损伤。除了神经毒性外,近年来发现铝对生殖系统也有毒性。无论是流行病学研究还是整体动物实验,都证实了铝会对雄性的生殖系统带来损伤。有研究显示,铝暴露将导致雄性小鼠的睾丸、附睾质量减轻,导致精子数量和质量显著下降[1],但是作用机制目前仍不清楚。睾丸支持细胞是睾丸组织中重要的保姆细胞,它能够为精子提供稳定的微环境,为生精提供所需的营养物质与能量,还能分泌大量的生长因子参与生精细胞的分化和成熟,其功能的受损将对精子的生成产生巨大的影响。因此,睾丸支持细胞被认为是评价雄性生殖毒性的重要靶细胞[2]。支持细胞所分泌的抑制素B(INHB)能直接反映其功能状态,一旦生精受到抑制,INHB的水平将发生变化[3-4]。目前排铝药物主要是铝螯合剂,但其不良反应多。近年来,患者对于不良反应小的天然药物的需求越来越高,开发出一种不良反应比较小的驱铝药物迫在眉睫[5]。茶多酚(TP)是一种天然的强抗氧化剂,可以预防肿瘤及神经退行性疾病[6-7]。但其能否保护铝暴露的睾丸支持细胞,目前未见报道。本研究将探讨TP对铝暴露大鼠睾丸支持细胞的保护作用,并初步研究其可能的发生机制。
1 材料与方法
1.1材料
1.1.1动物清洁级雄性Sprague-Dawley(SD)大鼠6只,18~22 d,以体质量50~55 g睾丸未降出腹腔为标准。由桂林医学院实验动物中心提供。
1.1.2主要仪器与试剂TP(浙江东方茶叶科技有限公司,≥95%),氯化铝(分析纯,广州化学试剂厂产品),DMEM/F12培养液(Gibco公司),胎牛血清(武汉谷歌生物有限公司),四甲基偶氮唑盐(MTT,美国Sigma公司),胶原酶Ⅰ(美国Sigma公司),胰蛋白酶(Difco公司),第一链cDNA试剂盒和PCR试剂盒(北京赛百盛公司),酶标仪(奥地利Tecan公司)。
1.2方法
1.2.1大鼠睾丸支持细胞原代培养[8]颈椎脱臼法处死大鼠。鼠体置于75%乙醇中浸泡2 min,然后利用眼科剪在超净工作台中取出大鼠睾丸,放入含有预冷的D-Hanks液的培养皿中。剥除睾丸被膜,用眼科剪把睾丸实质剪碎成约1 mm3的碎块。加入D-Hanks液,静置5 min后,冲洗2次。采取胰蛋白酶和胶原酶二步法消化组织。将睾丸组织碎块加入3 mL 0.25%胰蛋白酶,37 ℃水浴振荡消化30 min。加入少量胎牛血清终止消化,800 r/min离心5 min去上清。加入无血清的培养基,1 000 r/min离心5 min去上清,再用D-Hanks液洗涤沉淀。再加2 mL 0.1%胶原酶Ⅰ液,37 ℃水浴振荡消化20 min。取出后放入超净台,将消化液经100目不锈钢筛过滤。加入少量含胎牛血清的DMEM/F-12培养液,制成细胞悬液。用0.4%台盼兰计数活细胞含量,补充适量含血清培养基,调节细胞浓度至合适。接种细胞在培养箱中,37 ℃ 5%CO2及饱和湿度条件下培养。48 h后弃培养液,用D-Hanks液冲洗,再用pH7.4的20 mmol/L Tris-HCl低渗处理3 min,以去除精原细胞。
1.2.2大鼠睾丸支持细胞的鉴定采取Feulgen染色法对大鼠睾丸支持细胞进行鉴定[9]。
1.2.3实验分组及处理本实验采用离体培养2 d后的原代细胞进行相关处理,将细胞分为0 μmol/L AlCl3(对照组)、400 μmol/L AlCl3(铝暴露组)、 40 μg/mL TP+400 μmol/L AlCl3组(低剂量拮抗组)、160 μg/mL TP+400 μmol/L AlCl3组(高剂量拮抗组),各组用相应的药物处理24 h。
1.2.4MTT法检测细胞生长活性调整细胞密度5×105/mL接种在96孔板中,每孔200 μL,每组设6个复孔。于37 ℃ 5% CO2培养箱中培养48 h后,施加相关处理因素。各组细胞经过相关处理24 h后,加入5 mg/mL的MTT 20 μL,继续培养4 h后,弃培养液,每孔加入200 μL二甲基亚砜(DMSO),室温下振荡10 min,使结晶物体完全溶解。利用酶标仪在490 nm波长下检测各孔的吸光度(A)值。实验重复3次。
1.2.5采取RT-PCR法检测大鼠睾丸支持细胞中INHB mRNA表达水平将培养于96孔板的各组细胞经过24 h处理后,加入Trizol提取RNA,并逆转录cDNA,具体步骤严格按照试剂说明书进行。INHB:上游引物5′-CTC TGC TGC TGC TCC TTT TG-3′,下游引物5′-TGG TGG CTG CGT ATG TG-3′,产物片段361 bp。内参3-磷酸甘油醛脱氢酶(GAPDH):上游引物5′-GGT GCT GAG TAT GTC GTG GAG T-3′,下游引物5′-CAG TCT TCT GAG TGG CAG TGA T-3′,产物片段292 bp。引物均由北京赛百盛基因技术有限公司合成。以2 μL cDNA为模板,建立PCR反应体系[包括10×PCR缓冲液5 μL,MgCl27 μL,三磷酸脱氧核苷酸(dNTP)2 μL,上下游引物各1 μL,2 μL cDNA,Taq酶1 μL,灭菌双蒸水31 μL]。PCR反应条件: 95 ℃ 5 min;94 ℃ 40 s,55 ℃ 45 s,72 ℃ 1 min;60 ℃ 10 min循环35次。5 μL用琼脂糖凝胶电泳分离,采取Gene Tools分析条带A值,以INHB与GAPDH的比值代表其mRNA的相对表达量。
1.3统计学处理运用SPSS 18.0统计软件对数据进行分析,采用单因素方差分析,SNK-q检验运用于各组之间的两两比较,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1茶多酚对铝暴露支持细胞活性的影响支持细胞活性铝暴露组(0.822±0.028)、低剂量拮抗组(0.933±0.033)、高剂量拮抗组(0.950±0.026)与对照组(1.008±0.044)相比较,差异有统计学意义(P<0.05)。低剂量拮抗组、高剂量拮抗组与铝暴露组相比较,差异有统计学意义(P<0.05)。
2.2TP对铝暴露大鼠睾丸支持细胞INHB mRNA表达的影响INHB mRNA铝暴露组(0.333±0.022)、低剂量拮抗组(0.365±0.010)、高剂量拮抗组(0.412±0.019)与对照组(0.452±0.011)相比较,差异有统计学意义(P<0.05)。高剂量拮抗组与铝暴露组INHB mRNA表达相比较,差异有统计学意义(P<0.05)。见图1。
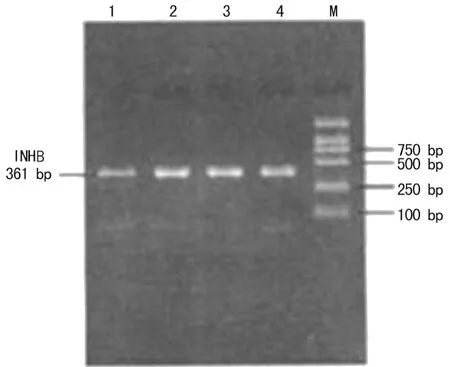
M:DNA标记物;1~4:铝暴露组、对照组、高剂量拮抗组、低剂量拮抗组。
图1INHB mRNA RT-PCR产物电泳结果
3 讨 论
睾丸是铝雄性生殖毒性最敏感的器官之一。生精功能的障碍和睾酮合成的抑制是铝雄性生殖毒性的主要表现形式。有研究发现,给小鼠腹腔注射三氯化铝,随着剂量的增加,生精细胞和睾丸支持细胞都明显减少[10]。铝暴露会导致睾丸组织中超氧化物歧化酶(SOD)活力下降,增加丙二醛(MDA)的含量[11]。铝暴露将产生大量的活性氧化簇,促进脂质过氧化损伤,导致精母细胞和精子坏死。正常精子的生成,都需要睾丸支持细胞。睾丸支持细胞具有保护、营养和支持生精细胞的功能。有研究证实,卵泡刺激素(FSH)能够选择性刺激支持细胞分泌INHB。FSH对雌性的生殖影响是巨大的、绝对的[12],然而对雄性来说,FSH的影响是比较细微的。如果通过基因敲除法敲除FSH基因,雌性动物不育,而雄性小鼠却依然可以生育。此外,INHB和精子浓度有很好的正相关性。铝导致睾丸氧化损伤依然是最主要的机制。有研究表示铝暴露后,将产生大量的一氧化氮合酶,从而抑制环磷酸腺苷(cAMP),使睾酮的分泌将减少,导致精子浓度下降。随着cAMP活性的下降,睾丸间质细胞转运胆固醇进入线粒体的量也随之减少[13]。
本实验发现,与对照组比较,铝暴露组的细胞活性、INHB mRNA表达均明显下降,差异有统计学意义(P<0.05)。INHB对FSH的负反馈作用要强于正反馈。说明支持细胞在受到铝暴露后,将负反馈降低抑制素的表达,减少对FSH的抑制,促进FSH分泌雄激素结合蛋白(ABP)。ABP能与睾酮结合,从而拮抗铝对支持细胞的损伤效应。
TP是一类富含酚羟基的化合物,提供活性氢,使自由基灭活,清除自由基过多引起的DNA损伤[14]。TP还能抑制诱导型一氧化氮合成酶mRNA的表达,从而阻断一氧化氮的合成[15]。而抑制素的转录主要是受到FSH刺激的cAMP的影响。本研究发现,TP能够通过增加抑制素的转录,拮抗铝对睾丸支持细胞的损伤效应,增加睾丸支持细胞活性。其机制可能是提高cAMP活性,抑制一氧化氮合酶的产生,从而拮抗铝对睾丸支持细胞的损伤。
[1]Llobet JM,Colomina MT,Sirvent JJ,et al.Reproductive toxicology of Aluminum in male mice[J].Fundam Appl Toxicol,1995,25(1):45-51.
[2]高明,吴南翔,宋杨,等.原代培养大鼠睾丸支持细胞PCB153暴露后超氧化物歧化酶活力和丙二醛含量的时间变化特征[J].环境与健康杂志,2011,23(5):380-382.
[3]刘国红,王翀,刘宏凯,等.p,p′-DDE对大鼠睾丸Sertoli细胞雄激素结合蛋白,转铁蛋白和抑制素B mRNA表达的影响[J].中华男科学杂志,2006,12(2):104-107.
[4]钟先玖,吴鑫,周元陵,等.丙烯腈对大鼠睾丸中雄激素结合蛋白和抑制素基因表达的影响[J].环境与职业医学,2005,22(5):414-416.
[5]苏式兵,王汝宽,李梢,等.医学发展趋势和前景分析[J].世界科学技术:中医药现代化,2007,9(1):112-118.
[6]耿文学,董华进.茶多酚免疫调节及抗肿瘤的研究进展[J].实用癌症杂志,2009,24(3):315-317.
[7]李锐,杜芳,乐卫东.绿茶多酚的神经保护作用[J].中国临床神经科学,2003,11(4):428-431.
[8]赵龙坡,徐铮,张文,等.大鼠睾丸支持细胞的原代培养,鉴定与抑制素的表达[J].华北国防医药,2006,18(4):232-234.
[9]韩晓冬,龚昳,屠志刚,等.大鼠睾丸支持细胞的原代培养与鉴定[J].解剖学报,2005,36(6):682-684.
[10]崔慧慧,白晓琴,李莉,等.三氯化铝暴露致雄性小鼠生殖细胞的遗传毒性[J].环境与健康杂志,2009,26(1):68-70.
[11]徐华雷,刘萍,郝丽娜,等.铝螯合剂对染铝大鼠睾丸抗氧化系统及必需元素的影响[J].环境与健康杂志,2009,26(4):290-292.
[12]Gassei K,Schlatt S,Ehmcke J.De novo morphogenesis of seminiferous tubules from dissociated immature rat testicular cells in xenografts[J].J Androl,2006,27(4):611-618.
[13]Guo CH,Lin CY,Yeh MS,et al.Aluminum-induced suppression of testosterone through nitric oxide production in male mice[J].Environ Toxicol Pharmacol,2005,19(1):33-40.
[14]张军,张敬,石红军,等.茶多酚对紫外线引起的DNA损伤的保护作用[J].同济大学学报(医学版),2004,25(2):91-92.
[15]刘英莉,张艳淑,王广增.茶多酚联合维生素C,维生素E对染尘大鼠肺泡巨噬细胞DNA损伤的保护实验研究[J].中国职业医学,2000,27(5):21-22.
The antagonistic effects of tea polyphenols on damage of rat sertoli cells induced by Aluminum chloride*
Wang Chengqiang,Ou Chaoyan,Shi Wenxiang,Qian Bo△
(School of Public Health,Guilin Medical College,Guilin,Guangxi 541004,China)
ObjectiveTo observe the antagonistic effects of tea polyphenols on the damage of sertoli cells of rats induced by Aluminum chloride.MethodsRat sertoli cells were cultured,purified and identified.Cells were divided into 0 μmol/L AlCl3(control group),400 μmol/L AlCl3(Aluminum exposure group) and 40 μg/mL TP+400 μmol/L AlCl3group (low dose anti group) and 160 μg/mL tea polyphenol + 400 μmol/L AlCl3group (high dose of anti group),each group with the corresponding drug treatment for 24 h.MTT method was used to detect the growth activity of the cells in each group,the levels of INHB mRNA expression were measured by RT-PCR.ResultsCompared with the control groups,the cell viability and the level of INHB mRNA expression of Aluminum exposure groups were obviously decreased,there were statistical significant differences(P<0.05).Compared with the Aluminum exposure group,the cell viability of low dose anti group and high dose of anti group was remarkably increased,there were statistical significant differences(P<0.05).Compared with the Aluminum exposure group,the level of INHB mRNA expression of high dose of anti group was remarkably increased,there was statistial significant difference(P<0.05).ConclusionHigh dose of tea polyphenols can enhance the expression of mRNA,increase the cell activity,and antagonism Aluminum on the injury of rat′s testis.
tea polyphenols;Aluminum chloride;sertoli cell;inhibin-B
广西科技厅自然基金青年基金一般项目(2012GXNSFBA053120);广西教育厅高等学校一般资助项目(201203YB121)。作者简介:王程强(1981-),讲师,硕士,主要从事毒理学的相关研究。△
,E-mail:805558188@qq.com。
论著·基础研究10.3969/j.issn.1671-8348.2016.22.003
R697
A
1671-8348(2016)22-3031-03
2016-02-15
2016-04-20)

