MECP2基因甲基化和羟甲基化水平的性别差异研究
刘亚卉 郑煜芳 刘 星 王红艳 蔡春泉
·论著·
MECP2基因甲基化和羟甲基化水平的性别差异研究
刘亚卉1郑煜芳1刘星2王红艳1蔡春泉3
目的探讨MECP2在不同性别脑组织中是否有表达差异,从而与孤独症等疾病的性别差异相关。方法利用4例非疾病流产胎儿脑标本,采用酚氯仿方法提取基因组DNA。在MethPrimer在线软件上检测MECP2基因-1 000 bp至+1 200 bp区间的CpG 岛。甲基化检测采用亚硫酸氢盐修饰后测序法(使用EZ DNA Methylation-goldTMKit 试剂盒)。对于超声断裂后的基因组DNA,用基因组羟甲基化试剂盒(diagenode,hMeDIP kit)进行ChIP反应。反转录cDNA采用FastQuant RT Kit(With gDNase)试剂盒,定量PCR检测MECP2表达量采用 SuperReal PreMix Plus (SYBR Green)试剂盒。结果标本1男,重量106 g,长度17.4 cm;标本2女,重量100 g,长度19.1 cm;标本3男,重量500 g,长度28.3 cm;标本4女,重量510 g,长度31.5 cm。MECP2表达量男性胚胎(标本1=0.0367,标本3=0.0155)高于女性胚胎(标本2=0.0177,标本4=0.0088)。MECP2的甲基化水平女性个体平均1条X染色体上MECP2的甲基化程度显著高于男性,特别是在启动子的核心区域-309 bp至-179 bp,男性MECP2上几乎没有甲基化,而羟甲基化水平男性高于女性。结论男性MECP2基因的DNA修饰促进其表达,可能提高了男性胚胎对MECP2基因突变的易感性,从而影响MECP2基因突变导致的患病人群的性别差异。
MECP2基因;甲基化;羟甲基化
孤独症(ASD)是儿童发育障碍中最为严重的疾病之一,典型的临床特征包括社交障碍、重复的刻板行为、智力发育迟缓和自主的神经系统紊乱等[1]。ASD主要发生在男性中,男女比例约为4∶1。与ASD同属于广泛性发育障碍的Rett综合征(RTT)却表现为女性为主。这2种疾病在致病基因、临床表现和病程进展中有诸多重叠,临床上>60%的RTT患者同时可有ASD的表现,甚至导致RTT被误诊为ASD[2]。然而2种疾病为何在男女患病比例上存在差异,长期以来始终不明。
甲基化CpG结合蛋白2(MECP2)基因位于X染色体,基因全长约为75.9 kb,包含5′UTR区,长达8.4 kb的3′UTR区以及4个外显子。MECP2蛋白是一种结合甲基化DNA的转录因子,包含2个具有重要的功能结构域,即甲基化结合域和转录抑制域[3]。小鼠研究显示,MECP2在全身有广泛性表达,但也显示了一定的组织特异性和发育阶段特异性表达谱。MECP2在脑的表达相对于其他组织要高,特别是在成熟的神经细胞[4]。MECP2蛋白在胚胎发育时水平较低,但在出生后神经元成熟阶段其蛋白表达水平逐渐增多[4~9]。
1999年Amir首先确认了MECP2是RTT的主要致病基因[10],之后研究发现90%的RTT患者存在MECP2突变[1];也有研究显示,MECP2基因突变与ASD也密切相关[10~17]。共同的致病基因为探索ASD和RTT男女患病比例差异的原因提供了切入点。已知在正常个体的中枢神经系统中,MECP2 的表达量受到严格的调控,表达量过高或过低对于ASD等疾病的症状都有影响,而甲基化和羟甲基化是调控基因表达最常见的表观遗传修饰。因此,推测MECP2在不同性别人群中的甲基化和羟甲基化水平可能存在差异,并可能是导致MECP2相关疾病如ASD和RTT发病性别差异的因素。为验证该假说,设计了从表观遗传的角度探索MECP2的表达水平是否与性别相关的实验。
1 方法
1.1标本及其来源本研究脑组织来自于天津市儿童医院外科非疾病因素流产的胎儿。
1.2知情同意和伦理胎儿脑组织的收集均获得流产胎儿家属的知情同意。本研究得到复旦大学生命科学学院伦理委员会审核通过(伦理审批号:216)。
1.3组织DNA提取取胎儿脑组织样本,采用酚氯仿的方法提取基因组DNA。扩增MECP2编码区以及潜在的启动子区(-1 375 bp至+1 bp),检测是否存在基因突变,所用引物见表1。
表1PCR扩增引物序列

正向引物反向引物1TGCCAGGCATAGTCTCTCCTCTTCGGCAGAAGCAGCAAAG2GGGCAGGCTCGGATGAAATAGAGGGTAGAGAGGAGGGACG3ACTGTGTGTTACGTGCCAGTCCTTTCAGGGCTCAGGGAAG4GAGTGTATGATGGCCTGGGGCCACCCTGGGCACATACATT5AGAGCGTTGTCACCACCATCGCCTTTGGGGACTCTGAGTG6GAAAAGCAAGGAGAGCAGCCCCCTGAAGCCACGAAACTCT
1.4胞嘧啶-鸟嘌呤(CpG)岛预测在MethPrimer在线软件(http://www.urogene.org/methprimer/)上检测MECP2基因-1 000 bp至+1 200 bp区间的CpG 岛。参数设置为Island size>200 bp, GC Percent >50.0, Obs/Exp >0.6。
1.5甲基化检测甲基化检测采用亚硫酸氢盐修饰后测序法(EZ DNA Methylation-goldTMKit 试剂盒)。其原理是,对提取的基因组DNA进行亚硫酸氢盐修饰后,其胞嘧啶如被甲基化,则保持胞嘧啶不变,如胞嘧啶没有被甲基化,则经过亚硫酸氢盐处理后变为尿嘧啶。亚硫酸氢盐处理后的基因组DNA经过PCR反应,纯化,连T载体,挑单克隆,测序后与原序列对比,即可判断该胞嘧啶是否被甲基化。
1.6羟甲基化检测将3 μg基因组DNA超声断裂成小的片段,片段范围为200~500 bp。超声断裂后的基因组DNA用基因组羟甲基化试剂盒(diagenode,hMeDIP kit)进行ChIP反应,纯化和定量PCR(Takara,SYBR®Primemix Ex TaqTMKit)。操作按照实际和操作说明进行。
1.7MECP2表达量检测胎儿脑组织经酚氯仿方法提取的基因组RNA,反转录cDNA采用FastQuant RT Kit(With gDNase)试剂盒,定量PCR采用 SuperReal PreMix Plus (SYBR Green)试剂盒。
2 结果
2.1胎儿标本一般情况标本1男,重量106 g,长度17.4 cm;标本2女,重量100 g,长度19.1 cm;标本3男,重量500 g,长度28.3 cm;标本4女,重量510 g,长度31.5 cm;标本1和2重量和长度相似,标本3和4重量和长度相似。
2.2MECP2启动子区甲基化的状态图1显示,在MECP2基因-1 000 bp至+1 200 bp区间共找到2个CpG岛,第1个CpG岛为1 137 bp,位于-506 bp至+631 bp。第2个CpG岛为251 bp,位于+841 bp至+1 091 bp。

图1MeCP2的CpG岛
用重硫酸盐处理的4个胎儿脑组织标本的DNA,对MECP2 -613 bp至+77 bp内的38个CpG位点进行亚硫酸氢钠测序检测(硫化测序PCR引物见表2),PCR纯化之后将DNA片段连接到T载体上,每个样品挑10个单克隆进行测序和统计,计算出CpG位点的甲基化百分比(图2)。结果显示,女性个体平均1条X染色体上MECP2的甲基化程度显著高于男性,特别是在启动子的核心区域-309 bp至-179 bp,男性MECP2上几乎没有甲基化。
表2硫化测序PCR引物

编号正向引物反向引物覆盖区域1AAATTAAGGTTTTTTAGTTGGGGTAATTAACCCTCTATCCACAAATACACC-613bp至-466bp2TTAGGTTTTTATTTGTTTTAGTATTCTCCAACTATTAATTAACTACTTTC-431bp至-290bp3GGGCYGGTTAAGAGGGCGGGGYGACTTTTACCACAACCCTCTCTCC-110bp至-10bp4GGAGAGAGGGTTGTGGTAAAAGTCCCACTCACAATCTCTCCTCCTC-33bp至+77bp

图2标本1~4的X染色体上MECP2启动子区甲基化状况
2.3MECP2启动子区羟甲基化的状态标本1~4的MECP2基因的-406 bp至+77 bp区域羟甲基化检测引物见表3。图3显示,与甲基化富集程度相反,女性个体平均1条X染色体上MECP2的羟甲基化富集程度低于男性。
表3羟甲基化检测引物

编号正向引物反向引物覆盖区域/bp1CGCAAGGGTCCATTAATCCTTAACCTCCAGCTGTTGATTGGC-406~-2892CCGAAAGCAGCCAATCAACACGTCATTGGCTGTGATGGC-317~-1673GGAGAGAGGGCTGTGGTAAAGTCCCACTCACAGTCTCTCC-34~+73
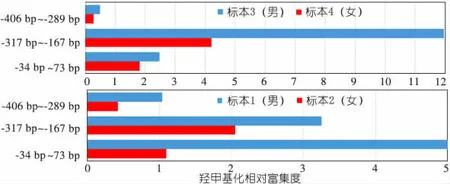
图3标本1~4的MECP2基因启动子区平均1条X染色体上的羟甲基化状况
2.4脑组织中MECP2定量PCR结果利用定量PCR的引物对MECP2 mRNA的表达水平进行定量,定量PCR的引物:①MECP2-qPCR正向引物GGACCCATGTATGATGACCCC,反向引物CCGTGAAGTCAAAAT-CATTAGGGT;②GAPDH-qPCR正向引物GAAGGTGAAGGTCGGAGTC,反向引物GAAGATGGTGATGGGATTTC。结果显示,脑组织中MECP2表达量男性标本1(0.0367)和3(0.0155)比女性标本2(0.0177)和4(0.0088)高,MECP2的表达量比值胚胎期较晚的脑组织(标本3/标本4=1.76)比胚胎期较早的脑组织(标本1/标本2=2.07)低。
3 讨论

甲基化和羟甲基化是调控基因表达的常见表观遗传修饰。基因组中的胞嘧啶上会发生甲基化修饰,通常是位于CpG上的胞嘧啶。约40%的基因在其启动子区域包含CpG岛,其甲基化通常与基因沉默相关[27]。而羟甲基化修饰的作用与甲基化相反,可促进基因表达。研究发现羟甲基化修饰在大脑中最为丰富,特别是在皮质和脑干[28, 29],是其他组织中的10多倍[29~31]。羟甲基化与神经系统的发育密切相关,和甲基化共同参与神经元的分化以及海马区神经元的发生,并与小脑的发育呈正相关[32~35],提示羟甲基化在大脑中是一个稳定的遗传标记。有研究发现在各种分化的中枢神经系统细胞中5-羟甲基化富集在有活性基因上,而甲基化在这些区域显著减少[36]。
本文实验结果显示,女性MECP2平均1条X染色体上的甲基化程度明显高于男性,并且在检测的2个男性胎儿脑组织中,MECP2启动子区几乎没有甲基化富集,而MECP2启动子区的羟甲基化富集程度男性高于女性。考虑到甲基化对基因的沉默和羟甲基化促进基因的表达,猜测在男性中,5-羟甲基化的富集和5-甲基化的缺乏可能导致MECP2在男性大脑中的表达高于女性。本文4个脑组织标本MECP2表达水平的检测结果显示,男性MECP2表达量比女性高,印证了上述推测。
之前的研究证实RTT是一种由MECP2基因突变引起的X染色体连锁性ASD,患者主要是女性,传统观点认为男女比例的严重失调,是因为携带纯合突变基因的男性在胚胎早期即死亡,但在近年的研究也发现了男性 RTT 的病例,均表现为不同程度的神经发育异常[37]。ASD主要发生在男性,目前的研究认为ASD病因多样化,与多基因和染色体区域相关。患者的男女差异可能是女性有某种特异性的保护机制,因此可能需要更多的致病因素(遗传或环境)才能达到诊断的阈值[38]。这也表明ASD是一种X连锁的疾病,因此性别层面显得尤为重要。此外,在ASD及其他神经发育障碍中观察到MECP2基因突变或表达缺陷[11~15]。
由于MECP2对于大脑的发育非常重要,在中枢神经系统的表达受严格调控,因此在男女脑组织中的表达差异,提示不同性别对其表达的敏感度不同。因此推测,如果携带了MECP2突变,男性受到的影响更大,这可能与ASD患者男女性别差异相关。而当MECP2突变效应太强时,男性胚胎很可能难以存活,因而RTT主要表现为女性患者。
本研究局限性在于样本量太小,后续将进一步收集不同胚胎期匹配的男女脑组织标本扩大验证;同时收集年龄相匹配的男女性ASD患者和非ASD对照,以外周血或皮肤成纤维细胞为对象,观察MECP2基因甲基化、羟甲基化以及基因表达的情况,深入验证所得结果。
[1] Percy AK.Rett syndrome:exploring the autism link.Arch Neurol,2011,68(8):985-989
[2] Neul JL,Fang P,Barrish J,et al.Specific mutations in methyl-CpG-binding protein 2 confer different severity in Rett syndrome.Neurology,2008,70(16):1313-1321
[3] Nan X,Campoy FJ,Bird A.MeCP2 is a transcriptional repressor with abundant binding sites in genomic chromatin.Cell,1997,88(4):471-481
[4] Jung BP,Jugloff DG,Zhang G,et al.The expression of methyl CpG binding factor MeCP2 correlates with cellular differentiation in the developing rat brain and in cultured cells.J Neurobiol,2003,55(1):86-96
[5] Kishi N,Macklis JD.MECP2 is progressively expressed in post-migratory neurons and is involved in neuronal maturation rather than cell fate decisions.Mol Cell Neurosci,2004,27(3):306-321
[6] Shahbazian MD,Antalffy B,Armstrong D L,et al.Insight into Rett syndrome:MeCP2 levels display tissue-and cellspecific differences and correlate with neuronal maturation.Hum Mol Genet,2002,11(2):115-124
[7] Cohen DR,Matarazzo V,Palmer A M,et al.Expression of MeCP2 in olfactory receptor neurons is developmentally regulated and occurs before synaptogenesis.Mol Cell Neurosci,2003,22(4):417-429
[8] Balmer D,Goldstine J,Rao YM,et al.Elevated methyl-CpGbinding protein 2 expression is acquired during postnatal human brain development and is correlated with alternative polyadenylation.J Mol Med (Berl),2003,81(1):61-68
[9] Mullaney BC,Johnston M V,Blue M E.Developmental expression of methyl-CpG binding protein 2 is dynamically regulated in the rodent brain.Neuroscience,2004,123(4):939-949
[10] Amir RE,Van den Veyver IB,Wan M,et al.Rett syndrome is caused by mutations in X-linked MECP2,encoding methyl-CpG-binding protein 2.Nat enet,1999,23(2):185-188
[11] Lam CW,Yeung WL,Ko CH,et al.Spectrum of mutations in the MECP2 gene in patients with infantile autism and Rett syndrome.J Med Genet,2000,37(12):E41
[12] Dotti MT,Orrico A,De Stefano N,et al.A Rett syndrome MECP2 mutation that causes mental retardation in men.Neurology,2002,58(2):226-230
[13] Kleefstra T,Yntema HG,Nillesen WM,et al.MECP2 a alysis in mentally retarded patients:implications for routine DNA diagnostics.Eur J Hum Genet,2004,12(1):24-28
[14] Hammer S,Dorrani N,Dragich J,et al.The phenotypic consequences of MECP2 mu0tations extend beyond Rett syndrome.Ment Retard Dev Disabil Res Rev,2002,8(2):94- 98
[15] Van Esch H,Bauters M,Ignatius J,et al.Duplication of the MECP2 region is a frequent cause of severe mental retardation and progressive neurological symptoms in males.Am J Hum Genet,2005,77(3):442-453
[16] Carney RM,Wolpert CM,Ravan SA,et al.Identification of MeCP2 mutations in a series of females with autistic disorder. Pediatr Neurol,2003,28(3):205-211
[17] Samaco RC,Mandel-Brehm C,McGraw CM,et al.Crh and Oprm1 mediate anxiety-related behavior and social approach in a mouse model of MECP2 duplication syndrome.Nat Genet, 2012,44(2):206-211
[18] LaSalle JM,Yasui DH.Evolving role of MeCP2 in Rett syndrome and autism.Epigenomics,2009,1(1):119-130
[19] Chao HT,Chen H,Samaco RC,et al.Dysfunction in GABA signalling mediates autism-like stereotypies and Rett syndrome phenotypes.Nature,2010,468(7321):263-269
[20] Guy J,Hendrich B,Holmes M,et al.A mouse Mecp2-null mutation causes neurological symptoms that mimic Rett syndrome.Nat Genet,2001,27(3):322-326
[21] Ito-Ishida A,Ure K,Chen H,et al.Loss of MeCP2 in Parvalbumin-and Somatostatin-Expressing Neurons in Mice Leads to Distinct Rett Syndrome-like Phenotypes.Neuron,2015,88(4):651-658
[22] Chen RZ,Akbarian S,Tudor M,et al.Deficiency of methyl- CpG binding protein-2 in CNS neurons results in a Rett-like phenotype in mice.Nat Genet,2001,27(3):327-331
[23] Chahrour M,Zoghbi HY.The story of Rett syndrome:from clinic to neurobiology.Neuron,2007,56(3):422-437
[24] Liu Z,Li X,Zhang JT,et al.Autism-like behaviours and germline transmission in transgenic monkeys overexpressing MeCP2.Nature,2016,530(7588):98-102
[25] Collins AL,Levenson JM,Vilaythong A P,et al.Mild overexpression of MeCP2 causes a progressive neurological disorder in mice.Hum Mol Genet,2004,13(21):2679-2689
[26] Luikenhuis S,Giacometti E,Beard CF,et al.Expression of MeCP2 in postmitotic neurons rescues Rett syndrome in mice. Proc Natl Acad Sci U S A,2004,101(16):6033-6038
[27] Fatemi M,Pao MM,Jeong S,et al.Footprinting of mammalian promoters:use of a CpG DNA methyltransferase revealing nucleosome positions at a single molecule level. Nucleic Acids Res,2005,33(20):e176
·140· Chin J Evid Based Pediatr April 2016,Vol 11,No 2 [28]Globisch D,Munzel M,Muller M,et al.Tissue distribution of 5-hydroxymethylcytosine and search for active demethylation intermediates.PLoS One,2010,5(12):e15367
[29]Kriaucionis S,Heintz N.The nuclear DNA base 5- hydroxymethylcytosine is present in Purkinje neurons and the brain.Science,2009,324(5929):929-930
[30]Munzel M,Globisch D,Bruckl T,et al.Quantification of the sixth DNA base hydroxymethylcytosine in the brain.Angew Chem Int Ed Engl,2010,49(31):5375-5377
[31]Szulwach KE,Li X,Li Y,et al.5-hmC-mediated epigenetic dynamics during postnatal neurodevelopment and aging.Nat Neurosci,2011,14(12):1607-1616
[32]Hahn MA,Qiu R,Wu X,et al.Dynamics of 5- hydroxymethylcytosine and chromatin marks in Mammalian neurogenesis.Cell Rep,2013,3(2):291-300
[33]Chen Y,Ozturk NC,Zhou FC.DNA methylation program in developing hippocampus and its alteration by alcohol.PLoS One,2013,8(3):e60503
[34]Zhou FC.DNA methylation program during development. Front Biol (Beijing),2012,7(6):485-494
[35]Zhou FC,Chen Y,Love A.Cellular DNA methylation program during neurulation and its alteration by alcohol exposure.Birth Defects Res A Clin Mol Teratol,2011,91(8): 703-71
[36]Mellen M,Ayata P,Dewell S,et al.MeCP2 binds to 5hmC enriched within active genes and accessible chromatin in the nervous system.Cell,2012,151(7):1417-1430
[37]Zeev BB,Yaron Y,Schanen NC,et al.Rett syndrome: clinical manifestations in males with MECP2 mutations.J Child Neurol,2002,17(1):20-24
[38]Lai MC,Lombardo MV,Baron-Cohen S.Autism.Lancet, 2014,383(9920):896-910
(本文编辑:张崇凡)
Gender differences in methylation and hydroxymethylation levels of MECP2
LIUYa-hui1,ZHENGYu-fang1,LIUXing2,WANGHong-yan1,CAIChun-quan3
(1StateKeyLaboratoryofGeneticEnginering-MinistryofEducationKeyLaboratoryofContemporaryAnthropology,SchoolofLifeSciences,FudanUniversity,Shanghai200433;2NationalEngineeringCenterforBiochipatShanghai,Shanghai201203; 3DepartmentofSurgery,TianjingChildren′sHospital,Tianjing300074;China)
CAI Chun-quan,E-mail:tjpns@126.com
Objective To understand whether there are expressional differences ofMECP2 between male and female brains, which may contribute to the gender differences inMECP2 associated diseases, e.g. autism. MethodsGenomic DNA of brain tissues from four normal aborted fetuses was obtained by phenol-chloroform extraction. By using MethPrimer online software, the CpG island ofMECP2 gene was enriched between -1 000 bp to + 1 200 bp. To detect the level of methylation, bisulfite sequencing method was used (by using the EZ DNA Methylation-goldTMKit ). For ultrasound fractured genomic DNA, ChIP assay was performed with genomic hydroxymethyl kit (diagenode, hMeDIP Kit). The expression levels ofMECP2 in brain tissues were detected with cDNA that was obtained by FastQuant RT Kit (With gDNase) and were quantitated using SuperReal PreMix Plus (SYBR Green) kits.ResultsSample 1, male,weight 106 g, length 17.4 cm;sample 2, female, weight 100 g,length 19.1 cm; sample 3, male, weight 500 g, length 28.3 cm; sample 4, female, weight 510 g, length 31.5 cm.The expression level ofMECP2 in brain of male (sample1=0.0367, sample3=0.0155) was higher than that in female (sample2=0.0177, sample 4=0.0088) during early embryonic stage. The methylation level of the core promoter region ofMECP2 in male was significantly lower than that in female per X chromosome, especially in the core promoter region -309 bp to -179 bp. Almost no methylation appeared onMECP2 in brain of male while the hydroxymethylation level was the opposite. ConclusionThese results indicated that the gene modifications onMECP2 in male may contribute to its expression. This may in turn increase the susceptibility of male toMECP2 mutations in disease such as autism and result in sex ratio changes in patient population.
MECP2; Methylation; Hydroxymethylation
10.3969/j.issn.1673-5501.2016.02.011
天津市应用基础与前沿技术研究计划:14JCYBJC25000
1 复旦大学生命科学学院 遗传工程国家重点实验室-现代人类学教育部重点实验室上海,200433;2 生物芯片上海国家工程研究中心上海,201203;3 天津市儿童医院外科天津,300074
蔡春泉,E-mail:tjpns@126.com
2016-03-10
2016-04-03)

