两种样品处理方法对LC-MS/MS测定鸡肉中金刚烷胺基质效应比较
周 剑, 王 敏*, 杨梦瑞, 张立华
(中国农业科学院农业质量标准与检测技术研究所,中国农业科学院农产品质量与食物安全重点开放实验室,北京 100081)
金刚烷胺是一种人用抗病毒药物[1,2],农业部早在2005年就已公告明令禁止其在动物产品生产中使用[3]。因此,建立高准确度动物产品中金刚烷胺检测方法,能有效支撑对动物养殖过程中该药物违规使用行为的监管。目前已有多种高效液相色谱-质谱(HPLC-MS/MS)联用技术检测动物源性食品中金刚烷胺[4 - 8],然而这些方法都没有对可能产生的基质效应进行研究。在样品前处理和仪器分析过程中,流动相组分、样品中与目标分析物共提取的其他物质也会同时进入质谱系统,这些物质将会影响目标分析物在质谱中的离子化过程,使得目标分析物的质谱信号增强或者减弱,产生基质效应[9]。2001年,美国食品药品管理局在《生物分析方法验证准则》中明确要求:在HPLC-MS/MS分析方法开发和验证过程中需要对基质效应进行评价[10]。
优化改进样本尤其是生物样本的前处理方法,并且采用待测物的同位素标记物为内标是消除基质效应较有效的方法。为此,本文以同位素稀释质谱法为基础,从绝对基质效应、提取回收率和方法过程效率等方面,系统考察了QuEChERS法和固相萃取(SPE)法两种前处理方法对LC-MS/MS分析鸡肉中抗病毒药物金刚烷胺的基质效应的影响,从而选定合适的前处理方法,为动物源性产品中抗病毒药物金刚烷胺监测,以及鸡肉粉中金刚烷胺分析基体标准物质研制提供方法支持。
1 实验部分
1.1 仪器与试剂
Agilent1200液相色谱仪(美国,Agilent公司);API2000质谱仪(美国,AB Sciex公司);色谱柱:Zorbax Eclipse Plus C18柱(150×2.1 mm i.d.,3.5 μm);VORTEX-5涡旋混合器(美国,Scientific industries公司);EYELA旋蒸仪(日本,东京理化公司);TTL-DCII氮吹仪(北京同泰联科技发展有限公司);XS105DU电子天平(瑞士,梅特勒公司);Oasis MCX固相萃取小柱(150 mg,6 mL)(美国,Waters公司)。移液器:1 000 μL,200 μL,20 μL(德国,Eppendorf 公司)。
金刚烷胺选用实验室自行研制的国家二级标准物质(编号GBW(E)090594);D15-金刚烷胺标准品购于Sigma公司;乙腈、甲醇、正己烷、甲酸(色谱纯,德国Merck公司);乙酸铵、无水硫酸钠、乙酸、氨水(分析纯,中国国药试剂有限公司);PSA:40~60 μm。实验用水为Milli-Q超纯水。
1.2 标准溶液的制备
金刚烷胺储备液:直接选用GBW(E)090594,浓度1 001 μg/mL,不确定度10%;D15-金刚烷胺标准储备液:精密称取10 mg D15-金刚烷胺于10 mL容量瓶中,用甲醇溶解并稀释,配制浓度1 000 μg/mL;金刚烷胺和D15-金刚烷胺标准储备液均在-20 ℃保存。氨化甲醇溶液:准确吸取2.5 mL氨水和2.5 mL乙酸铵溶液于100 mL容量瓶,用甲醇定容,混匀备用。
1.3 样品的前处理方法
1.3.1QuEChERS法提取:称取试样2.0 g(精确至0.01 g)于50 mL离心管中,加入D15-金刚烷胺标准溶液。然后加入乙腈(含1%乙酸)10 mL,漩涡2 min,3 000 r/min离心5 min,上清液转入另一50 mL离心管中,重复提取一次,合并两次上清液,待净化。净化:备用液中加入无水Na2SO43 g,正己烷10 mL,涡旋1 min,3 000 r/min离心5 min,弃去正己烷层,剩余溶液转至100 mL鸡心瓶中,40 ℃水浴下旋转蒸干,用1 mL甲醇溶解残渣。然后加入PSA 50 mg,涡旋30 s,取上清液过滤膜供LC-MS/MS测定。
1.3.2SPE法提取:称取试样2.0 g(精确至0.01 g)于50 mL离心管中,加入D15-金刚烷胺标液,加入4 mL 20 g/L三氯乙酸溶液和1 mL乙腈,漩涡2 min,3 500 r/min离心10 min,上清液转入另一50 mL离心管中,重复提取一次,合并两次上清液备用。净化:依次用3 mL甲醇、3 mL水活化Oasis MCX萃取小柱,移取10 mL备用液上样(控制流速≤1 mL/min);依次用3 mL水、3 mL甲醇淋洗Oasis MCX柱;然后真空抽干5 min,用3.5 mL氨化甲醇洗脱至5 mL玻璃管中,温度 45 ℃下氮气吹干。用1 mL乙腈-甲醇-水(体积比为90∶5∶5)溶液溶解残渣,过0.22 μm滤膜,取上清液供LC-MS/MS测定。
1.4 仪器条件
1.4.1液相色谱条件分析柱采用Zorbax Eclipse Plus C18柱(150×2.1 mm,3.5 μm);流动相A为乙腈,流动相B为0.1%甲酸水溶液,梯度洗脱条件:0~4 min,95%B;4~5 min,95%~40%B;5~8 min,40%B;8~8.1 min,40%~95%B;8.1~10 min,95%B;流速:0.3 mL/min;进样量:10 μL。
1.4.2质谱条件离子源:电喷雾正离子(ESI+)监测模式,多重反应监测(MRM)扫描模式;离子源喷射电压4.5 kV;温度:550 ℃;驻留时间:200 ms;雾化气压力(GS1):50 psi;辅助气压力(GS2):50 psi;气帘气压力(CUR):35 psi。金刚烷胺(准分子离子峰m/z152、定量离子m/z135)、D15-金刚烷胺(准分子离子峰m/z167.3、定量离子m/z150.3)。
2 结果与讨论
2.1 QuEChERS法前处理条件的选择
2.1.1提取剂的选择根据金刚烷胺溶于2.5倍水、5倍的乙醇、18倍的氯仿,不溶于苯和乙醚的特点及相似相溶原理,实验以旋蒸后离心管的状态和提取效率为指标,比较优化了甲醇、乙腈以及分别加入三氯乙酸、1%乙酸和1%氨水条件下,不同提取剂的提取效果。提取效率采用SAS软件进行显著性比较,结果表明选用乙腈/1%乙酸作为提取剂时,提取效率较好且实验过程中样品旋蒸后比较干净,可知蛋白和脂肪去除效果较优于其他提取剂,更便于下一步目标物的净化。
2.1.2净化剂的选择本文选取C18、PSA、硅藻土、弗罗里硅土四种净化剂,以净化后待上机液的颜色及谱图杂质峰多少为指标,通过实验对比可知,PSA和弗罗里硅土的净化效果明显优于其他两种,检测中发现弗罗里硅土对金刚烷胺药物的吸附作用比较大,最终选用PSA吸附剂进行提取液的处理。
2.2 固相萃取前处理条件的选择
2.2.1提取剂的选择在分散固相萃取优化中,最佳的提取溶剂是含有1%乙酸的乙腈,但固相萃取方法中,提取溶剂的性质影响过SPE柱时待分析物的保留能力,所以应重新优化。实验比较了2.1.1节中各种提取剂的提取效率,结果用回收率和SAS软件比较,多次测量的统计结果显示,含三氯乙酸的乙腈具有更高的提取效率,进一步优化比较含5、10、20、30 g/L三氯乙酸的乙腈的提取效率,综合比较回收率和峰形等因素,选择含20 g/L的三氯乙酸的乙腈为最佳提取剂。
2.2.2净化条件的选择由于在酸性提取条件下,金刚烷胺主要以离子形式存在,实验比较了强阳离子交换柱SCX和混合阳离子交换柱MCX,结果显示在常规的淋洗洗脱条件下,MCX柱就能取得相对较好的净化效果,考虑金刚烷胺的pKa值大于9,采用碱化的甲醇更能提高淋洗效率,实验比较了不同比例的氨化甲醇,最后确定5%氨化甲醇为最佳淋洗溶液。
2.3 色谱条件的选择
基质效应主要出现在出峰较早的时间段,所以可使分析物的峰有一定的色谱保留,以降低基质效应。通过比较不同品牌的色谱柱,本实验采用Zorbax Eclipse Plus C18柱(150×2.1 mm i.d.,3.5 μm),将出峰时间调节至4.5 min以后进行测定。因金刚烷胺易溶于水和乙醇,且其分子中含有氨基呈碱性,在酸性条件下易离子化提高质谱的信号响应;同时由于鸡肉组织含大量蛋白质和脂肪,故本方法采用有机相和酸性水溶液混合体系对金刚烷胺进行提取。而当流动相中加入甲酸时,可改善金刚烷胺的色谱峰形。由于甲酸的加入对结果影响不大,综合考虑色谱柱压力、仪器耐受、色谱峰形等多种因素,本方法采用乙腈和水(含0.1%甲酸)作为流动相。
2.4 质谱条件的选择
全扫描模式下,在正离子和负离子模式下分别进行扫描,以确定分子离子峰和合适的电离方式。实验结果表明,正离子模式下有更好的离子响应,金刚烷胺类药物均含有氨基,容易得到H+而形成较为稳定的[M+H]+准分子离子,所以选择正离子模式。全扫描下确定的金刚烷胺和D15-金刚烷胺的母离子分别是m/z152.2和m/z167.3,在确定分子离子峰的情况下,采用LC-MS/MS的多重反应监测模式(MRM)进行进一步优化,主要优化去簇电压(Declustering Potential,DP)和碰撞能(Collision Energe,CE),在碰撞诱导解离中,本实验以氮气作为碰撞气体,得到金刚烷胺和D15-金刚烷胺的子离子分别是m/z分别是m/z135.2和150.3,在确定了母离子和子离子的条件下,对DP和CE分别进行优化,以保证得到的子离子有最大的离子响应。实验所得金刚烷胺和D15-金刚烷胺的离子质谱条件见表1,样品中金刚烷胺和D15-金刚烷胺提取离子色谱图如图1所示,MRM模式下子离子质谱图和结构式如图2所示。

表1 金刚烷胺和D15-金刚烷胺的MRM模式质谱优化参数
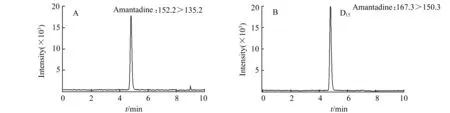
图1 样品中金刚烷胺(A)和D15-金刚烷胺(B)提取离子色谱图Fig.1 The extracted ion chromatograms of amantadine(A) and D15-amantadine(B) in sample
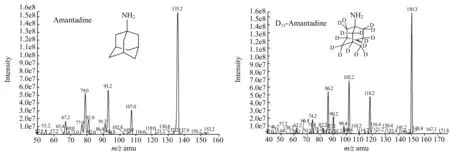
图2 金刚烷胺和D15-金刚烷胺的LC-MS/MS质谱图和结构式Fig.2 LC-MS/MS mass spectra of amantadine and D15-amantadine
2.5 方法学考察
2.5.1检出限和定量限实验计算了鸡肉中含有100 μg/kg金刚烷胺时的信噪比,检测限按3倍信噪比时金刚烷胺浓度计算。QuEChERS法和SPE法的检出限分别为1.0 ng/mL、4.0 ng/mL。在两种前处理方法中,QuEChERS法作为一个改进的萃取方法检出限更低,而较低的检出限有利于实验前样品的稀释,更有效地避免基体效应。
2.5.2方法线性范围取金刚烷胺标准储备液适量,分别配制成浓度为2、4、16、32、60、120、240 ng/mL的金刚烷胺标准系列溶液,每个浓度都加入同一质量的D15-金刚烷胺,并准确称量。以检测到的金刚烷胺与D15-金刚烷胺的峰面积比(Y)和金刚烷胺的浓度(X)进行线性回归,得线性回归方程为:Y=32.76X-2.2570,回归系数(R2)为0.9980。实验表明在2.0~240.0 ng/mL浓度范围内,质谱对金刚烷胺具有良好的线性响应。
2.6 基质效应考察
实验根据提取后添加法建立数学模型评定基质效应,可同时考察提取回收率。采用国际上通行的Matuszewski提出的方法,比较不同条件下的峰面积平均值。A组:纯的对照品溶液;B组:鸡肉空白经不同前处理方法提取后添加对照品溶液;C组:鸡肉空白中加入混合对照品溶液后经不同前处理方法提取。绝对基质效应:ME=B/A,提取回收率:RE=C/B,方法过程效率:PE=C/A。样本经QuEChERS法和SPE法两种前处理方法处理后,与高、低浓度混合对照品溶液进行分析,结果见表2。

表2 采用QuEChERS和SPE进行样本前处理时的基质效应、回收率和过程效率
经QuEChERS法和SPE法两种前处理方法处理后,不同浓度金刚烷胺的ME均大于90%。固相萃取法虽能较强增强LC-MS/MS分析金刚烷胺的离子化效率,但高浓度金刚烷胺的RE小于85%,不符合相关生物样本分析方法的规定,此外方法的PE也很低。与之相比,采用QuEChERS法处理鸡肉样本后,不仅能够有效增强金刚烷胺离子化效率;同时RE较高且相对稳定,其PE也相对较高。综合考虑方法所耗费的时间以及实验药品的消耗,QuEChERS法更适于作为提取鸡肉中金刚烷胺的标准方法。
3 结论
本文在采用LC-MS/MS测定鸡肉组织中金刚烷胺化合物时,在同位素稀释质谱法的基础上比较了QuEChERS法和SPE法两种前处理方法对基质效应的影响,从绝对基质效应、提取回收率、方法过程效率及方法稳定性等方面的考察发现,采用QuEChERS法对鸡肉组织样本进行处理后,LC-MS/MS测定肌肉组织中金刚烷胺化合物的绝对基质效应大于样品经MCX固相萃取后的绝对基质效应,表明相对于SPE前处理方法,QuEChERS法能增加金刚烷胺化合物的离子化效率,且该方式下的提取回收率和方法过程效率均较高和稳定。因此,针对禽肉中抗病毒药物金刚烷胺的检测,QuEChERS法与同位素稀释质谱法结合能有效降低基质效应,可以作为禽产品中抗病毒药物金刚烷胺监测以及鸡肉粉中金刚烷胺分析基体标准物质研制时采用的方法。

