适宜氮水平下冬油菜苗期不同叶位叶片光合氮分配特征
刘 涛,鲁剑巍,任 涛,汪 威,王 振,王少华
(1华中农业大学资源与环境学院/农业部长江中下游耕地保育重点实验室,武汉 430070;2湖北省武穴市农业技术推广中心,湖北武穴 435400)
适宜氮水平下冬油菜苗期不同叶位叶片光合氮分配特征
刘涛1,鲁剑巍1,任涛1,汪威1,王振2,王少华2
(1华中农业大学资源与环境学院/农业部长江中下游耕地保育重点实验室,武汉 430070;2湖北省武穴市农业技术推广中心,湖北武穴 435400)
【目的】探讨适宜氮水平下冬油菜苗期不同叶位叶片的光合速率及其内部光合氮素利用特征,并分析氮素营养影响光合氮利用效率的限制因子,为合理施用氮肥提供理论依据。【方法】采用田间试验,设置4个施氮水平(0、45、180和360 kg·hm-2,分别用N0、N45、N180和N360表示),测定苗期干物质积累及成熟期产量。选取N0(对照)和N180(适宜氮水平)处理,将植株绿叶从上而下平均分为上部、中部和下部,测定不同叶位叶片最大净光合速率(Pnmax)、氮含量(NA)、叶绿素含量(Cc)以及可溶性蛋白氮含量(NS)等相关生理、光合参数,并计算叶片氮素在光合组织系统(羧化系统、生物力能学组分和捕光系统)的分配比例,分析叶片氮素利用特征。【结果】施氮对冬油菜增产效果显著,N45、N180和N360较N0处理增产幅度分别达170.0%、505.6%和604.1%,其中,N180与N360处理产量差异不显著;苗期干物质积累与产量表现一致。与N0处理相比,N180处理冬油菜不同叶位叶片NA、Cc和Pnmax均显著升高,上部和中部叶片光合氮利用效率(PNUE)有所下降。光合组织系统氮分配结果表明,N180处理上部、中部叶片,氮素在光合组织系统中羧化系统(PC)、生物力能学组分(PB)及捕光系统(PL)的分配比例均低于N0处理,但各组分氮含量较N0处理平均增加幅度分别达到20.6%、11.8%和28.8%。施氮与否对相同叶位叶片可溶性蛋白氮(NS)与非可溶性蛋白氮(Nnon-S)的比例影响不大,但显著影响光合组织系统在NS和Nnon-S中的分配,其中N0处理各部叶片的羧化系统氮含量(NC)占NS的比例平均为83.4%,N180处理比例为60.3%。基于边界线分析法定量各光合组织系统分配对PNUE的影响结果表明,PC和PB对PNUE的影响大小分别为26.8%和42.6%,显著高于PL的影响。氮素营养对PNUE的影响以PC和PB限制为主,平均所占比例达77.8%。上部叶PNUE主要受PC限制,所占比例达83.3%;而下部叶片PNUE主要受PB和PL限制。【结论】施氮对冬油菜增产效果显著,施氮量为180 kg·hm-2时较为适宜。缺氮条件下,植株将有限的氮尽可能地向光合器官中分配,且下部叶片光合氮素较早发生降解,而适宜氮水平下能维持光合蛋白在各自蛋白类型内的分配比例。氮素营养限制光合氮素利用效率提高的主要因子是羧化系统和生物力能学组分氮分配;随着叶位的降低光合氮素利用效率的主要限制因子由羧化系统氮分配逐渐转变为捕光系统及生物力能学组分氮分配。
冬油菜;氮素营养;叶位;氮分配;光合氮利用效率
0 引言
【研究意义】植物的光合能力依赖于叶片氮含量,而氮在叶片内的分配也是影响光合速率的重要因素。叶片中超过一半的蛋白质分配于光合组织系统中,要提高光合效率就需要优化不同形态氮素(酶、叶绿素等)的分配比例[1]。不增加氮素投入,只是优化氮素在光合蛋白之间的分配,就可以提高光合能力60%[2]。因此,探究氮素在叶片光合组织系统中的分配及其对光合速率的影响,对于合理施用氮肥及提高作物光合潜力具有重要意义。【前人研究进展】关于氮素在植物叶片光合组织系统中的分配,前人做了大量的研究。MAKINO等[3]研究表明,C4作物玉米的光合速率之所以高于C3作物水稻,一方面源于其CO2浓缩机制;另一方面发现玉米叶片中只有8.5%的氮素分配于碳同化酶(Rubisco),而将更多的氮素投入到捕光蛋白中。同一物种叶片的氮素分配也会受到环境的影响,ONODA等[4]和HIKOSAKA等[5]研究发现植株通过改变细胞壁和Rubisco之间的氮素分配,提高光合效率以应对环境变化。TROUWBORST等[6]对不同光照条件下黄瓜叶片中光合氮素分配的研究结果显示,弱光下植株将更多的氮投入到吸收光能的组织中,相应减少了光能利用的氮投入。XU等[7]通过模型模拟,表明CO2浓度升高会降低碳同化酶的分配数量。另有研究表明,不同叶位叶片的氮素含量、Rubisco含量及其光合能力对氮素营养水平的响应均存在明显差异[8]。KICHEY等[9]发现小麦冠层上部叶片为了尽可能多的捕获光能,将大部分氮素投资于光合组织系统,使氮素得到高效利用。【本研究切入点】上述研究多集中于不同物种以及CO2、光照等生态因子对氮素分配影响[10-11],缺少植物本身的氮素营养条件对叶片光合氮素分配的影响研究。施用氮肥是改善作物氮素营养条件和增产的主要措施之一,了解这一措施对光合组织系统氮分配的影响,对优化氮素养分管理有重要的指导作用。此外,大多数研究都集中在单一叶片的光合作用及氮营养状态,而对于同一植株而言,不同叶位叶片因叶片发育程度、所受辐照水平以及自身氮营养状况差异,均会对氮素利用产生显著影响。【拟解决的关键问题】本研究以冬油菜为研究材料,探究适宜氮水平下冬油菜苗期不同叶位叶片光合速率及其内部光合氮素利用特征,并分析氮素营养影响光合氮素利用效率的限制因子,以期为合理施用氮肥及提高作物光合潜力提供理论依据。
1 材料与方法
1.1试验设计
试验于2013—2014年在湖北省武穴市梅川镇(30°06′47″ N,115°35′35″ E)进行,供试田块前茬为水稻,基础土壤(0—20 cm土层)理化性质:有机质29.69 g·kg-1、全氮1.69 g·kg-1、速效磷8.10 mg·kg-1、速效钾47.21 mg·kg-1,pH 5.60。试验品种为华油杂9号,育苗移栽(9月27日育苗,10月31日移栽),移栽密度为1.125×105株/hm2。
施氮水平设4个处理,分别为0、45、180和360 kg·hm-2,分别用N0、N45、N180和N360表示;各处理的其他养分施用量相同,分别为磷(P2O5)90 kg·hm-2、钾(K2O)120 kg·hm-2、硼砂15 kg·hm-2。氮肥(尿素)60%作基肥(移栽前施用),越冬期和抽薹前期分别追施20%。磷肥(过磷酸钙)、钾肥(氯化钾)和硼肥(硼砂)全部作基肥施用。每个处理3次重复,随机区组排列,小区面积20 m2。
叶位选择:于苗期(2月20日)选取N0和N180处理植株(不施氮和施氮处理绿叶数分别为12—14和18—20片)将叶片从上而下以绿叶数平均分为上部(upper)、中部(middle)和下部(lower)等三组,并选取每组中间一片叶作为本叶位的代表叶片(图1)用于各项光合、生理指标的测定[12-13]。
1.2测定项目与方法
1.2.1光合指标测定每小区选取长势均匀的油菜3株,于9:00—15:30,采用Li-6400XT便携式光合测定仪(LI-COR,USA)测定不同叶位代表叶片的最大净光合速率(Pnmax, µmol·m-2·s-1)。测定时设置光强1 200 µmol·m-2·s-1(饱和光强),叶室温度25℃,CO2浓度为400 µmol·mol-1。
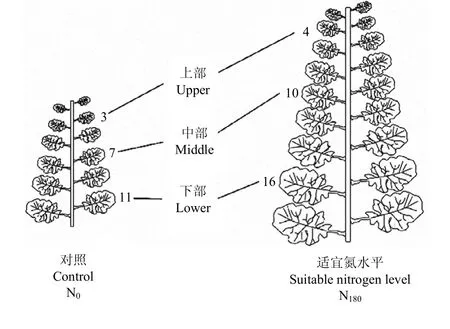
图1 叶位选择示意图Fig. 1 Schematic diagram of leaf position selection
CO2响应曲线测定:控制光强和叶室温度条件不变,用CO2注入系统控制CO2浓度依次为400、300、200、150、100、50、400、400、600、800、1 000、1 200和1 500 µmol·mol-1。测得各点的净光合速率(Pn)和胞间CO2浓度(Ci)值,绘制Pn-Ci曲线。根据FARQUHAR等[14]的生化模型计算Rubisco最大羧化效率(Vcmax)、最大电子传递速率(Jmax)。
1.2.2生理特性测定光合性状测定结束后,将测定叶片以及剩余植株取回,利用数码相机拍照获取叶面积。然后用内径为6 mm打孔器于叶片中上部(即光合指标测定部位)避开叶脉以及边缘区域取两份各15个圆片并称重,分别用于测定叶绿素含量和可溶性蛋白氮含量。取样后的叶片去除主脉并称重,然后与剩余植株分别置于105℃下杀青30 min,60℃恒温烘干、称重。最后磨细过0.5 mm筛,测定全氮含量。
叶面积测定:将叶片置于A3纸上并加5 cm×5 cm绿色纸板作对照,利用数码相机拍照,通过imagepro plus 6.0软件计算叶片叶面积。
叶绿素(Cc)含量的测定:以95%乙醇定容至50 mL,浸泡48 h。分别在665和649 nm测定吸光值,计算叶绿素含量(mmol·m-2)。
可溶性蛋白氮素(主要指以球蛋白和清蛋白为主的酶类所含氮素,以NS表示)含量测定[15]:将样品置于瓷研钵中,加少量10%的氯化钠溶液,研磨至匀浆,2 500 r/min离心3—5 min,取上清液,重复操作3次后往上清液中加入冰醋酸,水浴上加热5—10 min,无灰滤纸过滤,1%醋酸冲洗4次,将沉淀和滤纸一起烘干,将烘干后的沉淀和滤纸一起用凯氏定氮法测定N含量,空白用同样滤纸作对照。
全氮含量测定:采用H2SO4-H2O2消化,并运用流动分析仪(AA3,GER)测定样品的氮素含量。
非可溶性蛋白氮素(主要指形成胞壁及与脂类结合的蛋白质、维生素等大分子功能性物质所含氮素,以Nnon-S表示)含量:为样品的全氮含量减去可溶性蛋白氮素含量[3]。
1.2.3叶片光合组织系统中氮分配计算参考NIINEMETS等[16]研究方法,将叶片光合组织系统按功能划分为羧化系统(主要为Rubisco)、生物力能学组分(即光合电子传递和光合磷酸化组分)和捕光系统(即PSⅠ、PSⅡ和LHCⅡ等捕光色素蛋白复合体),其氮素分配比例计算公式如下:

式(1)中,Vcr是Rubisco比活,即单位Rubisco蛋白的CO2固定活性,值为20.8 μmol CO2·g-1Rubisco·s-1,NA为单位面积叶氮含量,6.25为氮转换成蛋白的系数;式(2)中,Jmc为单位细胞色素f(Cyt f)的最大电子传递速率,值为155.6 μmol electrons·μmol-1Cyt f·s-1,8.06为生物力能转换载体每克氮所含µmol Cyt f数;式(3)中,Cc为叶片叶绿素含量(mmol·m-2),CB为结合PSⅠ、PSⅡ、LHCⅡ中的叶绿素,值为2.15 mmol·g-1N[6,16-17]。
光合组织系统的氮分配比例(Pphoto)为PC、PB和PL三者之和。叶片中氮素含量在羧化系统中的分配数量(NC)、生物力能学组分中的分配数量(NB)、捕光系统中的分配数量(NL)以及光合系统中的分配数量(Nphoto),分别为NA与对应分配比例的乘积。由于羧化系统(Rubisco)主要分布在叶绿体基质中,将其归为NS,剩余NS以Other NS表示;而捕光系统和生物力能学组分所含蛋白均存在与叶绿体的类囊体膜上,将其归为非可溶性蛋白氮Nnon-S,剩余Nnon-S以Other Nnon-S表示[3,18]。
1.2.4边界线分析法SCHNUG等[19]和WAIREGI等[20]提出了边界线分析法(boundary line approach),对总体有影响的各因素的贡献率进行分析。通过对总体有影响的各因素(x1, x2, …, xn)的上边界点拟合,得到该因素条件下的边界线方程。然后根据方程计算各因素条件下能达到的边界线值Yxn,依据最小因子定律Ymin= Min(Yx1, Yx2,…, Yxn)确定不同条件下的限制因子,并计算该因素对总体影响的比率,其公式为gap = (Yatt-Yxn)/Yatt×100%,Yatt为此因素下能达到的最大值。
1.2.5产量测定成熟期各处理小区选10 m2(2.0 m ×5.0 m)收获测定产量。
1.3数据处理与分析
光合氮利用效率(photosynthetic nitrogen use efficiency,PNUE):最大净光合速率(Pnmax)与叶片单位面积氮含量(NA)的比值[21]。
所有数据均由Excel 2013和SPSS 13.0分析处理,采用LSD法检验差异显著性(P<0.05),利用Origin 8.0 软件进行制图。
2 结果
2.1不同氮肥处理对冬油菜籽粒产量和苗期干物质积累的影响
从图2可以看出,施氮对冬油菜增产效果显著,N45、N180和N360较N0增产幅度分别达170.0%、505.6%和604.1%,其中,N180与N360产量差异不显著。表明在一定施氮范围内,可以显著提高冬油菜的产量,但过量施氮对产量的贡献不大。苗期干物质量对氮肥的响应与产量的变化一致,表明冬油菜前期的干物质积累与产量密切相关。
2.2适宜氮水平下冬油菜不同叶位叶片生理特征
表1结果显示,适宜氮水平(N180)显著增加冬油菜单株叶片数、总叶面积和总叶干重,较对照处理(N0)分别提高44.4%、507.1%和535.4%;同时也显著增加各叶位的单叶叶面积和单叶干重,尤其以下部叶片提升较为明显,平均增加幅度分别达450.7%和490.0%。
2.3适宜氮水平下冬油菜不同叶位叶片光合生理特性
表2结果显示,与N0处理相比,N180处理不同叶位的叶片叶氮含量(NA)、叶绿素含量(Cc)和最大净光合速率(Pnmax)均显著升高,平均升高幅度分别达到74.9%、32.2%和35.6%;N180处理上部和中部叶片光合氮素利用效率(PNUE)有所下降。PNUE在不同施氮处理间表现出明显差异,N0处理表现为中部叶显著高于上部、下部叶片,N180处理表现出至上而下逐渐升高的现象。
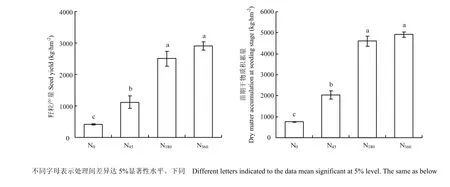
图2 不同氮肥处理冬油菜籽粒产量和苗期干物质积累Fig. 2 Seed yield at harvest and dry matter accumulation at seedling stage under different N treatments
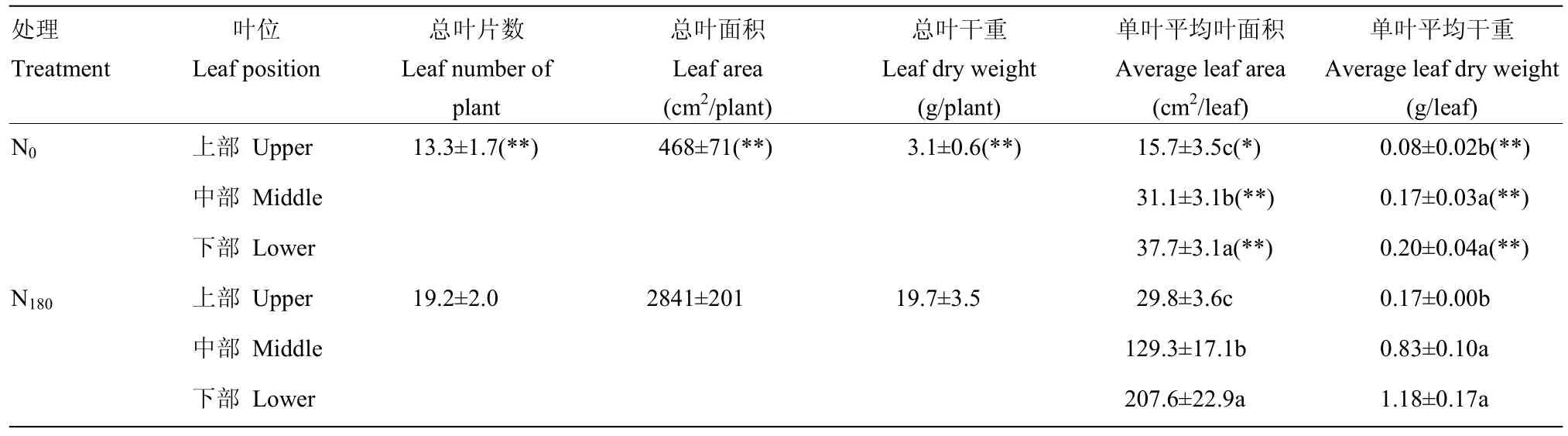
表1 适宜氮水平下冬油菜不同叶位叶片生理特征Table 1 Physiological characteristics of leaves at different positions of winter oilseed rape at suitable nitrogen level

表2 适宜氮水平下冬油菜不同叶位叶片光合生理特性Table 2 Photosynthetic physiological characteristicsof leaves at different positions of winter oilseed rape at suitable nitrogen level
2.4适宜氮水平下冬油菜不同叶位叶片中氮分配特征
2.4.1叶片光合组织系统氮分配从图3可以看出,N180处理的上部、中部叶片的氮素在光合组织系统羧化系统(PC)、生物力能学组分(PB)及捕光系统(PL)中的分配比例低于N0处理,但其分配数量却显著高于N0处理,各组分平均增加幅度分别达到20.6%、11.8%和28.8%;下部叶各组分氮素分配比例在2个处理间无明显差异。表明氮缺乏情况下植株将有限的氮尽可能地向光合组织系统中分配。
不同叶位叶片光合组织系统内部各组分的氮分配比例对氮素营养供应的响应也存在明显差异。N0处理各叶位在光合组织系统内部的氮分配比例均表现为上部、中部>下部,其中,上部叶的光合系统氮分配比例(Pphoto)较下部叶片高出50.4%;而N180处理各部位无明显差异。这说明氮胁迫使得下部叶片氮素更早的发生降解,而施氮能维持光合蛋白分配比例。
2.4.2叶片光合组织系统与非光合组织氮分配图3结果显示,N180处理在光合组织系统中的氮素(Nphoto)在各叶位的平均含量为1.11 g·m-2,较N0处理升高幅度达到31.1%;NS和Nnon-S含量亦都显著高于N0处理。结合分配比例结果显示,施氮与否对相同叶位叶片NS与Nnon-S之间的比例影响不大,但显著影响光合组分在NS和Nnon-S中的分配。其中,N0处理各部叶片NC占NS的比例平均为83.4%,N180处理比例为60.3%。表明不同光合蛋白仅在各自蛋白类型范围内调节。
无论施氮与否,不同叶位叶片的NS含量及比例呈现从上至下逐渐降低,而Nnon-S所占比例却呈现出从上至下逐渐升高的现象。此外,上部叶的NC占NS的比例平均仅为55.1%,而下部叶达95.5%。表明下部叶片衰老过程中光合蛋白的氮素降解转运较迟。
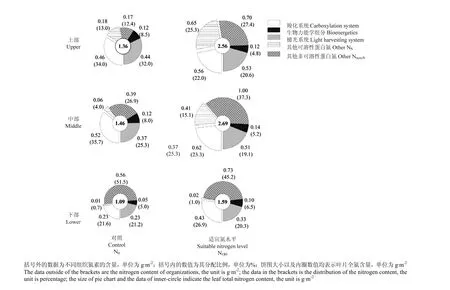
图3 适宜氮水平下冬油菜不同叶位叶片中氮分配Fig. 3 Nitrogen allocation in leaves at different positions of winter oilseed rape at suitable nitrogen level
2.5基于边界线分析法分析冬油菜叶片光合组织系统氮分配对光合氮素利用效率的影响
边界回归方程结果显示,PNUE的增益均随各光合组织系统氮分配比例的升高而逐渐下降(图4-a—图4-c)。进一步分析各光合组织系统氮分配对PNUE的影响大小,结果表明,羧化系统和生物力能学组分氮分配对PNUE的平均影响大小分别为26.8%和42.6%,显著高于捕光系统氮分配的影响(图4-d)。
图5结果显示,氮素营养对PNUE的影响以羧化系统和生物力能学组分分配为主导,平均所占比例达77.8%。施氮后,受生物力能学组分分配限制比例有所降低,降低幅度为33.3%;相应在羧化系统分配限制比例有所升高,升高幅度为25.0%。不同叶位叶片PNUE限制因子分析结果表明,上部叶片PNUE主要受羧化系统分配限制,所占比例达到83.3%;中部叶片PNUE主要受羧化系统和生物力能学组分分配限制;而下部叶片PNUE转变为受捕光系统和生物力能学组分分配限制。
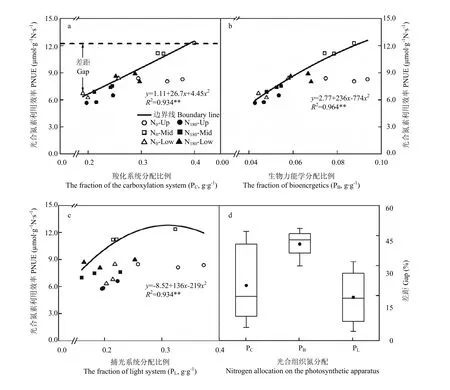
图4 基于边界线分析法分析光合组织系统氮分配对冬油菜叶片光合氮利用效率影响Fig. 4 Based on boundary line approach to quantify the influence of each component of the photosynthetic tissue system on PNUE
3 讨论
3.1适宜施氮对不同叶位叶片光合氮素利用的影响
适宜施氮不仅能提高叶片光合色素含量,而且能延缓其降解[22-23]。本研究中适宜施氮显著提高了不同叶位叶片的叶绿素含量,尤其是下部叶片达到极显著差异。植物叶片中大约75%的氮都存在于叶绿体中,而叶绿体中绝大多数的氮又存在于光合组织系统中,直接用于光合作用过程[24]。本研究结果显示各处理整个光合组织系统在叶片中的氮分配处于47.3%—74.6%,与FENG等[10-11]研究结果范围接近。对羧化系统氮分配而言,MAKINO等[25]和SUDO等[26]研究结果显示Rubisco在叶氮的分配比例随叶片氮含量升高而升高,而SUZUKI等[27]研究结果表示其比例与氮素营养之间并没有显著差异。本研究结果显示施氮后其比例尤其是上、中部叶片显著下降,因为模型得到结果为叶片中有活性的Rubisco比例,而高氮叶片下增加的Rubisco更多的作为氮库形式存在,并没有催化能力[28]。而适宜氮水平下作为氮库存在的光合氮素优先降解,维持有活性的光合氮素比例。与LI等[8]和SUZUKI等[27]的研究结果类似,Rubisco的分配比例在低氮情况下亦自上而下逐渐下降,说明氮胁迫情况下下部叶片光合蛋白降解较早。
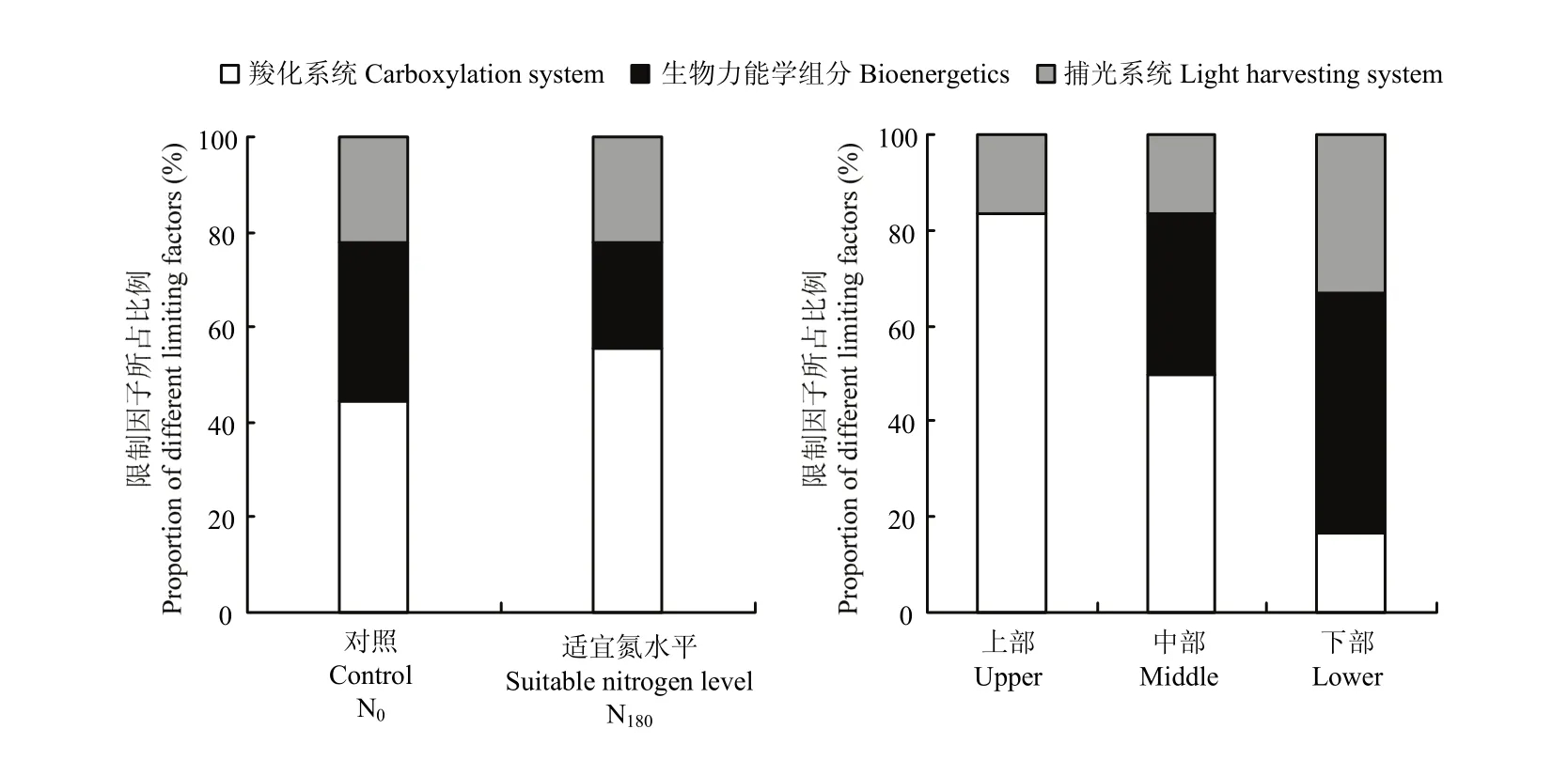
图5 不同氮素营养及叶位下光合氮素利用效率限制因子分析Fig. 5 Analysis of limiting factors on photosynthetic nitrogen use efficiency under different nitrogen nutritions and leaf positions
3.2光合蛋白在叶片中的分配及调节
SUZUKI等[27,29]通过基因手段得到Rubisco的正/反义表达植株,对其结果进一步分析发现可溶性蛋白总量均与野生型无显著差异,但Rubisco分配比例出现显著差异,特别是反义植株叶片中分配比例仅为野生型的50%左右,相反其在剩余可溶性蛋白显著高于野生型。本研究中也发现虽然光合组分在NS和Nnon-S中的分配出现差异,但施氮与否对相同叶位叶片NS与Nnon-S之间的比例影响不大。由此说明氮素营养对光合蛋白调节确是受限于其蛋白类型,仅在各自蛋白类型范围内调节。
3.3光合组织系统氮分配计算的限制
叶片在光合组织系统(羧化系统、生物力能学组分和捕光系统)的氮分配模型是NIINEMETS等[16]根据FARQUHAR等[14]提出的CO2光合同化的生化模型基础上发展而来。其理论依据为饱和光照下,低CO2供应时光合速率主要受Rubisco活性的限制;当CO2浓度升高到一定程度时,Rubisco逐渐趋向被CO2饱和,此时的光合速率主要受体内二磷酸核酮糖(RuBP)再生速率的限制[30]。由此,基于Pn-Ci曲线拟合得到Rubisco最大羧化速率(Vcmax)和最大电子传递速率(Jmax),进而根据单位Rubisco的CO2固定活性(Vcr)和单位Cyt f的最大电子传递速率(Jmc)计算光合组织系统氮分配。本研究中下部叶片在羧化系统的氮分配比例达到95.5%,有的甚至超过可溶性蛋白氮含量,说明基于模型计算光合组织系统氮分配(特别是下部叶片)可能存在一定的高估。SUZUKI等[27]对3种不同类型水稻的研究发现,各品种不同叶位叶片单位Rubisco的CO2固定活性并没有显著差异,这说明可能是下部叶片的Vcmax测定值偏高,有可能是下部叶片饱和光强设置偏高造成。尽管如此,对不同叶位间叶片的光合氮分配趋势并不会造成严重影响,这在以后研究中需要对不同叶位叶片饱和光强进行测定。
4 结论
4.1施氮对冬油菜增产效果显著,促进苗期地上部干物质积累,施氮量为180 kg·hm-2时较为适宜。
4.2适量施氮显著提高各叶位叶片的光合性能,尤其是延缓了下部叶片的衰老。缺氮条件下植株将有限的氮尽可能的向光合组织系统中分配,并且下部叶片的光合氮素降解较早;而适宜氮水平下能维持不同叶位叶片的光合蛋白在各自蛋白类型内的分配比例。
4.3氮素营养限制光合氮素利用效率提高的主要因子是羧化系统和生物力能学组分氮分配;随着叶位的降低光合氮素利用效率的主要限制因子由羧化系统氮分配逐渐转变为捕光系统及生物力能学组分氮分配。
References
[1] 米国华, 陈范骏, 张福锁. 作物养分高效的生理基础与遗传改良.北京: 中国农业大学出版社, 2012: 38-42.
MI G H, CHEN F J, ZHANG F S. Physiological Basis and Genetic Improvement of Nutrient Use Efficiency in Crops. Beijing: China Agricultural University Press, 2012: 38-42. (in Chinese)
[2] ZHU X G, DE STURLER E, LONG S P. Optimizing the distribution of resources between enzymes of carbon metabolism can dramatically increase photosynthetic rate: A numerical simulation using an evolutionary algorithm. Plant Physiology, 2007, 145: 513-526.
[3] MAKINO A, SAKUMA H, SUDO E, MAE T. Differences between maize and rice in N-use efficiency for photosynthesis and protein allocation. Plant and Cell Physiology, 2003, 44(9): 952-956.
[4] ONODA Y, HIKOSAKA K, HIROSE T. Allocation of nitrogen to cell walls decreases photosynthetic nitrogen-use efficiency. Functional Ecology, 2004, 18: 419-425.
[5] HIKOSAKA K, SHIGENO A. The role of Rubisco and cell walls in the interspecific variation in photosynthetic capacity. Oecologia, 2009,160: 443-451.
[6] TROUWBORST G, HOGEWONING S W, HARBINSON J, VAN IEPEREN W. Photosynthetic acclimation in relation to nitrogen allocation in cucumber leaves in response to changes in irradiance. Physiologia Plantarum, 2011, 142: 157-169.
[7] XU C, FISHER R, WULLSCHLEGER S D, WILSON C J, CAI M,MCDOWELL N G. Toward a mechanistic modeling of nitrogen limitation on vegetation dynamics. PloS One, 2012, 7(5): e37914.
[8] LI D, TIAN M, CAI J, JIANG D, CAO W, DAI T. Effects of low nitrogen supply on relationships between photosynthesis and nitrogen status at different leaf position in wheat seedlings. Plant Growth Regulation, 2013, 70(3): 257-263.
[9] KICHEY T, HEUMEZ E, POCHOLLE D, PAGEAU K, VANACKER H, DUBOIS F, LE GOUIS J, HIREL B. Combined agronomic and physiological aspects of nitrogen management in wheat highlight a central role for glutamine synthetase. New Phytologist, 2006, 169(2): 265-278.
[10] FENG Y L. Nitrogen allocation and partitioning in invasive and native Eupatorium species. Physiologia Plantarum, 2008, 132: 350-358.
[11] FENG Y L, FU G L, ZHENG Y L. Specific leaf area relates to the differences in leaf construction cost, photosynthesis, nitrogen allocation, and use efficiencies between invasive and noninvasive alien congeners. Planta, 2008, 228: 383-390.
[12] 余克强, 赵艳茹, 李晓丽, 丁希斌, 庄载椿, 何勇. 高光谱成像技术的不同叶位尖椒叶片氮素分布可视化研究. 光谱学与光谱分析,2015, 3: 42.
YU K Q, ZHAO Y R, LI X L, DING X B, ZHUANG Z C, HE Y. Application of hyperspectral imaging for visualization of nitrogen content in pepper leaf with different positions. Spectroscopy and Spectral Analysis, 2015, 3: 42. (in Chinese)
[13] TROUWBORST G, OOSTERKAMP J, HOGEWONING S W,HARBINSON J, VAN IEPEREN W. The responses of light interception,photosynthesis and fruit yield of cucumber to LED- lighting within the canopy. Physiologia Plantarum, 2010, 138(3): 289-300.
[14] FARQUHAR G D, VON C S, BERRY J A. A biochemical model of photosynthetic CO2assimilation in leaves of C3species. Planta, 1980,149: 178-190.
[15] 波钦诺克. 植物生物化学分析方法. 荆家海, 丁钟荣, 译. 北京:科学出版社, 1981: 91-93.
ПОЦИНОК X H. Analysis Method for Plant Biochemistry. JING J H,DING Z R, trans. Beijing: Science Press, 1981: 91-93. (in Chinese)
[16] NIINEMETS U, TENHUNEN J D. A model separating leaf structural and physiological effects on carbon gain along light gradients for the shade-tolerant species Acer saccharum. Plant Cell Environment, 1997,20: 845-866.
[17] NIINEMETS U, KULL O, TENHUNEN J D. An analysis of light effects on foliar morphology, physiology, and light interception in temperate deciduous woody species of contrasting shade tolerance. Tree Physiology, 1998, 18: 681-696.
[18] 许大全. 光合作用学. 北京: 科学出版社, 2013: 256-258.
XU D Q. The Science of Photosynthesis. Beijing: Science Press, 2013: 256-258. (in Chinese)
[19] SCHNUG E, HEYM J, ACHWAN F. Establishing critical values for soil and plant analysis by means of the boundary line development system (BOLIDES). Communications in Soil Science & Plant Analysis, 1996, 27(13/14): 2739-2748.
[20] WAIREGI L W, VAN ASTEN P J, TENYWA M M, BEKUNDA M A. Abiotic constraints override biotic constraints in East African highland banana systems. Field Crops Research, 2010, 117(1): 146-153.
[21] POORTER H, EVANS J R. Photosynthetic nitrogen-use efficiency of species that differ inherently in specific leaf area. Oecologia, 1998,116(1/2): 26-37.
[22] 云菲, 刘国顺, 史宏志, 宋晶. 光氮互作对烤烟光合作用及叶绿素荧光特性的影响. 中国农业科学, 2010, 43(5): 932-941.
YUN F, LIU G S, SHI H Z, SONG J. Effects of light and nitrogen interaction on photosynthesis and chlorophyll fluorescence characteristics in flue-cured tobacco. Scientia Agricultura Sinica, 2010, 43(5): 932-941. (in Chinese)
[23] CHIBA A, ISHIDA H, NISHIZAWA N K, MAKINO A, MAE T. Exclusion of ribulose-1, 5-bisphosphate carboxylase/oxygenase fromchloroplasts by specific bodies in naturally senescing leaves of wheat. Plant and Cell Physiology, 2003, 44(9): 914-921.
[24] EVANS J R. Photosynthesis and nitrogen relationships in leaves of C3plants. Oecologia, 1989, 78(1): 9-19.
[25] MAKINO A, SAKASHITA H, HIDEMA J, MAE T, OJIMA K,OSMOND B. Distinctive responses of ribulose-1, 5-bisphosphate carboxylase and carbonic anhydrase in wheat leaves to nitrogen nutrition and their possible relationships to CO2-transfer resistance. Plant Physiology, 1992, 100(4): 1737-1743.
[26] SUDO E, SUZUKI Y, MAKINO A. Whole-plant growth and N utilization in transgenic rice plants with increased or decreased Rubisco content under different CO2partial pressures. Plant and Cell Physiology, 2014: 55(11): 1905-1911.
[27] SUZUKI Y, MIYAMOTO T, YOSHIZAWA R, MAE T, MAKINO A. Rubisco content and photosynthesis of leaves at different positions in transgenic rice with an overexpression of RBCS. Plant, Cell & Environment, 2009, 32(4): 417-427.
[28] WARREN C R, DREYER E, ADAMS M A. Photosynthesis-Rubisco relationships in foliage of Pinus sylvestris in response to nitrogen supply and the proposed role of Rubisco and amino acids as nitrogen stores. Tree, 2003, 17: 359-366.
[29] SUZUKI Y, OHKUBO M, HATAKEYAMA H, OHASHI K,YOSHIZAWA R, KOJIMA S, HAYAKAWA T, YAMAYA T, MAE T,MAKINO A. Increased Rubisco content in transgenic rice transformed with the ‘sense' rbcS gene. Plant and Cell Physiology, 2007, 48(4): 626-637.
[30] LONG S P, BERNACCHI C J. Gas exchange measurements, what can they tell us about the underlying limitations to photosynthesis?Procedures and sources of error. Journal of Experimental Botany,2003, 54(392): 2393-2401.
(责任编辑杨鑫浩,李莉)
Characteristics of Photosynthetic Nitrogen Allocation in Leaves of Different Positions in Winter Oilseed Rape at Seedling Stage Under Suitable Nitrogen Level
LIU Tao1, LU Jian-wei1, REN Tao1, WANG Wei1, WANG Zhen2, WANG Shao-hua2
(1College of Resources and Environment, Huazhong Agricultural University/Key Laboratory of Arable Land Conservation(Middle and Lower Reaches of Yangtse River), Ministry of Agriculture, Wuhan 430070;2Wuxue Bureau of Agriculture,Wuxue 435400, Hubei)
【Objective】 This study was carried out to investigate the effects of nitrogen allocation on the photosyntheticapparatus of leaves at different positions in winter oilseed rape under suitable nitrogen level at seedling stage and to analyze the limiting factors that affect the photosynthetic nitrogen use efficiency by nitrogen nutrition, and provide a theoretical basis for the reasonable application of nitrogen fertilizer.【Method】A field experiment was carried out with designed four nitrogen levels (0, 45,180, 360 kg·hm-2, marked as N0, N45, N180and N360, respectively). The dry matter at seedling stage and seed yield were determined. Then the N0and N180treatments were selected, the plant leaves were equally divided into 3 groups (upper, middle and lower) by leaf number from top to bottom. Some physiology and photosynthetic parameters (e.g., net photosynthetic rate (Pnmax), nitrogen content(NA), chlorophyll content (Cc) and soluble protein nitrogen content (NS)) tested on leaves at different positions were measured to calculate nitrogen allocation in the photosynthetic apparatus (carboxylation, bioenergetics and light-harvesting components).【Result】 Seed yield was increased significantly by nitrogen fertilization, compared with N0treatment, N45, N180and N360were increased by 170%, 505.6% and 604.1%, respectively and the dry matter accumulation was consistent with the yield. Compared with N0treatment, NA, Cc and Pnmaxwere significantly increased in different leaf positions by nitrogen fertilization, but photosynthetic nitrogen use efficiency (PNUE) has significantly declined in the upper and middle leaves. For nitrogen allocation on the photosynthetic apparatus, the proportion of the carboxylation (PC), bioenergetics (PB) and light harvesting system (PL) in the upper and middle leaves of N180treatment were lower than that of N0treatment, but the nitrogen contents of those components were higher than that of N0treatment and the increasing extent of the components were 20.6%, 11.8% and 28.8%, respectively. The ratio between soluble protein nitrogen content (NS) and non-soluble protein nitrogen content (Nnon-S) was not significantly influenced by whether nitrogen fertilization or not in the same position leaves, but the photosynthetic component partitioning in NSor Nnon-Swas significantly influenced, which the ratio of nitrogen content of the carboxylation (NC) to NSwas an average of 83.4% in all leaves in N0treatment, while that of the N180treatment was only 60.3%. Based on boundary line approach to quantify the influence of each component of the photosynthetic apparatus for PNUE, the results indicated that the influence degrees of PCand PBwere 26.8% and 42.6%, significantly higher than that of PL. The influence of nitrogen nutrition on PNUE was dominated by PCand PB, which the average proportion reached 77.8%. PCwas the main limiting factor of PNUE in upper leaves, which the influence degree reached 83.3%, while dominated by PBand PLin the lower leaves.【Conclusion】 Nitrogen fertilizer had a significant effect on increasing yield of winter rape and the optimum nitrogen application rate was 180 kg·hm-2. More nitrogen was allocated to photosynthetic apparatus by plant, and the photosynthetic nitrogen can be degraded earlier in the lower leaves under nitrogen deficiency. Suitable nitrogen level can maintain the distribution of the photosynthetic proteins within the types of their proteins. The effect of nitrogen nutrition on photosynthetic nitrogen use efficiency is dominated by allocation of nitrogen to the carboxylation and bioenergetics. The dominant effect by the distribution of the carboxylation was transformed to the dominant effect by the distribution of the light harvesting system and bioenergetics along with the decline of leaf position.
winter oilseed rape; nitrogen; leaf position; nitrogen allocation; photosynthetic nitrogen use efficiency
2016-01-13;接受日期:2016-04-18
国家自然科学基金(31471941)、国家油菜产业技术体系建设专项(CARS-13)
联系方式:刘涛,E-mail:liutao3@webmail.hzau.edu.cn。通信作者任涛,E-mail:rentao@mail.hzau.edu.cn

