绵羊肺炎支原体的培养和PC R鉴定
侯宏艳,惠文巧,张丹俊,胡晓苗,赵瑞宏
(安徽省农业科学院畜牧兽医研究所,安徽 合肥 230031)
绵羊肺炎支原体的培养和PC R鉴定
侯宏艳,惠文巧,张丹俊,胡晓苗,赵瑞宏
(安徽省农业科学院畜牧兽医研究所,安徽 合肥 230031)
安徽省3个山羊场有羊只发生肺炎症状,用支原体培养基对病料进行病原分离,经传代和纯化后分离到3株支原体,随后对分离到的支原体进行了形态学观察、PCR鉴定和序列比对,结果显示分离到的支原体均为绵羊肺炎支原体。
山羊;绵羊肺炎支原体;培养;鉴定
绵羊肺炎支原体可引起绵羊和山羊发生以患羊被毛粗乱,食欲减少,体温升高,咳嗽、喘气和间质增生性肺炎为特征的慢性呼吸道传染病。成年羊有一定的抵抗力,羔羊发病率和死亡率较高,呈现地方性流行。绵羊肺炎支原体(Mycoplasma ovipneumoniae,MO)已在世界许多国家和地区流行。研究表明,在我国引起山羊和绵羊发生羊支原体性肺炎的主要病原是MO,如冷清文等[1]在新疆地区患呼吸道疾病的盘羊中分离到MO,杨发龙等[2]在四川地区患胸膜肺炎的山羊群中分离鉴定出MO,此外,还有马玉等[3]、张轩等[4]、付琦等[5]和侯宏艳等[6]在不同地区分离鉴定出MO。
安徽省作为我国的养羊省份之一,近年来养羊业发展迅速,羊支原体性肺炎是影响养羊业健康发展的重要疾病之一。笔者对引起安徽省3个山羊场发生肺炎的病原进行分离培养和PCR鉴定,以期为更清楚地了解该类疾病的发病原因,提供更有效的防控措施提供科学依据。
1 材料与方法
1.1 培养基 病原分离的培养基为改良KM2培养基,参照储岳峰[7]报道的方法进行配制。
1.2 病料 安徽省某3个羊场发病羊只的肺组织。
1.3 病原分离 取肺组织样品剪碎并用液体培养基进行匀浆,随后进行10倍梯度稀释至10-3,37℃恒温培养5~7 d后进行传代,直至培养物颜色变黄。当培养基由红色变为黄色时,取液体培养物接种于固体培养基进行观察,置于湿盒中37℃培养,生长4~5 d后,挑取单个特征明显的菌落接种于液体培养基继续培养,待培养基颜色变黄后再次接种固体培养基。重复2~3次,得到分离纯化的培养物。
1.4 病原鉴定
1.4.1 形态学观察:将纯化的液体培养物涂片,革兰染色,用油镜观察菌体形态。将培养4~5 d的纯化的固体培养物置于低倍镜下观察菌落形态。
1.4.2 PCR 鉴定:根据参考文献[8]和[9]报道的MO和丝状支原体族的特异性引物合成PCR用引物。MO的上游和下游引物为5′-GACTTCATCCTGCACTCTGT-3′和 5′-TGAACGGAATATGTTAGCTT-3′,丝状支原体族的上游和下游引物为5′-CGAAAGCGGCTTACTGGCTTGTT-3′和 5′-TTGAGATTAGCTCCCCTTCACAG-3′。使用北京天根生化科技有限公司的细菌基因组DNA抽提试剂盒提纯培养物基因组DNA,对分离到的病原进行PCR 鉴定。 反应体系为:2×Taqmix 12.5 μL,ddH2O 8.5 μL,上下游引物各 1 μL,模板 3 μL。 反应条件为:95℃ 4 min;95℃ 30 s,55℃(扩增丝状支原体簇为 62℃)40 s,72℃ 45 s,34个循环;72℃延伸10 min,PCR产物进行1%琼脂糖凝胶电泳,预期扩增片段长度为361 bp(丝状支原体簇的扩增片段长度为548 bp)。
1.4.3 序列比对:将PCR产物进行克隆测序,并将测序结果与绵羊肺炎支原体标准株Y-98用MegAlign软件进行比对。
2 结果与分析
2.1 分离与纯化 病料在液体培养基中传代培养后,培养基颜色由红变黄,培养基除了有组织块外,整体呈透明状。在固体培养基上培养2 d后出现透明的小菌落,大小不一,低倍光学显微镜下可看到菌落呈圆形、突起(见图1)。

图1 分离物的纯化菌落形态(100×)
2.2 革兰染色 革兰染色镜检可见有多形态的菌体,颜色为红色,多为小球状。
2.3 PCR鉴定 对纯化的MO菌株提取DNA后,利用MO特异性引物进行PCR扩增,得到与预期大小相符的361 bp的片段 (见图2)。经MegAlign软件比较,3株分离株的序列与绵羊肺炎支原体标准株Y-98序列的相似性为97.8%、98.1%和97.5%。而用丝状支原体簇的特异性引物扩增后,没有得到预期片段。
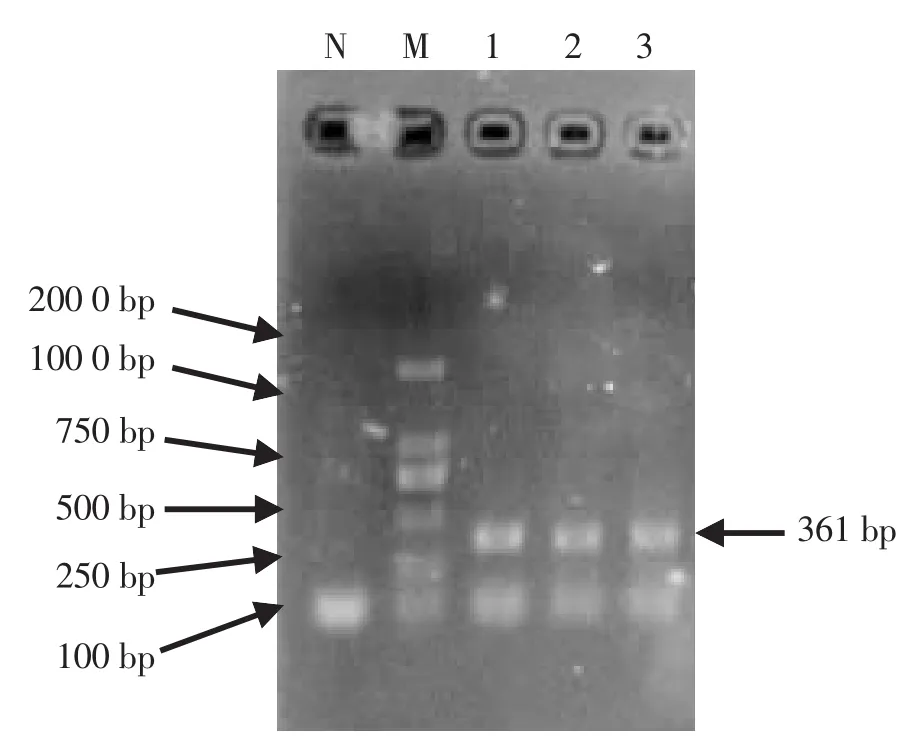
图2 支原体分离株PCR扩增产物电泳结果
3 讨论
MO由 Mackay等[10]于 1963年在苏格兰首次分离。 1972 年,Carmicheal等[11]证明了该种支原体的致病性。Goltz等[12]用人工感染方法进行研究后认为,MO 可引起山羊肺炎。 Rosário 等[13]研究结果也表明,MO在引起山羊肺炎的多种病原中有着重要的作用。羊支原体的培养比较困难,其对营养要求比较高,其中,醋酸铊、青霉素、酚红和血清等都是必须要添加的。储岳峰[7]使用改良KM2培养基和Thiaucourt′s培养基对 MO 进行分离培养,付琦等[5]和冷清文等[1]则使用改良 Hayflick′s培养基。 该研究使用了改良的KM2培养基,成功分离到了3株MO。
该研究从表现肺炎症状的发病山羊肺组织中分离到菌株,经形态学观察、PCR鉴定及序列比对确认为MO,而非丝状支原体感染,说明MO是引起3个羊场发生肺炎的病原。通过序列比对发现,3株MO的序列与标准株序列的相似性分别为97.8%、98.1%和97.5%,它们的致病性是否存在差异,需要进一步研究。
山羊相对绵羊更易发生支原体性肺炎,许多羊场防疫的疫苗为山羊传染性胸膜肺炎氢氧化铝灭活苗,其主要对Mmc起到保护作用,而MO灭活疫苗还没有广泛使用。在支原体性肺炎的高发地区免疫接种MO灭活疫苗是预防该病的有效措施[5]。同时,羊场要重视和严格执行生物安全措施,冬春季节注意羊只保暖,发现流鼻涕、咳嗽等呼吸道疾病症状的羊只,应及时对其进行隔离治疗,特别要对被污染的羊舍、场地、用具和发病死亡羊只的尸体等进行彻底消毒和无害化处理。
[1]冷清文,李志远,鲁海富,等.盘羊体内绵羊肺炎支原体的分离和鉴定 [J]. 中国预防兽医学报,2014,36(3):197-200.
[2]杨发龙,王华,岳华,等.山羊中绵羊肺炎支原体的分离及鉴定[J].中国畜牧兽医,2010,37(8):177-180.
[3]马玉,乔军,孟庆玲,等.绵羊肺炎支原体新疆流行株的分离鉴定及其膜蛋白P80基因序列分析[J].西南农业学报,2015,28(3):1375-1380.
[4]张轩,赵萍,贺英,等.绵羊肺炎支原体的分离鉴定[J].动物医学进展,2013,34(6):193-195.
[5]付琦,赵宝华,朱子杰,等.绵羊肺炎支原体的分离与鉴定[J].华北农学报,2008,23(增刊):289-291.
[6]侯宏艳,惠文巧,张丹俊,等.山羊的绵羊肺炎支原体的分离和鉴定[J].安徽农业科学,2015,43(28):159-160.
[7]储岳峰.我国山羊(接触)传染性胸膜肺炎病原学、流行病学研究及灭活疫苗的研制[D].兰州:中国农业科学院,2011.
[8]McAULIFFE L,HATCHELL F M,AYLING R D,et al.Detection of Mycoplasma ovipneumoniae in Pasteurellavacinnated sheep flocks with respiratory disease in England[J].Vet Rec,2003,153(22):687-688.
[9]BÖLSKE G,MATTSSON J G,BASCUNANA C R,et al.Diagnosis of contagious caprine pleuropneumonia by detection and identification of Mycoplasma capricolum subsp.capripneumoniae by PCR and restriction enzyme analysis[J].J Clin Microbiol,1996,34(4):785-791.
[10]MACKAY J M K,NISBET D I,FOGGIE A.Isolation of pleuropneumonia-like organisms (Genus Mycoplasma)from case of sheep pulmonary adenomatosis(S.P.A)[J].Vet Res,1963,75(21):550-551.
[11]CARMICHEAL L E,GEORGE T D,SULLIVAN N D.Isolation,propagation for proliferative interstitial pneumonia[J].Cornell Vet,1972,62(4):654-679.
[12]GOLTZ J P,ROSENDAL S,McCRAW B M.Experimental studies on the pathogenicity of Mycoplasma ovipneumoniae and Mycoplasma argininifor the respiratory tract of goats [J].Can J Vet Res,1986,50(1):59-67.
[13]ROSÁRIO G,MARIANOB I,ALEJANDRO N,et al.A typical non-progressive pneumonia in goats [J].Vet J,2010,183(2):219-221.
Culture and PCR Identification of Mycoplasma ovipneumoniae
HOU Hong-yan,HUI Wen-qiao,ZHANG Dan-jun,HU Xiao-miao,ZHAO Rui-hong
(Institute of Animal Husbandry and Veterinary Medicine,Anhui Academy of Agricultural Sciences,Hefei230031,China)
Pneumonia symptoms of goats appeared in three goat farms in Anhui Province.The mycoplasma isolate was cultivated and purified from lung tissue sample of goats using mycoplasma medium.The mycoplasma isolate was characterized by morphologic observation,PCR identification and sequence alignment.The results indicate that the mycoplasma isolate belongs to Mycoplasma ovipneumoniae.
goat;Mycoplasma ovipneumoniae;culture;identification
S858.272.62
A文章顺序编号1672-5190(2016)11-0097-02
2016-10-29
项目来源:安徽省农业科学院学科建设项目(16A0413);国家自然科学基金项目(31402048)。
侯宏艳(1975—),女,助理研究员,硕士,主要从事动物病原学研究工作。
张丹俊(1962—),男,研究员,主要从事畜禽传染病学研究工作。
(责任编辑:赵俊利)

