硒对杏鲍菇营养品质和抗氧化酶活性的影响
王明洋,方 勇,裴 斐,夏 季,赵尔敏,汤 静,胡秋辉,,*(.南京农业大学食品科技学院,江苏 南京 0095;.南京财经大学食品科学与工程学院,江苏 南京 0046)
硒对杏鲍菇营养品质和抗氧化酶活性的影响
王明洋1,方 勇2,裴 斐2,夏 季2,赵尔敏2,汤 静1,胡秋辉1,2,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.南京财经大学食品科学与工程学院,江苏 南京 210046)
为了研究硒对杏鲍菇子实体硒含量、营养品质和抗氧化酶活性的影响,通过向培养料中添加Na2SeO3的方式培育富硒杏鲍菇。采用电感耦合等离子体质谱法测定富硒杏鲍菇子实体中的硒含量,分析硒在子实体中的分布情况,并且以普通杏鲍菇为对照,对富硒杏鲍菇的主要营养成分及抗氧化酶活性进行测定。结果表明:杏鲍菇子实体中的硒含量与培养料中硒含量成正相关性,当培养料中硒含量在40~50 mg/kg范围内时,杏鲍菇子实体对硒的生物富集因子最高,达到0.46~0.47,有机化率达到83.00%~84.00%,并且可溶性蛋白质含量和总糖含量与对照组相比分别显著提高了12.02%和25.76%(P<0.05),谷胱甘肽过氧化物酶、超氧化物歧化酶和过氧化氢酶活性显著增强(P<0.05)。杏鲍菇子实体菌盖和菌柄的硒含量并没有显著性差异。本实验研究表明,适宜的施硒量可以提高杏鲍菇子实体中硒含量,有助于改善其营养品质和生理特性。
杏鲍菇;硒;营养品质;抗氧化酶活性
硒是人体必需的一种微量营养元素,在机体中与一些酶相结合,生成有生物特性的大分子化合物,这些化合物能够保护机体免受氧化损害,增强免疫力[1-2]。由于人体无法自身合成硒,所以需要从外界摄取[3]。然而,硒在地壳中分布零散,含量极不均匀,大多数地域土壤属于低硒或缺硒状态,并且土壤中的硒大多以矿物晶格形态存在,难以被作物吸收利用[4-5],这些现状制约着中国居民饮食中硒的摄入。研究证明,缺乏硒易引起克山病、大骨节病等地方病[6],所以在安全和适宜的范围内,科学补硒十分重要。研制富含对人体无毒副作用的有机硒农产品,提高食物链硒水平,从源头调控硒营养是补充人体硒元素的重要途径[7]。
实践证实,食用菌富硒能力较强,菌丝生长过程中吸收培养料中的养分,无机硒进入细胞内,细胞内的物质代谢可以将其结合到大分子活性物质(如多糖和蛋白质)上,转化为多糖硒和蛋白硒等有机形态的硒,提高天然食用菌中的硒含量[8]。杏鲍菇作为食用菌的一种,不仅具备较强的富硒能力,而且营养丰富,杏鲍菇中含有的真菌多糖能增强机体的免疫功能,具有抗病毒、抗疲劳、降低胆固醇含量和防止动脉硬化的作用[9]。此外,杏鲍菇脂肪含量较低,是一种健康食品,适合高血压,高血脂人士食用[10]。
本研究在杏鲍菇培养料中加入Na2SeO3,考察富硒杏鲍菇子实体中硒含量、硒分布及不同施硒量处理对子实体可溶性蛋白质含量、总糖含量、氨基酸含量和抗氧化酶活性的影响,为杏鲍菇的富硒栽培提供理论依据。
1 材料与方法
1.1 材料与试剂
杏鲍菇富硒实验区位于江苏天丰生物科技有限公司。
硒标液(1 000 μg/L) 国家有色金属及电子材料分析测试中心;HNO3(优级纯)、HCl(分析纯,下同)、H2SO4(分析纯) 国药集团化学试剂有限公司;Na2SeO3成都西亚化工股份有限公司;杏鲍菇培养料江苏天丰生物科技有限公司;环己烷(分析纯) 国药集团化学试剂有限公司;磷酸盐缓冲液 北京索莱宝科技有限公司。
1.2 仪器与设备
微波消解系统 美国CEM公司;7700系列电感耦合等离子体质谱(包括自动进样器(I-AS)、微型同心雾化器、Scott双通道雾化室(℃)、屏蔽炬管、7500ce透镜组和八极杆碰撞池反应系统 美国Agilent公司;64R冷冻离心机 美国Beckman公司;HH-6数显恒温水浴锅 常州国华电器有限公司;JH-722s可见分光光度计上海精密科学仪器有限公司。
1.3 方法
1.3.1 富硒杏鲍菇的制备
本实验中采用袋栽方式,所用的培养料为合成培养料,配方由江苏天丰生物科技有限公司提供,具体为:木屑35%~40%、麸皮15%~20%、玉米芯25%~30%、豆粕10%~20%、甘蔗渣 10%~15%。按每个处理组32 袋,每袋1.35 kg培养料计算,每组共需培养料43.2 kg。根据60%含水率换算成每个处理需干料总质量17.28 kg,然后按处理浓度比例喷施预先配制好的Na2SeO3溶液,搅拌均匀,最后将每组栽培料平均分成32 份,分别装入低压聚乙烯袋中,并做好标记,由当地工作人员统一接种和标准化日常管理。实验中普通杏鲍菇作为对照组,栽培料中不加入Na2SeO3。
样品采集与处理:经人工舒蕾,待杏鲍菇成熟后,每袋收集1~2 根杏鲍菇,分别在每组采集并尽量挑选长势相近的杏鲍菇样品,各处理样品分成两部分,新鲜样品用于营养成分和抗氧化酶活性的测定分析,剩余样品分为整菇、菌盖、菌柄部分,分别冻干后,经打粉,用于硒元素的分析测定。
1.3.2 总硒含量的测定
准确称取各组杏鲍菇子实体粉0.300 0 g(精确到0.000 1 g)于微波消解管中,加入8 mL硝酸,放好垫片,旋紧罐盖,放置于CEM消解系统中按表1程序消化。程序结束后,取出消解管,赶酸,定容至50 mL,空白与每组样品皆做3 次平行,配制标准曲线溶液,用电感耦合等离子体质谱仪检测样液中硒的含量。根据公式(1)计算杏鲍菇的生物富集因子(bioconcentration factor,BCF)[11]。


表1 微波消解步骤Table 1 Working conditions for microwave digestion system
1.3.3 无机硒含量的测定
准确称取菌粉0.500 0 g(精确到0.000 1 g)于50 mL离心管中,加入30 mL超纯水,超声波提取20 min,然后80 ℃水浴振荡10 min,冷却后,10 000 r/min离心10 min,移取上清液至分液漏斗,用环己烷反复萃取3 次,分出水相即为无机硒提取液。浓缩无机硒提取液至4~7 mL,转移至消解管中,加入10 mL HNO3,按1.3.2节中的方法测定硒含量。
1.3.4 有机硒含量测定
采用差值法[12],按公式(2)计算有机硒含量,并按公式(3)计算硒的有机化率。

1.3.5 可溶性蛋白质含量测定
采用考马斯亮蓝法[13]测定蛋白质含量,具体方法参照南京建成生物工程研究所相关试剂盒说明书,按公式(4)计算样品中可溶性蛋白质含量。
式中:ρ为待测样品蛋白质质量浓度/(g/L);V为样品体积/mL;m为样品鲜质量/g。
1.3.6 总糖含量测定
采用硫酸苯酚法[13]测定,按公式(5)计算样品中总糖含量。
式中:ρ为待测样品总糖质量浓度/(g/L);V为样品体积/mL;m为样品鲜质量/g;100为样品稀释倍数。1.3.7 氨基酸组成及含量测定
分别准确称取0.100 0 g(精确到0.000 1 g)普通杏鲍菇(Se含量0.02 mg/kg)与富硒杏鲍菇(Se含量23.06 mg/kg),参照盐酸水解法[14],6 mol/L HCl 110 ℃下加热水解23 h,日立L-8900氨基酸自动分析仪测定氨基酸组成。
1.3.8 抗氧化性分析
样品前处理:称取杏鲍菇子实体4.000 0 g(精确到0.000 1 g),按1∶9(m∶V)的比例加36 mL预冷过的0.1 mol/L pH 7.0~7.4磷酸盐缓冲液在冰浴中研磨,最终得10%匀浆液,转移至离心管中,4 ℃、12 000 r/min条件下离心20 min,上清液即为酶液。
1.3.8.1 谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活力的测定
取前处理中得到的10%匀浆液200 μL,按照南京建成生物工程研究所谷胱甘肽过氧化物酶测试盒说明书进行具体操作,于412 nm波长处测定吸光度,并根据说明书中的公式进行计算。
1.3.8.2 超氧化物歧化酶(superoxide dismutase,SOD)活力的测定
取前处理中得到的10%匀浆液50 μL,按照南京建成生物工程研究所超氧化物歧化酶测试盒说明书进行具体操作,于550 nm波长处测定吸光度,并根据说明书中的公式进行计算。
1.3.8.3 过氧化氢酶(hydrogen peroxidase,CAT)活力的测定
将前处理中得到的10%匀浆液稀释至1%,取50 μL,按照南京建成生物工程研究所过氧化氢酶测试盒说明书进行具体操作,于405 nm波长处测定吸光度,并根据说明书中的公式进行计算。
1.3.8.4 丙二醛(malonic dialdehyde,MDA)含量测定
取前处理中得到的10%匀浆液200 μL,按照南京建成生物工程研究所丙二醛测试盒说明书进行具体操作,于532 nm波长处测定吸光度,并根据说明书中的公式进行计算。
1.4 数据统计分析
采用SPSS 19.0软件进行方差分析和Duncan’s多重比较差异显著性检验。
2 结果与分析
2.1 硒对杏鲍菇子实体硒富集的影响
培养料是杏鲍菇生长过程中营养供给的主要来源,菌丝体培养阶段需依靠分解基质中的营养成分得以延续和生长。本研究在培养料中加入Na2SeO3,菌丝细胞通过物质代谢转化,将无机硒转化为有机硒[8]。

图1 不同施硒量下杏鲍菇子实体硒含量和BBCCFFFig. 1 Selenium contents and BCF in fruit bodies of P. eryngii grown inselenium-supplemented substrates at various concentrations
由图1可知,随着施硒量的增加,杏鲍菇子实体中硒含量也随之增加,达到4.08~33.95 mg/kg(干质量,下同),显著高于对照组0.02 mg/kg的硒含量(P<0.05),处理组的硒含量在峰值期比对照组提高了200~1 700倍。培养料中硒含量在10~60 mg/kg范围内,子实体中硒含量(Y)与施硒量(X)成显著正相关,相关方程式为Y=0.453 5X-0.331 3(R2=0.992 7)。BCF可以衡量杏鲍菇的富硒能力[11],当施硒量在40~50 mg/kg范围内,BCF最高,为0.46~0.47。在低施硒量(0~40 mg/kg)条件下,随着施硒量的增加,BCF也逐渐增加。在高施硒量(60~100 mg/kg)条件下,随着施硒量的增加,BCF逐渐下降,由此可推断,高施硒量会降低杏鲍菇对硒的利用率。生产时需根据具体硒含量要求来选择合适的培养料,以达到最佳的富硒效果和最高的硒利用率。
2.2 杏鲍菇子实体菌盖、菌柄硒含量分析
祝传望等[15]研究富硒平菇时发现同一培养料生长的平菇子实体,菌盖对硒的富集能力大于菌柄,平菇具有顶端优势;李华为等[16]在研究富硒金针菇时发现,同一培养料生长的子实体,不同器官含硒量有所不同,菌盖硒含量大于菌柄,表现出明显的顶端优势。与上述研究结果不同,如图2所示,同一处理组内的杏鲍菇菌盖和菌柄中硒含量基本上没有显著性差异。究其原因,可能是因为杏鲍菇菌柄肉质厚实,是主要食用部位,而菌盖占整体比例较小,所以硒在杏鲍菇子实体内各部位的分布情况没有显著差异。

图2 不同施硒量处理下杏鲍菇菌盖、菌柄硒含量Fig. 2 Selenium contents of P. eryngii cups and stalks grown in selenium-supplemented substrates at various concentrations
2.3 不同施硒量对杏鲍菇子实体有机硒含量的影响

图3 不同施硒量处理下杏鲍菇子实体的有机硒含量与有机化率Fig. 3 Organic selenium contents and conversion percentage of organic selenium in fruit bodies of P. eryngii in selenium-supplemented substrates at various concentrations
由图3可知,随着施硒量的增加,杏鲍菇子实体有机硒含量呈先上升后下降趋势。当培养料中硒含量在40~50 mg/kg范围内,有机化率达到最高,约83%~84%,与其他组差异显著(P<0.05)。培养料中硒含量在80~100 mg/kg范围内时,有机化率最低,说明高施硒量处理下,过多的硒进入杏鲍菇子实体内无法与足够的载体相结合,离子化的无机硒化合物游离于细胞质或吸附在细胞膜上,无机硒难以转化为有机硒,造成了无机硒含量多于有机硒含量的现象。
2.4 不同施硒量对杏鲍菇子实体可溶性蛋白质含量和总糖含量的影响

图4 不同施硒量处理下杏鲍菇子实体的可溶性蛋白质含量和总糖含量Fig. 4 Soluble protein contents and total sugars in fruit bodies of P. eryngii in selenium-supplemented substrates at various concentrations
可溶性蛋白质属于植物所有蛋白质组分中最活跃的一部分[13],其含量可以反映植物的营养品质,如图4所示,在低、中施硒量处理下,杏鲍菇子实体的可溶性蛋白质含量呈增加趋势,当施硒量在40~50 mg/kg范围内,可溶性蛋白质含量达到8.70 mg/g左右,与对照组相比含量显著升高12%(P<0.05)。当施硒量达80~100 mg/kg时,可溶性蛋白质含量与对照组相比显著下降(P<0.05)。硒对蛋白质含量影响的机理是硒代蛋氨酸和硒代半胱氨酸取代蛋氨酸和半胱氨酸,结合到蛋白质中。硒原子的大小和离子化性质与硫存在差异,造成蛋白质三级结构发生变化,可能影响了一些重要的蛋白质反应和合成[17]。此外,硒也是谷胱甘肽过氧化物酶、硒蛋白P的组成部分[18]。Xia Yiming等[19-20]研究表明,机体合成硒蛋白P需要摄入比合成正常水平的谷胱甘肽过氧化物酶更多的硒,因此可以推断多余的硒摄入一部分用于硒蛋白的合成,得到低施硒量处理使子实体蛋白质含量升高的结果。但是,随着施硒量的升高,硒促进过氧化产物的生成,植物机体内产生过多的活性氧,活性氧能以多种方式直接或间接地对蛋白质进行攻击从而导致蛋白质的修饰[21],这些作用会使蛋白结构、功能失常和降解。破坏细胞内生物酶系,使得蛋白合成途径受阻,蛋白质水平反而下降。
由图4可知,随着施硒量的升高,杏鲍菇子实体可溶性总糖的含量呈现先上升后下降的趋势,当施硒量为40 mg/kg时,杏鲍菇子实体可溶性总糖含量最高,为532.65 mg/g。施硒量为10~20 mg/kg的杏鲍菇中总糖含量与对照组无显著性差异(P>0.05),施硒量为30~60 mg/kg的杏鲍菇中总糖含量显著高于对照组(P<0.05),当施硒量达到80~100 mg/kg时,总糖含量显著低于对照组(P<0.05)。分析原因,当施硒量较低时,能明显促进杏鲍菇子实体中糖类的合成,刺激子实体自身的生长;而当施硒量较高时,由于硒诱导脂质过氧化反应,产生活性氧自由基,进而破坏生物酶系统,从而抑制了糖类的合成。因此当施硒量在30~60 mg/kg范围内,增加施硒量有利于杏鲍菇子实体中糖类的积累。

表2 普通杏鲍菇与富硒杏鲍菇氨基酸组成和含量Table 2 Amino acid profi le and contents of normal and seleniumenricchheedd P. erynnggiiiimg/g
2.5 富硒杏鲍菇与普通杏鲍菇氨基酸组成与含量的比较
由表2可知,在培养料中加入Na2SeO3后,富硒杏鲍菇(Se含量23.06 mg/kg)与普通杏鲍菇(Se含量0.02 mg/kg)的氨基酸组成基本相似。富硒杏鲍菇中7 种必需氨基酸总量高于普通杏鲍菇,含硫的氨基酸,如半胱氨酸和甲硫氨酸含量与普通杏鲍菇相比有所减少,这一现象与方勇[7]
和余芳[22]等研究结果相似,即硒在提高水稻籽粒和茶叶硒含量的同时,含硫氨基酸有一定程度的减少。因为硒和硫属于同一主族,性质相似,硒通过主动运输进入菌丝细胞内,一般是沿着硫代谢的途径,依靠细胞内的还原力把无机硒盐还原成H-Se-H,取代了植物中含硫氨基酸中的硫,并进一步转化为硒半胱氨酸和硒甲硫氨酸,因此含硫氨基酸含量减少[23]。
2.6 硒对杏鲍菇子实体抗氧化性的影响
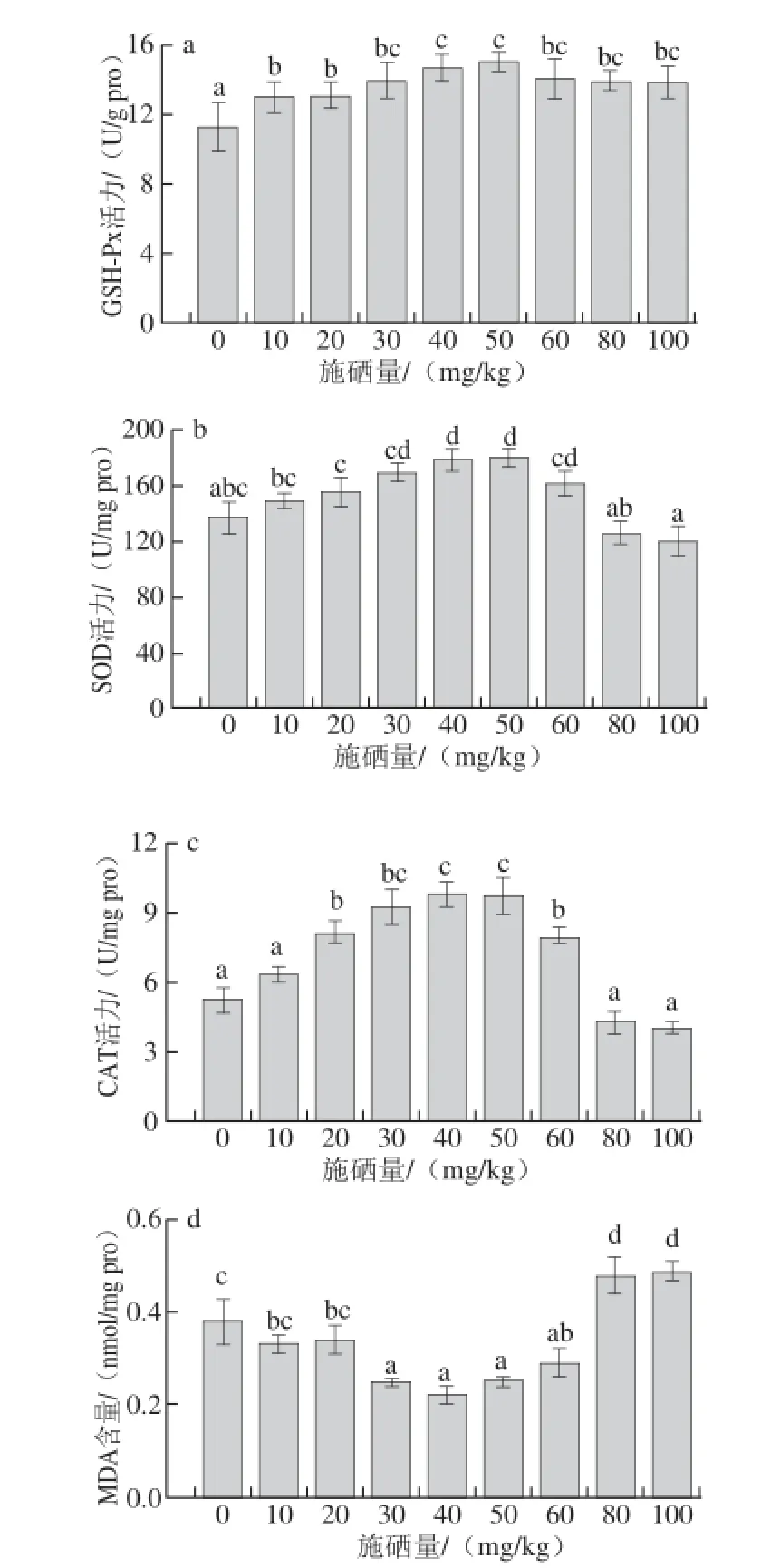
图5 不同施硒量下杏鲍菇子实体GSH-Px(a)、SOD(b)、CAT(c)的活力和MDA(d)的含量Fig. 5 GSH-Px (a), SOD (b) and CAT (c) activities and MDA (d) contents in fruit bodies of P. eryngii in selenium-supplemented substrates at various concentrations
GSH-Px是一种含硒酶,它的活性中心为硒代半胱氨酸,硒在生物体内的抗氧化作用主要通过GSH-Px来实现。郭静成等[24]的研究表明,硒对GSH-Px活性及GSH含量具有一定的影响,硒处理可以在一定程度上提高高等植物中GSH-Px活性。由图5a可知,随着培养料中硒含量的增加,GSH-Px活力呈先上升后下降的趋势,并且处理组的GSH-Px活力均显著高于对照组,说明硒对杏鲍菇子实体中GSH-Px的活性具有积极作用。杏鲍菇菌丝体吸收了培养料中的Se(IV),硒作为诱导因子,启动了该酶合成有关的基因,从而增加了该酶在杏鲍菇中的活性[25]。
SOD是机体内抗氧化系统的第一道防线,能清除超氧阴离子自由基,保护生物体免受活性氧伤害,其活性的高低变化反映了植物对氧化损伤的修复能力,与植物抗逆性及衰老有着密切关系,对机体的氧化和抗氧化平衡起着非常重要的作用[26-27]。由图5b可知,随着培养料中硒含量的增加,SOD活力呈先升高再下降趋势。当培养料中硒含量在50 mg/kg时,杏鲍菇子实体中的SOD活力达到最高。施硒量在30~60 mg/kg范围内时,杏鲍菇子实体中的SOD活性显著高于对照组(P<0.05),当施硒量过高时,SOD活性下降,低于对照组。
CAT是抗氧化酶系统的重要组成部分,可以催化过氧化氢分解为分子氧和水,有效清除体内活性氧[28]。由图5c可知,随着培养料中硒含量的增加,CAT活力呈先上升后下降的趋势,当培养料中硒含量在20~60 mg/kg范围内时,杏鲍菇中CAT活力显著高于对照组(P<0.05)。当培养料中硒含量较高时,CAT活性下降。
MDA是生物体内自由基作用于脂质发生过氧化反应最重要的产物之一,它的产生加剧膜的损伤,会引起蛋白质、核酸等生命大分子的交联聚合,且具有细胞毒性,因此在植物衰老生理和抗性生理研究中MDA含量是一个常用指标,可通过MDA了解膜脂过氧化的程度,以间接测定膜系统受损程度[26]。由图5d可知,随着培养料中硒含量的增加,MDA含量呈先下降后上升的趋势,当培养料中硒含量为30~60 mg/kg时,MDA含量显著低于对照组,当施硒量过高时,MDA含量高于对照组。
生物体内的过氧化作用,主要是由活性氧及其衍生物引起的脂质过氧化反应。抗氧化酶可以针对这些过氧化反应发挥作用,利用氧化还原作用将过氧化物转换为毒害较低或无害的物质。硒进入生物体内,在催化分解活性氧的同时又能促进产生活性氧,硒在生物体内产生的影响与其含量有关。低硒浓度下,硒可以通过非酶促机制直接清除O2-·[29],并且刺激糖类合成,促进子实体生长。当硒浓度过高时,硒对植物产生了毒害作用,促进植物机体产生过氧化反应。此外,硒进入植物机体中,对抗氧化系统产生重要的影响。硒对植物的抗氧化作用主要是通过GSH-Px来实现,通过启动GSH-Px合成的有关基因,合成GSH-Px,清除植物体内的过氧化物。在低硒浓度下,杏鲍菇子实体中GSH-Px活性显著高于对照组,而SOD和CAT的活性并没有显著增强,产生这一现象的原因可能是SOD作用于清除O2-·,而在低硒浓度下,硒自身可通过非酶促机制清除O2-·,GSH-Px虽不能直接清除,但可通过O2-·之间的动态平衡间接影响O2-·的含量。植物体内一部分O2-·由硒及GSH-Px清除,所以SOD活性增强并不明显。随着硒浓度的升高,植物体内生成更多的O2-·和H2O2,此时SOD和CAT的活性逐渐增强,以补充GSH-Px抗氧化性的不足。在低、中施硒量处理下,杏鲍菇体内的各抗氧化系统相互补偿,发挥协同作用,所以MDA含量保持相对较低的水平。当施硒量过高时,SOD与CAT的活性低于对照组,但GSH-Px的活性仍然显著高于对照组,这一现象再次证实GSH-Px与硒水平有着极其密切的关系。高硒浓度促进脂质过氧化作用,有较多的活性氧产生,子实体中的抗氧化酶又无法将过多的活性氧分解。活性氧不能及时被清除而积累,会导致脂质、蛋白、核酸等生物大分子的损伤[30],这个过程也会导致MDA含量显著升高。
2.7 富硒杏鲍菇子实体可食用性评价
硒元素具有两面性,硒缺乏会导致一些疾病的产生,但过量摄入硒元素,会发生硒中毒。2013年新版的《中国居民膳食营养素参考摄入量》[31]规定了居民每日硒摄入量:18岁以上者的推荐摄入量为60 μg/d,可耐受最高摄入量为400 μg/d。硒含量为4.08~8.44 mg/kg(干质量,下同)的杏鲍菇可作为身体健康的居民膳食中硒的来源,每日食用这种新鲜杏鲍菇(含水量88%)60~120 g可达到日推荐摄入量,最高摄入量不能超过400 g。硒含量为12.98~23.06 mg/kg的杏鲍菇可作为硒缺乏患者的硒补充剂,根据需求量食用。
3 结 论
杏鲍菇富硒实验证明在培养料中加入Na2SeO3可以显著提高杏鲍菇子实体中硒含量,施硒量不大于50 mg/kg条 件下,杏鲍菇均能正常生长,表现出良好的营养品质和生理特性,并且杏鲍菇对硒的有机化率可达到80%~84%。当培养料中Na2SeO3含量在40~50 mg/kg范围内时,子实体的BCF最大,对硒的利用率最高。此施硒量下可显著提高子实体可溶性蛋白质和多糖含量,增强GSH-Px、SOD、CAT活性,降低MDA含量,但对氨基酸的组成和含量影响并不显著。此外,硒在杏鲍菇子实体各部位分布均匀。综上所述,富硒杏鲍菇可以作为膳食中优良的硒源。
[1] 李颂, 衣喆, 王春玲, 等. 微量元素硒的营养价值及应用[J].食品研究与开发, 2014, 35(20): 120-132. DOI:10.3969/ j.issn.1005-6521.2014.20.031.
[2] DUNTAS L H, BENVENGA S. Selenium: an element for life[J]. Endocrine, 2015, 48(3): 756-775. DOI:10.1007/s12020-014-0477-6.
[3] 李军, 张忠诚. 微量元素硒与人体健康[J]. 微量元素与健康研究, 2011, 28(5): 59-63.
[4] 罗杰, 王佳媛, 游远航, 等. 硒在土壤-水稻系统中的迁移转化规律[J]. 西南师范大学学报(自然科学版), 2012, 37(3): 60-66. DOI:10.13718/j.cnki.xsxb.2012.03.007.
[5] 李玲飞, 蔡松伟, 吴根福. 富硒食用菌及其保健功效[J]. 食药用菌, 2011, 19(6): 38-43. DOI:10.14083/j.issn.1001-4942.2012.07.039.
[6] 刘培棣. 硒资源及其综合开发利用(文集)[M]. 北京: 中国科学技术出版社, 1993: 165-176.
[7] 方勇, 陈曦, 陈悦, 等. 外源硒对水稻籽粒营养品质和重金属含量的影响[J]. 江苏农业学报, 2013, 29(4): 760-765. DOI:10.3969/j. issn.1000-4440.2013.04.012.
[8] 黄春燕, 张柏松, 万鲁长, 等. 食用菌富硒培养研究进展[J]. 山东农业科学, 2012, 44(7): 81-87. DOI:10.14083/j.issn.1001-4942.2012.07.039.
[9] 郑微. 培养温度对杏鲍菇生长发育的影响及生理效应研究[D]. 长春: 吉林农业大学, 2014: 2-3.
[10] 熊文飞. 杏鲍菇有效成分提取、脱苦及其精粉加工技术的研究[D].福州: 福建农林大学, 2012: 1-2.
[11] KOMAREK M, CHRASTNY V, STICHOVA J. Metal/metalloid contamination and isotopic composition of lead in edible mushrooms and forest soils originating from a smelting area[J]. Environment International, 2007, 33(5): 667-684. DOI:10.1016/ j.envint.2007.02.001.
[12] 孙中涛, 王汉忠, 孙凤鸣, 等.硒在香菇体内的生物转化及硒蛋白的生物活性[J]. 食品与发酵工业, 2003, 29(8): 57-60. DOI:10.13995/ j.cnki.11-1802/ts.2003.08.013.
[13] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 1999: 112-113.
[14] 国家饲料产品质量监督检验中心. GB/T 18246—2000 饲料中氨基酸的测定[S].
[15] 祝传望, 刘安军, 郑捷, 等. 硒精氨酸对富硒平菇子实体品质的影响[J]. 现代食品科技, 2015, 31(6): 67-72. DOI:10.13982/ j.mfst.1673-9078.2015.6.011.
[16] 李华为, 铁梅, 张崴, 等. 金针菇子实体富硒栽培特性及HPLCICP-MS法对硒的分布研究[J]. 菌物学报, 2012, 31(1): 86-91. DOI:10.13346/j.mycosystema.2012.01.007.
[17] 张艳玲, 潘根兴. 叶面喷施硒肥对低硒土壤中大豆不同蛋白质组分及其硒分布的影响[J]. 南京农业大学学报, 2003, 26(1): 37-40.
[18] BURK R F, HILL K E. Selenoprotein P: an extracellular protein with unique physical characteristics and a role in selenium homeostasis[J]. Annual Review of Nutrition, 2005, 25(1): 215-235. DOI:10.1146/ annurev.nutr.24.012003.132120.
[19] XIA Y M, HILL K E, BURK R F. Biochemical studies of a seleniumdifi cient population in China: measurement of selenium, glutathione peroxidase and other oxidant defense indices in blood[J]. The Journal of Nutrition, 1989, 119(9): 1318-1326.
[20] XIA Y M, HILL K E, BYME D W, et al. Effectiveness of selenium supplements in a low-selenium area of China[J]. American Journal of Clinical Nutrition, 2005, 81(4): 829-834.
[21] 张梦如, 杨玉梅, 成蕴秀, 等. 植物活性氧的产生及其作用和危害[J]. 西北植物学报, 2014, 34(9): 1916-1926. DOI:10.7606/ j.issn.1000-4025.2014.09.1916.
[22] 余芳, 汪社英, 方勇, 等. 富硒绿茶硒蛋白的提取工艺研究[J].南京农业大学学报, 2008, 31(4): 140-143. DOI:10.7685/ j.issn.1000-2030.2008.04.026.
[23] 肖辉. 姬松茸中硒的形态分析[D]. 镇江: 江苏大学, 2010: 26-27.
[24] 郭静成, 尹顺平. 硒对高等植物中谷胱甘肽过氧化物酶活性及谷胱甘肽含量的影响[J]. 西北植物学报, 1998, 17(2): 157-161. DOI:10.3321/j.issn:1000-4025.1998.04.011.
[25] SONG Z, JIA L, XU F, et al. Characteristics of se-enriched mycelia by Stropharia rugoso-annulata and its antioxidant activities in vivo[J]. Biological Trace Element Research, 2009, 131(1): 81-89. DOI:10.1007/s12011-009-8343-8.
[26] 张明中. 番茄施硒的生理和品质效应及分子调控研究[D]. 重庆: 西南大学, 2014: 50-51.
[27] 唐玉巧. 大豆中硒的生理生化及其含硒蛋白的初步分离[D]. 长沙:湖南农业大学, 2005: 23-25.
[28] 田春丽. 硒与锌对紫花苜蓿生长品质的调控作用及其机理[D]. 郑州: 河南农业大学, 2014: 53-53.
[29] HARTIKAINEN H, XUE T L, PIIRONEN V. Selenium as an antioxidant and pro-oxidant in ryegrass[J]. Plant and Soil, 2000, 225(1): 193-200. DOI:10.1023/A:1026512921026.
[30] MOLLER I M, JENSEN P E, HANSSON A. Oxidative modifications to cellular components in plants[J]. Annual Review of Plant Biology, 2007, 58(1): 459-481. DOI:10.1146/annurev. arplant.58.032806.103946.
[31] 程义勇. 《中国居民膳食营养素参考摄入量》2013修订版简介[J].营养学报, 2014, 36(4): 313-317. DOI:10.13325/j.cnki.acta.nutr. sin.2014.04.002.
Effects of Selenium on Nutritional Quality and Antioxidant Enzyme Activities of Pleurotus eryngii
WANG Mingyang1, FANG Yong2, PEI Fei2, XIA Ji2, ZHAO Ermin2, TANG Jing1, HU Qiuhui1,2,*
(1. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China; 2. College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210046, China)
The objective of this study was to determine the selenium content, nutritional quality and antioxidant enzyme activity of Pleurotus eryngii (P. eryngii) growing on substrates supplemented with selenium salt (Na2SeO3). The selenium content was analyzed by inductively coupled plasma-mass spectrometry (ICP-MS). The soluble protein and total sugar contents as well as the activities of glutathione peroxidase (GSH-Px), superoxide dismutase (SOD) and hydrogen peroxidase (CAT) were measured using P. eryngii as the control. Results showed that the addition of selenium salt to the substrates led to a signifi cant (P < 0.05) increase in selenium content in the fruit bodies of P. eryngii. When the content of selenium salt in substrates was maintained in the range of 40–50 mg/kg, the bioconcentration factor (BCF) of P. eryngii reached the highest level (0.46–0.47) and the organic selenium content was 83.00%–84.00%. Compared to the control group, the soluble protein and total sugar content as well as the activities of GSH-Px, SOD and CAT were signifi cantly (P < 0.05) enhanced. These results showed that the optimal range of selenium content could increase the selenium content of P. eryngii, improve nutritional quality and enhance physiological property.
Pleurotus eryngii;selenium;nutritional quality;antioxidant enzyme activities
10.7506/spkx1002-6630-201611036
TS201.1
A
1002-6630(2016)11-0208-06
王明洋, 方勇, 裴斐, 等. 硒对杏鲍菇营养品质和抗氧化酶活性的影响[J]. 食品科学, 2016, 37(11): 208-213.
DOI:10.7506/spkx1002-6630-201611036. http://www.spkx.net.cn
WANG Mingyang, FANG Yong, PEI Fei, et al. Effects of selenium on nutritional quality and antioxidant enzyme activities of Pleurotus eryngii[J]. Food Science, 2016, 37(11): 208-213. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201611036. http://www.spkx.net.cn
2016-01-21
公益性行业(农业)科研专项(201303106)
王明洋(1991—),女,硕士研究生,研究方向为食品营养与化学。E-mail:2014108027@njau.edu.cn
*通信作者:胡秋辉(1962—),男,教授,博士,研究方向为食品科学与工程。E-mail:qiuhuihu@njau.edu.cn

