雏鸡感染肠炎沙门氏菌后脾脏中TLR4和TLR15 mRNA表达水平的变化
贾雪波,盛中伟,施寿荣,邹剑敏
(江苏省家禽科学研究所,扬州 225125)
雏鸡感染肠炎沙门氏菌后脾脏中TLR4和TLR15 mRNA表达水平的变化
贾雪波,盛中伟,施寿荣,邹剑敏
(江苏省家禽科学研究所,扬州 225125)
本研究以中国地方三黄鸡为实验对象,检测在肠炎沙门氏菌的急性感染期,雏鸡生长和脾脏中TLR4和TLR15 mRNA表达水平的变化。将2日龄三黄鸡随机分为对照组和攻毒组,攻毒组颈部皮下注射100 μL含106CFU肠炎沙门氏菌的PBS缓冲液,对照组则注射等体积PBS缓冲液。分别在感染后d1和d3(即3日龄和5日龄)记录雏鸡体重和采集脾脏样品,采用实时荧光定量PCR方法比较两组雏鸡脾脏样品中TLR4和TLR15 mRNA表达量的变化。结果显示,3日龄时对照组雏鸡体重与出雏重相比差异没有显著统计学意义,发生增重停滞,而攻毒组雏鸡体重显著低于出雏重(P=0.018)和3日龄对照组体重(P=0.026);攻毒后d3,对照组体重极显著高于0日龄体重(P=0.000),并且与攻毒组鸡的体重具有极显著统计学意义(P=0.000),而此时攻毒组鸡的体重亦增加并超过0日龄体重(P=0.051)。肠炎沙门氏菌攻毒后,雏鸡脾脏中TLR4(P=0.023)和TLR15(P=0.000)mRNA表达均发生显著上调,其中TLR15 mRNA表达的上调持续至5日龄(P=0.000);肠炎沙门氏菌对雏鸡体重、脾脏中TLR4和TLR15 mRNA表达的影响,在日龄上均表现出极显著的交互效应(P=0.000),且雏鸡体重和脾脏TLR4 mRNA表达量呈极显著的正相关(r=0.471,P=0.000)。综上所述,在肠炎沙门氏菌的急性感染期雏鸡的体重增长受到严重影响,脾脏中上调的TLR4和TLR15 mRNA表达参与了三黄鸡沙门氏菌感染的免疫应答过程。
肠炎沙门氏菌;体重;TLR4;TLR15;鸡
进入21世纪以来,禽类肉蛋产品的需求在我国肉食产品需求总量中呈刚性增长,人们对禽产品质量的追求意识亦日益增强。禽沙门氏菌病的危害伴随养鸡业的全周期,对禽类生产可造成无法估量的经济损失,尤其肠炎沙门氏菌(Salmonella enteritidis,S. enteritidis)感染鸡群后,表现为隐性感染且长期排菌,并能通过食物链将病菌传递给人类,严重威胁人类食品安全[1,2],已经引起养禽界、公共卫生界和禽病防治界的高度重视。对禽类特殊疫病抗性研究中发现,在病原菌对鸡的感染和侵入过程中,宿主的遗传背景和日龄对抗性的影响扮演着重要角色,找出鸡对肠炎沙门氏菌病抗性起决定作用的基因,研究免疫相关基因的差异表达规律是一个必要途径[3]。
Toll样受体(Toll-like receptor,TLR)家族被认为是目前哺乳动物和脊椎动物唯一将细胞外抗原识别信息向细胞内传递,并引发炎症反应的关键跨膜蛋白[4,5],从源头为疾病机制的研究提供了方向,成为目前研究禽类抗病力的热门基因。研究发现,TLRs作为机体炎性反应链的启动蛋白,可以识别并绑定一个或多个病原相关分子模式[6],控制适应性免疫活化所必需的刺激分子的表达,是连接天然免疫和适应性免疫的桥梁,已证实与禽类肠炎沙门氏菌感染后的免疫应答反应及抵抗力有关[3]。家禽Toll样受体(chTLRs)和脊椎动物相似,已在家禽基因组信息中相继发现至少8种核酸序列。
chTLR4是Toll样受体家族中最早被发现的TLR,能识别革兰氏阴性菌的LPS[7],和许多内源性及外源性配体结合[8],激活一系列的跨膜信号传导途径,后者进而调控众多炎性介质和细胞因子的表达,发挥防御和免疫调节作用。研究表明,chTLR4与家禽对沙门氏菌的易感性直接相关[3,9-10]。 chTLR15是通过生物信息学分析从家禽的基因组中鉴定出来的一个家禽特有的TLR[11],能在家禽的多种组织和细胞中表达,特别是免疫相关性组织,如脾脏、法氏囊和骨髓。关于chTLR15在家禽免疫相关细胞和组织中的表达水平以及其和家禽抵抗病原微生物的感染能力的关系是最近研究的焦点。相关研究也证实,chTLR15也参与了鸡对沙门氏菌的免疫应答反应[12-15]。
本研究选用中国地方三黄鸡品种,模拟生产中肠炎沙门氏菌的低剂量感染,采用实时荧光定量PCR(RT-rtQPCR)技术对肠炎沙门氏菌急性感染期雏鸡脾脏中TLR4和TLR15的mRNA表达进行分析,探讨肠炎沙门氏菌攻毒后对中国地方鸡早期生长和脾脏TLRs mRNA表达的影响,为进一步揭示TLR4和TLR15与鸡肠炎沙门氏菌病抗性的相关性提供科学依据。
1 材料与方法
1.1实验动物选取健康的0日龄中国地方三黄鸡雏鸡,进行血液和肛拭纸检测,从中选取血清中不含抗鸡白痢和肠炎沙门氏菌抗体、肛拭纸不含鸡白痢和肠炎沙门氏菌的鸡,随机分为对照组和实验组。雏鸡2日龄时,用肠炎沙门氏菌标准株进行攻毒,攻毒组颈部皮下注射100 μL浓度为107CFU/mL的菌液,即攻毒剂量为 106CFU(该攻毒剂量下雏鸡表现出肠炎沙门氏菌感染的典型症状,但不会出现死亡),对照组颈部皮下注射100 μL PBS溶菌缓冲液。对照组和实验组隔离饲养,在相同条件下按照标准化饲养程序饲养至5日龄,分别于3日龄和5日龄记录体重。采集3日龄和5日龄的雏鸡脾脏,装管后置于液氮速冻,然后-70℃冰箱保存待用。每个时间点每组采集12羽,公母各半。
1.2主要试剂和仪器TRNzol-A+总RNA提取试剂(DP421)、SuperReal PreMix(SYBR Green)(FP204-01)、Quant cDNA第一链合成试剂盒(QuantScript RT Kit,KR103-04)、pGM-T克隆试剂盒(VT302-02)、质粒小提试剂盒(TIANprep Mini Plasmid Kit,DP103-02)、DNA产物纯化回收试剂盒(TIANquick Midi Purification Kit,DP204-02)均购自TIANGEN公司;DNA Marker(DL2000)为TakaRa公司产品;9700PCR仪和7900荧光定量PCR仪购自爱普拜斯应用生物系统上海有限公司;凝胶成像系统(Tanon 2500);紫外分光光度计(GeneQuant II,Pharmacia Biotech)。
1.3总RNA提取和cDNA合成脾脏总RNA提取按TRNzol-A+总RNA提取试剂盒说明书进行。RNA 样品经1.4%琼脂糖-甲醛变性凝胶电泳和紫外分光光度计检测,保证RNA 样品质量可靠,计算样品总RNA浓度。取2 μg总RNA,cDNA 第1链的合成按照反转录试剂盒的使用说明书进行,用内参基因β-actin检测cDNA合成质量以及是否有基因组DNA污染。
1.4引物设计、目的片段标准品的制备根据GenBank中相关序列设计引物,由上海英俊生物工程有限公司合成。PCR产物经2%琼脂糖凝胶鉴定后,用DNA产物纯化回收试剂盒纯化回收目的片段,与pGM-T载体相连接,然后转化E.coli TOP10感受态细胞,挑取转化子于含氨苄抗性的LB液体培养基中,37℃、200 r/min振摇培养过夜,PCR鉴定。将鉴定正确的质粒由上海英俊生物工程技术服务有限公司测定序列,所获序列结果用Blast程序与GeneBank数据库中公布的已知基因进行序列同源性比较。用质粒小提试剂盒提取正确序列质粒,用分光光度计测其浓度后作为标准品备用。
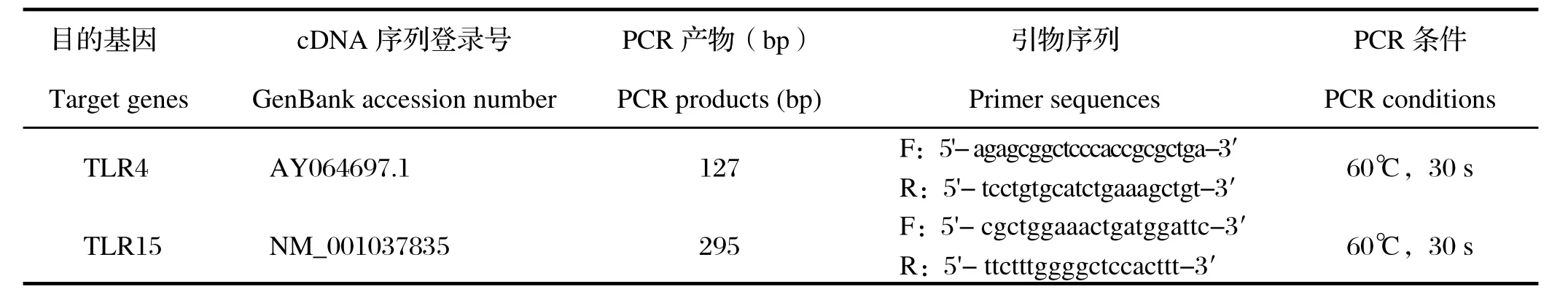
表1 基因引物序列Table 1 The primer sequences for the target genes
1.5荧光实时定量PCR由于本攻毒过程中,实验鸡的组织中常用的内参基因的表达受到干扰,且在对照组和实验组之间差异具备显著统计学意义,故本研究采用绝对定量PCR法进行实验操作和数据采集。所用荧光定量PCR采用SYBR Green I法,将每个待测样品RT产物取等体积混合,用混合样(cDNA mix)进行反应条件的优化,包括目的基因引物设计和合成、最佳退火温度、引物浓度、模板浓度等,确定最佳反应条件。将1.4中经测序验证后正确的含目的基因片段的标准质粒,进行10倍梯度稀释后和待测样品同时进行定量PCR,每次反应均设阴性对照,每个样品设置3个重复。根据标准品构建的标准曲线(标准曲线由系统软件自动分析获得),计算出待测样品中目的基因的拷贝数。
1.6统计分析运用SPSS软件(IBM SPSS Statistics 20)中Univarinate、One-way ANOVA和Bivariate Correlation分析组间和日龄对体重和基因表达的影响及其相关性。所有数据以平均值(x)±标准差(s)表示。P<0.05,表示差异具有显著的统计学意义;P<0.01,表示差异具有极显著的统计学意义。
2 结果
2.1肠炎沙门氏菌对攻毒雏鸡体重的影响对照组和实验组鸡在0日龄时体重无差异,攻毒后d1(即3日龄)对照组体重与0日龄体重没有差异,而实验组鸡的体重显著低于0日龄体重(P=0.018),并且与3日龄对照组体重相比差异具有显著统计学意义(P=0.026)。攻毒后d3(即5日龄时)对照组体重增加,与0日龄和实验组鸡的体重相比,均具有极显著统计学意义(P=0.000),而此时实验组鸡的体重亦增加并超过0日龄体重(P=0.051)(图1)。肠炎沙门氏菌对雏鸡体重的影响,在日龄上表现出极显著的交互效应(P=0.000)。
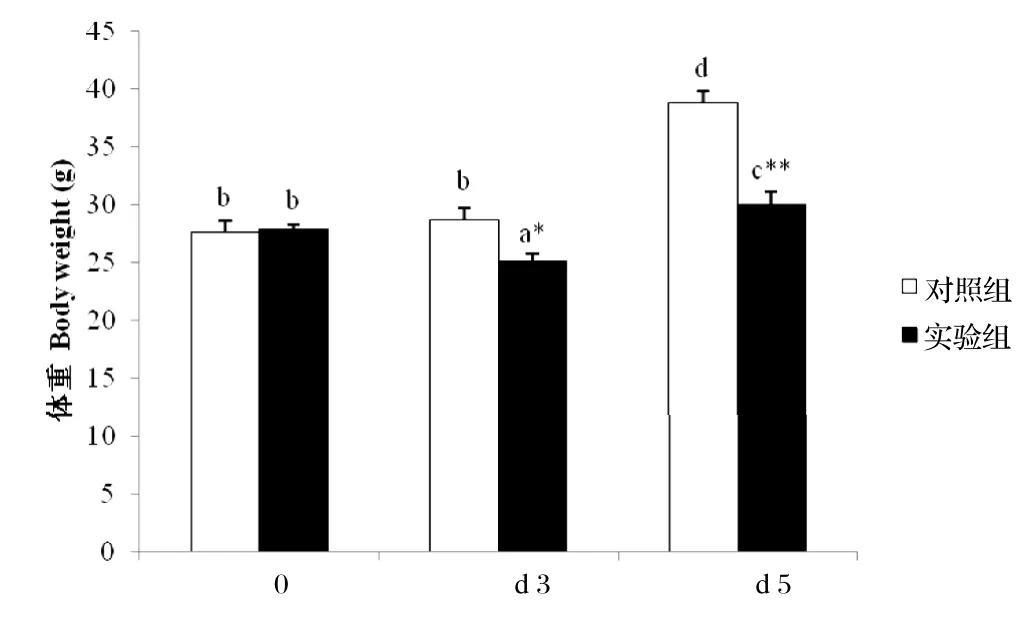
图1 肠炎沙门氏菌对攻毒雏鸡体重的影响Fig. 1 Effects of S. enteritidis infection on body weight of chicks
2.2肠炎沙门氏菌对攻毒雏鸡脾脏中TLR4 mRNA的影响对照组雏鸡脾脏TLR4 mRNA表达从3日龄到5日龄显著上升(P=0.000),攻毒后d1(即3日龄时)雏鸡脾脏TLR4 mRNA表达显著上调(P=0.023);5日龄时实验组和对照组TLR4 mRNA的表达没有差异,较3日龄实验组显著上调(P=0.002)。肠炎沙门氏菌对雏鸡脾脏TLR4 mRNA表达的影响,在日龄上表现出极显著的交互效应(P=0.000)。实验期间,雏鸡体重和脾脏TLR4 mRNA表达量呈极显著的正相关(r=0.471,P=0.000)(图2)。

图2 肠炎沙门氏菌对攻毒雏鸡脾脏中TLR4 mRNA表达的影响Fig. 2 Effects of S. enteritidis infection on the level of TLR4 mRNA expression in spleen of chicks
2.3肠炎沙门氏菌对攻毒雏鸡脾脏中TLR15 mRNA的影响对照组雏鸡脾脏TLR15 mRNA表达从3日龄到5日龄显著上升(P=0.000),攻毒后d1(即3日龄时)雏鸡脾脏TLR15 mRNA表达极显著上调(P=0.000);5日龄时实验组TLR15 mRNA的表达仍然极显著高于对照组(P=0.000),且极显著高于3日龄实验组(P=0.004)(图3)。肠炎沙门氏菌对雏鸡脾脏TLR15 mRNA表达的影响,在日龄上表现出极显著的交互效应(P=0.000)。实验期间,雏鸡体重和脾脏TLR15 mRNA表达量无相关性。

图3 肠炎沙门氏菌对攻毒雏鸡脾脏中TLR15 mRNA表达的影响Fig. 3 Effects of S. enteritidis infection on the level of TLR15 mRNA expression in spleen of chicks
3 讨论
成年鸡在育雏期和育成期感染低剂量肠炎沙门氏菌后,能够自然耐过,表现为隐性带菌而不发病,在生产上容易被忽视[1,2,16]。本研究结果显示,在接种后d1,对照组雏鸡的体重较出雏重没有增加,对抓捕表现出一定程度的应激(预试验结果显示在5日龄时对照组雏鸡体重已与相应日龄的空注组和无抓捕无空注组雏鸡体重无异);而实验组雏鸡体重显著下降,甚至低于出雏重;同时表现出食欲废绝、精神萎靡和白痢的典型沙门氏菌感染症状,气囊和脏器纤维素样变程度较大,特别是心包呈干洛样变,胆囊充盈,呈深绿色,也说明没有摄食。至5日龄进入转归期后,实验组鸡采食逐渐恢复,体重较3日龄有所增加,但仍然低于对照组;同时脏器纤维素样变程度降低,胆囊空泛,呈淡绿色,说明已经开始正常摄食。可见,肠炎沙门氏菌对雏鸡的体重的影响具有瞬时性和延续性,对鸡的早期生长乃至成年的生产性能的影响均不容轻视。
鸡的脾脏是招募机体内胞内菌(如沙门氏菌)汇集,继而启动机体免疫应答反应的重要免疫器官[17]。研究证实,Toll样受体作为一种先天免疫模式识别受体,在炎症、细胞信号转导、细胞凋亡和肿瘤等发生过程中扮演着重要的角色[18]。本研究结果显示,实验鸡感染肠炎沙门氏菌后脾脏中TLR4和TLR15的mRNA表达均发生上调,并且TLR15的mRNA表达上调延续至5日龄。已有研究证实,鸡感染沙门氏菌后脾脏中TLR4的mRNA表达会发生上调[19]。虽然目前尚未见关于鸡感染沙门氏菌后脾脏中TLR15的mRNA表达状况的报道,但是有研究表明鸟类特异性的TLR15在功能上和TLR2相似[20],且发现鸡感染沙门氏菌后脾脏中TLR2的mRNA表达会增加[19]。本研究发现受到肠炎沙门氏菌刺激后,鸡脾脏TLR4和TLR15 mRNA的表达上调,与上述研究结果一致,提示在急性感染期中国地方鸡脾脏中TLR4和TLR15也可能参与了抵抗肠炎沙门氏菌的免疫应答反应。
本研究结果显示,雏鸡体重和脾脏中TLR4 mRNA表达量呈极显著的正相关,而与脾脏中TLR15 mRNA表达量无相关性,主要和5日龄时实验组雏鸡脾脏中TLR15 mRNA的高表达有关。鸡TLR4和TLR15的功能存在差异。TLR4在该受体家族中最早被发现,主要是识别细菌脂多糖LPS[21];TLR15则被认为能特异性识别革兰氏阴性和阳性菌存活菌体上一种非分泌性的和具有热稳定性的致病成分,区别与其他类型的细菌源性的TLR配体和激动剂[22]。本研究已证实5日龄时实验组雏鸡脾脏中滞留的肠炎沙门氏菌高于机体其他组织,故5日龄时实验组雏鸡脾脏中TLR15 mRNA的高表达,可能和当时脾脏中滞留的细菌数有关。
综上所述,中国地方三黄鸡雏鸡在2日龄受到肠炎沙门氏菌低剂量感染后,虽然能够自然耐受,但是体重的增长会受到严重影响,并可能具有长期负效应。雏鸡脾脏中TLR4和TLR15的mRNA表达均发生上调,参与了机体对肠炎沙门氏菌感染的免疫应答反应。
[1] Foley S L, Lynne A M. Food animal-associated Salmonella challenges: pathogenicity and antimicrobial resistance[J]. J Anim Sci, 2008, 86(14 Suppl): E173-E187.
[2] Gantois I, Ducatelle R, Pasmans F, et al. Mechanisms of egg contamination by Salmonella Enteritidis[J]. FEMS Microbiol Rev, 2009, 33(4): 718-738.
[3] Zhou H, Lamont S J. Global gene expression profile after Salmonella enterica Serovar enteritidis challenge in two F8 advanced intercross chicken lines[J]. Cytogenet Genome Res, 2007, 117(1-4): 131-138.
[4] Gordon S. Pattern recognition receptors: doubling up for the innate immune response[J]. Cell, 2002, 111(7): 927-930.
[5] Nerren J R, Swaggerty C L, MacKinnon K M, et al. Differential mRNA expression of the avian-specific tolllike receptor 15 between heterophils from Salmonellasusceptible and -resistant chickens[J]. Immunogenetics. 2009, 61(1): 71-77.
[6] He H, Genovese K J, Nisbet D J, et al. Profile of Tolllike receptor expressions and induction of nitric oxide synthesis by Toll-like receptor agonists in chicken monocytes[J]. Mol Immunol, 2006, 43(7): 783-789.
[7] Lemaitre G, Forgetta V, Morroll S, et al. Allelic variation in TLR4 is linked to susceptibility to Salmonella enterica serovar Typhimurium infection in chickens[J]. Infect Immunol, 2003, 71(3):1116-1124.
[8] Johnson G B, Brunn G J, Platt J L. Cutting edge: an endogenous pathway to systemic inflammatory response syndrome (SIRS)-like reactions through Toll-like receptor 4[J]. J Immunol, 2004, 172(1): 20-24.
[9] Malek M, Hasenstein J R, Lamont S J. Analysis of chicken TLR4, CD28, MIF, MD-2, and LITAF genes in a Salmonella enteritidis resource population[J]. Poult Sci. 2004, 83(4): 544-549.
[10] Redmond S B, Chuammitri P, Andreasen C B, et al. Chicken heterophils from commercially selected and non-selected genetic lines express cytokines differently after in vitro exposure to Salmonella enteritidis[J]. Vet Immunol Immunopathol, 2009, 132(2-4): 129-134.
[11] Higgs R, Cormican P, Cahalane S, et al. Induction of a novel chicken Toll-like receptor following Salmonella enterica serovar Typhimurium infection[J]. Infect Immun, 2006, 74(3): 1692-1698.
[12] Kogut M H, Chiang H I, Swaggerty C L, et al. Gene expression analysis of toll-like receptor pathways in Heterophils from genetic chicken lines that differ in their susceptibility to Salmonella enteritidis[J]. Front in Genet, 2012, 3: 121.
[13] Kogut M H, Genovese K J, He H, et al. Modulation of chicken intestinal immune gene expression by small cationic peptides as feed additives during the first week post-hatch[J]. Clin Vaccine Immunol, 2013, 2(9): 1440-1448.
[14] Ramasamy K T, Reddy M R, Verma P C, et al. Expression analysis of turkey (Meleagris gallopavo) toll-like receptors and molecular characterization of avian specific TLR15[J]. Mol Biol Rep, 2012, 39(8): 8539-8549.
[15] Ramasamy K T, Verma P, Reddy M R. Toll-like receptors gene expression in the gastrointestinal tract of salmonella serovar pullorum-infected broiler chicken[J]. Appl Biochem Biotechnol, 2014, 173(2): 356-364.
[16] Okamura M, Lillehoj H S, Raybourne R B, et al. Differential responses of macrophages to Salmonella enterica serovars Enteritidis and Typhimurium[J]. Vet Immunol Immunopathol, 2005, 107(3-4): 327-335.
[17] Chappell L, Kaiser P, Barrow P, et al. The immunobiology of avian systemic salmonellosis[J]. Vet Immunol Immunopathol, 2009, 128(1-3): 53-59.
[18] Gou Z, Liu R, Zhao G, et al. Epigenetic modification of TLRs in leukocytes is associated with increased susceptibility to Salmonella enteritidis in chickens[J]. PLoS One, 2012, 7(3): 33627.
[19] Abasht B, Kaiser M G, Lamont S J. Toll-like receptor gene expression in cecum and spleen of advanced intercross line chicks infected with Salmonella enterica serovar Enteritidis[J]. Vet Immunol Immunopathol, 2008, 123(3-4): 314-323.
[20] Oven I, Resman Rus K, Dusanic D, et al. Diacylatedlipopeptide from Mycoplasma synoviae mediates TLR15 induced innate immune responses[M]. Vet Res, 2013, 44: 99.
[21] Lemaitre G, Forgetta V, Morroll S, et al. Allelic variation in TLR4 is linked to susceptibility to Salmonella enterica serovar Typhimurium infection in chickens[J]. Infect Immunol, 2003, 71(3): 1116-1124.
[22] Nerren J R, He H, Genovese K, et al. Expression of the avian-specific toll-like receptor 15 in chicken heterophils is mediated by gram-negative and gram-positive bacteria, but not TLR agonists[J]. Vet Immunol Immunopathol, 2010, 136(1-2): 151-156.
DIFFERENCES IN EXPRESSION LEVELS OF TLR4 AND TLR15 MRNAS IN CHICKEN SPLEENS POST EXPERIMENTAL INFECTION WITH SALMONELLA ENTERITIDIS
JIA Xue-bo, SHENG Zhong-wei, SHI Shou-rong, ZOU Jian-min
(Jiangsu Institute of Poultry Science, Yangzhou 225125, China)
The present experiment was conducted to study the change of body weight and expression of TLR4 and TLR15 mRNAs in spleens of native Chinese Sanhuang chicks post experimental infection of Salmonella enteritidis (SE). Two days old SE-negative chicks were randomly divided into infection group and control group. The infection group was inoculated with SE at 106CFU/ 100 μL via subcutaneous injection in the neck and control group with 100 μL PBS. The growth performance of chicks was recorded at 3 and 5 days old. The spleen samples were collected and expression of s TLR4 and TLR15 mRNAs was detected in real-time PCR. Compared with the neonatal weights, the body weights of the control group presented no difference at 3 days old. The SE infected chicks performed signifi cantly lower body weigh at 3 days old (P = 0.018) and also lower than that of the control group (P = 0.026). At 5 days old, the body weights of the control group was signifi cantly higher than that of their neonatal weights (P = 0.000) and the SE infected group (P = 0.000)and the body weights of the SE infected chicks was laso signifi cantly higher than their neonatal weights (P = 0.051). After SE infection, the expression levels of TLR4 (P = 0.023) and TLR15 (P = 0.000) mRNAs in chick spleens continued to increase (P = 0.000) to the age of 5 days old. There was a signifi cant interaction between treatment and age in determining body weight and the expression of spleen TLR4 and TLR15 mRNAs in chicks during the acute period of SE infection (P = 0.000, respectively). The correlation between the body weight and the expression of spleen TLR4 mRNA was signifi cantly positive and linear (r = 0.471, P = 0.000). In summary, the capture stress and SE infection caused continued growth retardation in chicks and up-regulation of spleen TLR4 and TLR15 expression in native Chinese Sanhuang chicks was related to the SE-mediated immune response during the acute infection period.
Salmonella enteritidis; body weight; TLR4; TLR15; chicks
S852.612
A
1674-6422(2016)03-0041-07
2015-09-15
“十二五”国家科技支撑计划(2012BAD39B04);江苏省科技公共服务平台项目(BM2012060)
贾雪波,男,硕士,助理研究员,主要从事家禽疾病调控研究
邹剑敏,E-mail:jqszjm@163.com

