长江中下游湖泊和云南抚仙湖黄颡鱼群体遗传结构研究
刘红艳, 陈校辉, 熊 飞
(1.江汉大学 生命科学学院, 武汉 430056; 2.江苏省淡水水产研究所, 南京 210017)
长江中下游湖泊和云南抚仙湖黄颡鱼群体遗传结构研究
刘红艳1*, 陈校辉2, 熊 飞1
(1.江汉大学 生命科学学院, 武汉 430056; 2.江苏省淡水水产研究所, 南京 210017)
采用10个微卫星位点对长江中下游5个湖泊和云南抚仙湖黄颡鱼群体遗传结构进行分析.结果显示,黄颡鱼各群体平均等位基因数为3.5~4.6,平均有效等位基因数为2.240~3.041,平均观测杂合度为0.343~0.499,平均期望杂合度为0.432~0.600,平均多态性信息指数为0.389~0.571.鄱阳湖、滆湖和洪泽湖群体的遗传多样性高于太湖、巢湖和抚仙湖群体.群体间的遗传距离为0.089~0.524,其中,鄱阳湖与巢湖群体的遗传距离最小,鄱阳湖与滆湖群体遗传距离最大,IBD分析结果显示黄颡鱼群体不遵循地理距离模型.AMOVA显示大多数遗传变异存在于群体内(84.51%),群体间的遗传变异为15.49%(Fst=0.1549),表明黄颡鱼群体存在明显的遗传分化,两两遗传分化指数也证实了这一点.UPGMA聚类和Structure分析结果均显示6个黄颡鱼群体可分为2组,鄱阳湖、巢湖和洪泽湖为一组,滆湖、太湖和抚仙湖群体为另一组.
黄颡鱼; 微卫星; 遗传结构
黄颡鱼(Peltebagrusfulvidraco)属鲶形目(Siluriformes)、鲿科(Bagridae)、黄颡鱼属(Pelteobagrus),是一种以动物性饵料为主的杂食性鱼类,常栖息于河流、水库和湖泊的底层[1].黄颡鱼的营养价值高,生存适应能力强,黄颡鱼在我国各大水系均有分布[2-3].通过微卫星对不同水系黄颡鱼群体的遗传多样性和遗传结构分析已经有一些报道,如吴勤超等[4]分析了长江中上游流域黄颡鱼野生群体的遗传多样性,李大宇等[5]研究了东北、长江中上游和天津地区黄颡鱼群体的遗传多样性,马洪雨等[6]和郭金峰等[7]研究了山东黄颡鱼群体的遗传多样性.而目前未见长江中下游的湖泊黄颡鱼群体微卫星遗传变异研究.另外,黄颡鱼作为一种广适性鱼类,成功建群于云南高原湖泊抚仙湖,成为抚仙湖的外来种,目前仅有黄颡鱼作为外来种的年龄和生长特征报道[8],未见其遗传多样性研究.
本研究采集鄱阳湖、巢湖、洪泽湖、滆湖及太湖5个长江中下游湖泊群体和云南抚仙湖黄颡鱼群体,通过对其微卫星基因型的分析,探讨6个湖泊黄颡鱼群体遗传多样性和遗传结构差异,群体间遗传关系和遗传分化情况,以期了解长江中下游黄颡鱼野生群体的遗传背景和种质资源现状.同时对比分析长江中下游地区和抚仙湖群体遗传多样性差异,考察抚仙湖外来黄颡鱼群体的遗传多样性情况,为探讨外来种的遗传适应机制提供参考.
1 材料与方法
1.1 样本采集和DNA提取
黄颡鱼样品采集于鄱阳湖、巢湖、洪泽湖、滆湖和太湖5个长江中下游湖泊及云南高原湖泊抚仙湖.鄱阳湖群体样本数为21尾,其它群体的样本数均为30尾.取黄颡鱼背部肌肉组织置于95%乙醇中带回实验室.取保存于乙醇中的样品约20 mg,0.9%的生理盐水浸泡约12 h(期间更换生理盐水3~4次),用标准的酚-氯仿法提取DNA.获得的DNA用核酸蛋白分析仪检测其纯度和浓度,最终DNA模板浓度定量在20 ng/μL,保存于冰箱备用.
1.2 微卫星分析
根据已发表的文献[4,6,9],选取10个黄颡鱼微卫星位点进行研究,这些位点为:AG12、AG48、AG128、CT30、CT81、CT154、CT209、HSY208、HSY407及MFW30(Thermo Fisher公司合成),微卫星特征如表1.PCR反应总体积为10 μL,包括Taq DNA 聚合酶0.5 U(Thermo Fisher公司生产),dNTP 0.2 mmol/L,MgCl22.0 mmol/L,1×Buffer,引物0.2 μmol/L,DNA 模板约20 ng,补充灭菌蒸馏水到10 μL.PCR 扩增程序为95℃预变性5 min,接着进行35个循环:94℃变性45 s、适当退火温度退火30 s(表1)、72℃延伸45 s,最后72℃延伸10 min.反应在PCR仪(PTC100型)上进行.扩增产物用非变性的8%聚丙烯酰胺凝胶电泳进行分离,并通过银染法进行检测.
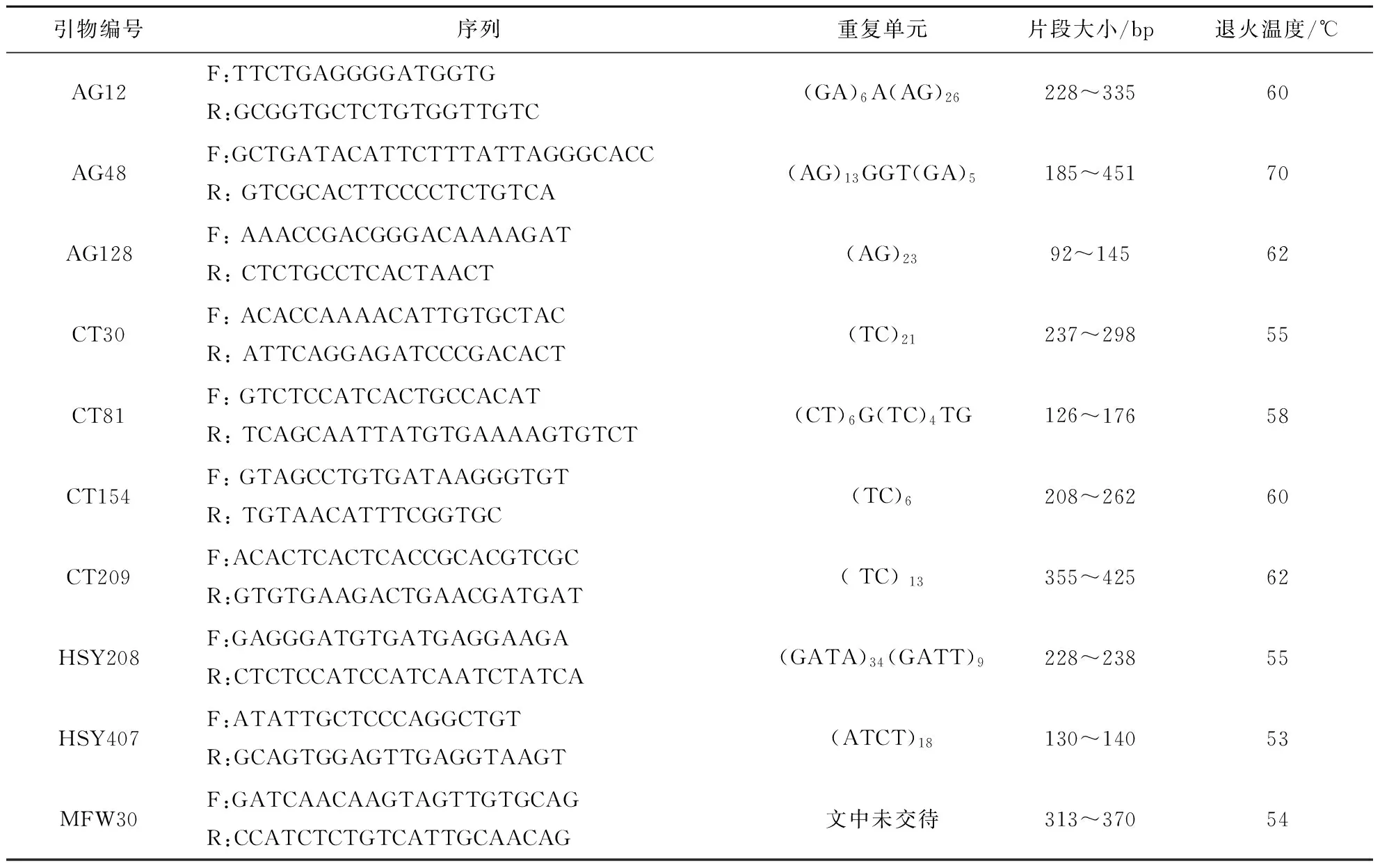
表1 10对微卫星引物特征
1.3 数据分析
根据DNA Marker标记和微卫星DNA的迁移率,读取各等位基因条带.利用CONVERT1.31软件[10]将各群体等位基因条带矩阵,转化相关分子遗传学软件所需的格式.用GenePop1.2软件[11]计算各遗传多样性参数,包括各位点的等位基因数目(Na)、有效等位基因数目(Ne)、观测杂合度(Ho)、期望杂合度(He).用PIC-CALC 0.6软件计算多态性信息指数(PIC).
群体间遗传距离、遗传分化指数用Arlequin 3.1软件[12]计算.通过IBDWS 3.23软件[13]里的Mantel检验程序,对不同群体遗传距离和地理距离的相关性进行检验(参数设定为10 000次重复).基于Nei’s遗传距离,采用NTSYS-PC 2.1软件[14]中的SAHN程序和非加权组平均法(UPGMA)进行聚类,分析群体间的相互遗传关系.
分子变异方差分析用AMOVA软件[15]计算,检测群体内和群体间的遗传变异情况,计算中考虑微卫星等位基因的大小差异,所有多重比较中的P值都进行泊松校正.群体遗传结构用Stucture2.3软件[16]的Bayesian方法进行分析,采用混合模型和等位变异发生相关频率模型,参数“Burnin Period”设为200 000次,“after Burnin”设为 500 000 次,将所有个体设定为1~7个种群(即K=1~7),每个K值运行10次.基于K值对应的对数值变化率的ΔK作曲线图,确定真正的K值.
2 结果
2.1 微卫星遗传多样性
从表2可以看出,黄颡鱼各群体平均等位基因数为3.5~4.6,平均有效等位基因数为2.240~3.041,平均观测杂合度为0.343~0.499,平均期望杂合度为0.432~0.600,平均多态性信息指数为0.389~0.571.6个群体的总体Na=7.5,Ne=3.527,Ho=0.444,He=0.615,PIC=0.575.有效等位基因数为:鄱阳湖>滆湖>洪泽湖>太湖>抚仙湖>巢湖.观测杂合度为:鄱阳湖>滆湖>洪泽湖>太湖>巢湖>抚仙湖.期望杂合度为:洪泽湖>鄱阳湖>滆湖>太湖>抚仙湖>巢湖;多态性信息含量指数为:鄱阳湖>洪泽湖>滆湖>太湖>抚仙湖>巢湖.总体来看,鄱阳湖、滆湖和洪泽湖的遗传多样性高于太湖、抚仙湖和巢湖.相对而言,巢湖群体和外来抚仙湖群体的遗传多样性较低.

表2 黄颡鱼6个群体的遗传多样性参数
Na:等位基因数;Ne:有效等位基因数;Ho:观测杂合度;He:期望杂合度;PIC: 多态性信息含量指数
Notes:Na: No. of alleles;Ne:No. of effective alleles;Ho: observed heterozygosity;He: expected heterozygosity;PIC: polymorphism information content
2.2 遗传距离与聚类分析
群体间的两两遗传距离为0.089~0.524,鄱阳湖与巢湖群体的遗传距离最小,鄱阳湖与滆湖群体遗传距离最大(表3).UPGMA聚类分析结果如图1.鄱阳湖与巢湖群体首先聚在一起,然后再与洪泽湖群体聚为一分支,滆湖与太湖群体聚在一起,然后再与抚仙湖群体聚成另一分支.

表3 黄颡鱼群体两两遗传距离和遗传分化指数

图1 基于Nei’s遗传距离的UPGMA聚类图Fig.1 UPGMA Clustering result based on Nei’s genetic distance
IBD检验6个群体的遗传距离与地理距离相关性,表明黄颡鱼遗传距离与地理距离不相关(r=0.2230,p=0.5440,图2A).因抚仙湖黄颡鱼群体为外来种,为了排除干扰,去掉抚仙湖群体,只检测长江中下游5个群体的遗传距离与地理距离相关性,结果同样显示遗传距离与地理距离没有相关性(r=0.4611,p=0.0825,图2B),表明黄颡鱼群体不遵循地理距离模型.

A):6个黄颡鱼群体的遗传距离与地理距离相关性检验;B):去掉抚仙湖群体后,长江中下游5个群体遗传距离与地理距离相关性检验图2 Mantel检验遗传距离与地理距离相关性Fig.2 Correlation of genetic distance and geographic distance by Mantel test
2.3 遗传分化和遗传结构
分子方差分析(AMOVA)显示(表4),大多数遗传变异存在于黄颡鱼的个体水平(81.41%),群体内个体间的为3.10%,群体间的遗传变异为15.49%(Fst=0.1549).从群体两两比较的遗传分化指数来看(表3),抚仙湖、滆湖和太湖的两两遗传分化指数在0.005~0.024之间,这3群体间的遗传分化指数较小;同样,鄱阳湖、巢湖和洪泽湖两两遗传分化指数在0.069~0.107之间,这3群体间的遗传分化指数也较小.但聚类关系中两分支的两两群体间遗传分化指数较大,为0.202~0.367.太湖与抚仙湖的遗传分化指数最小(0.005),鄱阳湖与滆湖的遗传分化指数最大(0.367).

表4 黄颡鱼群体遗传结构AMOVA分析
通过Bayesian分析得出的ΔK值,构建K与ΔK的值曲线图(图3),可以看出,虽然出现多峰,但当ΔK值最大时,对应的K值为2,表明黄颡鱼遗传结构可分为2组.我们进一步对K=2时生成的Structure柱状图进行了分析,结果显示,抚仙湖、滆湖和太湖群体为一组,洪泽湖、巢湖和鄱阳湖群体为另一组(图4).2组间的遗传分化显著,表明6个黄颡鱼群体可分为2个明显的遗传分化群.

图3 structure 混合模型分析的K与ΔK值曲线图Fig.3 The model choice criterion ΔK of the Structure analysis for each K value

图4 STRUCTURE 2.3混合模型分析黄颡鱼的遗传分化群Fig.4 Genetic clusters of Pelteobagrus fulvidraco performed by mixture model with STRUCTURE 2.3
3 讨论
遗传多样性是评价物种资源状况的一个重要依据.它是物种适应多变的环境条件、维持长期生存和进化的基础[17-18].Ne、Ho、He和PIC等都是反映群体遗传多样性的度量,其数值越大,说明基因丰富度越高.从本次研究结果来看,黄颡鱼群体的遗传多样性水平较高(Ne=3.527,Ho=0.444,He=0.615,PIC=0.575).与吴勤超等[4]报道的长江中上游3个黄颡鱼群体的平均值(Ne=2.568,He=0.543 8,PIC=0.465 7)相比,本研究结果要略高.与李大宇等[5]报道的东北、长江中上游和天津地区6个黄颡鱼群体(Ne=1.96,Ho=0.49,He=0.40,PIC=0.34)和马洪雨等[6]报道的东平湖黄颡鱼群体(Ho=0.583 3,He=0.537 2,PIC=0.488)相比,本研究所检测的观测杂合度稍低,但有效等位基因、期望杂合度和多态性信息指数要高于马洪雨和李大宇的结果.与郭金峰等[7]报道的3个山东黄颡鱼群体(Ho=0.641 8,PIC=0.588 9)相比略低.DeWoody等[19]得出淡水鱼类(He=0.46,Ne=7.50)的结论,本研究6个黄颡鱼群体的He与之相差不大,而Ne偏低.Ne较低的原因可能是由于过度捕捞、栖息地环境的变化及产卵场的缩小等原因所导致的有效种群缩小使得有效等位基因更容易丢失.
根据Botstein等[20]的标准,当PIC>0.5时,为高度多态性;当0.25
在这6个群体中,抚仙湖外来黄颡鱼群体的遗传多样性相对较低.Wares等[21]对29个有关外来动物的遗传多样性的比较研究后发现,外来种群的期望杂合度比原产地种群均有降低,本研究中,抚仙湖外来黄颡鱼群体的观测杂合度均低于原产地;期望杂合度除高于原产地巢湖外,相比其它原产地的期望杂合度均有降低.这可能是由于外来种群常常由原产地的少数个体繁衍而来,会受到奠基者效应的影响,另外,外来种在引入地可能会因新环境的选择压力而长期处于小种群状态,因此遗传多样性水平往往会低于原产地.
6个黄颡鱼群体间的遗传距离为0.089~0.524,相对于李大宇等[5]用微卫星对东北、长江中上游和天津地区黄颡鱼的遗传距离结果要小,但本研究的微卫星遗传距离结果要远大于线粒体Cyt b和线粒体D控制区的遗传距离结果[22-23].6个群体当中,仅考虑原产地的群体,滆湖与太湖在地理位置上距离最近,鄱阳湖与太湖的距离最远,而群体间的遗传距离表明:鄱阳湖与巢湖群体的遗传距离最小,鄱阳湖与滆湖群体遗传距离最大,IBD检验结果显示群体所分布的地理位置及群体间遗传距离的远近并没有一定的联系.这可能与近年来长江水域人类活动的干扰(如捕捞强度,引种、栖息地破坏等因素)相关,而人类活动的干扰具有一定的差异性和随机性.
本研究中,群体间的Fst为0.154 9,显示黄颡鱼群体存在明显的遗传分化.聚类结果显示鄱阳湖、巢湖和洪泽湖群体聚为一支,滆湖、太湖和抚仙湖群体聚成另一支,Structure分析结果也支持这6个黄颡鱼群体分为2个明显的遗传分化群.钟立强等[22]用线粒体Cyt b(Fst=0.068 4)研究长江中下游黄颡鱼群体认为群体间没有遗传分化,刘朋朋等[23]用线粒体D控制区(Fst=0.089 6)研究长江中下游黄颡鱼群体认为群体间的遗传分化处于中等水平.本研究是用微卫星分子标记是对整个基因组的检测,而线粒体Cyt b和线粒体D控制区仅对几百个碱基的检测,故而本研究能检测到更多的遗传变异,微卫星与mtDNA技术比,信息含量更大,灵敏度更高,因此,微卫星标记检测到长江中下游水系黄颡鱼群体间存在2个明显的遗传分化群是较为可信的.外来物种的遗传变异可用来推测其地理起源,聚类分析和Structure结果均支持,抚仙湖外来群体与太湖和滆湖群体聚在一起.20世纪80年代初,云贵高原湖泊相继从长江流域太湖等湖泊引入太湖新银鱼等经济鱼类,黄颡鱼卵或幼鱼可能随太湖新银鱼等经济鱼类而被引入,另外黄颡鱼抚仙湖群体与太湖群体的遗传距离和遗传分化指数均较小,由此推测,抚仙湖黄颡鱼可能从长江流域太湖等湖泊引入.
[1] 褚新洛, 莫天培. 中国动物志[M].北京:科学出版社,1999:152-156.
[2] 代应贵, 陈毅峰. 清水江的鱼类区系及生态类型[J].生态学杂志, 2007, 26(5):682-687.
[3] 张国松, 侯新远, 尹绍武, 等. 黄颡鱼属(Pelteobagrus)鱼类遗传多样性的研究进展[J].江苏农业科学, 2014, 42(3):174-179.
[4] 吴勤超, 梁宏伟, 李 忠, 等. 黄颡鱼微卫星标记的筛选及三个野生群体的遗传结构分析[J].生物技术通报, 2010(3):154-159.
[5] 李大宇, 殷倩茜, 侯 宁, 等. 黄颡鱼(Pelteobagruseupogon)不同生态地理分布群体遗传多样性的微卫星分析[J].海洋与湖沼, 2009, 40(4):460-469.
[6] 马洪雨, 姜运良, 郭金峰, 等. 利用微卫星标记分析东平湖黄颡鱼的遗传多样性[J].激光生物学报, 2006, 15(2):136-139.
[7] 郭金峰, 王 玉, 马洪雨, 等. 三个黄颡鱼群体遗传多样性及亲缘关系的微卫星标记分析[J].氨基酸和生物资源, 2006, 28(3):5-8.
[8] 李秀启, 陈毅峰, 李 堃. 抚仙湖外来黄颡鱼种群的年龄和生长特征[J].动物学报, 2006, 52(2):263-271.
[9] 刘 臻, 鲁双庆, 张建社, 等. 黄颡鱼微卫星标记筛选及特征分析[J].农业生物技术学报, 2008, 16(4):604-609.
[10] GLAUBITZ J. CONVERT:A user-friendly program to reformat diploid genotypic data for commonly used population genetic software packages[J].Molecular Ecology Notes, 2004, 4(2):309-310.
[11] RAYMOND M,ROUSSET F. POPGENE (version 1. 2),population genetics software for exact test and ecumenicism[J]. Journal of Heredity, 1995, 86:248-249.
[12] SCHNEIDER S,KUEFFER J M,ROESSLI D,et al. Arlequin, version 2.0:a software for population genetic data analysis[D]. Geneva:University of Geneva,2000.
[13] JENSEN J L,BOHONAK A J,KELLEY S T. Isolation by distance,web service[J]. BMC Genet, 2005, 6:13.
[14] ROHLF F J. Ntsys-PC Version 2.1:Numerical taxonomy and multivariate analysis system[D]. New York:Stony Brook University,2000.
[15] EXCOFFIER L,SMOUSE P E,QUATTRO J M. Analysis of molecular variance inferred from metric distances among DNA haplotypes:application to human mitochondria DNA restriction sites[J]. Genetics, 1992, 131(2):479-491.
[16] PRITCHARD J K,WEN W,FALUSH D. Documentation for structure software:Version 2. 3[M]. Pittsburgh:Software Engineering Institute,2009:369-371.
[17] 肖明松, 崔 峰, 康 健, 等. 淮河乌鳢线粒体DNA控制区结构分析及遗传多样性研究[J]. 华中师范大学学报(自然科学版), 2013, 47(1):82-90.
[18] 刘红艳, 熊 飞, 董元火, 等. 鱇浪白鱼野生与养殖群体遗传多样性的ISSR分析[J]. 华中师范大学学报(自然科学版), 2012, 46(5):591-595.
[19] DEWOODY J A,AVISE J C. Microsatellite variation in marine,freshwater and anadromous fishes compared with other animals[J]. J Fish Biol, 2000, 56(3):461-473.
[20] BOTSTEIN D,WHITE R L,SKOLNICK M,et al. Construction of a genetic linkage map in man using restriction fragment length polymorphisms [J]. Am J Human Genet, 1980, 32:314-331.
[21] WARES J P,HUGHES A R,GROSBERG P K. Species Invasions:Insights into Ecology, Evolution and Biogeography[M].Sunderland:Sinauer Press, 2005: 229-257.
[22] 钟立强, 刘朋朋, 潘建林, 等. 长江中下游5个湖泊黄颡鱼(Pelteobagrusfulvidraco)种群线粒体细胞色素b基因的遗传变异分析[J]. 湖泊科学, 2013, 25(2):302-308.
[23] 刘朋朋, 钟立强, 潘建林, 等. 基于线粒体D-loop区分析黄颡鱼(Pelteobagrusfulvidraco)五个淡水湖泊群体的遗传多样性[J]. 海洋与湖沼, 2013, 44(3):728-733.
Population genetic structure ofPelteobagrusfulvidracoin the lakes of the middle and lower reaches of the Yangtze River and in Fuxian Lake of Yunnan
LIU Hongyan1, CHEN Xiaohui2, XIONG Fei1
(1.School of Life Sciences, Jianghan University, Wuhan 430056;2.Freshwater Fisheries Research Institute of Jiangsu Province, Nanjing 210017)
Ten microsatellite loci were used to analyze the population genetic structure of Pelteobagrus fulvidraco in five lakes of the middle and lower reaches of the Yangtze River and in Fuxian Lake of Yunnan. In P. fulvidraco populations, the average number of alleles was 3.5 to 4.6 with the mean number of valid alleles being 2.240 to 3.041. The average value of observed and expected heterozygosity ranged from 0.343 to 0.499 and 0.432 to 0.600, and the mean PIC was 0.389 to 0.571. Genetic diversity parameters indicated that the populations from Poyan Lake, Ge Lake, and Hongze Lake had higher levels of genetic diversity than those from Taihu Lake, Chao Lake and Fuxian Lake. The value of pairwise genetic distance was 0.0089 to 0.524. The genetic distance between Poyang Lake and Chao Lake was the smallest, while the largest one was that between Poyang Lake and Ge Lake. IBD results showed that P. fulvidraco populations did not match the geographic distance model. AMOVA analysis revealed that most of the total variation occurred within populations (84.51%). The amount of differentiation among populations was 15.49% (Fst=0.1549), which exhibited a clear population differentiation. PairwiseFstcomparisons of populations also confirmed this. Both UPGMA clustering and Structure analysis results showed that the six populations were able to be divided into two groups. One was assembled with the individuals from Hongze Lake,Poyang Lake and Chao Lake, while the other was consisted of the individuals from the rest lakes.
Pelteobagrusfulvidraco; microsatellite; genetic structure
2015-11-13.
国家自然科学基金项目(51109091);江汉大学出国留学基金项目.
1000-1190(2016)02-0269-07
Q347
A
*E-mail: lhy9603@126.com.

