碳纳米管上原位沉积钯-钴-镍纳米颗粒及其对乙醇氧化的电活性
陈清华 易清风*,,2 阳 铮 周秀林 刘小平 聂会东 徐国荣
(1湖南科技大学化学化工学院,湘潭411201)
(2理论有机化学与功能分子教育部重点实验室,湘潭411201)
碳纳米管上原位沉积钯-钴-镍纳米颗粒及其对乙醇氧化的电活性
陈清华1易清风*,1,2阳铮1周秀林1刘小平1聂会东1徐国荣1
(1湖南科技大学化学化工学院,湘潭411201)
(2理论有机化学与功能分子教育部重点实验室,湘潭411201)
以水合肼为还原剂,在水和乙醇的混合溶液中制备多壁碳纳米管(MWCNT)负载的纳米镍(Ni/MWCNT)和纳米镍钴(Ni-Co/ MWCNT)颗粒,然后将它们分别与氯化钯溶液反应,形成的钯纳米颗粒原位沉积在MWCNT表面,从而得到MWCNT负载的Pd-Ni/MWCNT和Pd-Ni-Co/MWCNT催化剂。SEM和TEM图像显示,MWCNT上的催化剂颗粒是由5~10 nm的小颗粒团聚而成的30~100 nm的大颗粒,三金属催化剂的粒径比双金属的粒径小,在MWCNT上的分散度更高。ICP和EDS分析显示,Pd直接还原并包覆在纳米镍和纳米镍钴表面;采用循环伏安和计时电流技术,研究了催化剂在碱性溶液中对乙醇氧化的电催化活性,结果表明,Pd-Ni-Co/MWCNT催化剂对乙醇氧化具有强的电催化活性,乙醇氧化对应的峰电流密度达101.8 mA·cm-2,并且催化剂催化活性稳定。
钯催化剂;乙醇氧化;镍纳米颗粒;燃料电池;原位还原
0 引言
直接醇燃料电池具有能量密度高、燃料易存储且安全、低毒等优点,受到各国科学家广泛研究。直接乙醇燃料电池以乙醇为燃料,它是一种生物质燃料,能量密度高,污染排放物少,是一种环境友好和可再生型的燃料,因此研究对乙醇电化学氧化具有高效活性的催化剂具有重要的实际意义[1]。虽然铂或铂基催化剂对乙醇氧化具有优异的活性,但铂的储量和成本以及易毒化限制了它的广泛使用[2-4]。研究表明,钯在碱性环境下能够高效催化乙醇氧化,并且钯在地球上的丰度至少是铂的50倍,因此,制备对乙醇氧化更加高效的钯基催化剂具有重要的研究意义[5-6]。在钯催化剂中掺入过渡金属或其氧化物可以提高催化剂的活性及稳定性,并能减少燃料电池的成本[7-10],如PdPt/CNTs[11],PdCo[12]和PdCu/C[13]等;此外,Ni和Co可以提高Pd在载体表面的分散性,减少金属的团聚,提高Pd的催化活性和其抗毒性[14-17]。通过“双金属原理”和“配位效应”可以较合理地解释这类复合钯基催化剂所具有的强催化活性[18-20]。
本文首先以氯化镍(NiCl2·6H2O)和氯化钴(CoCl2·6H2O)为金属前驱体,以水合肼为还原剂将金属离子还原[21],得到的纳米颗粒负载在碳纳米管表面,制备纳米镍和纳米镍钴颗粒修饰的碳纳米管复合物(Ni/MWCNT和NiCo/MWCNT);然后以此复合物为还原剂将Pd2+还原为金属Pd颗粒[22],形成的Pd颗粒原位负载在复合物表面,从而形成PdNi/ MWCNT和PdNiCo/MWCNT复合催化剂。利用SEM、TEM和XRD等技术对催化剂的表观结构进行了分析;采用循环伏安和计时电流法,对催化剂在碱性溶液中电化学催化乙醇氧化的活性和稳定性进行了研究。结果表明,催化剂的钯负载量小,但具有优异的电化学活性。
1 实验部分
1.1实验试剂与仪器
本文所用试剂为氯化钯(PdCl2,天津市科密欧化学试剂有限公司),氯化镍(NiCl2·6H2O,广州市海珠区华安化工厂),氯化钴(CoCl2·6H2O,汕头市光华化学厂有限公司),无水乙醇(CH3CH2OH,天津市大茂化学试剂厂),氢氧化钠(NaOH,天津市永大化学试剂有限公司),水合肼(N2H4·H2O,80%,湖南汇虹试剂有限公司)等,所有试剂均为分析纯,未对其进行后续提纯;多壁碳纳米管(MWCNT)管径为20~30 nm;所用纯水为二次蒸馏水。
实验仪器:XRD衍射仪(UltimaⅣMultipurpose X-Ray Diffraction System,Rigaku,Japan),辐射源为Cu Kα(λ=0.154 18 nm),管电压为40 kV,管电流为40mA,扫描速率为5°·min-1,扫描范围为20°~90°;场发射扫描电镜(Nova NanoSEM230),加速电压为15 kV;透射电子显微镜(Tecnai G20,FEICompany,USA),加速电压为200 kV;等离子体发射光谱仪(ICPS-7510,日本岛津株式会社)。Autolab PGSTAT30(荷兰)电化学工作站。
1.2催化剂的制备
1.2.1Ni/MWCNT纳米颗粒的制备
首先将MWCNT在浓H2SO4和浓HNO3的混合液中,于80℃水浴回流反应4 h,离心分离后过滤,并用大量水洗至弱酸性,真空40℃干燥,得到酸化MWCNT。然后将165.9mg NiCl2·6H2O、200.0 mg酸化MWCNT与13.6 mL无水乙醇和16.7 mL水混合,搅拌均匀后置于50℃水浴锅中,不断搅拌;同时用5.0 mol·L-1NaOH调节pH=14左右,随后逐滴加入新配置的20 mL 10%N2H4·H2O,50℃下水浴保温0.5 h。所得样品用无水乙醇和二次水洗至中性,真空40℃干燥4 h。
1.2.2NiCo/MWCNT纳米颗粒的制备
按物质的量之比nNi∶nCo=1∶1加入NiCl2·6H2O和CoCl2·6H2O,在与Ni/MWCNT相同的制备条件下得到NiCo/MWCNT纳米颗粒。
1.2.3PdNi/MWCNT和PdNiCo/MWCNT催化剂的制备
分别将Ni/MWCNT和NiCo/MWCNT颗粒于水中超声分散30 min,另将5 mmol·L-1PdCl2用稀NaOH溶液调节pH=3~4。按物质的量之比nPd∶nNi=1∶2和nPd∶(nNi+nCo)=1∶2的比例,分别将已调好pH的PdCl2溶液缓慢滴加到上述Ni/MWCNT和NiCo/ MWCNT在水中的分散液中。搅拌过夜后抽滤,并用水洗至中性,40℃下真空干燥10 h,得到的催化剂分别记为PdNi/MWCNT和PdNiCo/MWCNT。作为对比,在相同条件下以NaBH4为还原剂制备了Pd负载量为20%的Pd/MWCNT催化剂。
1.3样品测试
电化学性能测试在常规的三电极体系中进行,参比电极为Hg/HgO(1.0 mol·L-1NaOH),辅助电极为铂电极,工作电极为催化剂修饰的玻碳电极(d=3 mm)。测试前对玻碳电极(GC)进行打磨抛光,超声清洗3min后自然晾干备用。之后在950μL无水乙醇和50μL Nafion(5%)的混合溶液中加入5 mg催化剂,超声分散1 h至形成均匀的悬浊液,移取12 μL悬浊液滴在GC电极表面,室温干燥约3 h,得到催化剂修饰的工作电极。本文所报道的电位均相对于Hg/HgO,电流密度均相对于玻碳电极的几何面积,电化学测试所用电解质均为1.0mol·L-1NaOH或含乙醇的1.0 mol·L-1NaOH,循环伏安(CV)测试电位控制在0.9到0.5 V,扫描速度为50mV·s-1。恒电位阶跃电位为-0.4 V。
2 结果与讨论
图1分别为Ni/MWCNT(a,a′)和NiCo/MWCNT (b,b′)的SEM和TEM图,从SEM图(图1a,b)中看出,MWCNT缠绕到所形成的金属纳米颗粒的结构中,Ni和NiCo颗粒比较大,有团聚现象,但NiCo的粒径比Ni小,Ni和NiCo颗粒分别约为250和150 nm,原因可能是Ni为磁性金属,容易相互吸引,比较容易导致颗粒之间的团聚;而有Co存在时,减少了Ni纳米粒子的相互接触而使团聚现象减少。但从催化剂的TEM图(图1a′,b′)可看到,在MWCNT的管壁上负载了大量的金属颗粒,粒径大小分别为8~15和8~13 nm,也说明了SEM图像中的团聚现象是由较小的颗粒形成的。
Pd/MWCNT,PdNi/MWCNT和PdNiCo/MWCNT的SEM和TEM图见图2,从SEM图看到,3种催化剂颗粒均较均匀地负载在MWCNT上,Pd/MWCNT、PdNi/MWCNT和PdNiCo/MWCNT的催化剂颗粒分别为4~6、60~100和30~50 nm,说明Pd颗粒的粒径比较小,分散性更好,且大部分颗粒大小均匀,仅有少量的团聚。从图2(b)和(c)看出,双金属PdNi/ MWCNT和三金属PdNiCo/MWCNT复合催化剂颗粒比纯钯的大,但PdNiCo/MWCNT的颗粒比PdNi/ MWCNT的颗粒小,且均比Ni/MWCNT和NiCo/ MWCNT的颗粒小,这是Ni和NiCo与Pd2+进行还原反应的结果。从3种催化剂的TEM图中可知,催化剂都有少量的团聚现象,颗粒大小分别在4~6、8~10和5~8 nm。从图2(b′)和图2(c′)得出的颗粒大小数据与图2(b)和(c)不同,说明催化剂PdNi/MWCNT和PdNiCo/MWCNT是由许多小颗粒形成的。
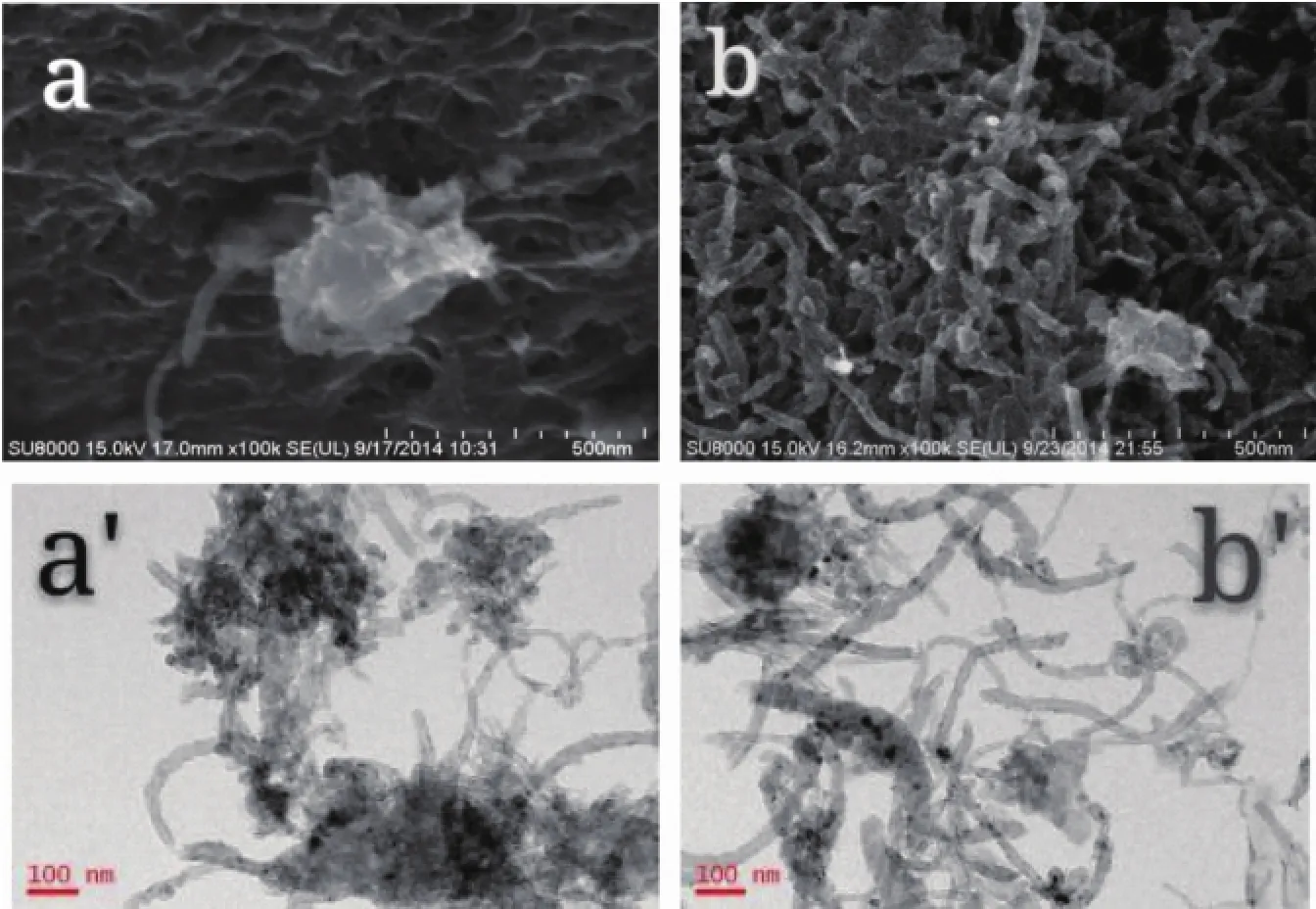
图1 Ni/MWCNT(a,a′)和NiCo/MWCNT(b,b′)的SEM(a,b)和TEM(a′,b′)图Fig.1 SEM(a,b)and TEM(a′,b′)images of Ni/MWCNT(a,a′)and NiCo/MWCNT(b,b′)
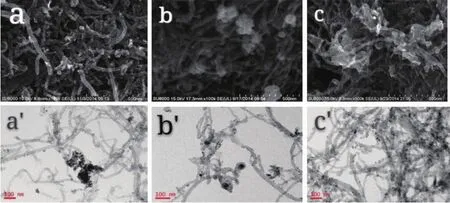
图2 Pd/MWCNT(a,a′),PdNi/MWCNT(b,b′)和PdNiCo/MWCNT(c,c′)的SEM(a,b,c)和TEM(a′,b′,c′)图Fig.2 SEM(a,b,c)and TEM(a′,b′,c′)images of Pd/MWCNT(a,a′),PdNi/MWCNT(b,b′)and PdNiCo/MWCNT(c,c′)
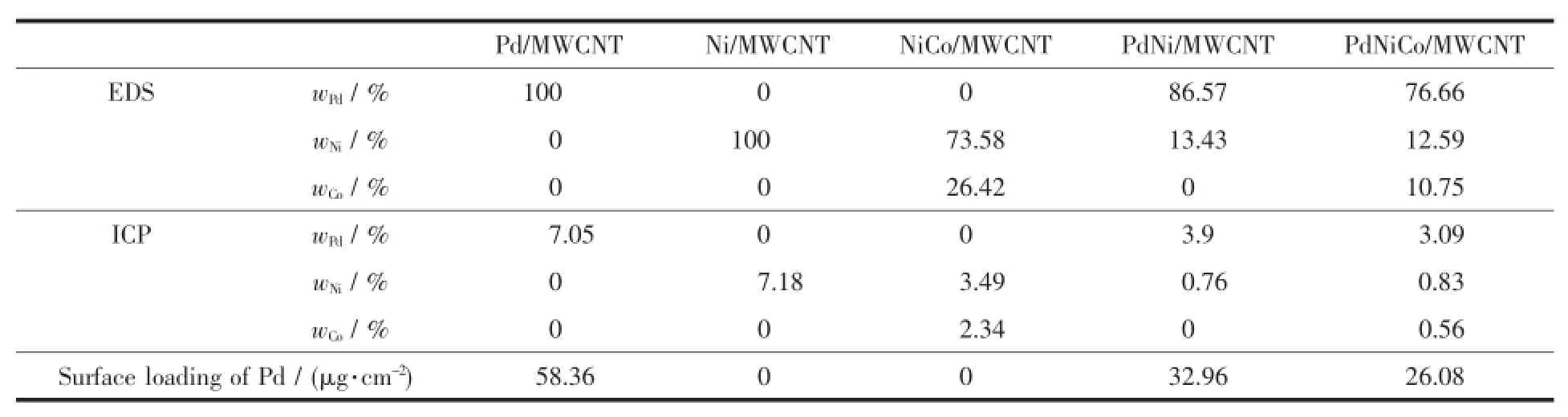
表1 不同催化剂的金属元素质量分数及电极表面Pd质量分数Table1 M ass percentage of the as-prepared catalysts and Pd loading on electrode of the prepared catalysts
催化剂表面上和催化剂整体中的金属含量分别用EDS和ICP技术进行了分析,结果见表1。EDS是对催化剂表面微区所激发的体积为10μm3左右所含各种元素含量的半定量分析,ICP是对催化剂中某种元素含量的定量分析。从表1看出,在制备NiCo/MWCNT的反应投料比为1:1,而实际反应后负载在MWCNT上的Co与Ni的质量比并不等于1,这是由于在pH较高时Co2+易形成氢氧化物而不易被还原成金属单质,可能在反应开始就形成的氢氧化物或氧化物被后来还原的Ni覆盖,或是在后续处理过程中流逝。从EDS分析可知,PdNi/ MWCNT和PdNiCo/MWCNT的Pd/Ni质量比分别为6.45和6.09,而ICP分析得到的Pd/Ni质量比分别为5.13和3.72,以此可知大部分Pd颗粒沉积在Ni颗粒和NiCo颗粒表面,是以原位沉积的方式进行反应的,这样增大了金属之间的接触面,Pd的活性位点有可能增多。表1显示,纯钯电极表面的含钯量最大,说明用NaBH4能很好地将Pd2+还原为Pd。Ni和Co的还原能力没有NaBH4强,使得反应并未按最初的投料比进行,与EDS分析结论相似。
图3为催化剂的XRD图,所有催化剂在衍射角为25.8°的衍射峰对应于MWCNT的(002)晶面。除Pd/MWCNT之外,其它催化剂在44.5°、51.9°和76.3°的衍射峰分别对应于Ni晶体的(111)、(200)和(220)面心立方晶体结构。Pd/MWCNT、PdNi/MWCNT和PdNiCo/MWCNT在40.1°、44.6°、68.1°和82.1°的衍射峰分别对应于Pd晶体(111)、(200)、(220)和(311)面心立方结构。NiCo/MWCNT在38.2°处的峰对应于NiOOH的(102)面,而衍射角为81.9°对应的是NiO晶体(222)面的立方晶体结构,因为在碱性环境下Ni和Co较易形成对应的氢氧化物和氧化物。Co的2θ衍射角与Ni的衍射角度相近,因此在图3中难以看出Co的衍射峰,只有在(e)中能看到2θ为34.0°处的峰对应的是Co晶体的(111)的面心立方结构。
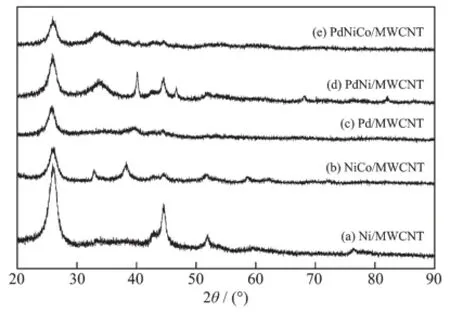
图3催化剂的XRD图Fig.3 XRD patterns of the prepared catalysts
图4为催化剂在1.0 mol·L-1NaOH溶液中的CV图,从图中看出,在PdNi/MWCNT和PdNiCo/ MWCNT催化剂上,氢的吸/脱附峰相对于Pd/ MWCNT而言向正向移动。在正向扫描过程中,PdNi/MWCNT和PdNiCo/MWCNT催化剂分别在电位为0.41和0.26 V附近出现明显的氧化电流,这是催化剂中高价镍开始形成所引起的;反向扫描过程中,在0.32 V附近出现的还原峰为Ni(Ⅲ)还原到Ni(Ⅱ)的特征峰。此外,PdNiCo/MWCNT催化剂在-0.1 V附近有一个明显的还原峰,它对应于Ni(Ⅱ)还原到Ni单质的过程,但PdNi/MWCNT上没有该还原峰,可能与其中镍的量较少有关(见表1)。从图4还可看出,Pd/MWCNT,PdNi/MWCNT和PdNiCo/ MWCNT 3种催化剂均在-0.38、-0.35和-0.32 V出现Pd的特征还原峰,对应的峰电流分别为14.2、21.7和26.6mA·cm-2。

图4催化剂在1.0mol·L-1NaOH溶液中的循环伏安曲线,v=50mV·s-1Fig.4 CVs of the prepared catalysts in 1.0mol·L-1NaOH solution at 50 mV·s-1
图5为催化剂在0.5mol·L-1乙醇存在下的CV图。在Pd/MWCNT,PdNi/MWCNT和PdNiCo/MWCNT催化剂上,乙醇氧化的起始电位分别在-0.51、-0.51和-0.48 V附近,峰电流密度分别为77.3、89.6和101.8 mA·cm-2,可以看到,在PdNiCo/MWCNT催化剂上的起始电位稍有提前,且峰电流密度差别很大,说明纯钯催化剂在催化乙醇氧化过程中电极表面的Pd会发生少量毒化,使得其催化性能降低,而加入过渡金属后催化剂抗毒化的能力增强。根据乙醇在钯基催化剂上的电氧化机理[23],即:(1)乙醇在催化剂表面形成吸附态乙氧基(CH3COad);(2)吸附态羟基(OHad)的形成;(3)CH3COad和OHad反应形成CH3COO-,以及“双功能效应”可以解释这一现象,在乙醇氧化反应开始阶段(电位<-0.52 V)电极表面吸附了大量的OHads,在第二种金属存在下,降低了水活化的电位,因此OHads会在水活化之后脱离电极表面,使Pd的活性位点暴露出来。Liang等人的研究表明,CH3COads和OHads在电极表面和溶液间的转移是反应的决速步骤[23],因此在Ni和NiCo存在时,乙醇氧化的电流密度比纯钯催化剂的大,而Co的加入改善了催化剂的分散性,Pd的活性位点更多,所以PdNiCo/MWCNT对乙醇氧化的电流密度要大于PdNi/MWCNT。从图5还能看到,催化剂正向扫描的氧化峰比负向扫描的氧化峰大,3种催化剂的正向氧化峰与负向氧化峰的峰电流之比分别为1.3、1.2、1.3。负向扫描氧化峰电流的大小主要取决于正向扫描氧化之后,形成的产物从电极表面转移到溶液本体的快慢,比例越大说明产物转移速率越快,电极表面能放出更多的活性位点供下一循环使用,也表明所制备的催化剂有更好的电催化活性以及更好的去除中间体产物的能力[24]。据报道,碳负载的PdNi合金系列催化剂(金属碳载量20%)对1 mol·L-1乙醇的氧化电流密度最大为29.16 mA·cm-2[25];用乙二醇还原法制备Pd含量20%的PdNi/MWCNT催化剂,在扫速20 mV·s-1时对乙醇的氧化电流为34 mA·cm-2[26]。表明本文所报道的催化剂的活性要优于相关文献报道的结果。因此,将Pd纳米颗粒原位沉积在Ni和NiCo颗粒的表面,有利于增大Pd纳米颗粒的催化活性位点,提高了Pd纳米颗粒对乙醇氧化的电催化活性,同时降低了催化剂中的Pd含量,有利于降低燃料电池的成本。

图5 催化剂在1.0mol·L-1NaOH+0.5mol·L-1EtOH溶液中的循环伏安曲线,v=50mV·s-1Fig.5 CVs of the prepared catalysts in 1.0mol·L-1NaOH+0.5 mol·L-1EtOH solution at 50mV·s-1
利用恒电位阶跃比较了不同催化剂的电活性稳定性,图6为催化剂在电位为-0.4 V时乙醇氧化电流的变化情况。在3种催化剂上,乙醇氧化的电流密度在电解初始阶段都迅速下降,这是因为电极/溶液界面双电层充电,以及界面处乙醇浓度迅速下降引起的。但在约100 s之后电流都趋于稳定。恒电位电解600 s后,在Pd/MWCNT、PdNi/MWCNT和 PdNiCo/MWCNT催化剂上乙醇氧化的电流密度分别为2.7、4.1和8.6mA·cm-2,进一步表明PdNiCo/ MWCNT催化剂对乙醇氧化具有较强的电活性。
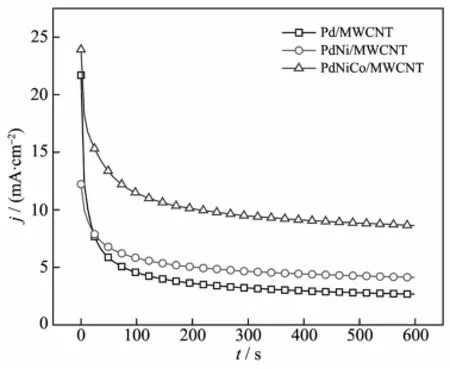
图6 催化剂在1.0 mol·L-1NaOH+0.5mol·L-1EtOH溶液中的恒电位阶跃曲线,阶跃电位为-0.4 VFig.6 Chronoamperograms obtained on the prepared catalysts at-0.4 V in 1.0mol·L-1NaOH+0.5 mol·L-1EtOH solution
PdNiCo/MWCNT催化剂在不同乙醇浓度下的循环伏安曲线见图7。从图7a可知,随着乙醇浓度的增大,电流密度也相应地增大,但当浓度达到1.5 mol·L-1时峰电流开始下降,在乙醇浓度0.1~0.7 mol·L-1范围内,峰电流几乎呈直线增加,此后增加缓慢(见图7b)。在半峰电位之前电极表面进行的反应是OHads的形成,催化剂对乙醇氧化的峰电流是OHads和CH3COads共同作用的结果。OHads吸附到电极表面的浓度随乙醇浓度的增大而增大,在较低浓度下,电极表面的OHads和CH3COads浓度并未达到饱和,且在较低电位时,OHads的吸附与CH3COads的反应是相对独立进行的,当浓度高于1.5mol·L-1时,随电位慢慢变大,OHads和CH3COads的浓度也增大了,趋近于达到饱和状态时在电极表面就会形成竞争关系,在较高电位下,CH3COads的浓度将会占主导地位,CH3COads大量迁移到电极表面并将取代OHads的位置,OHads向电极表面迁移将受限,由此也将导致峰电流的下降[23]。在乙醇浓度为1.5mol·L-1,电位为0.019 V时催化剂对乙醇氧化的峰电流密度为160.6mA·cm-2,当电位超过此峰值电位时,电极表面的Pd开始发生氧化反应,NiCo也相应被氧化而形成各自对应的氧化物或氢氧化物,电极表面Pd的活性表面积减小,阻碍了对乙醇的催化作用而导致电流密度下降。正向扫描形成的氧化物或氢氧化物在反向扫描过程中被还原为金属,可作为下一个循环的活性物质继续发挥其催化作用。从图7c看出,随乙醇浓度增大,峰电位的增幅也减小,可能是OHads和CH3COads之间的反应达到了一个相对稳定的状态,导致在较高乙醇浓度时的峰电位增加变缓。
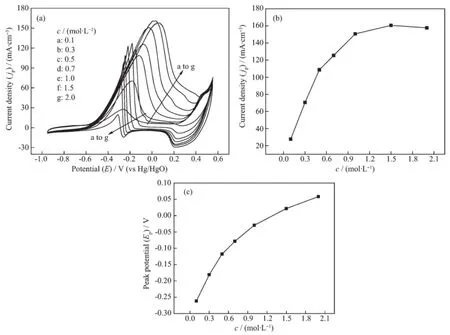
图7 (a)PdNiCo/MWCNT在1.0mol·L-1NaOH中,不同浓度乙醇(图中数字)的循环伏安曲线,v=50mV·s-1, (b)乙醇浓度与峰电流的关系,(c)乙醇浓度与峰电位的关系Fig.7 CVs of PdNiCo/MWCNT catalyst in 1.0mol·L-1NaOH with EtOH range from 0.1mol·L-1to 2.0mol·L-1at50mV·s-1(a), plots of EtOH concentration vs anodic peak current density jp(b)and EtOH concentration vs anodic peak potential Ep(c)
不同电位扫描速度下PdNiCo/MWCNT对乙醇氧化的循环伏安图见图8a。从图8b看到乙醇氧化的峰电流在扫速低于100 mV·s-1时呈直线增加,扫速进一步增大时峰电流缓慢增加,主要原因是电极附近乙醇的氧化反应速率随扫速增大而增大,乙醇浓度下降的趋势也增强,整个电极反应过程受电极附近乙醇浓度变化影响较大,且本体溶液中的乙醇扩散到电极附近的速率有限,在较高的扫描速度下电极反应是浓差极化控制过程[6]。图8c表明,峰电位随扫速增大也呈现正向移动的趋势,除在低扫速下增幅稍大之外,在50mV·s-1之后,峰电位随扫速变化呈现缓慢的增加,可能与过电位对OHads的形成以及在电极表面的迁移有较大影响,而对CH3COads的形成和迁移影响不大有关。在反向扫描过程中,Pd的还原电位负移,有可能是Pd的氧化物表面吸附了OHads,OHads的解吸需要在一定的过电位下才能进行。

图8 PdNiCo/MWCNT在1.0mol·L-1NaOH+0.5mol·L-1EtOH溶液中不同扫速(图中数字)的循环伏安曲线(a),扫速与峰电流的关系(b),扫速与峰电位的关系(c)Fig.8 CVs of PdNiCo/MWCNT catalyst in 1.0mol L-1NaOH+0.5mol L-1EtOH solution at various sweep rates(a), plots of sweep rate vs the anodic peak currency density jp(b)and sweep rate vs the anodic peak potential Ep(c)
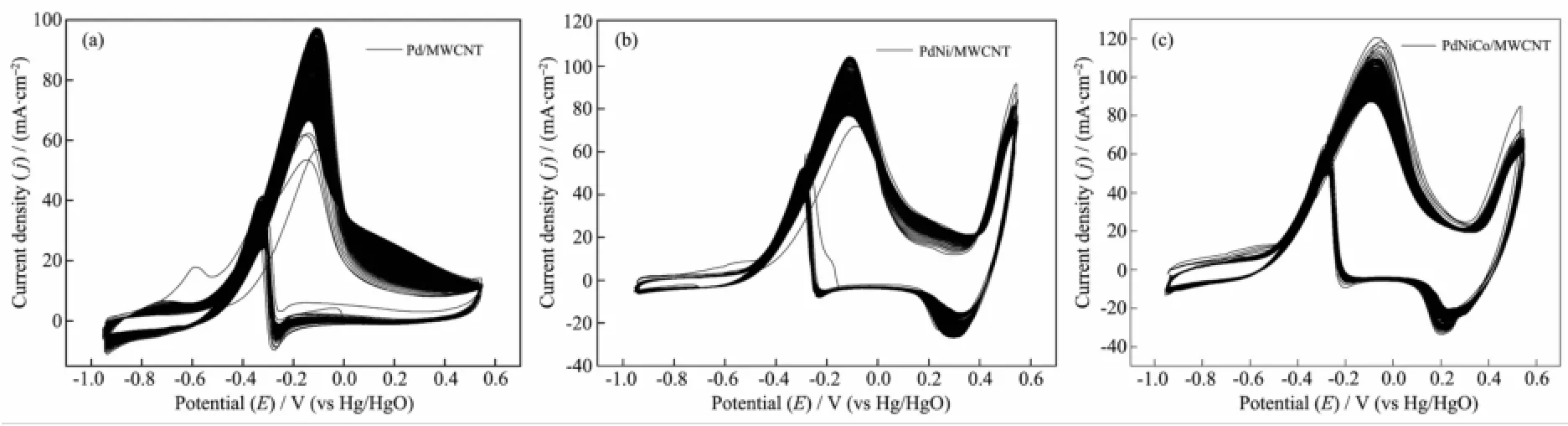
图9 Pd/MWCNT(a),PdNi/MWCNT(b)和PdNiCo/MWCNT(c)在1.0mol·L-1NaOH+0.5mol·L-1EtOH溶液中,连续循环扫描400次的循环伏安曲线,v=100mV·s-1Fig.9 CVs of Pd/MWCNT(a),PdNi/MWCNT(b)and PdNiCo/MWCNT(c)catalysts in 1.0mol·L-1NaOH+0.5mol·L-1EtOH solution for consecutive 400 cycles at100mV·s-1
采用连续循环伏安法进一步研究了催化剂对乙醇电催化氧化活性的稳定性,图9为催化剂在含0.5mol·L-1EtOH的1.0 mol·L-1NaOH溶液中,连续进行400次循环扫描的结果,3种催化剂的CV图形没有太大变化,随着扫描次数的增加,除峰电位附近的电流密度有所下降外,其他电位下的电流密度并未发生很大的变动。3种催化剂对应的最大峰电流密度分别为97.4、103.9和112.4mA·cm-2,循环400次之后分别为66.5、76.8和87.7 mA·cm-2,其下降的降幅分别为31.7%、26.1%、22.0%。这是因为随着反应的进行,溶液中的乙醇浓度有所下降,而在峰电位附近时乙醇浓度对电极反应的影响较大,从而导致峰电流下降比较明显。对比3种催化剂的CV图形不难看出,纯钯催化剂的催化性能受乙醇浓度变化更为明显,峰电流下降更多,这也说明它的稳定性不如掺杂过渡金属催化剂的稳定性,其稳定性次序为PdNiCo/MWCNT>PdNi/MWCNT>Pd/ MWCNT。
3 结论
以水合肼为还原剂,制备了负载于碳纳米管上的纳米镍和纳米镍钴颗粒。以此颗粒为还原剂与PdCl2溶液反应,还原Pd2+得到负载在多壁碳纳米管表面的PdNi/MWCNT和PdNiCo/MWCNT催化剂。采用扫描电镜,透射电镜和X射线粉末衍射对所制备的催化剂的形貌和微结构进行了表征,结果显示Ni/MWCNT和NiCo/MWCNT颗粒是由直径分别为8~15和8~13 nm的小颗粒团聚形成的,粒径分别约为250和150 nm,Pd-Ni/MWCNT和PdNiCo/ MWCNT催化剂是由粒径为8~10和5~8 nm小颗粒形成的、粒径为60~100和30~50 nm球形颗粒。EDS数据显示,Pd2+与Ni/MWCNT和NiCo/MWCNT反应以原位沉积的方式进行,形成的Pd纳米颗粒包覆在镍和镍钴颗粒表面。采用循环伏安和恒电位阶跃技术,对所制备的催化剂在碱性环境中对乙醇的电氧化催化活性进行了测试。结果表明,三金属对乙醇的电氧化催化活性最高,乙醇氧化的峰电流密度达101.8mA·cm-2,并表现出更好的稳定性。
[1]Rousseau S,Coutanceau C,Lamy C,et al.J.Power Sources, 2006,158(1):18-24
[2]ZhouW J,Zhou ZH,Song SQ,etal.App l.Catal.B:Environ., 2003,46:273-285
[3]Mohammad K,Forouzan A,Ham id R L Z Z,et al.J.Fuel Chem.Technol.,2013,4(1):91-95
[4]TANG Ya-Wen(唐亚文),BAO Jian-Chun(包建春),ZHOU Yi-Ming(周益明),et al.Chinese J.Inorg.Chem.(无机化学学报),2003,19(8):905-908
[5]CHEN Ying(陈滢),TANG Ya-Wen(唐亚文),GAO Ying(高颖),et al.Chinese J.Inorg.Chem.(无机化学学报),2008, 24(4):560-564
[6]CHEN Qing-Hua(陈清华),YIQing-Feng(易清风).Chinese J.Inorg.Chem.(无机化学学报),2015,31(6):1145-1152
[7]Xu CW,Shen PK,Liu Y L.J.Power Sources,2007,164(2): 527-531
[8]LI Ruo-Shi(李若诗).Thesis for the Doctorate of Fudan University(复旦大学博士论文).2013.
[9]Ding K Q,Yang H W,Cao Y L,et al.Mater.Chem.Phys., 2013,142(1):430-411
[10]Amideddin N,Abbas A K,Yadollah M,et al.Electrochim. Acta,2014,147:192-200
[11]Yang G H,Zhou Y Z,Pan H B,et al.Ultrason.Sonochem., 2016,28:192-198
[12]YIN Wen-Ping(阴文平).Thesis for the Master of Tianjin University(天津大学硕士论文).2010.
[13]Mao H,Huang T,Yu A S.Electrochim.Acta,2015,174:1-7
[14]Zhang Yu(张宇).Thesis for the Master of Shenyang Ligong University(沈阳理工大学硕士论文).2013.
[15]YiQ F,Sun L Z,Liu X P,etal.Fuel,2013,111:88-95
[16]Zhang Z Y,Xin L,Sun K,et al.Int.J.Hydrogen Energy, 2011,36(20):12686-12697
[17]Tsui L,Zafferoni C,Lavacchi A,et al.J.Power Sources,2015,293:815-822
[18]Antolini E,Salgado J R C,Gonzalez E R.J.Electroanal. Chem.,2005,580:145-154
[19]Siracusano S,Stassi A,Baglio V,et al.Electrochim.Acta, 2009,54:4844-4850
[20]Antolini E,Salgado J R C,Gonzalez E R.Appl.Catal.B: Environ.,2006,63:137-149
[21]JIN Chun-Gui(晋传贵),TAN Jie(檀杰).J.Anhui University of Technology(安徽工业大学学报),2007,24(1):36-38
[22]MarchionniA,BevilacquaM,BianchiniC,etal.ChemSusChem, 2013,6:518-528
[23]Liang Z X,Zhao T S,Xu J B,et al.Electrochim.Acta, 2009,54:2203-2208
[24]Manohara R,Goodenough JB.J.Mater.Chem.,1992,2:875-887
[25]LI Qiao-Xia(李巧霞),LIU Ming-Shuang(刘明爽),MAO Hong-Min(毛宏敏),et al.J.Shanghai University of Electric Power(上海电力学院学报),2012,28(6):565-568
[26]Chen W M,Zhang Y,Wei X F.Int.J.Hydrogen Energy, 2015,40(2):1154-1162
In Situ Formation of Ternary Pd-Ni-Co Nanocatalyst on MWCNT for Ethanol Electro-oxidation in Alkaline M edia
CHEN Qing-Hua1YIQing-Feng*,1,2YANG Zheng1ZHOU Xiu-Lin1LIU Xiao-Ping1NIE Hui-Dong1XUGuo-Rong1
(1School of Chemistry and Chemical Engineering,Hunan University of Science and Technology,Xiangtan,Hunan 411201,China) (2Key Laboratory of Theoretical Organic Chemistry and Function Molecule,Ministry of Education, Hunan University of Science and Technology,Xiangtan,Hunan 411201,China)
Ni/MWCNT and NiCo/MWCNT nanoparticleswere firstly prepared by chemical reductionmethod with hydrazine as reductant in a mixture medium of water and alcohol using Multi-walled carbon nano-tubes (MWCNTs)as the support.PdNi/MWCNT and PdNiCo/MWCNT catalysts were then prepared through an in-situ reduction by the reaction of the Ni/MWCNT and NiCo/MWCNT with the aqueous PdCl2solution respectively. SEM and TEM images show that the large aggregates on the surface of MWCNTs with the diameter of 30~100 nm are composed of small particles with the diameter of 5~10 nm.The ternary PdNiCo catalyst presents the smaller diameter than PdNi catalyst,as well as the better dispersity on MWCNT.ICP and EDS analyses reveal that Pd nanoparticles are directly reduced and coated on the surface of Ni and NiCo nanoparticles.The electrochemical activity of the catalysts towards ethanol oxidation in alkalinemedia has been examined by cyclic voltammetry(CV)and chronoamperometry(CA)methods.PdNiCo/MWCNT catalyst presents an anodic peak current density of 101.8 mA·cm-2for ethanol oxidation inalkalinemedium.Long-term cyclic voltammetric tests show superior stability of Pd nanoparticles upon addition of Niand NiCo to the support.
Pd catalyst;ethanol oxidation;Ni nanoparticles;fuel cell;in situ reduction
O614.82+3
A
1001-4861(2016)07-1161-09
10.11862/CJIC.2016.163
2015-12-17。收修改稿日期:2016-03-30。
国家自然科学基金(No.21376070)和湖南省自然科学基金(No.14JJ2096)资助项目。
*通信联系人。E-mail:yqfyy2001@hnust.edu.cn;会员登记号:S060019184M。

