溶血磷脂酸通过RhoA⁃YAP通路调控脂肪干细胞增殖的研究
叶亚平 李觅 吴颖星 黄俊明 印卫锋 郭风劲
·实验研究论著·
溶血磷脂酸通过RhoA⁃YAP通路调控脂肪干细胞增殖的研究
叶亚平 李觅 吴颖星 黄俊明 印卫锋 郭风劲
目的探讨溶血磷脂酸(lysophosphatidic acid,LPA)调控脂肪干细胞(adipose⁃derived stem cells,ASCs)增殖的作用及其分子机制。方法分离SD大鼠ASCs,利用LPA对其进行干预,干预时间为1 h,采用Western Blot检测YES相关蛋白(yes associated protein,YAP)、结缔组织生长因子(connective tissue growth factor,CTGF)蛋白表达水平。利用免疫荧光检测YAP亚细胞定位,逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT⁃PCR)检测CTGF和Ankrd1的mRNA表达水平。慢病毒转染ASCs,Western Blot检测不同分组YAP蛋白表达。进一步利用流式细胞术和CCK⁃8法检测不同分组中ASCs增殖情况。最后采用RhoA抑制剂C3干预,免疫荧光检测不同分组中YAP亚细胞定位,Western Blot检测YAP、CTGF和GTP⁃RhoA的表达情况。结果LPA能显著促进YAP的表达和在细胞核内的聚集,同时LPA也能够促进YAP靶基因CTGF在蛋白水平的表达。LPA能上调YAP靶基因CTGF和锚蛋白重复域1(ankyrin repeating domain 1,Ankrd1)的mRNA表达水平。慢病毒转染敲除YAP表达后,LPA对YAP的上调作用被明显抑制。细胞周期流式细胞术和CCK⁃8检测结果显示LPA可显著促进ASCs的增殖,但在shYAP慢病毒转染特异性敲除YAP后,LPA对ASCs的促增殖能力被明显削弱。RhoA抑制剂C3处理后,LPA对YAP细胞核聚集的促进作用被削弱,同时LPA对YAP、CTGF和GTP⁃RhoA表达的促进作用也得到了明显抑制。结论LPA能够通过RhoA⁃YAP通路调控ASCs的增殖。
溶血磷脂酸;脂肪干细胞;RhoA⁃YAP通路;细胞增殖
间充质干细胞为具有自我更新能力的成体干细胞,其能向中胚层方向(如软骨细胞、成骨细胞和脂肪细胞等)分化[1]。间充质干细胞存在于诸多部位,如骨髓、脂肪、牙髓及滑膜等组织中[2,3]。Zuk等[4]学者最早在脂肪组织中发现间充质干细胞,并将其命名为脂肪干细胞(adipose⁃derived stem cells, ASCs)。De Ugarte等[5]发现分离获取ASCs与其他来源的间充质干细胞比较,操作更为简单,所获取的细胞量也更大。目前以ASCs为种子细胞的多项临床试验正在进行中[6]。但是利用ASCs等干细胞的治疗依旧具有局限性,主要因为移植的细胞数目偏低,且移植的细胞容易发生凋亡[7]。促进ASCs细胞的增殖能力对于有效提高以ASCs为种子细胞的临床治疗效果意义重大,目前仍缺乏关于ASCs细胞增殖及其分子机制的相关研究报道。
YES相关蛋白(yesassociated protein,YAP)能显著促进细胞增殖、器官发育及肿瘤生长[8]。Hippo通路能通过磷酸化YAP的127丝氨酸位点从而抑制YAP进入细胞核并导致YAP表达下调[9]。Hippo⁃YAP通路在细胞增殖、凋亡、迁移和分化等领域中发挥着十分重要的作用[8]。Yung等[10]研究显示溶血磷脂酸(lysophosphatidic acid,LPA)能通过G蛋白偶联受体来调控细胞增殖、存活、黏附迁移等一系列生物学行为。LPA能通过激活ERK1/2和PI3K/AKT通路从而抑制H2O2导致的骨髓间充质干细胞(bone marrow⁃derived stem cells,BMSCs)凋亡[11]。Radeff⁃Huang等[12]研究显示LPA能够抑制其他细胞(如成纤维细胞、肠上皮细胞、肾小管上皮细胞等)的凋亡。Yu等[13]于2012年报道了他们的研究,结果显示LPA能够调控乳腺癌上皮细胞中YAP的表达。但是LPA对于ASCs增殖的作用及其相关机制尚未见文献报道。
LPA对于ASCs的促增殖作用,LPA相关分子机制对提高ASCs干细胞治疗的效果和ASCs在再生医学中的研究意义重大。在本研究中,我们将对其作用和相关分子机制进行详细阐述。
材料与方法
一、实验材料与仪器
DMEM培养基、胎牛血清(Gibco公司,美国),Ⅰ型胶原酶、胰蛋白酶、结缔组织生长因子(connec⁃ tive tissue growth factor,CTGF)一抗、辣根过氧化物酶偶联二抗(Santa Cruz公司,美国),RhoA抑制剂C3(Cytoskeleton公司,美国),YAP一抗(CST公司,美国),GTP⁃RhoA一抗、RhoA检测试剂盒(Thermo公司,美国),RIPA裂解缓冲液(上海碧云天生物科技公司),Alexa Fluor488免疫荧光二抗、Alexa Fluor 594免疫荧光二抗、TrizolReagent(Invitrogen公司,美国),DAPI染液(博士德公司,中国),逆转录聚合酶链反应(reverse transcription polymerase chain reac⁃tion,RT⁃PCR)试剂盒、Taq聚合酶、dNTP(MBI公司,美国),引物合成(北京擎科生物技术有限公司),RNA酶、PI染液(Sigma公司,美国),IQ SYBR Green supermix(Bio⁃Rad公司,美国),流式细胞仪(FAC⁃Sort,BD公司,美国),CCK⁃8细胞增殖检测试剂盒(日本同仁生物科技公司,日本),蛋白定量检测试剂盒(武汉博士德生物工程有限公司),慢病毒构建(上海吉凯生物科技有限公司),荧光显微镜(奥林巴斯公司,日本)。
二、实验方法
(一)ASCs的分离、培养
选取200~250 g成年SD大鼠(由华中科技大学同济医学院实验动物中心提供)。所有实验动物操作都经过华中科技大学同济医学院伦理委员会批准。手术分离得到大鼠腹股沟脂肪组织后,仔细修剪并去除血管及浅筋膜等结缔组织,用眼科剪剪至糊状,加入2倍于组织体积的0.1%Ⅰ型胶原酶,37℃水浴30min,加入等体积的含10%胎牛血清的DMEM终止消化,900×g离心10min后去掉上清液,沉淀物用5m l含10%胎牛血清的DMEM重悬,并以80目尼龙筛网过滤,倒置显微镜下观察并计数后,将细胞种植于25 cm2培养瓶中,置于37℃、5%CO2孵箱内培养,并标记为原代。以后每隔2 d换液1次,并于换液后在倒置显微镜下观察细胞生长状况和形态特征。待细胞接近融合时用0.25%胰蛋白酶消化,按1∶2比例传代。
(二)免疫荧光染色
PBS漂洗后将不同分组中的细胞以4%多聚甲醛固定15min,然后以0.1%Triton X⁃100于室温下穿孔处理10 min。5%BSA封闭处理1 h后,将细胞爬片以YAP一抗4℃条件下孵育过夜。PBS漂洗3次,再以Alexa Fluor 488免疫荧光二抗或AlexaFluor 594免疫荧光二抗室温下继续孵育1 h。PBS漂洗3次,室温下DAPI染色孵育5min。再次PBS漂洗去除背景干扰。最后将细胞置于荧光显微镜下观察。
(三)Western Blot检测
收获细胞,用RIPA裂解缓冲液裂解细胞,提取总蛋白。用蛋白定量检测试剂盒对总蛋白进行定量。蛋白上样量为25μg,SDS⁃PAGE法分离蛋白质,将蛋白质转移到硝化纤维膜上,用5%脱脂牛奶进行封闭。然后使用相应一抗抗体进行孵育,4℃过夜。漂洗后再加入辣根过氧化物酶偶联的抗兔二抗,室温下孵育2 h。最后采用化学发光法对蛋白表达浓度进行检测,选取GAPDH为内参。条带强度以Quantity One软件进行相对定量。
(四)RT⁃PCR检测
收获细胞,PBS轻柔漂洗,并使用Trizol分别提取各组细胞的总RNA,按逆转录试剂盒的操作步骤逆转录得到cDNA,并选取逆转录产物进行实时荧光定量RT⁃PCR。CTGF、锚蛋白重复域1(ankyrin repeating domain 1,Ankrd1)、GAPDH引物标记采用荧光染料SYBR GreenⅠ(表1)。聚合酶链反应程序为:95℃预变性2min;95℃变性10 s,55℃退火30 s,72℃延伸30 s,该步骤循环40次;溶解曲线。反应结束后在PCR仪上读取Ct值,并进行相应计算。以GAPDH为内参。
(五)CCK⁃8法检测细胞增殖
将不同分组细胞以2×103个/孔的密度种植于96孔板中。细胞分别予以LPA或不予以LPA进行处理,处理时间分别为1 d、2 d、3 d。将10μL的CCK⁃8染液加入每个孔中,于37℃条件下避光孵育2 h。之后于490 nm波长下微孔板分光光度计中读取不同孔中的吸光度值(A490)并以此来计算细胞相对数量。种植细胞每24 h标记为1 d。记录不同时间点分光光度计中的A490,并与2×103个细胞组A490进行比较计算出实际细胞数目,研究细胞增殖情况。
(六)流式细胞术检测细胞周期
PBS漂洗细胞2次,70%冷乙醇于-20℃条件下孵育过夜。乙醇固定后的细胞以RNA酶于37℃条件下处理30min,然后以PI染液室温下避光染色30min。PI染液的荧光强度采用流式细胞术进行检测。数据采用FlowJo软件进行分析。
(七)慢病毒载体的构建和转染
将YAP特异性限制位点(NM_001034002)插入GV118质粒中。YAP特异性抑制位点序列为GGCAATACGGAATATCAAT。插入YAP特异性抑制位点序列后的产物以双酶切法及DNA测序法进行进一步验证。之后采用Lipofectamine 2000将慢病毒载体系统转染进入293T细胞,连续稀释法测定病毒滴度。最后根据吉凯公司的操作说明将慢病毒转染进入ASCs细胞中,并于24孔板中继续培养。72 h后丢弃上清液,更换为普通DMEM培养基进行培养。
为了进一步研究LPA对YAP的调控作用,我们在LPA干预前利用shYAP慢病毒对YAP表达进行了特异性的敲除。慢病毒转染成功后72 h再采用LPA对细胞进行干预,干预时间为24 h。随机序列shRNA被标记为shControl组,YAP特异性敲除shRNA被标记为shYAP组。最后采用Western Blot对YAP蛋白表达进行分析。
慢病毒转染ASCs后,采用LPA对ASCs进行进一步干预,干预时间为72 h,72 h后采用流式细胞术分析ASCs细胞周期,并利用CKK⁃8法于24 h、48 h和72 h对细胞进行计数。S及G2/M期细胞所占比例代表细胞增殖情况。
(八)GTP⁃RhoA检测
利用RhoA检测试剂盒对RhoA进行定量检测。采用GST⁃rhotekin⁃RBD融合蛋白及谷胱甘肽树脂下拉激活的RhoA。最后利用RhoA特异性抗体对激活的RhoA进行检测。
采用RhoA特异性抑制剂C3(1mg/L)对LPA调控ASCs细胞的分子机制进行进一步研究。ASCs预先以C3干预2 h,再以LPA干预4 h,最后固定细胞进行免疫荧光及Western Blot分析。
三、统计学处理

表1 各基因引物序列
采用SPSS 11.0统计软件分析。数据以均数±标准差(±s)表示,两组间比较采用独立样本t检验,多组间比较采用oneway⁃ANOVA检测。P<0.05为差异有统计学意义。
结果
一、LPA对YAP表达的影响
将LPA(10μmol/L)加入ASCs细胞培养液中,作用时间共计1 h。结果显示LPA可以显著上调YAP蛋白的表达,随着作用时间的延长,LPA对YAP蛋白的上调效益更加明显(图1)。CTGF和Ankrd1为YAP蛋白的下游靶基因,我们也采用Western Blot对CTGF的表达进行的分析。结果显示,LPA(10μmol/L)亦可以显著上调CTGF蛋白的表达,且该促进作用同样具有时间依赖性(图1)。同时,我们利用免疫荧光染色对YAP的亚细胞定位和表达进行分析,结果显示LPA作用1 h后,YAP在细胞核内表达得到明显增强(图2 a)。同时,RT⁃PCR检测结果也进一步显示LPA作用可以显著促进CTGF的表达(图2 b)。
二、shRNA慢病毒转染对YAP表达的调控
研究shRNA慢病毒转染对YAP的调控作用,采用Western Blot对YAP蛋白表达进行分析,结果显示shYAP慢病毒转染能特异性抑制YAP蛋白的表达,同时shYAP慢病毒敲除YAP之后LPA虽然依旧能够轻微促进YAP表达,但其促进YAP表达的效果不明显,差异无统计学意义(P>0.05,图3)。而在shControl组中,LPA可显著上调YAP的表达,且该促进效果差异具有统计学意义(P<0.05,图3)。
三、LPA对ASCs增殖的调控作用研究
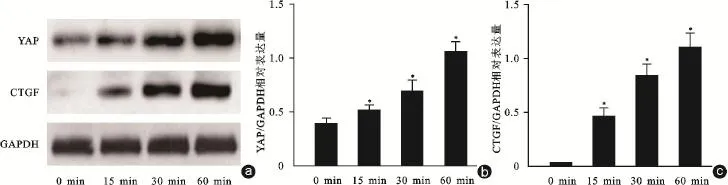
图1 LPA对YAP和CTGF表达的调控作用a~c:LPA能够显著上调YAP和CTGF的表达,且其促进作用具有时间依赖性。与0 min比较,*P<0.05

图2 LPA对YAP亚细胞定位及其靶基因表达的调控作用(Alexa Fluor 488染色,×200)a、b:LPA能显著促进YAP在细胞核内的表达,并上调其靶基因CTGF和Ankrd1的表达。与未加LPA比较,*P<0.05
慢病毒转染ASCs后,采用LPA对ASCs进行进一步干预,结果显示与shControl组相比,shYAP组ASCs细胞增殖受到明显抑制(P<0.05)。shControl组+LPA与shControl组比较,可见LPA能够显著促进ASCs的增殖(P<0.05,图4),我们推测这种增殖效益可能与LPA能促进YAP的表达相关。同时,CCK⁃8计数结果显示,shControl组中,LPA干预后的ASCs细胞增殖能力最强,而shYAP组ASCs细胞增殖能力被明显抑制(图4)。
四、RhoA⁃YAP通路在LPA调控ASCs中的作用研究
免疫荧光研究结果显示,LPA(10μmol/L)能够显著促进YAP在细胞核内的表达,加入RhoA特异性抑制剂C3(1mg/L)后,LPA对YAP细胞核内表达的上调作用得到明显减弱(图5 a)。同时,Western Blot显示RhoA特异性抑制剂C3干预可显著抑制LPA对YAP、CTGF和GTP⁃RhoA的上调作用(图5 b)。因此,我们的结果初步显示LPA可能通过RhoA来调控YAP的表达,并进一步影响ASCs的增殖等生物学行为。
讨论

图3 慢病毒转染ASCs细胞a、b:shYAP转染能显著抑制YAP表达,同时LPA对YAP表达的促进作用被shYAP转染削弱。与shControl比较,*P<0.05

图4 ASCs细胞增殖情况a、b:利用流式细胞术分析细胞周期,结果显示LPA可以显著促进ASCs增殖,shYAP转染后LPA对ASCs的促增殖作用得到明显抑制;c:CCK⁃8法分析细胞增殖,结果进一步证实LPA能有效促进ASCs增殖,同时shYAP转染抑制YAP表达后,LPA对ASCs促增殖作用得到明显抑制。与shYAP比较,*P<0.05;与shControl组比较,#P<0.05
ASCs为具有多向分化潜能且分离获取相对容易的一类成体干细胞,其临床应用前景良好。ASCs能显著促进受损组织或器官的功能恢复,相比骨髓间充质干细胞而言,ASCs的分离获取更加简便、微创。Barba等[14]研究显示ASCs在体外传代次数更多,且增殖能力也更强。ASCs在骨修复和骨重建的过程中发挥着十分关键的作用,骨形态发生蛋白2与ASCs结合应用可以显著促进其骨修复效果。Ma⁃rino等[15]研究显示磷酸钙三维支架可以显著促进ASCs的成骨分化。Arrigoni等[16]采用羟基磷灰石或者种植有ASCs细胞的羟基磷灰石来治疗胫骨骨缺损,他们以骨形态学、生物力学、免疫组化为研究指标,显示种植有ASCs的羟基磷灰石支架与单独羟基磷灰石支架相比可以显著促进其骨缺损修复效果。Yeh等[17]发现ASCs在靶组织或器官中的数量对于提高治疗效果至关重要。因此,对于ASCs增殖及其相关分子机制的研究意义重大。

图5 LPA通过RhoA调控YAP表达(Alexa Fluor 594染色,DAPI染色,×200)a:免疫荧光分析显示LPA可以促进YAP在细胞核内表达,RhoA抑制剂C3能够显著削弱LPA对于YAP核内表达的促进作用;b:RhoA抑制剂C3能够削弱LPA对于YAP、CTGF及GTP⁃RhoA表达的促进作用
LPA能够通过G蛋白偶联受体来调控细胞的一系列生物学行为,其下游信号包括Ras、Rac和MAPK等[18]。下游信号通路的激活能进一步调控细胞的增殖、迁移、分化等生物学行为。Cai等[19]研究发现LPA⁃LPA3⁃G13⁃RhoA⁃ROCK⁃PP1A⁃dpYAP⁃AREG⁃EGFR信号轴在卵巢癌上皮细胞转移中起着关键的作用。另Chen等[20]研究显示在急性心肌梗死患者急性发病时间为48~72 h,LPA浓度可上升至10mg/L,可能是因为LPA可以通过调控间充质干细胞的增殖或者存活以提供对心脏的保护作用。LPA也能够抑制缺氧诱导的间充质干细胞凋亡,并且LPA诱导凋亡的浓度与其在血液中的浓度(2~20μmol/L)十分一致[21]。Chen等[22]的研究进一步显示LPA抗间充质干细胞凋亡的分子机制可能与LPA1受体相关,LPA1受体的激活介导LPA对新生大鼠心脏成纤维细胞凋亡的调控。LPA也能够通过LPA1受体来调控Schwann细胞的程序性细胞死亡[23⁃25]。LPA1下游的信号通路包括ERK1/2和PI3K/Akt通路,Li等[26]研究显示这两条通路与LPA对许多不同细胞的抗凋亡作用关系密切。考虑到LPA是具有多种生物学活性的脂类小分子,若能通过LPA调控ASCs的增殖将有助于进一步优化ASCs对相关的疾病的治疗效果。
我们拟阐明LPA对ASCs的调控作用及其相关分子机制。本实验结果表明LPA能显著促进YAP的表达和在细胞核内的聚集,同时LPA也能够促进YAP靶基因CTGF在蛋白水平的表达。LPA能进一步上调YAP靶基因CTGF和Ankrd1在mRNA水平的表达。之后我们利用慢病毒转染特异性敲除YAP表达,以研究LPA对YAP表达的调控作用。结果显示LPA在shControl组中可显著促进YAP的表达,而在shYAP组中,LPA对YAP的上调作用得到明显抑制。随后利用流式细胞术和CCK⁃8对ASCs的增殖能力进行了分析研究,结果显示LPA可明显促进ASCs的增殖,我们推测这种促进增殖能力可能和LPA对YAP的上调作用相关。同时,利用shYAP特异性敲除YAP表达后,LPA对ASCs增殖能力的促进作用得到明显削弱。最后,利用RhoA抑制剂C3特异性抑制RhoA的表达,显示LPA能够促进YAP和GTP⁃RhoA的表达,RhoA抑制剂C3干预能显著抑制LPA诱导的YAP的表达和细胞核的聚集,同时CTGF表达也得到明显下调。Qiao等[27]研究显示RhoA分子在细胞增殖、迁移等生物学行动中也十分关键,但是缺乏RhoA与YAP间存在上下游的直接调控关系的充分证据。本研究通过RhoA抑制剂C3对RhoA表达进行调控,从而初步揭示了RhoA和YAP的上下游调控关系,该结果具有较大意义,但是需要进行进一步的研究去证实RhoA和YAP间相互作用的直接分子机制。
本实验中,我们研究结果初步证实LPA可有效促进ASCs的增殖,该促增殖效应可能由RhoA/YAP通路来介导。我们的研究结果进一步证实了LPA⁃RhoA⁃YAP信号通路在调控细胞生物学行为中的重要作用。与之前的研究不同的是,我们的研究重点集中于细胞增殖及其分子机制研究ASCs的增殖及其分子机制对于提高ASCs相关的干细胞治疗效果及其在再生医学中的应用。同时,本研究也存在一定的不足之处,LPA介导细胞的一系列生物学行为,但是LPA在细胞膜上的受体较多,包括LPA1、LPA2和LPA3[28]。LPA与不同受体的结合可能导致细胞出现完全不同的生物学行为,而该研究中并未涉及。我们将在下一步的研究中对此进行深入研究,以期进一步明确LPA对ASCs增殖的调控作用和分子机制。
[1]Murphy MB,Moncivais K,Caplan AI.Mesenchymal stem cells: environmentally responsive therapeutics for regenerativemedicine[J].Exp MolMed,2013,45:e54.
[2]Davies OG,Cooper PR,Shelton RM,et al.A comparison of the in vitro mineralisation and dentinogenic potential of mesenchymal stem cells derived from adipose tissue,bone marrow and dental pulp[J].JBoneMinerMetab,2015,33(4):371⁃382.
[3]Qi J,Chen A,You H,etal.Proliferation and chondrogenic differen⁃tiation of CD105⁃positive enriched rat synovium⁃derived mesen⁃chymal stem cells in three⁃dimensional porous scaffolds[J]. Biomed Mater,2011,6(1):015006.
[4]Zuk PA,Zhu M,Ashjian P,etal.Human adipose tissue isa source ofmultipotent stem cells[J].Mol Biol Cell,2002,13(12):4279⁃4295.
[5]De Ugarte DA,Morizono K,Elbarbary A,et al.Comparison of multi⁃lineage cells from human adipose tissue and bone marrow[J].Cells TissuesOrgans,2003,174(3):101⁃109.
[6]Dai R,Wang Z,Samanipour R,et al.Adipose⁃derived stem cells for tissue engineering and regenerativemedicine applications[J]. Stem Cells Int,2016:6737345.
[7]Swanger SA,Neuhuber B,Himes BT,etal.Analysis of allogeneic and syngeneic bonemarrow stromal cellgraft survival in the spinal cord[J].Cell Transplant,2005,14(10):775⁃786.
[8]HalderG,Johnson RL.Hippo signaling:growth controland beyond[J].Development,2011,138(1):9⁃22.
[9]Zhao B,Tumaneng K,Guan KL.The Hippo pathway in organ size control,tissue regeneration and stem cellself⁃renewal[J].Nat Cell Biol,2011,13(8):877⁃883.
[10]Yung YC,Stoddard NC,Chun J.LPA receptor signaling:pharma⁃cology,physiology,and pathophysiology[J].JLipid Res,2014,55 (7):1192⁃1214.
[11]Wang XY,Fan XS,Cai L,et al.Lysophosphatidic acid rescues bone mesenchymal stem cells from hydrogen peroxide⁃induced apoptosis[J].Apoptosis,2015,20(3):273⁃284.
[12]Radeff⁃Huang J,Seasholtz TM,Matteo RG,et al.G protein me⁃diated signaling pathways in lysophospholipid induced cell pro⁃liferation and survival[J].JCell Biochem,2004,92(5):949⁃966.
[13]Yu FX,Zhao B,Panupinthu N,etal.Regulation of the Hippo⁃YAP pathway by G⁃protein⁃coupled receptor signaling[J].Cell,2012, 150(4):780⁃791.
[14]Barba M,Cicione C,Bernardini C,et al.Adipose⁃derived mesen⁃chymal cells for bone regereneration:state of the art[J].Biomed Res Int,2013,2013:416391.
[15]Marino G,Rosso F,Cafiero G,etal.Beta⁃tricalcium phosphate 3D scaffold promote alone osteogenic differentiation of human adipose stem cells:in vitro study[J].JMater SciMater Med,2010,21(1): 353⁃363.
[16]Arrigoni E,de Girolamo L,Di GA,et al.Adipose⁃derived stem cells and rabbit bone regeneration:histomorphometric,immuno⁃histochemical and mechanical characterization[J].JOrthop Sci, 2013,18(2):331⁃339.
[17]Yeh DC,Chan TM,Harn HJ,et al.Adipose tissue⁃derived stem cells in neural regenerativemedicine[J].Cell Transplant,2015,24 (3):487⁃492.
[18]Sheng X,Yung YC,Chen A,et al.Lysophosphatidic acid signal⁃ling in development[J].Development,2015,142(8):1390⁃1395.
[19]Cai H,Xu Y.The role of LPA and YAP signaling in long⁃term migration of human ovarian cancer cells[J].Cell Commun Signal, 2013,11(1):31.
[20]Chen X,Yang XY,Wang ND,et al.Serum lysophosphatidic acid concentrations measured by dot immunogold filtration assay in patients with acute myocardial infarction[J].Scand JClin Lab Invest,2003,63(7⁃8):497⁃503.
[21]Gaits F,FourcadeO,Le BF,etal.Lysophosphatidic acid asa phos⁃pholipidmediator:pathwaysofsynthesis[J].FEBSLett,1997,410 (1):54⁃58.
[22]Chen J,Han Y,Zhu W,et al.Specific receptor subtypemediation of LPA⁃induced dual effects in cardiac fibroblasts[J].FEBSLett, 2006,580(19):4737⁃4745.
[23]Fukushima N,Weiner JA,Chun J.Lysophosphatidic acid(LPA)is a novel extracellular regulator of cortical neuroblastmorphology[J].Dev Biol,2000,228(1):6⁃18.
[24]Weiner JA,Fukushima N,Contos JJ,etal.Regulation of Schwann cellmorphology and adhesion by receptor⁃mediated lysophospha⁃tidic acid signaling[J].JNeurosci,2001,21(18):7069⁃7078.
[25]Contos JJ,Fukushima N,Weiner JA,et al.Requirement for the lpA1 lysophosphatidic acid receptor gene in normal suckling behavior[J].Proc Natl Acad Sci U S A,2000,97(24):13384⁃13389.
[26]LiY,Gonzalez MI,Meinkoth JL,etal.Lysophosphatidic acid pro⁃motes survival and differentiation of rat Schwann cells[J].JBiol Chem,2003,278(11):9585⁃9591.
[27]Qiao F,Zou Z,Liu C,et al.ROCK2mediates the proliferation of pulmonary arterial endothelial cells induced by hypoxia in the development of pulmonary arterial hypertension[J].Exp Ther Med,2016,11(6):2567⁃2572.
[28]Kanehira M,Kikuchi T,Ohkouchi S,et al.Targeting lysophospha⁃tidic acid signaling retards culture⁃associated senescence of humanmarrow stromalcells[J].PLoSOne,2012,7(2):e32185.
Lysophosphatidic acid regulates the proliferation of adipose⁃derived stem cells via the RhoA/YAP signaling pathway.
YE Yaping,LIMi,WU Yingxing,HUANG Junming,YINWeifeng,GUO Fengjin.Depart⁃ment ofOrthopaedics,TongjiHospital,TongjiMedical College,Huazhong University ofScience and Technology, Wuhan 430030,China
Corresponding author:GUOFengjin,E⁃mail:fjguo@tjh.tjmu.edu.cn
Objective To study the role andmolecularmechanism of lysophosphatidic acid(LPA)in regulating adipose⁃derived stem cells(ASCs)proliferation.M ethods ASCs were isolated from SD rats and treated with LPA for 1 h.Western blotting was applied to detect the expression of YAP and CTGF proteins. Immunofluorescence stainingwas performed to detect YAP subcellular localization.RT⁃PCRwas used to detect the expressions of YAP target genes CTGF and Ankrd1.Western blotting was done to detect YAP protein expression after lentivirus transfection.Flow cytometry and CCK⁃8 assaywere carried out to detect the prolifera⁃tion of ASCs in different groups.Finally,RhoA inhibitor C3 was utilized and YAPwas subcellularly localized by immunofluorescence staining.The expression of YAP,CTGF and GTP⁃RhoA was examined byWestern blot⁃ting.Results LPA could significantly promote the expression and nuclear localization of YAP.LPA could also promote the expression of YAP targetgene CTGF.The RT⁃PCR also showed that LPA promoted the expression of YAP targetgenes CTGF and Ankrd1.The promotion effectof LPA on YAP protein expressionwas abrogated after shYAP lentivirus transfection.LPA could also significantly promote proliferation of ASCs as demonstrated by the flow cytometry and CCK8 assay.However,the effectwas abrogated by transfection of shYAP lentivirus. The effectof LPA on YAPnuclear localization was abrogated by RhoA inhibitor C3 treatment.C3 treatmentalso abrogated the effect of LPA on YAP,CTGF and GTP⁃RhoA protein expression.Conclusion LPA could promote proliferation ofASCsvia the RhoA/YAPsignaling pathway.
Lysophosphatidic acid;Adipose⁃derived stem cells;RhoA⁃YAP signaling pathway;Cell proliferation
10.3969/j.issn.1674⁃8573.2016.06.011
国家自然科学基金资助项目(81371915)
430030武汉,华中科技大学同济医学院附属同济医院骨科
郭风劲,E⁃mail:fjguo@tjh.tjmu.edu.cn
(2016⁃05⁃13)