基于一种酰腙和咪唑配体的铜(Ⅱ)、镍(Ⅱ)配合物的水热合成、晶体结构及体外抗癌活性
高平章 陈雅心 郑敏敏 王景梅 解庆范 陈延民
基于一种酰腙和咪唑配体的铜(Ⅱ)、镍(Ⅱ)配合物的水热合成、晶体结构及体外抗癌活性
高平章 陈雅心 郑敏敏 王景梅 解庆范 陈延民*
(泉州师范学院化工与材料学院,泉州362000)
采用水热法合成了5-硝基水杨醛缩噻吩-2-甲酰腙的铜和镍配合物[Cu(Him)L]2(1)和[Ni(Him)L](2)(H2L=5-硝基水杨醛缩噻吩-2-甲酰腙,Him=咪唑)并经元素分析、红外光谱和紫外光谱表征。X射线单晶衍射分析表明,1的晶体属单斜晶系,空间群P21/c,晶胞参数:a=1.135 68(12)nm,b=0.770 45(8)nm,c=2.140 4(2)nm,β=97.405(3)°。2的晶体属三斜晶系,空间群P1,晶胞参数:a=0.726 91(4)nm,b=0.976 34(6)nm,c=1.265 74(8)nm,α=79.533(2)°,β=82.862(2)°,γ=68.985(2)°。1是中心对称的双核配合物,Cu(Ⅱ)处于四方锥配位环境;2是单核配合物,Ni(Ⅱ)处于平面四边形的配位环境。化合物1通过N-H…O氢键形成一维超分子链,而化合物2通过N-H…O和C-H…O氢键形成二维超分子网络。初步研究了配体和配合物的体外抗癌活性。结果表明,配合物1和2对人肝癌细胞HEPG2和人结肠癌细胞SW620均有较强的增殖抑制作用。
酰腙;配合物;晶体结构;抗癌活性
自从1969年美国化学家Rosenberg等[1]发现顺铂对肿瘤有强烈抑制作用后,金属配合物作为抗癌药物成为非常活跃的研究领域[2],非铂系金属配合物的抗癌活性更是受到极大的关注。铜和镍都是生物必需的微量元素,在生物过程中扮演着重要角色[3-4]。例如,铜参与电子传递、氧化还原等许多生命过程,人体内至少有11种氧化酶含有铜;而镍可以促进铁的吸收和氨基酶的合成,同时镍在DNA和RNA的结构中还起到稳定剂的作用。许多研究表明,铜配合物[5-9]和镍配合物[10-12]具有抗菌、抗病毒、抗炎、抗肿瘤等作用。另外,酰腙类Schiff碱配位环境与生物系统相似,其配合物具有良好的抗肿瘤、抗氧化、抗菌等多种生物活性[13-18],因而备受关注。早在20世纪70年代就已发现此类Schiff碱的抗肿瘤活性的构效关系[19]:①水杨醛比其他醛制得的Schiff碱的抗肿瘤活性好;②取代基拉电子能力越强抗仲瘤效果越好。因此,本文以5-硝基水杨醛与噻吩-2-甲酰肼反应合成了一种新的酰腙型Schiff碱(Scheme 1),并用水热法合成了咪唑为第二配体的铜和镍配合物,分析了它们的晶体结构和体外抗癌活性。

Scheme 1
1 实验部分
1.1 仪器与试剂
德国Elmentar Vario EL元素分析仪;美国Nicolet is10型FT-IR红外光谱仪;日本岛津的UV-2401PC紫外分光光度计;德国Bruker Smart ApexⅡCCD单晶衍射仪;美国Thermo二氧化碳培养箱;中国XDS-1B型数码摄影倒置显微镜;美国Thermo全波段酶标仪。噻吩-2-甲酰肼、5-硝基水杨醛等均为市售分析纯试剂。
1.2 配合物的合成
1.2.1 5-硝基水杨醛缩噻吩-2-甲酰腙(H2L)的合成
10 mmol噻吩-2-甲酰肼与10 mmol 5-硝基水杨醛分别溶解于25mL无水乙醇中,然后混合于100 mL圆底烧瓶,并加入1 mL冰醋酸,加热回流2h,冷却至室温,抽滤,用无水乙醇洗涤数次,得黄色粉末状产物,产率85%。对C12H9N3O4S的元素分析实测值(计算值,%):C 49.40(49.46);H 3.15(3.11);N 14.49(14.42)。IR(cm-1):3 293(N-H),1 626(C=O),1 601 (C=N),1 582,1 556,1 522(NO2),1 484,1 416;1 371 (NO2);1 336(C-N),1 293(C-O),1 243(C-S-C),1 127,1 076;959(N-N);834,750,719(C-H面外弯曲振动);699(噻吩C-S)。
1.2.2 配合物1的合成
将0.1 mmol H2L,0.1 mmol乙酸铜和0.2 mmol咪唑以及5 mL甲醇和2 mL蒸馏水置于20 mL的内衬聚四氟乙烯的不锈钢自动升压反应釜中。在140℃下反应2 d,得到适于X射线单晶衍射分析的黑褐色晶体。对C30H22Cu2N10O8S2元素分析的实测值(计算值,%):C 42.72(42.81);H 2.59(2.63);N 16.76 (16.64)。IR(cm-1):3 230,1 599,1 551,1 530,1 465,1 423,1 380;1 301,1 240,952,854,754,729,705。
1.2.3 配合物2的合成
用乙酸镍代替乙酸铜,其他步骤同上,得到橙黄色晶体。对C15H11N5NiO4S元素分析的实测值(计算值,%):C 43.41(43.30);H 2.64(2.67);N 16.79 (16.82)。IR(cm-1):3 258,1 600,1 550,1 508,1 481,1 467,1 383,1 300,1 242,956,854,754,722,710。
1.3 晶体结构测定
选取0.50 mm×0.23 mm×0.22 mm(1)的单晶和0.22 mm×0.21 mm×0.20 mm(2)的单晶置于Bruker Smart ApexⅡCCD单晶衍射仪上,用经石墨单色器单色化的Mo Kα射线(λ=0.071 073 nm)分别于296(2)和293(2)K下以φ~ω扫描方式在3.20°~25.09°和2.98°~25.10°范围收集衍射数据。晶体结构用SHELXS-97软件由直接法解出,对所有非氢原子坐标及其各向异性温度因子用SHELXL-2014/7程序[20]进行了全矩阵最小二乘法精修。有机物碳原子上的氢原子为理论加氢。晶体数据列于表1,主要键长和键角列于表2。
CCDC:1041671,1;1041672,2。

表1 化合物的晶体数据Table 1 Crystal data of the compounds

表2 配合物1和2的主要键长和键角Table 2 Selected bond lengths(nm)and angles(°)of 1 and 2
1.4 体外抗肿瘤活性实验
在无菌条件下,分别取对数生长期的人肝癌细胞HEPG2和人结肠癌细胞SW620,用2.5 g·L-1胰酶消化,调整细胞密度为2.5×104mL-1,参照文献[15]的方法进行实验。实验重复3次,取平均值,并根据线性回归方程求出化合物的半数抑制浓度IC50。
2 结果与讨论
2.1 晶体结构
配合物1的分子结构见图1,它是一种中心对称的双核配合物,由2个中心离子Cu(Ⅱ)、2个咪唑和2个-2价的5-硝基水杨醛缩噻吩-2-甲酰腙(L2-)组成。Cu(Ⅱ)与配原子构成CuN2O3四方锥的配位几何构型。其中酰腙配体以烯醇式配位并脱除质子,提供羰基O4和亚胺基N2与Cu(Ⅱ)配位形成五元环;而酚羟基脱质子提供μ-O3与Cu(Ⅱ)配位,并与亚胺基N构成稳定的六元环;咪唑上C=N的N4原子则占据锥底的第四个配位点;N4、O3、N2和O4构成锥底,扭转角为-8.20°,键角为81.44(7)°~93.27(8)°和169.52(8)°~173.74(7)°;Cu-O和Cu-N键长分别为0.190 03(15)~0.192 45(17)nm和0.190 94(18)~0.193 7(2)nm,比吴琼洁等[21]报道的类似结构的双核铜配合物[Cu2(L2)2(Py)2]和仇晓阳[8]报道的双Schiff碱双核配合物[Cu(L)]2相应的键长要短得多。锥顶被另一酰腙配体的酚盐氧μ-O3占据,从而构成双核结构,在[Cu2(μ-O)2]片段中Cu1…Cu1i间距为0.345 5 nm。由于Jahn-Teller效应所致,Cu1…O3i间距达0.277 87(16)nm,与文献[23]报道的相似。C4-O3和C8-O4键长为0.128 9(3)和0.128 3(3)nm,C7-N2和C8-N3键长为0.128 6(3)和0.129 7(3)nm,均为典型的双键。
酰腙配体从O1到S1所有的原子几乎共平面,存在较强的共轭作用,扭转角C2-C3-C7-N2、N3-C8-C9-S1、O2-N1-C1-C2和C3-C7-N2-N3、C7-N2-N3-C8为173.55°~174.75°和-177.67°~-179.47°。噻吩环与苯环最小二乘面夹角为5.6°。相邻的双核基元的平面相互平行,水杨基与亚胺基形成的C2-C1-C6-C5-C4-C3-C7-N2共轭片段的离域电子之间存在较强的π-π相互作用(图2),二面角为0.0°,质心Cg1(O3-C4-C3-C7-N2)与质心Cg2iii(C1-C2-C3-C4-C5-C6)间距0.349 1 nm(垂直距离0.338 0 nm)。而硝基O2与邻近结构基元的咪唑的次氨基NH构成氢键(N(5)-H(5A)…O(2)ii0.286 5(3)nm)。配合物借助这种N-H…O氢键和π-π相互作用扩展为二维超分子。
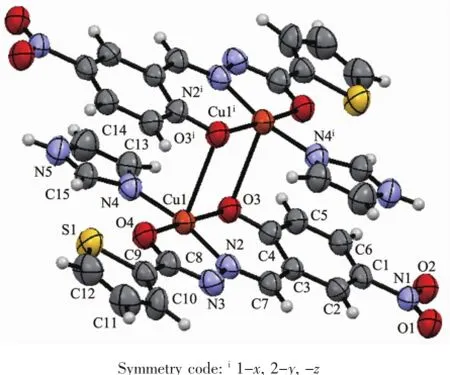
图1 配合物1的晶体结构(椭球率30%)Fig.1 Crystal structure of complex 1 with 30% probability ellipsoid

图2 化合物1中的分子间氢键和π…π相互作用Fig.2 Intermolecular hydrogen bonds andπ…π interactions in 1
配合物2的分子结构见图3,它由1个中心离子Ni(Ⅱ)、1个咪唑配体和1个5-硝基水杨醛缩噻吩-2-甲酰腙配体组成,与1中相似,酰腙配体以烯醇式三齿螯合配位,形成几乎完全共平面的五元环和六元环,二者平面夹角1.2°。Ni(Ⅱ)与羰基氧O1、亚胺基N2、酚盐基O2和咪唑基N4形成NiN2O2平面四边形配位构型,N4-O1-N2-O2扭转角为5.41°,中心原子周围的4个键角在83.99(17)°~95.55(17)°范围。酰腙三齿配原子与Ni(Ⅱ)形成的配位键Ni1-N2、Ni1-O2和Ni1-O1键长与文献[21]报道的酰腙配合物中相应的键长相近,分别为1.827(4)、1.827(3)和1.841(3) nm,而咪唑与Ni(Ⅱ)的Ni1-N4键长(1.903(4)nm)比张奇龙等[22]报道的基于Schiff碱及咪唑类配体的镍配合物的Ni-N键长(0.192 0~0.193 8 nm)短,也比文献[21]中辅助配体的N-Ni键长短。硝基、苯环、酰腙基团和Ni(Ⅱ)近似共平面,而噻吩环与苯环的二平面夹角为21.0°,咪唑环与苯环二平面夹角为14.5°。硝基的O3分别与另外2个相邻的配合物基元的咪唑次胺基N5-H5A和噻吩的C1-H1之间的氢键(表4),将配合物扩展为二维超分子网络(图4),从而增加了配合物的稳定性。

表3 配合物1的氢键参数Table 3 Hydrogen bond parameters for complex 1

表4 2的氢键参数Table 4 Hydrogen bond parameters for 2
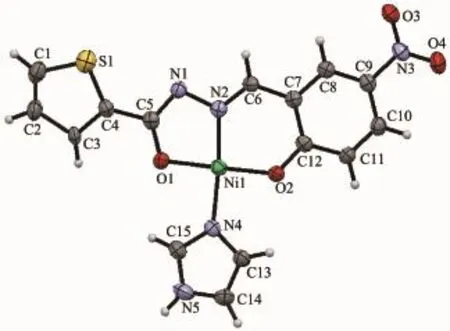
图3 配合物2的晶体结构(椭球率30%)Fig.3 Crystal structure of complex 2 with 30% probability ellipsoid

图4 配合物2中分子间的C-H…O和N-H…O氢键Fig.4 Intermolecular C-H…O and N-H…O hydrogen bonds in 2
2.2 红外光谱和电子光谱
在配体H2L的IR谱图中,3 293 cm-1处尖锐的吸收峰属于次胺基的νN-H,1 626和1 601 cm-1分别属于酰胺基的νC=O和亚胺基的νC=N,而959 cm-1可指认为是νN-N。硝基-NO2的特征吸收峰出现在1 522和1 371 cm-1,1 336 cm-1归属于νC-N;1 293 cm-1归属于酚羟基的νC-O。1 243和699 cm-1是噻吩杂环的特征吸收峰(νC-S-C和νC-S)。在1和2的IR中,νC=O消失,说明配体以烯醇式配位;3 230(1)和3 258(2) cm-1来自咪唑的νN-H。1 599(1)和1 600(2)cm-1归属νC=N,νN-N出现在952(1)和956(2)cm-1,而噻吩的特征νC-S-C和νC-S出现在1 240、705 cm-1(1)和1242、710 cm-1(2)。

图5 配体H2L及其配合物的紫外可见光谱Fig.5 UV-Vis spectra of ligand H2L and complexes 1 and 2
由电子吸收光谱(图5)可见,配体H2L在297和395 nm出现2个强而宽的吸收带,分别归属于酰腙与苯环形成的共轭体系的π→π*电子跃迁(即K带)和配体内的电荷转移跃迁(ILCT),n→π*电子跃迁强度弱而被部分掩盖。配合物1和2中出现的新吸收带261和259 nm来自辅助配体咪唑的π→π*电子跃迁,而酰腙配体与金属配位致使π→π*电子跃迁分别红移至325和329 nm(出现的精细结构可能与其中包含n→π*电子跃迁有关),ILCT(396和403 nm)则未发生明显的位移,但相对强度发生了变化。
2.3 体外抗肿瘤活性
配体H2L和配合物对癌细胞的半数抑制浓度IC50列于表5。1和2对人肝癌细胞HEPG2半数抑制浓度IC50(表5)分别为1.30和2.77μg·mL-1(即 1.54和6.66μmol·L-1),对人结肠癌细胞SW620半数抑制浓度IC50分别为2.22和2.97μg·mL-1(即2.64和7.1μmol·L-1)。结果表明,配合物1和2对HEPG2和SW620有较强的增殖抑制作用,都比相应的配体强,且与浓度的增加正相关(图6和7),呈浓度依赖性。根据Shier[23]的建议,当IC50<5μg·mL-1时化合物的抑制活性为强效。配合物与DNA的作用模式主要有插入型和面上型,具有大平面结构的配合物,可能更有利于配合物与DNA发生作用,从而增加了抑制活性。其作用机理有待进一步研究。
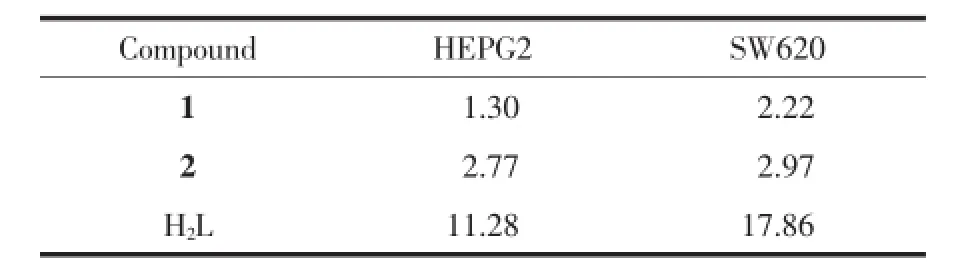
表5 配体H2L和配合物对癌细胞的半数抑制浓度IC50Table 5 IC50values of ligand H2L and the complexes on cancer cell μg·mL-1
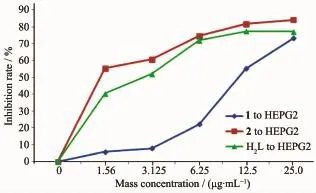
图6 配体H2L和配合物对HEPG2的抑制作用Fig.6 Inhibition effects of ligand H2L and the complexes on cell HEPG2
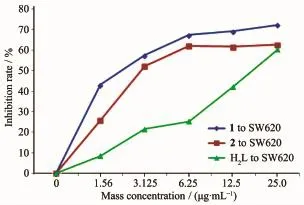
图7 配体H2L和配合物对SW620的抑制作用Fig.7 Inhibition effects of ligand H2L and the complexes on cell SW620
3 结论
以咪唑为第二配体利用水热反应合成了具有大平面结构的5-硝基水杨醛缩噻吩-2-甲酰腙铜双核配合物[Cu(Him)L]2和镍单核配合物[Ni(Him)L],二者的晶体结构分别属单斜晶系P21/c空间群和三斜晶系P1空间群。这两种配合物对人肝癌细胞HEPG2和人结肠癌细胞SW620均表现出很强的增殖抑制作用,强弱顺序为[Cu(Him)L]2>[Ni(Him)L]≫H2L,有望成为抗癌候选药物。
[1]Rosenberg B,Van Camp L,Trosko J E,et al.Nature,1969, 222:385-386
[2]Jungwirth U,Kowol C R,Keppler B K,et al.Antioxid.Redox Signaling,2011,15(4):1085-1127
[3]HUANG Juan(黄娟),CUI Zi-Ning(崔紫宁),LI Ying(李映), etal.Chinese J.Org.Chem.(有机化学),2008,28(4):598-604
[4]Garbutcheon-singh K B,Grant M P,Harper B P,et al.Curr. Top.Med.Chem.,2011,11:521-542
[5]XIA Si-Feng(夏寺丰),LU Xiao-Ming(鲁晓明).Chemistry (化学通报),2011,74(12):1096-1104
[6]Duraisamy S R,Nattamai S P.Eur.J.Med.Chem.,2011,46 (45):4584-4594
[7]Li X W,Yan C W.Inorg.Chim.Acta,2011,367(1):64-72
[8]QIU Xiao-Yang(仇晓阳).Chinese J.Inorg.Chem.(无机化学学报),2014,30(7):1667-1672
[9]Ramakrishnan S,Shakthipriya D,Suresh E,et al.Inorg. Chem.,2011,50:6458-6471
[10]Prabbakaran P,Kalaivani P.J.Inorg.Biochem.,2013,18(2): 233-247
[11]Eswaran R,Karuppannan N.RSC Adv.,2012,2(46):8515-8525
[12]Krishnamoorthy P,Dharmaraj N.RSC Adv.,2012,2(56): 12190-12203
[13]Zhang Y H,Zhang L,Liu L,et al.Inorg.Chim.Acta,2010, 363(2):289-293
[14]Pait M,Kundu B,Kundu S C,etal.Inorg.Chim.Acta,2014, 418:30-41
[15]XIE Qing-Fan(解庆范),GAO Ping-Zhang(高平章),CHEN Yan-Min(陈延民).Chinese J.Inorg.Chem.(无机化学学报), 2014,30(10):2382-2388
[16]HUANG Juan(黄娟),CUI Zi-Ning(崔紫宁),LI Ying(李映), etal.Chinese J.Org.Chem.(有机化学),2008,28(4):598-604
[17]Sriram D,Yongeeswari P,Madhu K.Bioorg.Med.Chem. Lett.,2005,15(20):4502-4505
[18]Patole J,Sandbhor U,Padhye S,et al.Bioorg.Med.Chem. Lett.,2003,13(1):51-55
[19]Hodnett E M,Dunn W J.J.Med.Chem.,1970,13:768-780
[20]Sheldrick G M.Acta Crystallogr.Sect.A,2015,A71:3-8
[21]WU Qiong-Jie(吴琼洁),CHEN Xiao-Hua(陈小华),CAI Bi-Qiong(蔡碧琼),et al.Chinese J.Inorg.Chem.(无机化学学报),2012,28(1):201-206
[22]ZHANG Qi-Long(张奇龙),FENG Guang-Wei(冯广卫), WANG Li(王丽),et al.Chinese J.Inorg.Chem.(无机化学学报),2014,30(5):1025-1030
[23]Shier WT.Mammalian CellCulture on$5 a Day,A Laboratory Manual of Low Cost Methods.Los Baños,Philippines: University of the Philippines at Los Baños,1991.
Syntheses,Crystal Structures and in Vitro Antitumor Activities of Copper(Ⅱ)and Nickel(Ⅱ)Complexes Based on Acylhydrazone and Imidazole Ligands
GAO Ping-Zhang CHEN Ya-Xin ZHENG Min-Min WANG Jing-Mei XIE Qing-Fan CHEN Yan-Min*
(College of Chemical Engineering and Materials Science,Quanzhou Normal University,Quanzhou,Fujian 362000,China)
Two new complexes[Cu(Him)L]2(1)and[Ni(Him)L](2),where H2L is 2-thiophenecarboxylic acid(2-hydroxly-5-nitro-benzylidene)-hydrazide and Him is imidazole,were synthesized by hydrothermal reaction and characterized by elemental analysis,FT-IR and electronic spectra.The structure of complexes has been accomplished by single crystal X-ray diffraction which results confirmed that the crystal of 1 belongs to the monoclinic system,space group P21/c with cell parameters:a=1.135 68(12)nm,b=0.770 45(8)nm,c=2.140 4(2) nm,β=97.405(3)°and the crystalof 2 belongs to the triclinic system,space group P1 with cellparameters:a= 0.726 91(4)nm,b=0.976 34(6)nm,c=1.265 74(8)nm,α=79.533(2)°,β=82.862(2)°,γ=68.985(2)°.The X-ray analyses revealed that 1 displays a centrosymmetric binuclear structure with the Cu atoms in square pyramidal coordination.The binuclear units are further linked by hydrogen bonds to generate an infinite 1D chain.The mononuclear units in 2 are linked through weak N-H…O and C-H…O hydrogen bonds to form an infinite 2D network.The in vitro antitumor activities of ligand and complexes were tested by MTT method,which results show that 1 and 2 have strong in vitro antitumor activity against HEPG2 and SW620 cancer cells lines.CCDC: 1041671,1;CCDC 1041672,2.
acylhydrazone;complex;crystal structure;antitumor activity
O614.121;O614.81+3
A
1001-4861(2016)09-1572-07
10.11862/CJIC.2016.198
2016-05-02。收修改稿日期:2016-06-17。
泉州师范学院学科建设资金和福建省大学生创新创业训练计划项目(No.201510399025,201510399030)资助。
*通信联系人。E-mail:qzucym@163.com;会员登记号:S06N5449M1311(解庆范),S06N2113M1304(陈延民)。

