Netrin-1通过下调氧糖剥夺诱导的人神经母细胞瘤自噬促进细胞存活
阙嘉丽, 李晨光, 刘可嘉, 余 剑
Netrin-1通过下调氧糖剥夺诱导的人神经母细胞瘤自噬促进细胞存活
阙嘉丽, 李晨光, 刘可嘉, 余 剑
目的 通过建立体外人神经母细胞瘤(SH-SY5Y)氧糖剥夺(oxygen and glucose deprication,OGD)模型模拟脑梗死后神经元缺血缺氧环境(OGD),探索神经导向因子Netrin-1是否影响OGD后细胞的生存,以及自噬在其中的可能作用。方法 体外培养SH-SY5Y细胞,检测Netrin-1对细胞活性及自噬的影响。使用自噬诱导剂雷帕霉素、自噬抑制剂3-甲基腺嘌呤干预自噬水平,同时构建过表达Netrin-1受体UNC5H2-HA基因的HEK293T细胞;CCK-8试剂盒检测细胞活性,免疫印迹检测自噬相关标志物(Beclin 1、LC3、p62)的表达及免疫荧光检测LC3斑点的形成。结果 与OGD对照组相比,Netrin-1及3-甲基腺嘌呤的干预均显著提高细胞活性,伴有LC3-Ⅱ斑点形成减少;相反,雷帕霉素增加LC3-Ⅱ斑点的同时抑制细胞活性,并减弱了Netrin-1提高细胞活性的作用。过表达UNC5H2-HA细胞较对照质粒组相比,LC3-Ⅱ表达增加;同时进行Netrin-1干预后仅过表达组出现LC3-Ⅱ表达下降,p62表达上升。结论 Netrin-1可能通过受体UNC5H2下调OGD损伤的人神经母细胞瘤自噬而提高细胞活性。
Netrin-1; 氧糖剥夺; 自噬; UNC5H2
脑卒中是导致我国成人残疾和死亡的第一原因[1]。脑梗死后神经元自噬过程被激活,研究发现降低自噬活性能够降低神经元死亡数量,减小梗死面积并促进神经功能恢复[2,3],但其调节因素尚未完全阐明。作为一种神经导向因子,Netrin-1不仅在发育中神经系统调节细胞迁移黏附[4],而且在成年后与依赖性受体UNC5H2结合后,显著地减少脑卒中后细胞凋亡,并改善运动功能恢复[5~7],提示其在脑保护作用上具有治疗潜能。
进一步地研究显示Netrin-1在减少缺血导致心肌细胞死亡的同时也显著地降低了自噬活性[8],但在脑梗死后尚缺乏两者的研究。
本实验利用稳定表达Netrin-1及其受体UNC5H2的人神经母细胞瘤(SH-SY5Y)建立模拟脑梗死环境的体外氧糖剥夺细胞模型[9,10],同时构建UNC5H2过表达的HEK 293T细胞系,旨在探讨Netrin-1对缺氧损伤后自噬及细胞活性的调节作用,以及其受体UNC5H2对细胞自噬的影响,为Netrin-1的脑保护作用探寻新的机制。
1 材料与方法
1.1 细胞培养及建立过表达体系 人神经母细胞瘤(SH-SY5Y)、HEK 293T细胞购自American Type Culture Collection(ATCC)公司。细胞接种于含10%胎牛血清的DMEM培养基(Gibco)中,置于37 ℃、5%CO2的细胞培养箱中培养。每2~3 d更换培养液一次,生长达80%融合时传代,取第2-7代细胞分组进行实验。HEK 293T细胞按104/ml的密度种植于六孔板及培养皿中,12 h贴壁后,按Lipofectamine 3000(Life Technologies)说明书步骤瞬转UNC5H2-HA-tag质粒及对照质粒(吉凯生物),使用HA抗体(1∶1000,Abcam)进行免疫荧光法测定转染效率,观察计数100个细胞并计算带绿色荧光的细胞的比例。
1.2 OGD模型建立 该模型用于模拟体内脑梗死环境并进行自噬和细胞活性检测[11]。SH-SY5Y按105/ml正常接种于96孔板后,吸净原有培养基,更换成DMEM无糖培养基(Gibco),置于含有氧气指示剂(日本三菱)的缺氧罐内,使用真空抽气泵抽空罐内空气后,通入由95%N2及5%CO2组成的混合气体,反复抽吸3次构建缺氧环境,氧气指示剂持续显示粉红色表明缺氧过程成功,最后将缺氧罐放置在37 ℃恒温箱中2 h后置于正常氧糖环境中。
1.3 CCK-8试剂盒检测细胞活性 SH-SY5Y接种于96孔板中,接种密度为105/孔,设6个复孔,培养24 h后细胞贴壁,分别加入以下药物:对照组(不加药);Netrin-1组(50 ng/ml);自噬诱导剂雷帕霉素组(Rapamycin,RAPA,50 nmol/L);Netrin-1+RAPA组;自噬抑制剂3-甲基腺嘌呤(3-Methyladenine,3-MA,1mmol/L);Netrin-1+3-MA组。药物预处理2 h后置于OGD模型中,2 h后每孔加入10 μl CCK-8(日本同仁),37 ℃孵育1.5 h后用酶标仪在450 mm波长下进行比色,计算相对吸光度,吸光度越高,细胞活性越高。
1.4 免疫荧光检测自噬标记物LC3斑点形成 SH-SY5Y经100%甲醇固定15 min,0.01 mol PBS摇床洗5 min 3次,加入封闭液封闭1 h后孵育兔抗大鼠LC3一抗(1∶100,CST)检测LC3斑点形成,4 ℃冰箱放置过夜,加入delight 555标记的山羊抗兔荧光二抗(1∶600,CST)室温孵育1 h后再漂洗,封片后于共聚焦显微镜下拍照。
1.5 Western blot HEK 293T细胞用细胞裂解液(博彩生物)提取蛋白,BCA试剂盒(Thermo)进行蛋白定量测定,蛋白样品(每孔40 μg)进行12% SDS-PAGE垂直电泳,恒流转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,分别加入兔抗人一抗UNC5B、Beclin 1、p62、LC3及GAPDH,4 ℃孵育过夜,次日加入抗兔二抗室温孵育1 h,加入化学发光HRP底物(Millipore)于荧光化学发光成像分析系统(Image Quant Las4000 mini)中曝光成像,采用Quantity One 分析条带灰值。

2 结 果
2.1 CCK8检测细胞活性 各组经OGD处理后,与OGD对照组(0.63±0.03)相比,Netrin-1组(0.77±0.04)、3-MA组(0.76±0.03)以及3-MA+Netrin-1组(0.77±0.04)明显增强SH-SY5Y活性(P均<0.05);而RAPA组(0.63±0.01)对细胞活性影响不明显;与Netrin-1组相比,RAPA+Netrin-1组(0.65±0.02)的细胞活性下降(P<0.05)(见图1),表明50 nmol/L RAPA能够有效减弱OGD后Netrin-1对细胞活性的增强作用,而3-MA对此无明显影响。
2.2 免疫荧光检测LC3斑点形成 微管相关蛋白LC3是自噬标志物。自噬小体形成时,胞浆型LC3即LC3-I与磷脂酰乙醇胺共价结合,形成结合在自噬小体膜上的斑点状LC3-Ⅱ(见图2)。OGD时SH-SY5Y胞质中可见大量LC3斑点形成,RAPA作用后斑点明显增加,但Netrin-1组及3-MA组、Netrin-1+3-MA组则出现斑点数目明显减少,提示Netrin-1减轻SH-SY5Y自噬活性。另外,Netrin-1+RAPA组的斑点数较Netrin-1组增加。
2.3 Western blot 过表达UNC5H2-HA组较对照质粒组LC3-Ⅱ/GAPDH比值增高(P<0.05);对照质粒组中进行Netrin-1干预对自噬标志物无明显变化,而在UNC5H2-HA组中Netrin-1干预使LC3-Ⅱ相对比值下降,及Beclin 1相对下降,p62相对升高(P<0.05),提示细胞自噬活性降低(见图3)。
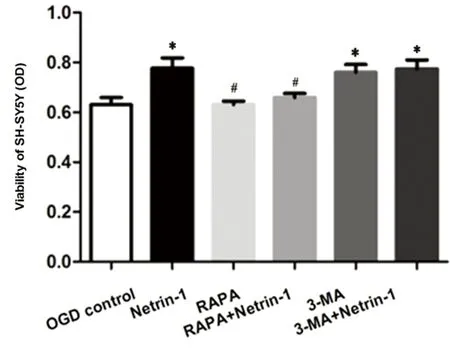
与对照组相比*P<0.05;与Netrin-1组相比#P<0.05
图1 CCK8试剂盒检测细胞活性

A:对照组;B:RAPA组;C:3-MA组;D:Netrin-1组;E:RAPA+Netrin-1组;F:3-MA+Netrin-1组 红色荧光为LC3-Ⅱ蛋白,蓝色荧光为细胞核,1000×,标尺=5μm
图2 LC3免疫荧光染色

A:蛋白泳道从左到右:vehicle组,vehicle组+Netrin-1,UNC5H2-HA组,UNC5H2-HA组+Netrin-1;B:Beclin 1蛋白的相对比值变化;C:p62蛋白的相对比值变化;D:LC3-Ⅱ蛋白的相对比值变化与vehicle对照组相比*P<0.05; 与UNC5H2-HA组相比#P<0.05
图3 过表达UNC5H2-HA及添加Netrin-1后的自噬标志物表达改变
3 讨 论
本实验通过对SH-SY5Y细胞活性和自噬相关标志物LC3的检测,结果发现,OGD后SH-SY5Y自噬增强,细胞活性降低,而给予Netrin-1预处理后,自噬明显减弱并伴细胞活性增强,这种增强作用可被自噬诱导剂RAPA所减弱。另外,过表达UNC5H2的HEK 293T细胞也出现自噬增强,并且Netrin-1仅减弱该过表达系的自噬活性,提示Netrin-1在体外对OGD后的SH-SY5Y生存具有保护作用,且该保护作用可能通过UNC5H2介导降低自噬而实现。
自噬过程与细胞死亡密切相关,并受mTOR、PI3K等多种因素调控,适量的自噬有助于适应外界刺激促进细胞存活,而过量的自噬则有可能加速细胞的死亡[12,13]。脑梗死后早期病灶周围神经元自噬即显著增强,但其作用尚存争议。一般认为这种自噬激活是一种损伤机制[14]。注射自噬抑制剂[10,15]或敲除自噬相关基因Beclin 1[16]后均可减少脑梗死面积并改善神经功能;但也有实验认为自噬激活具有保护作用,在侧脑室注入自噬抑制剂预处理后脑梗死面积反而增大[17],这可能与所使用的动物模型、药物剂量和观测时间点等不同相关[15,17]。本实验采用的神经源性细胞SH-SY5Y与原代神经元自噬活性相当,采用的50 nmol/L的RAPA和1 mmol/L的3-MA在保留有效调控自噬的同时可尽量避免对细胞造成损伤[18]。在该条件下通过观察OGD后自噬对SH-SY5Y的影响,发现OGD后自噬增强不利于该细胞的生存,而Netrin-1对其生存的促进作用则是通过减弱这种自噬来实现的,表现为LC3的减低和p62的增高。
已经发现过表达Netrin-1能够减少脑缺血导致的神经元死亡并改善神经功能恢复[5~7],同时,Netrin-1与其依赖性受体UNC5H2结合后能抑制细胞凋亡,促进细胞存活[19]。为进一步了解是否UNC5H2也介导Netrin-1对自噬的调节作用,我们构建了过表达UNC5H2的HEK 293T细胞系,结果发现过表达UNC5H2明显提高细胞的自噬活性,而同时给予Netrin-1干预后可减低这种自噬活性,提示Netrin-1/UNC5H2可能是自噬调节中的重要因素。
有研究发现UNC5在线虫神经元中与自噬相关基因UNC-51及UNC-14密切相关,后两者可协同定位UNC-5的亚细胞结构,并引导神经元生长[20]。另外,Netrin-1/UNC5H2介导的细胞存活的下游分子DAPK[21]也可能通过激活Beclin 1而启动自噬途径[22],但其机制仍有待进一步阐明。本实验没有检测Netrin-1的其他受体,如DCC、neoginin等,尚不能除外这些受体也在Netrin-1对自噬的调控起作用,这有待于今后深入研究。
[1]中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性缺血性脑卒中诊治指南2014[J].中华神经科杂志,2015,48(4):246-257.
[2]Tian F,Deguchi K,Yamashita T,et al.In vivo imaging of autophagy in a mouse stroke model[J].Autophagy,2010,6(8):1107-1114.
[3]Rami A.Upregulation of Beclin 1 in the ischemic penumbra[J].Autophagy,2008,4(2):227-229.
[4]Ko SY,Dass CR,Nurgali K.Netrin-1 in the developing enteric nervous system and colorectal cancer[J].Trends Mol Med,2012,18(9):544-554.
[5]Lu H,Wang Y,He X,et al.Netrin-1 hyperexpression in mouse brain promotes angiogenesis and long-term neurological recovery after transient focal ischemia[J].Stroke,2012,43(3):838-843.
[6]Sun H,Le T,Chang TT,et al.AAV-mediated netrin-1 overexpression increases peri-infarct blood vessel density and improves motor function recovery after experimental stroke[J].Neurobiol Dis,2011,44(1):73-83.
[7]Lu H,Wang Y,Yuan F,et al.Overexpression of netrin-1 improves neurological outcomes in mice following transient middle cerebral artery occlusion[J].Front Med,2011,5(1):86-93.
[8]Bouhidel JO,Wang P,Siu KL,et al.Netrin-1 improves post-injury cardiac function in vivo via DCC/NO-dependent preservation of mitochondrial integrity,while attenuating autophagy[J].Biochim Biophys Acta,2015,1852(2):277-289.
[9]Goldberg MP,Choi DW.Combined oxygen and glucose deprivation in cortical cell culture:calcium-dependent and calcium-independent mechanisms of neuronal injury[J].J Neurosci,1993,13(8):3510-3524.
[10]Shi R,Weng J,Zhao L,et al.Excessive autophagy contributes to neuron death in cerebral ischemia[J].CNS Neurosci Ther,2012,18(3):250-260.
[11]Luo T,Liu G,Ma H,et al.Inhibition of autophagy via activation of PI3K/Akt pathway contributes to the protection of ginsenoside Rb1 against neuronal death caused by ischemic insults[J].Int J Mol Sci,2014,15(9):15426-15442.
[12]Oral O,Akkoc Y,Bayraktar O,et al.Physiological and pathological significance of the molecular cross-talk between autophagy and apoptosis[J].Histol Histopathol,2016,31(5):479-498.
[13]Tovary-Romo LB,Penagos-Puig A,Ramirez-Jarquin JO.Endogenous recovery after brain damage:molecular mechanisms that balance neuronal life/death fate[J].J Neurochem,2016,136(1):13-27.
[14]Wei K,Wang P,Miao CY.A double-edged sword with therapeutic potential: an updated role of autophagy in ischemic cerebral injury[J].CNS Neurosci Ther,2012,18(11):879-886.
[15]Wen YD,Sheng R,Zhang LS,et al.Neuronal injury in rat model of permanent focal cerebral ischemia is associated with activation of autophagic and lysosomal pathways[J].Autophagy,2008,4(6):762-769.
[16]Zheng YQ,Liu JX,Li XZ,et al.RNA interference-mediated downregulation of Beclin1 attenuates cerebral ischemic injury in rats[J].Acta Pharmacol Sin,2009,30(7):919-927.
[17]Carloni S,Buonocore G,Balduini W.Protective role of autophagy in neonatal hypoxia-ischemia induced brain injury[J].Neurobiol Dis,2008,32(3):329-339.
[18]李治国,张继红,张锦华.mTOR通路对神经母细胞瘤SH-SY5Y细胞自噬作用的影响[J].现代肿瘤医学,2014,10:2278-2280.
[19]Wu TW,Li WW,Li H.Netrin-1 attenuates ischemic stroke-induced apoptosis[J].Neuroscience,2008,156(3):475-482.
[20]Ogura K,Goshima Y.The autophagy-related kinase UNC-51 and its binding partner UNC-14 regulate the subcellular localization of the Netrin receptor UNC-5 in Caenorhabditis elegans[J].Development,2006,133(17):3441-3450.
[21]Llambi F,Lourenco FC,Gozuacik D,et al.The dependence receptor UNC5H2 mediates apoptosis through DAP-kinase[J].EMBO J,2005,24(6):1192-1201.
[22]Bialik S,Kimchi A.Lethal weapons:DAP-kinase,autophagy and cell death:DAP-kinase regulates autophagy[J].Curr Opin Cell Biol,2010,22(2):199-205.
Netrin-1 protects SH-SY5Y neuroblastoma cells from oxygen-glucose deprivation by attenuating autophagy
QUE Jiali,LI Chenguang,LIU Kejia,et al.
(Department of Neurology,The First Affiliated Hospital of Sun Yat-sen University,Guangzhou 510080,China)
Objective To mimic hypoxic and ischemia environment caused by stroke,in vitro oxygen-glucose deprivation (OGD) model was established.The aim is to explore whether axon guidance factor Netrin-1 protectes SH-SY5Y neuroblastoma cells from OGD by regulating autophagy.Methods SH-SY5Ys were pretreated with Netrin-1 before OGD,apply applied autophagy inducer rapamycin and autophagy inhibitor 3-methyladeni-ne (3-MA) to modulate the autophagy flow,and transient transfected HEK 293T cell with UNC5H2-HA plasmid;cell viability was examined in CCK8 assay,western Western blot detected the autophagy markers (Beclin1,LC3,p62) and immunofluorescence detected punctuate LC3.Results We found that Netrin-1 improved cell viability and decreased the expression of LC3-Ⅱ,a protein related to autophagosome formation,in a manner sensitive to RAPA co-treatment.Additionally,the ability of Netrin-1 to decrease the expression of LC3-Ⅱ was present in UNC5H2-overexpressing HEK 293T cells but not vehivle-transfected cells,indicated the importance of Netrin-1-UNC5H2 interaction to this effect.Conclusion These results indicate that Netrin-1 may improve cell survival by attenuat-ing autophagy via UNC5H2.
Netrin-1; Oxygen-glucose derivation; Autophagy; UNC5H2
1003-2754(2016)06-513-04
2016-02-23;
2016-05-29
国家自然科学基金(No.81371276);广东省自然科学基金(No.2014A030313065);广东省重大神经疾病诊治研究重点实验室(No.2014B030301035)
(中山大学附属第一医院神经科,卫生部国家临床重点专科,教育部国家重点专科,广东 广州 510080)
余 剑,E-mail:yujian21cn@163.com
R739.4
A

