引起鲟鱼暴发性死亡病因分析
文/王静波 贾 丽 曹 欢 徐立蒲 王小亮 张 文 王 姝
引起鲟鱼暴发性死亡病因分析
文/王静波贾丽曹欢徐立蒲王小亮张文王姝
北京市鲟鱼、鲑鳟鱼创新团队专栏
2016年8月,河北省涞源县一家鲟鱼养殖场突发疾病,且出现大量死亡。为确定病原,从具有典型症状的患病鱼的肝、肾和脾中进行病原菌分离鉴定。经28℃培养后,上述三个组织中均分离获得大量形态一致菌落。肝、肾和脾分离的病原菌分别编号为LY160816L、LY160816K、LY160816S,经形态特征、生理生化鉴定以及16SrDNA基因序列比对,鉴定结果为海豚链球菌。结合临床症状,综合判断,导致该场鲟鱼暴发性死亡的病因是感染了海豚链球菌。
近年来,中国的鲟鱼养殖规模不断扩大,养殖产量逐年增加。随之而来的是养殖鲟鱼的疾病爆发更加频繁,严重制约鲟鱼养殖业的健康发展。目前,已报道的鲟鱼致病菌有嗜水气单胞菌(Aeromonas hydrophila)、豚鼠气单胞菌(Aeromonas carvia)、类志贺邻单胞菌(Plesiomonas shigelloides)、停乳链球菌(Streptococcus dysgalactiae)和海豚链球菌(Streptococcus iniae)。2016年8月,河北省涞源县一家鲟鱼养殖场鲟鱼出现大量死亡,且持续时间长,累计死亡率达40%以上。其外观症状主要表现为口周围、腹部两侧骨板、肛门出血,疑似细菌感染。为了搞清病因,作者对具典型症状患病鲟鱼进行病原菌分离、生理生化鉴定以及16SrDNA基因序列比对。
一、材料方法
1.材料
患病鲟鱼来自河北省涞源县鲟鱼养殖场。鲟鱼规格20cm~30cm。
2.主要试剂
脑心浸液琼脂培养基购于北京陆桥生物技术有限公司。革兰氏染色试剂盒购于北京索莱宝科技有限公司。哥伦比亚血琼脂培养基和API 20 STREP鉴定试剂条购于北京威泰科生物技术有限公司。UNIQ-10柱式细菌基因组抽提试剂盒及PCR相关试剂购于上海生物工程有限公司。
3.病原菌分离、纯化
取具典型症状的患病鲟鱼,无菌操作从肝、脾和肾划线分离于脑心浸液琼脂(BHIA)平板和哥伦比亚血琼脂培养基,于28℃恒温培养箱培养20小时。挑取形态一致的优势菌落于BHIA平板进行纯化。菌株编号为编号LY160816L、LY160816K、LY160816S。
4.分离株的形态观察和生理生化特征
纯化菌划线分离于BHIA,28℃培养20小时观察菌落形态,进行氧化酶、触酶实验、革兰氏染色和API 20 STREP细菌鉴定试剂条鉴定生化特征。
5.分离株的PCR鉴定、16SrDNA基因序列测定与系统发育分析
病原菌的DNA模板制备采用UNIQ-10柱式细菌基因组抽提试剂盒提取,置于-20℃保存备用。细菌16SrDNA序列扩增通用引物For:5'-AGAGTTTGATCCTGGCTCAG-3',Rev:5'-TACGGCTACCTTGTTACGCTT-3'(退火温度55℃),引物均由上海生物工程有限公司合成。PCR反应体系50μ L,包括10×PCR缓冲液5μ L,25 mmol/L氯化镁5μ L,5U/μ L Taq酶0.25μ L,10 mmol/L dNTP 1μL,模板DNA 2μL,20 pmol/μL上下游引物各2μL,DEPC水补至50μL。PCR反应条件为94℃预变性5分钟,94℃变性1分钟,退火温度退火1分钟,72℃延伸1分钟,32个循环后72℃延伸10分钟,4℃保存。PCR扩增产物纯化后,由上海生工生物工程技术公司进行基因序列测定。
将分离菌的16SrDNA基因序列通过NCBI的Blast检索系统进行序列同源性分析,从中选取与所获序列同源性较高的同种菌株的16SrDNA 基因序列,并从Genbank数据库中获得同属相关种的16SrDNA序列,利用MEGA 4.0采用邻位连接法(Neighbor-Joining,NJ)构建系统发育树,通过自举分析进行置信度检测,自举数集1000次。

图1 口周围出血
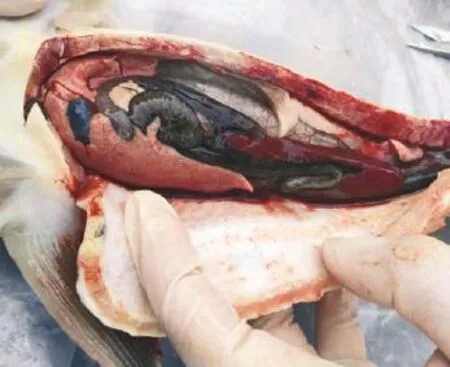
图2 肝、性腺出血,脾肿大
二、结果
1.临床症状
患病鱼外观主要症状为口周围、腹部两侧骨板、肛门出血,解剖后发现肝、性腺和腹腔内膜有出血点,脾肿大。
2.分离株的形态特征与生化特征
分离菌在BHIA培养基上28℃培养24小时的菌落特征为:白色、圆形、边缘齐整、扁平、直径约0.3mm~0.5mm。在血琼脂平板上28℃培养24小时,菌落为圆形,中心白色,周边半透明,形成β溶血环。氧化酶阴性,触酶反应阴性,革兰氏染色阳性,卵圆形,呈链状或双排链状(见图3)。

图3 鲟肾脏分离菌的革兰氏染色形态
采用API 20 STREP 系统鉴定,菌株编号为LY160816L、LY160816K、LY160816S的三个样品与Buller等报道的国外分离株的生化特征在β-葡萄糖醛酸酶、核糖和甘露醇项不同,而与Zhou等报道的中国分离株的生化特征完全一致。具体见表1。

表1 分离菌的生理生化试验结果
3.16SrDNA 基因序列分析及系统发育树构建
PCR扩增分离株LY160816K的16SrDNA 基因片段约1500bp。PCR经Blast同源性检索,发现其与海豚链球菌的同源性最高,在99.2%以上;与副乳房链球菌的同源性为97.6%,与停乳链球菌的同源性为97.2%,与无乳链球菌的同源性为97.0%。构建系统发育树,显示其与海豚链球菌聚为一支。

图4 菌株LY160816K的16s DNA系统发育树
三、讨论
通过对具有典型临床症状的发病鲟进行病原菌初次分离,获得大量形态一致的菌落。纯化菌株的生化特征与从中国其它鱼类分离的海豚链球菌一致,其16SrDNA基因序列与海豚链球菌的同源性在99.2%以上,综合确定分离株为海豚链球菌。
海豚链球菌自1976年从亚马逊河豚(Inia geoffrensis)皮肤脓肿处分离,目前在全世界范围内流行,可感染海水、半咸水和淡水的二十多种养殖或野生鱼类,每年对水产养殖业造成的经济损失超过100亿美元。但链球菌感染鲟鱼的相关报道非常少。1993年,Kitao等暗示鲟鱼也是链球菌感染的敏感对象。2006年,Roy和Ruth发现链球菌感染鲟鱼病例,未确认链球菌种类。2009年,潘厚军等和杨五名等证实停乳链球菌分别是西伯利亚鲟和施氏鲟的致病菌。2013年,王小亮等在北京怀柔某渔场鲟鱼体内分离到海豚链球菌。但至今还未见鲟鱼因感染海豚链球菌出现暴发性死亡病例的报道。
链球菌在水体中普遍存在,属于条件致病菌。当养殖密度大,水质环境差,水温高时会引起养殖鱼类感染。本渔场使用河道水进行鲟鱼养殖,在本次病害发生前,河道上游曾下暴雨,造成河道水出现浑浊,此水未经沉淀直接进入养殖池,随后养殖鲟鱼出现死亡,而且越发严重,累计死亡率达40%以上。同时,在发病后转移到虹鳟鱼养殖池的鲟鱼体内也分离到海豚链球菌,但是鲟鱼未出现死亡。因此,根据检测结果和结合临床症状综合分析,引起此渔场鲟鱼暴发死亡原因为感染海豚链球菌,同时水质环境变差,最终导致鲟鱼出现大量死亡。
作者单位:北京市水产技术推广站

