补体C3d-p28增强阿尔茨海默病DNA疫苗Th2型免疫反应的研究
郭婉姝, 邢晓娜, 王 楠, 曹云鹏
补体C3d-p28增强阿尔茨海默病DNA疫苗Th2型免疫反应的研究
郭婉姝1, 邢晓娜1, 王 楠1, 曹云鹏2
目的 探讨补体C3d-p28作为分子佐剂,在阿尔茨海默病DNA疫苗免疫反应中的作用。方法 分别将重组质粒p(Aβ3-10)10,p(Aβ3-10)10- C3d-p28.3和 空载体pcDNA3.1(+)用肌肉注射的方法免疫8~10周龄的雌性BALB/c鼠。质粒注射前24 h,布比卡因肌肉注射诱导轻微的肌肉变性。应用ELISA方法检测血清抗Aβ抗体的滴度、抗体分型、体外脾细胞培养上清液中IL-4 和 IFN-γ的含量。免疫组织化学染色法检测免疫血清与转基因鼠脑内Aβ斑的结合能力。结果 重组质粒疫苗p (Aβ3-10)10仅诱导出低滴度的抗Aβ抗体,产生了Th1/Th2混合型的免疫反应。而重组质粒疫苗p (Aβ3-10)10- C3d-p28.3诱导出较高滴度的抗Aβ抗体,体外脾细胞培养上清液中IFN-γ低和IL-4高,即引起了Th2型细胞免疫反应,同时产生的抗Aβ抗体能够与双转基因鼠APP/PS1脑中沉积的Aβ斑块结合。结论 补体C3d-p28分子佐剂能够增强抗Aβ抗体的产生并且诱发Th2型的免疫反应。
阿尔茨海默病; β淀粉样蛋白; DNA疫苗; C3d-p28分子佐剂
Aβ的基因免疫治疗,阻止Aβ产生、聚集和(或)增加Aβ清除被认为是治疗阿尔茨海默病的有效策略。一个理想的Aβ疫苗,不仅要刺激机体产生能够起治疗作用的抗Aβ抗体,还要避免不恰当的Th1型免疫反应引起的脑膜脑炎等副作用。引入恰当的基因佐剂可以增加抗原提呈和机体对抗原的免疫应答能力,把免疫应答导向Th2 方向。补体C3d能够促进抗体的产生及其亲和力的成熟[1],诱发更强烈的体液免疫反应[2]。而且C3d分子可降调节免疫活性细胞Th1型细胞因子的表达水平,升调节Th2型细胞因子的表达[3]。补体C3d分子与CR2特异性结合的结合域位于C3d分子1209-1236aa区域(C3d-p28),p28分子与全长C3d分子有相似的佐剂性质[4],但p28分子大小仅占C3d分子全长的9%[5],这更增强了DNA疫苗的有效利用。本研究旨在探讨补体C3d-p28作为分子佐剂,对阿尔茨海默病DNA疫苗免疫反应的影响。
1 材料与方法
1.1 实验动物及材料
1.1.1 动物 18只、8~10周龄、雌性BALB/c鼠购于中国医科大学实验动物研究中心。
1.1.2 主要材料 重组质粒疫苗p(Aβ3-10)10和重组质粒疫苗p(Aβ3-10)10-C3d-p28.3由湖南长沙赢润生物技术有限公司合成。抗Aβ抗体6E10 (Signet,美国);羊抗鼠IgG1-HRP (Zymed,美国);羊抗鼠IgG2a-HRP (Zymed,美国);羊抗鼠IgG2b-HRP (Zymed,美国);小鼠白介素-4 ELISA试剂盒(R&D Systems China Co.Ltd.,上海);小鼠IFN-γ ELISA试剂盒(R&D Systems China Co.Ltd.,上海)。
1.2 方法
1.2.1 动物分组 8~10周龄雌性BALB/c鼠共18只,按随机数字表法分成3组,每组6只。第一组:重组质粒p(Aβ3-10)10组;第二组:重组质粒p(Aβ3-10)10-C3d-p28.3组;第三组:空载体pcDNA3.1(+)组。
1.2.2 免疫方法 采用肌肉注射法。注射部位:小鼠左后腿股四头肌。重组质粒p(Aβ3-10)10组和重组质粒p(Aβ3-10)10-C3d-p28.3组:注射疫苗抗原浓度为1.0 μg/ μl,每只鼠注射体积为100 μl,一次注射疫苗100 μg。空载体pcDNA3.1(+)组:注射疫苗抗原浓度为1.0 μg/ μl,每只鼠注射体积为100 μl,一次注射疫苗100 μg。每次注射以上两组重组质粒疫苗前1 d注射部位用布比卡因进行预处理:布比卡因配制浓度5 mg/ml,一只小鼠一次注射50 μl(250 μg)。三组小鼠疫苗注射前均需腹腔注射10%水合氯醛(0.03 mg/kg)进行麻醉。三组小鼠共免疫5次,每2 w免疫一次。
1.2.3 取血及血清样本处理 疫苗接种前、从第2次注射开始每次接种后1 w取鼠眶静脉血0.5 ml。采血后,血液置于37 ℃ 3~5 h,4 ℃下5000×g离心10 min,吸取上清,分装-70 ℃冻存。
1.2.4 间接ELISA法检测血清中抗Aβ抗体滴度及分型 (1)抗原包被96孔板,每孔加入100 μl 稀释的Aβ42(5 μg/ml),4oC孵育过夜;(2)用含有0.05%TW20的1×PBS(200 μl每孔)洗板3次,下同;(3)每孔中加入200 μl封闭缓冲液,室温下孵育1 h;(4)免疫前和免疫后的血清以1∶1000(1 μl加入1 ml封闭缓冲液)稀释,用封闭缓冲液封闭1 h后,洗板;(5)孔中加入50 μl稀释的血清和标准抗体,然后室温孵育3 h,洗板;(6)加入稀释的二抗(IgG:1:2000;IgG1:1:2000,IgG2a:1:1000,IgG2b:1∶1000),50 μl每孔;室温下孵育1 h,洗板;(7)每孔中加入100 μl TMB,室温下孵育15 min,或者是到颜色产生;(8)每孔中加入100 μl终止液(2N H2SO4);(9)读取450 nm处的OD值。
1.2.5 ELISA法检测脾细胞培养上清液中细胞因子IL-4和IFN-γ的含量 步骤按试剂盒说明书进行。
1.2.6 免疫组织化学染色方法检测免疫血清与APP/PS1双转基因鼠脑内Aβ斑结合情况 (1)石蜡切片(APP/PS1双转基因鼠脑组织切片,4 μm),60 ℃烤箱烤片1 h,切片常规脱蜡至水,;(2)30%H2O21份加蒸馏水10份混合,室温5~10 min以灭活内源性酶。蒸馏水洗3次。(3)热修复抗原。将切片进入0.01 mol/L枸橼酸盐缓冲液(pH 6.0),微波炉加热至沸腾。后断电,间隔5~10 min后,反复2次。冷却后PBS洗涤2次;(4)滴加正常山羊血清封闭液,室温20 min;(5)滴加末次接种后的鼠血清,37 ℃ 1 h,PBS洗2 min×3次;(6)滴加生物素化山羊抗小鼠IgG,37 ℃ 20 min,PBS洗2 min×3次;(7)滴加试剂SABC,37 ℃ 20 min,PBS洗5 min×4次;(8)DAB显色:使用DAB显色试剂盒。取1 ml蒸馏水,加试剂盒中A,B,C试剂各1滴,混匀后加至切片。室温显色,镜下控制反应时间,一般在5~30 min之间;(9)脱水、透明、封片、显微镜观察。
2 结 果
2.1 血清抗Aβ抗体滴度及分型的检测 经重组质粒p(Aβ3-10)10和重组质粒p(Aβ3-10)10-C3d-p28.3免疫的小鼠均产生了抗Aβ抗体,并且在第二次免疫后血清抗Aβ抗体的滴度平稳增长,重组质粒p(Aβ3-10)10从最初的5.09±1.42 μg/ml增长到:(26.11±8.55) μg/ml;重组质粒p(Aβ3-10)10-C3d-p28.3组从最初的(10.46±4.35) μg/ml增长到(57.12±12.08) μg/ml。重组质粒p(Aβ3-10)10-C3d-p28.3组的抗Aβ抗体的滴度高于重组质粒p(Aβ3-10)10组(P<0.05),但是pcDNA3.1(+)免疫的小鼠未检测出抗Aβ抗体(见图1A)。
抗IgG1 抗体检测:重组质粒p(Aβ3-10)10- C3d-p28.3组(32.25±6.78) μg/ml较重组质粒p(Aβ3-10)10组(10.33±3.01) μg/ml明显增高(P<0.05),但是抗IgG2a和IgG2b抗体检测:重组质粒p(Aβ3-10)10- C3d-p28.3组(3.28 ± 1.54) μg/ml、(6.03± 2.17) μg/ml低于重组质粒p(Aβ3-10)10组(7.02 ±2.56) μg/ml和IgG2b抗体(12.62± 4.73) μg/ml(见图1B)。
重组质粒p(Aβ3-10)10- C3d-p28.3组的IgG1/IgG2a的比值(9.83 ±1.18)明显高于重组质粒p(Aβ3-10)10组(1.47 ±0.04)(P<0.05,图1C)。


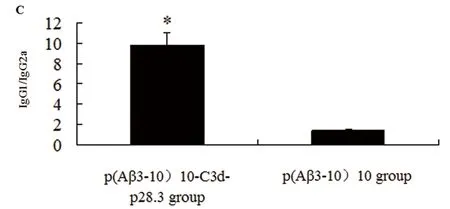
A:经重组质粒p(Aβ3-10)10、重组质粒p(Aβ3-10)10-C3d-p28.3和空载体pcDNA3.1(+)免疫后小鼠的血清抗Aβ抗体滴度。B:重组质粒p(Aβ3-10)10和重组质粒p(Aβ3-10)10-C3d-p28.3组抗Aβ抗体的分型:IgG1,IgG2a,IgG2b的含量。C:重组质粒p(Aβ3-10)10和重组质粒p(Aβ3-10)10-C3d-p28.3组的IgG1/IgG2a的比值。*P<0.05,与重组质粒p(Aβ3-10)10组相比
图1 抗Aβ抗体的滴度和分型分析


A:在相应的自身抗原刺激下的脾细胞培养上清液中IL-4的含量测定。*P<0.05,与空载体pcDNA3.1(+)组和重组质粒p(Aβ3-10)10组相比。B:在相应的自身抗原刺激下的脾细胞培养上清液中IFN-γ的含量测定。*P<0.05,与重组质粒p(Aβ3-10)10-C3d-p28.3组和空载体pcDNA3.1(+)组相比
图2 脾细胞培养上清液中IL-4、IFN-γ的检测


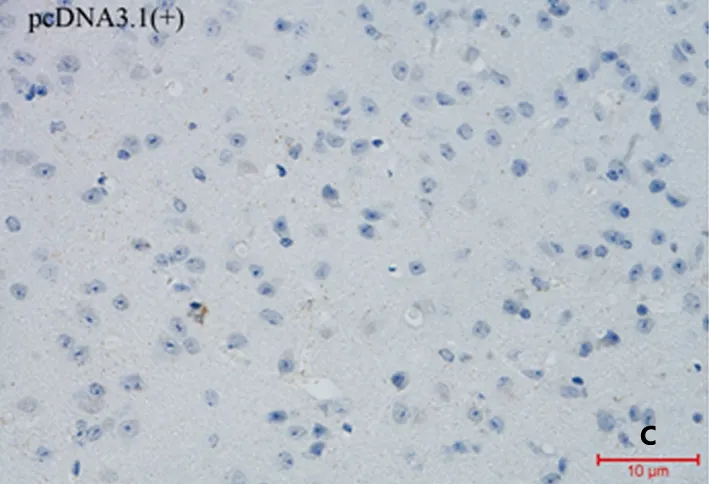
A:重组质粒p(Aβ3-10)10免疫后的血清能够与12月龄的APP/PS1双转基因鼠脑内Aβ斑结合。B:重组质粒p(Aβ3-10)10-C3d-p28.3免疫后的血清能够与Aβ斑结合。C:空载体pcDNA3.1(+)免疫后的血清不能与Aβ斑结合
图3 免疫血清与APP/PS1双转基因鼠脑内Aβ斑结合能力的检测
2.2 脾细胞培养上清液中细胞因子的检测 脾细胞培养上清液中的IL-4含量:重组质粒p(Aβ3-10)10-C3d-p28.3组(82.26 ±9.94 pg/ml)明显高于重组质粒p(Aβ3-10)10组(42.33 ± 6.78) pg/ml和pcDNA3.1(+)组(13.74±4.25) pg/ml(P<0.05),而重组质粒p(Aβ3-10)10组略高于pcDNA3.1(+)组(P<0.05,图2A)。
脾细胞培养上清液中的IFN-γ含量测定:重组质粒p(Aβ3-10)10组(51.2 ±9.67) pg/ml高于重组质粒p(Aβ3-10)10-C3d-p28.3组(29.77±7.76) pg/ml和pcDNA3.1(+)组(23.13±7.16) pg/ml(P<0.05),而后两组并没有差异(P>0.05,图2B)。
2.3 免疫血清与APP/PS1双转基因鼠脑内Aβ斑结合能力的检测 重组质粒p(Aβ3-10)10和重组质粒p(Aβ3-10)10-C3d-p28.3免疫后的血清均能够与12月龄的APP/PS1双转基因鼠的脑内Aβ斑结合(见图3A、B),但是重组质粒p(Aβ3-10)10结合Aβ斑的能力明显弱于重组质粒p(Aβ3-10)10-C3d-p28.3。空载体pcDNA3.1(+)免疫后的血清(见图3C)不能与12月龄的APP/PS1双转基因鼠的脑内Aβ斑结合。
3 讨 论
研究发现,编码不同抗原基因(西尼罗病毒、乙肝病毒、猪生殖和呼吸综合征病毒、疟原虫环孢子蛋白)的DNA疫苗在融合了C3d-p28分子佐剂后,抗原的免疫原性大大地增强了,DNA疫苗的有效性也大大提高[5~8]。因此,补体C3d-p28作为分子佐剂应用前景广阔。
本研究中,空载体pcDNA3.1(+)组没有抗Aβ抗体的产生。而在第二次免疫后,重组质粒p(Aβ3-10)10-C3d-p28.3组和重组质粒p(Aβ3-10)10组都产生了抗Aβ抗体,不过重组质粒p(Aβ3-10)10-C3d-p28.3组产生的抗Aβ抗体量要明显高于重组质粒p(Aβ3-10)10组,这说明融合了分子佐剂C3d-p28.3的Aβ疫苗免疫原性明显强于无佐剂的Aβ疫苗。
重组质粒p(Aβ3-10)10-C3d-p28.3组产生了以IgG1为主的抗体,IgG2a和 IgG2b的值较低,相对应的重组质粒p(Aβ3-10)10组则产生了低水平的IgG1,略高水平的IgG2a和 IgG2b抗体,而且重组质粒p(Aβ3-10)10-C3d-p28.3组IgG1/IgG2a的比值明显高于重组质粒p(Aβ3-10)10组。据研究证实疫苗免疫后诱导的免疫球蛋白IgG的亚型可以间接反应免疫反应是Th1型还是Th2型。Th1型免疫反应主要产生IgG2a抗体,通过产生IFN-γ,IL-2等细胞因子诱导细胞介导的炎症反应;而Th2型免疫反应主要诱导IgG1抗体,通过产生IL-4,IL-5等细胞因子增强体液免疫反应[9]。IgG1/IgG2a的比值可以反映出该Aβ疫苗所诱导的主要免疫应答类型。本实验中,融合了分子佐剂C3d-p28.3的Aβ疫苗产生了以IgG1为主的抗体,高比值的IgG1/IgG2a,这都倾向于Th2型免疫反应;而无佐剂的Aβ疫苗产生了Th1/ Th2混合型的免疫反应。
重组质粒p(Aβ3-10)10-C3d-p28.3疫苗免疫后,经自身抗原刺激,脾细胞培养上清液中IL-4高于重组质粒p(Aβ3-10)10组和空载体pcDNA3.1(+)组,脾细胞培养上清液中IFN-γ水平重组质粒p(Aβ3-10)10组高于重组质粒p(Aβ3-10)10-C3d-p28.3组和空载体pcDNA3.1(+)组,再次说明融合了分子佐剂C3d-p28.3的Aβ疫苗产生了Th2型免疫反应,所以对于AD主动免疫治疗,获得一个主要的Th2型免疫反应比单纯提高抗Aβ抗体的滴度更为重要;而且,Th2型的抗体清除Aβ沉积更为有效,发生炎症反应的可能性更低[10]。
脑内Aβ斑块沉积是AD诊断的决定性指标,它的清除用来评价AD模型鼠的治疗效果。一个12月龄的APP/PS1转基因鼠脑切片用来检测免疫血清产生的抗Aβ抗体与脑内Aβ斑块结合的能力。重组质粒p(Aβ3-10)10-C3d-p28.3疫苗和重组质粒p(Aβ3-10)10疫苗免疫后的血清均能够与12月龄的APP/PS1转基因鼠脑切片的Aβ斑块结合,而空载体pcDNA3.1(+)组的免疫血清不能够与脑切片的Aβ斑块结合。这说明了融合了分子佐剂C3d-p28.3的Aβ疫苗对脑内Aβ斑块产生了特异性的免疫反应,并且这种能力强于无佐剂的Aβ疫苗。
总之,重组质粒疫苗 p(Aβ3-10)10-C3d-p28.3,正因为融合了分子佐剂C3d-p28.3,不仅能够刺激产生具有治疗水平的抗Aβ抗体,还能够诱发Th2型的免疫反应,避免了炎症副作用,最重要的是,产生的抗Aβ抗体能够与APP/PS1双转基因鼠脑内的Aβ斑块结合。分子佐剂C3d-p28.3的作用机制正在研究中。
[1]Yang S,Wang C,Fang X,et al. Fusion of C3d molecule with neutralization epitope(s) of hepatitis E virus enhances antibody avidity maturation and neutralizing activity following DNA immunization K[J]. Virus Res,2010,151(2):162-169.
[2]Li DJ,Wang HM,Zhao XR,et al. Gene fusion of molecular adjuvant C3d to hCGβenhances the anti-hCGβ antibody response in DNA immunization[J]. J Reproduct Immunol,2003,60:129-141.
[3]Movsesyan N,Mkrtichyan M,Petrushina I,et al. DNA epitope vaccine containing complement component C3d enhances anti-amyloid-β antibody production and polarizes the immune response towards a Th2 phenotype[J]. J Neuroimmunol,2008,205:57-63.
[4]Bower JF,Ross TM. A minimum CR2 binding domain of C3d enhances immunity following vaccination[J]. Adv Experiment Med Biol,2006,587:249-264.
[5]Dunn MD,Rossi SL,Carter DM,et al. Enhancement of anti-DIII antibodies by the C3d derivative P28 results in lower viral titers and augments protection in mice[J]. Virology J,2010,7:95.
[6]Wang LX,Xu W,Guan QD,et al. Contribution of C3d-P28 repeats to enhancement of immune responses against HBV-preS2/S induced by gene immunization[J]. World J Gastroenterol,2004,10(14):2072-2077.
[7]Zhang D,Xia Q,Wu J,et al. Construction and immunogenicity of DNA vaccines encoding fusion protein of murine complement C3d-p28 and GP5 gene of porcine reproductive and respiratory syndrome virus[J]. Vaccine,2011,29:629-635.
[8]Bergmann-Leitner ES,Duncan EH,Leitner WW,et al. C3d-defined complement receptor-binding peptide p28 conjugated to circumsporozoite protein provides protection against Plasmodium berghei[J]. Vaccine,2007,25:7732-7736.
[9]Finkelman FD,Holmes J,Katona IM,et al. Lymphokine control of in vivo immunoglobulin isotype selection[J]. Annu Rev Immunol,1990,8:303-333.
[10]Chauhan NB,Siegel GJ. Efficacy of anti-Abeta antibody isotypes used for intracerebroventricular immunization in TgCRND8[J]. Neurosci Lett,2005,375:143-147.
Enhancement of Th2 Immune Response to Alzheimer’s disease DNA Vaccine by complement C3d-p28
GUO Wanshu,XING Xiaona,WANG Nan,et al.
(Department of Neurology,The People’s Hospital of Liaoning Province,Shenyang 110016,China)
Objective To discuss the effect of complement C3d-p28 in the immune response of Alzheimer DNA vaccine bstract. Methods Eight to ten week-old female BALB/c mice were immunized intramuscularly with recombinant plasmid p(Aβ3-10)10,p(Aβ3-10)10-C3d-p28.3 and pcDNA3.1(+). 24 h prior to plasmid injection,bupivacaine was injected to induce mild muscle degeneration. ELISA was used to detect the titer of serum anti-Aβ antibody,isotypes of immunoglobulin and levels of IL-4 and IFN-γ in ex vivo splenocyte culture supernatants. Immunohistochemistry was used to detect the binding capability of antisera to Aβ plaques in an APP/PS1 transgenic mouse brain. Results We have successfully constructed two plasmid DNA vaccines:p(Aβ3-10)10 expressing ten repeats of Aβ3-10 without adjuvant and p(Aβ3-10)10- C3d-p28.3 encoding ten repeats of Aβ3-10 and three copies of C3d-p28 as a molecular adjuvant. Immunization of eight to ten week-old female BALB/c mice with p(Aβ3-10)10 vaccine induced only moderate titers of anti-amyloid-β antibodies and elicited a Th1/ Th2 immune response. However,adding of the C3d-p28 molecular adjuvant to Aβ3-10 DNA vaccine could generate high levels of anti-amyloid-β antibodies (P<0.05) which bound to Aβ plaques in APP/PS1 transgenic mouse brain tissue. More importantly,the vaccine elicited a predominantly IgG1 humoral response (P<0.05),low levels of IFN-γ (P<0.05) and high levels of IL-4 in ex vivo cultured splenocytes (P<0.05),indicating a Th2-polarized cellular immune response. Conclusion Complement C3d-p28 molecular adjuvant enhances anti-amyloid-β antibody generation and induces a Th2-polarized immune response.
Alzheimer’s disease; Amyloid-β; DNA vaccine; C3d-p28 molecular adjuvant
1003-2754(2016)11-0976-04
2016-07-28;
2016-10-06
(1.辽宁省人民医院神经内科,辽宁 沈阳 110016;2.中国医科大学附属第一医院神经内科,辽宁 沈阳 110001)
曹云鹏,E-mail:ypengcao@yahoo.com
R749.1+6
A

