肝型和无症状型肝豆状核变性颅脑磁共振分析
方 媛, 李良勇, 张 静, 陈怀珍, 方 向
肝型和无症状型肝豆状核变性颅脑磁共振分析
方 媛, 李良勇, 张 静, 陈怀珍, 方 向
目的 观察肝型和无症状型的肝豆状核变性颅脑MRI表现。方法 对我院2014年5月-2016年5月收治的97例肝型和28例无症状型WD患者,均行头部MRI检查。结果 125例患者中颅脑磁共振检查发现有108例患者(87.8%)有脑部异常信号样改变,其中肝型83例,无症状型25例;83例有脑萎缩改变,肝型63例,无症状型20例。结论 肝型和无症状型肝豆状核变性患者颅脑MRI异常信号比例较高,主要集中在壳核;信号改变主要为对称性长T1和长T2,未发现有混杂样信号改变;病程与脑干和壳核相关,发病年龄与壳核、苍白球、尾状核密切相关;Child-Pugh分级与颅脑磁共振改变没有明显相关性。
肝豆状核变性; 磁共振成像; 肝型; 无症状型
肝豆状核变性(hepatolenticular degeneration,HLD)又称Wilson’s 病(WD)是一种常染色体隐性遗传的铜代谢障碍性疾病,主要是由于铜离子异常大量沉积于肝、脑、肾等组织,从而导致全身多系统多器官的损害,以肝脏和锥体外系症状最为常见[1]。而肝脏的表现通常为肝功能损害、肝硬化、门脉高压症等,一般年轻患者居多。以铜生化的异常而无任何临床表现的WD患者近年来也不少见。
对于有神经系统症状的WD,磁共振成像(MRI)是一个非常敏感的脑组织检查的诊断方法,揭示病变在基底节、脑白质、中脑、脑桥和小脑等。近年来,国内外对脑型WD患者的颅脑MRI研究颇多,相反,对肝型和无症状型研究较少。本研究的目的是分析脑核磁共振成像在无症状型和肝型WD中的表现,通过颅脑磁共振检查,早期发现肝型和无症状型WD患者颅脑磁共振异常信号改变,以便早期治疗,延缓患者病情,减轻患者痛苦。
1 资料与方法
1.1 研究对象 选取我院确诊的2014年5月-2016年5月收治的125例肝型和无症状型WD患者,肝型97例,无症状型的28例,其中71例为男性,64例为女性,发病年龄为2~44岁,病程15 d~30 y。
1.2 诊断标准 根据《肝豆状核变性诊断与治疗指南》[2]:①家族遗传史:父母是近亲婚配、同胞中有 WD 患者或死于原因不明的肝病者;②缓慢进行性震颤、肌僵直、构音障碍等锥体外系症状、体征或(及)肝症状;③ 肉眼或裂隙灯证实有 K-F 角膜色素环;④血清铜蓝蛋白(Ceruloplasmin,CP)<200 mg/L 或铜氧化酶<0.20 活力单位;⑤24 h尿铜排泄量>100 μg(1.56 μmol);⑥肝铜>250 μg/g(干重)。分型诊断标准:无症状型:①具备肉眼或裂隙灯证实有 K-F 角膜色素环;②CP<200 mg/L 或铜氧化酶<0.20 活力单位;③24 h尿铜排泄量>100 μg(1.56 μmol)④无任何自觉肝脏或神经症状;肝型:符合肝豆状核变性诊断标准,隐匿起病,表现为食欲减退、黄疸、腹腔积液或脾功能亢进等肝脏损害症状,可较长时间仅有肝脏症状而无神经症状,但病程进展缓慢,称为肝型。
1.3 纳入标准 (1)年龄2~50岁;(2)所有病例均符合WD诊断标准;符合肝型和无症状型WD诊断标准。
排除标准 (1)有任何神经系统症状体征、精神行为异常;(2)有脑外伤、中毒、感染等病史;(3)伴随其他影响脑萎缩的严重神经系统疾病,如阿尔茨海默病等;(4) 有严重的心脏病或安装起搏器或幽闭恐怖症者;(5)其他原因引起的肝病损害。
1.4 实验室检查 使用日本日立公司生产的 7072 全自动生化分析仪检测CP和肝功能;使用由意大利公司生产的 BT224半自动生化分析仪检测血铜氧化酶(Serum copper oxidase,Sco);使用北京瑞利分析仪器公司生产的 WFX-1E2)型原子吸收分光光度计检测血清铜和前24 h尿铜。
1.5 颅脑磁共振检查 使用安徽省中医院影像中心3.0特斯拉(Symphony Simens Germany 3.0T)超导磁共振诊断仪,多通道正交头线圈进行扫描。颅脑MRI 常规扫描包括横切位和矢状位,T1加权成像(T1-weighted imaging,T1WI)、T2加权成像(T2-weighted imaging,T2WI)、液体衰减反转恢复(Fluid attenuated inversion recovery,FLAIR)。核磁共振结果是由神经放射学专家结合临床检查结果分析得出的结论。
1.6 Chird-Pugh评分 计算每一位患者Child-Pugh评分,根据此分为肝硬化代偿和失代偿期[3]。5-6分为A级,7-9分为B级,10-15分为C级,A级为代偿性肝硬化,B、C级为失代偿性肝硬化。
1.7 统计方法 采用SPSS 17.0统计软件包,定性变量之间的关联性分析采用 R*C列联表的卡方检验,P<0.01 为有极显著性差异,P<0.05 为有显著性差异,P>0.05 为无显著性差异。
2 结 果
2.1 颅脑MRI异常信号部位 125例肝型和无症状型WD患者中有108例颅脑MRI有异常信号(87.8%),除脑干、豆状核、丘脑及小脑以外,发现额叶、胼胝体也有异常信号,这无论是在脑型还是其他类型均属少见。其中壳核81例(64.8%)、脑干55例(44%)、苍白球50例(40%)、丘脑34例(27.2%)、小脑9例(7.2%)、尾状核28例(22.4%)、额叶14例(11.2%)、胼胝体7例(5.6%)(见表1及图1~图4)。
2.2 颅脑MRI异常信号类型 125例颅脑MRI检查发现异常信号有对称性长T1和长T2,非对称性长T1和长T2,等T1短T2,等T1长T2,短T1短T2,其中以对称性长T1长T2信号最多(92.8%),未发现有混杂信号。
2.3 颅脑MRI脑萎缩样改变 在125例患者中发现83例(66.4%)患者有脑萎缩样改变(见图5)。其中肝型63例,无症状型20例。大脑皮质有9例(7.2%),小脑萎缩9例(7.2%)、脑室扩大37例(29.6%)、全脑萎缩43例(34.4%)。具体分型结果见表2。
2.4 发病年龄与颅脑MRI的关系 WD发病年龄主要是在11~20岁年龄段,共有52例,颅脑MRI显示壳核(73.1%)有异常信号最为多见,根据统计学分析,壳核、苍白球、尾状核与发病年龄有明显的相关性(P<0.05)。结果见表3。
2.5 病程与颅脑MRI关系 可以发现大部分患者病程都超过2 y,早期诊断率不高,病程较短的脑损害范围也是比较广。根据统计方法分析,得出脑干、壳核与病程的长短密切相关(P<0.05),结果见表4。
2.6 根据WD患者Child-Pugh评分分级 发现有116例为A级,5例为B级,4例为C级,得出肝型和无症状型WD的Child-Pugh分级与颅脑MRI无明显相关性。

表1 肝型、无症状型与颅脑MRI病变部位的关系(%)

表2 肝型、无症状型与脑萎缩关系(%)
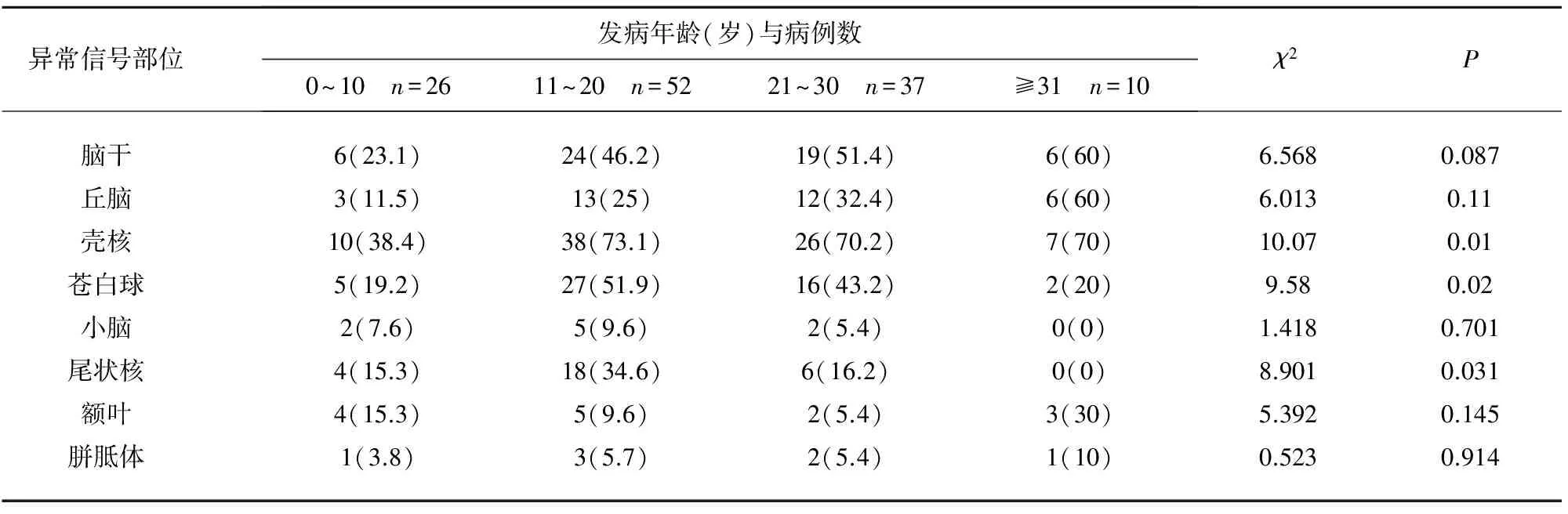
表3 发病年龄与颅脑MRI病变的关系(%)

表4 病程与颅脑MRI异常信号部位关系(%)
3 讨 论
WD患者由于基因突变,ATP7B 酶的活性丧失,则铜不能与肝细胞上的α-球蛋白结合,铜蓝蛋白合成减少;多余的铜不能经胆道排出,在肝脏内过多沉积,由于铜离子的毒性作用损伤肝细胞,导致肝细胞变性坏死。因此,肝细胞功能障碍引起的慢性肝衰竭、胆汁淤积性肝功能衰竭、慢性活动性肝炎、原发性胆汁性肝硬化及其他原因,可能会导致在壳核显示一个高信号模式,最易的观察到的是T2W序列。这些变化可能反映了微血管病障碍,沉积的顺磁物质或蛋白质结合所导致的肝衰竭的毒性,他们也存在于肝型WD患者中[4]。在WD患者中无论是什么类型,其本质是铜代谢处于一种失稳状态,以铜生化异常为特征,如铜蓝蛋白(Ceruloplasmin,CP)、铜氧化酶降低。有实验研究发现[5]Cu 负荷大鼠脑组织各功能区Cu含量明显升高,以基底节区、脑干Cu含量的升高为主,表明当Cu过量时这些脑功能区可能受损更加明显,所以本次研究中以壳核和脑干最多。CP是重要的亚铁氧化酶,主要在肝脏合成,可在大脑皮质、基底神经节、小脑、胼胝体等表达,国外有研究[6]认为CP缺乏可以驱使非铁蛋白结合的铁离子进入神经元或其他中枢神经系统组织细胞中,造成神经元或其他中枢神经系统组织细胞中铁的过度沉积,诱导氧化应激反应形成自由基,引起一连串的病理变化导致神经元死亡。另外,又有学者指出,铜蓝蛋白、血清铜减低,过量的铜在肝脏沉积时,人体内多余的铜已经过肝脏释放,进入其他脏器,尤其是脑部,导致脑病变通常是双侧的、对称的,常累及壳核、尾状核,苍白球等部位,在这些部位的组织病理学改变包括水肿、坏死等。这些都归因于铜过多积累造成的慢性缺血性损害、血管病变或脱髓鞘改变[7]。由此说明患者的颅脑MRI 的异常可先于临床症状的出现,可以作为非脑型WD患者的早期诊断依据。
肝豆状核变性是一种遗传性铜代谢障碍的疾病,最易侵犯的是肝脏和脑,在临床上通常分为无症状型、肝型、脑型及肝-脑混合型。随着生物医学的发展,颅脑MRI检查对于WD的诊断也是一种敏感的手段。在以往的研究中没有大样本、系统的探讨过肝型和无症状型WD患者颅脑MRI的病变情况。本项研究的目的主要是通过颅脑MRI检查,研究肝型和无症状型WD患者的颅脑MRI病变的分布。在早期的对小样本无症状或肝型WD患者颅脑MRI检查,基本上没有异常信号[8],在既往国外研究中,在8例脑型和15例肝型的WD患者中,只有7例脑型的患者颅脑MRI有异常信号,而肝型的均是正常的[9]。又有研究报道,在12例肝型的患者中只有3例颅脑MRI显示在基底节区 T1是高信号,尤其是苍白球[10],在一项国外报道中[11],7个无症状型的患者颅脑MRI均是正常的,4例肝型的患者只有纹状体有异常信号。后来国外有研究发现在3个无症状型WD患者均存在皮质萎缩情况[12]。近年来,国内也有小样本的报道,在6例肝型WD患者中,颅脑MRI检查发现只有壳核和丘脑的异常[13]。
我们这项研究与以往不同的是,在125例无症状和肝型患者中87.8%的患者颅脑MRI有病变,而且部位不仅仅局限于壳核与脑干。而且有66.4%的患者有脑萎缩样改变。同时,我们观察到无论是肝型还是无症状型中,壳核、尾状核、苍白球的病变是较多见的,这与WD患者最典型的颅脑MRI 特征是双侧基底节区的病变[14]是一致的;在丘脑、脑干也有病变;更值得注意的是在额叶、胼胝体也有病变,由此,可看出,肝型和无症状型WD患者颅脑MRI有异常信号的部位并不仅仅局限于常见的部位,范围比较广泛。而且发现125例颅脑MRI病变部位异常信号种类较多,有对称性长T1和长T2,非对称性长T1和长T2,等T1短T2,等T1长T2,短T1短T2,其中以对称性长T1长T2信号最多,这与既往研究相一致,但是,在此次研究中,未发现有混杂信号。
本组125例肝型和无症状型WD患者发病年龄的高峰期在11~20岁之间,发病年龄低者脑部病变也广泛,这与相关报道有差异[15]。可能与样本量有关。而且,发现发病年龄与壳核、苍白球、尾状核密切相关。有报道认为患者的病程越长,脑损害部位越广,与壳核、脑干及尾状核损害密切相关[13]。本次研究中发现病程较短的患者,脑部病变范围也比较广泛,且壳核、脑干与病程有相关性。在本组研究中,根据Child-Pugh评分发现其与颅脑MRI表现无明显相关性,大多数都属于A级,可能与样本有关。
本次研究中得出的结果与既往国内外研究有差别,可能与以下几点有关:(1)样本量不一样,可能存在抽样误差;(2)设备不同,既往主要是1.5T磁共振,敏感度较差;(3)关注部位不够多,既往研究可能只关注WD常见的部位,而忽视其他少见部位,如大脑皮质、胼胝体、小脑等。
总之,肝型和无症状型WD大多数患者的颅脑MRI表现有不同的脑部异常信号,且范围分布广泛,所以,在WD治疗及预后方面,颅脑MRI检查不仅对脑型患者有很大的作用,对肝型和无症状型也有重要作用;不能只关注其常见部位,同时应重视少见部位,如大脑皮质、胼胝体、小脑等。
[1]孙 怡,杨任民,韩景献. 实用中西医结合神经病学[M]. 第二版,北京:人民卫生出版社,2011. 41-742.
[2]中华医学会神经病学分会神经遗传病学组和运动障碍学组. 肝豆状核变性的诊断与治疗指南[J]. 中华神经科杂志,2008,41(8):566-567.
[3]王宝恩,张定凤. 现代神经病学[M]. 北京:科学技术出版社,2003. 548-549.
[4]Ball WS,Egelhoff JC,Jones BV,et al. Metabolic,Congenital,Neurodegenerative and Toxic Disorders[M]//Edelman RR,Hesselink JR,eds. Clinical Magnetic Resonance Imaging. 3rd ed,Philadelphia:Saunders,2006:1656-1704
[5]王佳炜,侯焕喜,王 训,等. 铜负荷大鼠脑组织 Cu、Zn、Fe 分布及其对神经元细胞损伤的机制[J]. 山东医药,2013,53(21):23-25.
[6]Mukhopadhyay CK,Mazumder B,Fox PL,et al. Role of hypoxia induc-ible actor 1 in transcriptional activation of ceruloplasmin by iron deficien-cy[J]. Biol Chem,2000,275(28):21048-21054.
[7]Sener RN. Diffusion MR Imaging Changes Associated with Wilson Disease[J]. American Journal of Neuroradiol,2003,24:965-967.
[8]Prayer L,Wimberger D,Kramer J,et al. Cranial MRI in Wilson’s disease[J]. Neuroradiology,1990,32:211-214.
[9]Giagheddu M,Tamburini G,Piga M,et al. Comparison of MRI,EEG,EPs and ECD-SPECT on Wilson’s disease[J]. Acta Neurol Scand,2001,103:71-81.
[10]Saatci I,Topcu M,Baltaoglu FF,et al. Cranial MRI findings in Wilson’s disease[J]. Acta Radiologica,1997,38:250-258.
[11]Kozi D,Svetel M,Petrovic B,et al. MR imaging of the brain in patients with hepatic form of Wilson’s disease[J]. European Journal of Neurology,2003,10:587-592.
[12]Alanen A,KomuM,Penttinen M,et al. Magnetic resonance imaging and roton MR spectroscopy in Wilson’s disease[J]. Br J Radiol,1999,72:749-756.
[13]喻绪恩,杨任民. 肝豆状核变性132例颅脑MRI扫描分析[J]. 中风与神经疾病杂志,2007,24(1):30-34.
[14]翟鲁辉. 肝豆状核变性的临床与MRI分析[J]. 临床医学,2005,25(7):34-35.
[15]Kozic D,Svetel B,Petrovic N,et al. MR imaging of rhe brain in patients with hepatic form of Wilson’s disease[J]. European Journal of Neurology,2003,10:537-592.
MR imaging analysis of the brain in patients with hepatic form and asymptomatic type of Wilson’s disease
FANG Yuan,LI Liangyong,ZHANG Jing,et al.
(Department of internal medicine,the First Affiliated Hospital of Anhui traditional Chinese Medicine University,Anhui Hefei 230031 China)
Objective To observe the expression of MRI in liver type and asymptomatic type of Wilson’s disease. Methods 97 cases of liver type and 28 patients with asymptomatic WD patients in our hospital from May 2014 to May 2016 were enrolled,all underwent brain MRI examination. Results 108 patients (87.8%) had abnormal brain signal changes with MRI scan,including 83 cases of hepatic type,25 cases of asymptomatic type,83 cases of brain atrophy,63 cases of liver type,and 20 cases without symptoms. Conclusions The proportion of MRI abnormal signals in liver type and no symptoms of hepatolenticular degeneration patients brain were higher,mainly concentrated in the putamen;signal changes mainly for symmetric long T1 and long T2,not found a mixed sample signal change;course of disease was related with brain stem and putamen,age of onset and putamen,globus pallidus,were closely related to the caudate nucleus;child Pugh classification and brain magnetic resonance changes did not show any significant correlation.
Wilson’s disease; Magnetic resonance imaging; Hepatic form; Asymptomatic type

图1 双侧额叶病变

图2 胼胝体病变

图3 双侧壳核、丘脑病变

图4 小脑蚓部病变
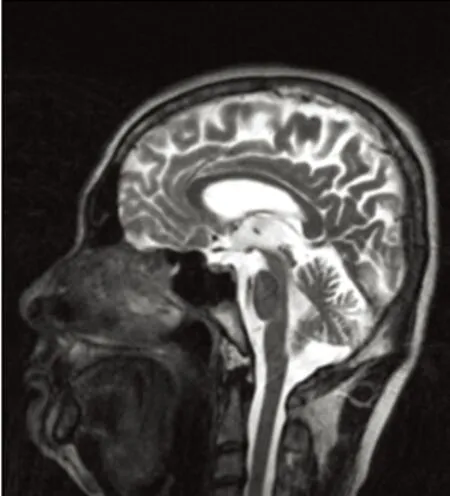
图5 脑萎缩明显
1003-2754(2016)11-1013-4
2016-07-20;
2016-10-20
国家自然科学基金(81102592):安徽省高校省级自然科学研究项目(KJ2013Z170)
(安徽中医药大学第一附属医院神经内科,安徽 合肥 230031)
陈怀珍,E-mail:chhz2000@163.com
R742.4
A

