鹿茸多肽诱导心肌干细胞向心肌细胞分化的机制研究Δ
王艳玲,黄晓巍,李 哲,何 璐,徐 岩,曲晓波(.吉林大学基础医学院,长春 300;.长春中医药大学药学院,长春 307)
鹿茸多肽诱导心肌干细胞向心肌细胞分化的机制研究Δ
王艳玲1*,黄晓巍2,李 哲1,何 璐1,徐 岩2,曲晓波2(#1.吉林大学基础医学院,长春 130021;2.长春中医药大学药学院,长春 130117)
目的:探讨鹿茸多肽诱导心肌干细胞(CSCs)向心肌细胞分化的机制。方法:从SD大鼠体内分离CSCs,鉴定后培养传代至P3代后,分为空白对照组、5-氮胞苷诱导组(3 μmol/L)、鹿茸多肽诱导组(800 μg/ml)及其联合诱导组,除空白对照组细胞只加含3%胎牛血清的培养液外,其余各组细胞加入含相应诱导剂的培养液,培养14 d。采用免疫组化法检测细胞表面心肌肌钙蛋白T(cTnT)表达,免疫印迹技术检测细胞cTnT、活化复制因子2(ATF-2)和肌细胞增强因子2C(MEF-2C)表达,实时定量聚合酶链式反应技术检测细胞cTnT和转录因子Nkx2.5、GATA4 mRNA表达。结果:成功制得CSCs,纯度>97%。与空白对照组(cTnT呈阴性)比较,各诱导组细胞cTnT呈阳性,cTnT、ATF-2、MEF-2C蛋白表达和cTnT、Nkx2.5、GATA4 mRNA表达均增强(P<0.05)。与5-氮胞苷诱导组比较,鹿茸多肽诱导组细胞cTnT、MEF-2C蛋白表达和cTnT、GATA4 mRNA表达均增强(P<0.05),联合诱导组细胞cTnT、ATF-2、MEF-2C蛋白表达和cTnT、GATA4 mRNA表达均增强(P<0.05)。结论:鹿茸多肽可能通过增强Nkx2.5、GATA4、ATF-2、MEF-2C等转录因子的表达来诱导CSCs向心肌细胞分化。
鹿茸多肽;心肌干细胞;心肌细胞;分化
心肌细胞死亡多发于缺血性心脏病和心力衰竭患者,最终导致功能性心肌细胞受损[1-2]。因此,如何通过增加心肌细胞数量来促进心肌细胞再生,恢复心脏功能的研究具有重要的现实意义。随着细胞移植疗法研究的不断深入,心脏损伤疾病的治疗有了希望。心肌干细胞(CSCs)由于具有向心肌细胞分化的潜能和生理学特性,被认为是一个理想的种子细胞[3]。CSCs在移植后可以分化成为心肌细胞修复心肌组织损伤,因此其在心肌细胞替代治疗方面受到了广泛关注。但如何通过小分子药物激活患者的CSCs,让其充分增殖和分化,是CSCs研究的重点之一[4]。多种物质可诱导CSCs分化为心肌细胞[5],但均存在不足。因此,发现新的诱导剂,建立稳定、安全、有效、定向诱导CSCs分化为心肌细胞的方法成为研究的重点。
本研究组多年来一直从事鹿茸多肽的开发利用研究,已经证明从新鲜鹿茸中分离提取的鹿茸多肽是具有较强生物活性的多肽混合物,对神经纤维、骨组织损伤的修复有明显的促进作用[6]。本文研究的核心思路是使用体外培养技术制备大鼠CSCs,以鹿茸多肽作为诱导剂进一步研究其对心肌细胞定向分化的作用及可能机制。
1 材料
1.1 仪器
倒置显微镜(日本Olympus公司);Biofuge Primp R低温离心机(德国Heraeus公司);VDS凝胶成像系统(瑞典Pharmacia公司);DT5-3低速自动平衡离心机(北京医用离心机厂);聚合酶链式反应(PCR)扩增仪(美国Bio-Rad公司);Syngene Bio Imaging System、BD FACSCantoⅡ流式细胞仪(美国BD Biosciences公司)。
1.2 药品与试剂
鹿茸多肽(长春中医药大学药学院自制,批号:20150417,纯度:>97%);5-氮胞苷(中国上海阿拉丁试剂有限公司,批号:B1412007,纯度:>98%);胎牛血清(FBS)、RPMI-1640(美国Gibco公司,批号:10099-141、31800-022);胰蛋白酶(美国Sigma公司,批号:T0303);抗大鼠CD45抗体、干细胞生长因子c-kit抗体、活化复制因子2(ATF-2)抗体、肌细胞增强因子2C(MEF-2C)抗体(美国Biosynthesis Biotechnology公司,批号:bs-0522r、bs-04130r、bs-0518r、bs-0672r);抗大鼠心肌肌钙蛋白T(cTnT)抗体、β-肌动蛋白(β-actin)抗体(碧云天生物技术有限公司,批号:F19064、A0208);Trizol试剂(美国Life Technologies公司,批号:15596-026);逆转录试剂盒(日本Takara公司,批号:RR037A);cTnT、Nkx2.5、GATA4 mRNA PCR引物(中国上海生物工程有限公司);二喹啉甲酸(BCA)蛋白定量试剂盒(北京百泰克生物技术有限公司,批号:0020160129);辣根过氧化物酶(HRP)标记的羊抗鼠免疫球蛋白G(IgG)(H+L)(北京鼎国生物技术公司,批号:IH-0031);PVDF膜(美国Millipore公司,批号:IPVH00010);增强化学发光(ECL)试剂(美国Biosharp公司,批号:BL520A)。
1.3 动物
清洁级新生Wister大鼠10只,♂,体质量6~8 g,由吉林大学实验动物中心提供,生产许可证号:SCXK(吉)2013-0001。
2 方法
2.1 CSCs的制备
CSCs的分离、培养参考王彤等[7]报道的分离方法。将大鼠乙醇浸泡消毒后,无菌取心脏。采用0.25%胰酶和0.1%的Ⅱ型胶原酶交替消化法制成心肌组织碎块悬液,接种到50 ml培养瓶内,于37℃、5%CO2下培养过夜后,每瓶补加CEM培养液(含FBS、L-谷氨酰胺、β-巯基乙醇的DMEM培养液)3 ml后,继续培养。每隔2~3 d更换一次培养液,同时观察记录细胞的形态、生长变化情况。采用流式细胞术对CSCs特异性表面标志物c-kit和CD45进行检测分析,以鉴定CSCs纯度。
2.2 CSCs的传代培养
待心脏细胞长满培养瓶底,弃培养液,用0.05%胰酶消化细胞,用CEM培养液终止胰酶消化反应。将消化细胞液离心后用CEM培养液制成细胞悬液,接种到两个培养瓶内,置于37℃、5%CO2下继续培养,每2~3 d换一次培养液,观察细胞的生长情况和形态变化。细胞传代到P3代即可用于试验。
2.3 流式细胞仪检测c-kit和CD45阳性细胞占比
按流式细胞仪分析操作规程,将培养的原代细胞与抗c-kit和CD45抗体进行结合反应过夜;用磷酸盐缓冲液(PBS)洗3次后,分别加异硫氰酸荧光素(FITC)和藻红蛋白(PE)标记的荧光抗体,室温孵育60 min;经PBS/Azide液洗涤、1 000 r/min(离心半径15.6 cm,下同)离心6 min后,弃上清,用2%多聚甲醛固定后,用流式细胞仪检测c-kit和CD45阳性细胞数,计算其占比。
2.4 分组与给药
P3代CSCs经胰酶消化后,制成浓度为105ml-1的细胞悬液,分别接种到孔内放有载玻片的12孔细胞培养板的孔内和50 ml塑料培养瓶中。待细胞贴壁后分为4组,分别为空白对照组、5-氮胞苷诱导组(3 μmol/L)、鹿茸多肽诱导组(800 μg/ml)及其联合诱导组。除空白对照组细胞只加含3%FBS的培养液外,其余各组细胞加含相应药物和3%FBS的培养液,每组3个复孔,于37℃、5%CO2下继续培养,每隔2~3 d换一次培养液。在倒置显微镜下观察细胞形态学变化。12孔细胞培养板接种的细胞培养3 d后,免疫组化染色,其余8瓶连续诱导培养14 d后收集细胞。
2.5 免疫组化染色检测c-kit、cTnT表达
取“2.4”项下培养14 d后的细胞,PBS冲洗后,滴加4%多聚甲醛,室温固定30 min;PBS清洗后,再用冰丙酮固定15 min,完成细胞膜打孔;之后依次加0.5%聚乙二醇辛基苯基醚(Triton X-100),室温孵育20 min,使细胞脱脂;加0.3%H2O2室温避光孵育20 min,阻断内源性过氧化物酶的活性;加FBS孵育20 min,封闭非特异性抗体结合位点;加cTnT抗体孵育60 min,完成抗原抗体的特异性结合;加二抗孵育60 min,完成酶标抗体的特异性结合反应,PBS洗3次,再加4′,6-二脒基-2-苯基吲哚(DAPI)溶液浸染3 min,对细胞核进行染色,封片。荧光显微镜下观察拍照、记录c-kit或cTnT表达情况。c-kit或cTnT表达阳性的细胞免疫荧光呈绿色荧光,采用显微成像系统对阳性细胞进行定量分析。
2.6 免疫印迹技术检测cTnT、ATF-2和MEF-2C蛋白表达
取“2.4”项下培养14 d后的细胞,加适量缓冲液,用超声破碎法制备细胞匀浆,4℃下5 000 r/min离心30 min,上清用BCA蛋白定量试剂盒测定蛋白浓度后,将样品稀释为1 mg/ml用于免疫印迹分析。分别吸取制得的待测蛋白样品50 μl于1.5 ml EP管中,加等体积的上样缓冲液,沸水中煮沸5 min,3 000 r/min离心10 min后,取上清液中的蛋白用十二烷基磺酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离(分离胶浓度为10%,浓缩胶浓度为4%,在100 V的恒压下电泳100 min)。电泳结束后,将SDS-PAGE胶内蛋白转到硝酸纤维素膜上,加入10 ml封闭液,封闭过夜;加入一抗特异性反应2 h;用洗涤液摇洗5次,洗去残留的未结合的一抗后,再加入二抗应用液10 ml,结合反应1 h;用洗涤液摇洗5次后,将ECL试剂A和B按1∶1比例混合后加入到杂交袋中反应2 min,去掉膜表面液体,放于两层塑料薄膜中间,用免疫印迹仪观察、记录结果。用凝胶成像系统扫描结果,以β-actin为内参,以cTnT、ATF-2和MEF-2C的目的条带的吸光度值与相应的内参条带的吸光度值的比值作为衡量指标进行结果分析。
2.7 RT-PCR分析cTnT、Nkx2.5、GATA4 mRNA表达
首先按照Trizol试剂使用操作程序提取细胞内总RNA;然后通过逆转录将mRNA转录为cDNA(反应条件为37℃孵育60 min,90℃孵育5 min后,冰浴上迅速冷却);再通过PCR反应,扩增得到目的基因。实验中所用引物的核苷酸序列为:cTnT基因的上游引物为5′-ACCGGGCGTTGGAAATAG-3′,下游引物为5′-CATAGTGCGGGCATAGGG-3′,产物大小为180 bp;转录因子Nkx2.5基因的上游引物为5′-GCTACAAGTGCAAGCGACAG-3′下游引物为5′-GGGTAGGCGTTGTAGCCATA-3′,产物大小为184 bp;GATA4基因的上游引物为5′-CGAGGGTGAGCCTGTATGT-3′,下游引物为5′-TGCTGTGCCCATAGTGAGAT-3′,产物大小为281 bp;甘油醛-3-磷酸脱氢酶(GAPDH)为内参,上游引物为5′-TGGTGAAGGTCGGTGTGAAC-3′,下游引物为5′-GCTCCTGGAAGATGGTGATGG-3′,产物大小为231 bp。PCR反应过程简述如下:首先将各引物用无DEPC水稀释为10 pmol/L,以10×Taq酶buffer 5 μl、dNTPs(10 mmol/L)溶液2 μl、目的基因上下游引物各10 μl、内参上下游引物各5 μl、cDNA溶液5 μl、Taq酶3 μl的顺序,依次加入到0.2 ml PCR反应管中,加入DEPC水到50 μl,点动离心后,94℃预变性5 min,再扩增30个循环(循环条件:94℃变性1 min,56℃退火1 min,72℃延伸2 min,最后72℃延长10 min)。含有EB的2.5%琼脂糖胶凝电泳对PCR产物分析,通过凝胶成像系统进行拍照、扫描分析。以目的基因与内参的灰度值之比表示目的基因在条件培养细胞中的mRNA表达量。
2.8 统计学方法
应用SPSS 17.0软件进行统计学分析处理。试验数据采用±s表示,采用单因素方差分析,两两比较行t检验。检验水准α=0.05,P<0.05表示差异有统计学意义。
3 结果
3.1 细胞形态
心肌组织碎块种植入培养瓶2 d后倒置显微镜下可见心肌组织碎块的边缘有细胞长出,且向外发散性生长。荧光染色结果显示,P0和P1代细胞内c-kit阳性细胞较少,细胞的大小和形状与CSCs明显不同;传代至P3代后,杂细胞越来越少,最后得到纯度较高的CSCs。不同培养时间和培养代次的CSCs形态学变化见图1。
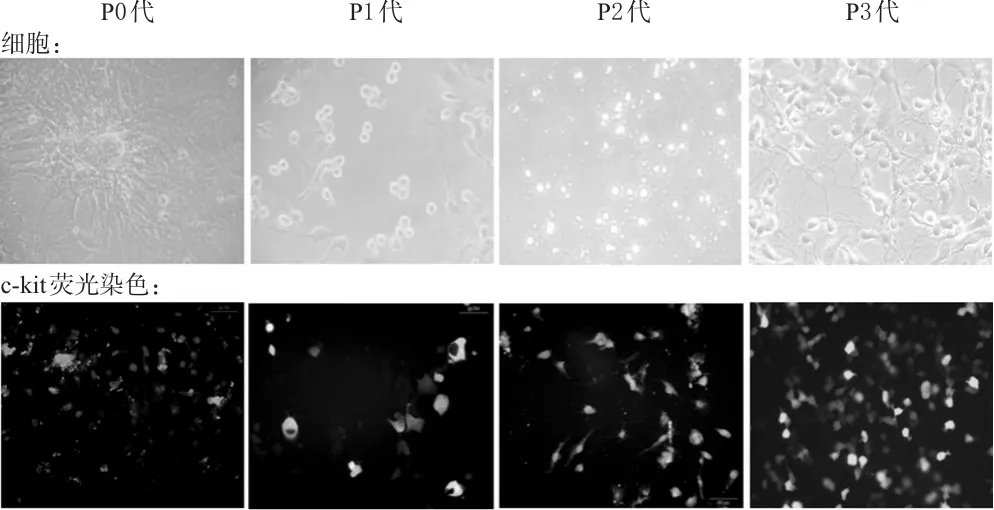
图1 不同培养时间和培养代次的CSCs形态学变化(×100)Fig 1 Morphology of CSCs with different generations after culturing for different periods(×100)
3.2 CSCs纯度
P0代细胞c-kit阳性细胞占比较少、CD45阳性细胞占比相对较多,随着细胞传代次数增加,c-kit阳性细胞占比明显增高;到P3代时,大多数细胞均为c-kit阳性,而CD45阳性细胞占比和杂细胞占比共占约2.7%,说明细胞经过4次传代后得到纯化的CSCs。CSCs纯度分析结果见表1。
表1 CSCs纯度分析结果(±s,n=3,%%)Tab 1 Purity of CSCs cell(s±s,n=3,%%)
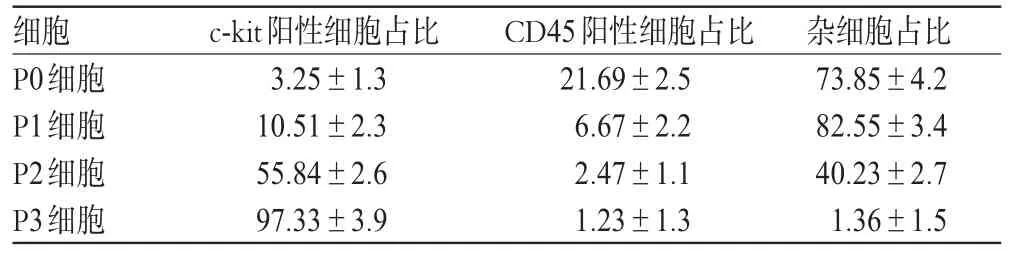
表1 CSCs纯度分析结果(±s,n=3,%%)Tab 1 Purity of CSCs cell(s±s,n=3,%%)
细胞P0细胞P1细胞P2细胞P3细胞c-kit阳性细胞占比3.25±1.3 10.51±2.3 55.84±2.6 97.33±3.9 CD45阳性细胞占比21.69±2.5 6.67±2.2 2.47±1.1 1.23±1.3杂细胞占比73.85±4.2 82.55±3.4 40.23±2.7 1.36±1.5
3.3 cTnT表达
与空白对照组比较,各诱导组细胞均有明显的cTnT阳性表达(P<0.01),其中5-氮胞苷诱导组和鹿茸多肽诱导组效果相当,联合诱导组效果最明显。各组细胞cTnT表达的免疫荧光图见图2。
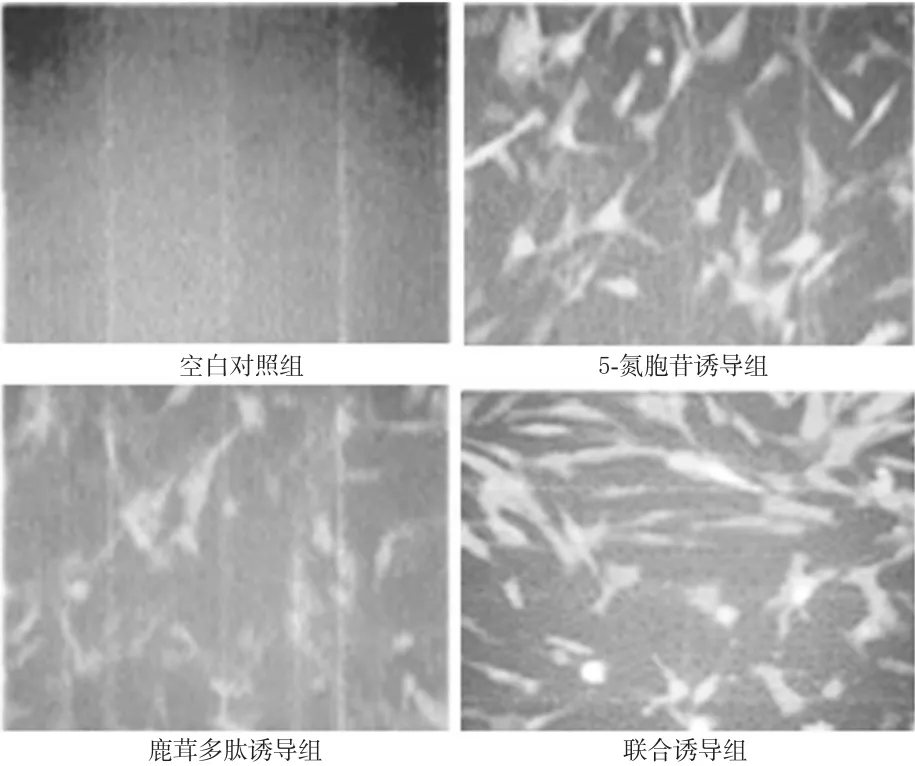
图2 各组细胞cTnT表达的免疫荧光图(×200)Fig 2 Immunofluorescence diagram of the expression of cTnT in CSCs(×200)
3.4 cTnT、ATF-2、MEF-2C蛋白表达
与空白对照组比较,各诱导组细胞cTnT、ATF-2和MEF-2C蛋白表达增强(P<0.05)。与5-氮胞苷诱导组比较,鹿茸多肽诱导组细胞cTnT、MEF-2C蛋白表达增强,联合诱导组细胞cTnT、ATF-2、MEF-2C蛋白表达均增强(P<0.05)。各组CSCs细胞cTnT、ATF-2、MEF-2C蛋白表达的电泳图见图3,检测结果见表2。
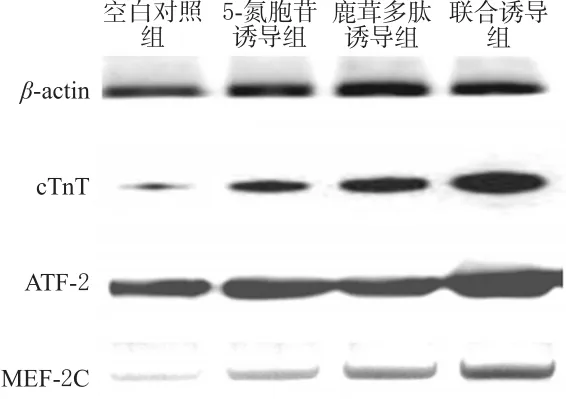
图3 各组CSCs细胞cTnT、ATF-2、MEF-2C蛋白表达的电泳图Fig 3 Electrophoretogram of the protein expression of cTnT,ATF-2 and MEF-2C in CSCs
表2 各组CSCs细胞cTnT、ATF-2、MEF-2C蛋白表达的检测结果(±s,n=3)Tab 2 The protein expression of cTnT,ATF-2 and MEF-2C in CSC(s±s,n=3)
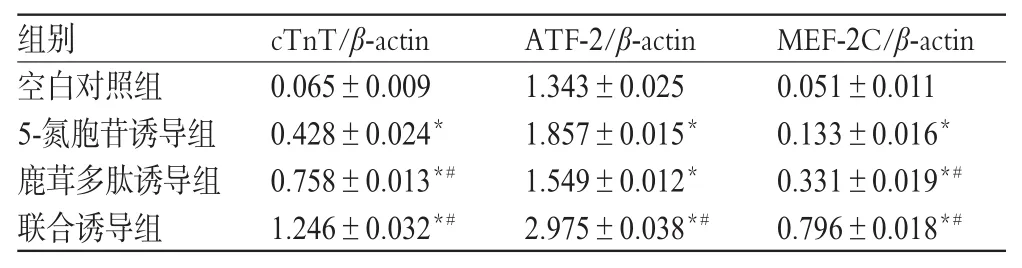
表2 各组CSCs细胞cTnT、ATF-2、MEF-2C蛋白表达的检测结果(±s,n=3)Tab 2 The protein expression of cTnT,ATF-2 and MEF-2C in CSC(s±s,n=3)
注:与空白对照组比较,*P<0.05;与5-氮胞苷诱导组比较,#P<0.05Note:vs.blank control group,*P<0.05;vs.5-azacitidine induction group,#P<0.05
组别cTnT/β-actin ATF-2/β-actin MEF-2C/β-actin空白对照组5-氮胞苷诱导组鹿茸多肽诱导组联合诱导组0.065±0.009 0.428±0.024*0.758±0.013*#1.246±0.032*#1.343±0.025 1.857±0.015*1.549±0.012*2.975±0.038*#0.051±0.011 0.133±0.016*0.331±0.019*#0.796±0.018*#
3.5 cTnT、Nkx2.5、GATA4 mRNA表达
与空白对照组比较,各诱导组细胞cTnT、Nkx2.5、GATA4 mRNA表达增强(P<0.05)。与5-氮胞苷诱导组比较,鹿茸多肽诱导组和联合诱导组细胞cTnT、GATA4 mRNA表达增强(P<0.05)。各组CSCs细胞cTnT、Nkx2.5、GATA4 mRNA表达的电泳图见图4,检测结果见表3。
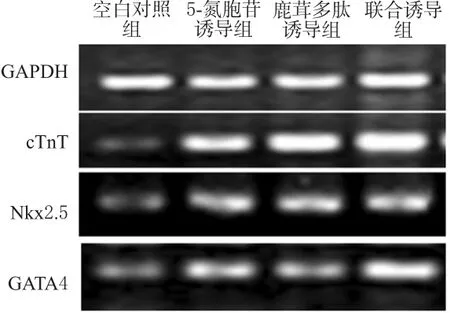
图4 各组CSCs细胞cTnT、Nkx2.5、GATA4 mRNA表达的电泳图Tab 4 Electrophoretogram of mRNA expression of cTnT,Nkx2.5 and GATA4 in CSCs
表3 各组CSCs细胞cTnT、Nkx2.5、GATA4 mRNA表达的检测结果(±s,n=3)Tab 3 mRNA expression of cTnT,Nkx2.5 and GATA4 in CSCs(±s,n=3)
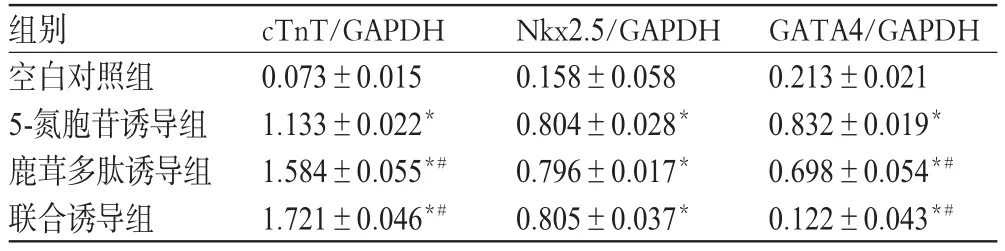
表3 各组CSCs细胞cTnT、Nkx2.5、GATA4 mRNA表达的检测结果(±s,n=3)Tab 3 mRNA expression of cTnT,Nkx2.5 and GATA4 in CSCs(±s,n=3)
注:与空白对照组比较,*P<0.05;与5-氮胞苷诱导组比较,#P<0.05Note:vs.blank control group,*P<0.05;vs.5-azacitidine induction group,#P<0.05
组别空白对照组5-氮胞苷诱导组鹿茸多肽诱导组联合诱导组cTnT/GAPDH 0.073±0.015 1.133±0.022*1.584±0.055*#1.721±0.046*#Nkx2.5/GAPDH 0.158±0.058 0.804±0.028*0.796±0.017*0.805±0.037*GATA4/GAPDH 0.213±0.021 0.832±0.019*0.698±0.054*#0.122±0.043*#
4 讨论
大量的实验模型及人类心脏疾病证实凋亡造成的心肌细胞的减少在人类多种类型的心脏疾病中占据极其关键的地位,并最终导致心脏功能的衰竭[8];同时,由于心肌生理结构的原因,心肌细胞的再生能力十分有限[3],故一旦出现受损,心功能水平和心肌细胞数量会长期处于较低水平。所以,目前临床已经将通过何种方法可以显著促进心肌细胞的增殖,进而达到恢复心脏功能的方法作为研究的热点、难点问题。随着细胞移植疗法研究的不断深入和临床实践应用成果的取得,使心脏疾病的细胞移植治疗成为可能。干细胞是来源于骨髓组织,并具有多向分化潜能的细胞,在体内或体外均可向多谱系的细胞分化[9-11]。CSCs在移植后可以分化成为心肌细胞而实现心肌组织损伤的修复,因此其在心肌细胞移植治疗方面的应用研究备受关注,是心肌细胞移植和心肌组织工程最具应用前景的干细胞之一。
CSCs向心肌细胞分化必须有Nkx2.5、GATA4和MEF-2C等早期心肌形成转录因子的表达的启动[12]。cTnT分子的启动子区有GATA4和Nkx2.5结合位点,且GATA4的表达要先于cTnT表达,这一结果提示通过心肌特异性基因的转录调节,干细胞获得心肌细胞的表型[13]。5-氮胞苷是经典的干细胞诱导剂,多见于骨髓间充质干细胞、胚胎干细胞等向心肌细胞分化[14]。本试验应用5-氮胞苷和鹿茸多肽诱导CSCs 14 d,结果显示5-氮胞苷和鹿茸多肽诱导均使cTnT、ATF-2、MEF-2C、Nkx2.5和GATA4表达明显增加(P<0.05);而鹿茸多肽诱导组和5-氮胞苷诱导组cTnT、Nkx2.5、GATA4 mRNA的表达量几乎一样(P>0.05)。这说明鹿茸多肽和5-氮胞苷具有同样的体外诱导cTnT、Nkx2.5、GATA4基因表达的作用。而5-氮胞苷是化学诱导剂,具有一定的毒性,长期使用,可能诱导细胞变异或死亡[15]。鹿茸多肽具有与5-氮胞苷相同的作用,但目前未见毒性报道。本研究表明,鹿茸多肽可通过诱导ATF-2、MEF-2C、Nkx2.5和GATA4的表达增加,促进cTnT增高,促进心肌细胞分化。
综上所述,本实验应用鹿茸多肽诱导CSCs,可使c-kit阳性表达早期心肌特异性转录因子GATA4、Nkx2.5、ATF-2、MEF-2C,从而显示出了强效的诱导心肌细胞分化的作用,但其机制有待进一步深入研究。
[1] Wang L,Hu X,Zhu W,et al.Increased leptin by hypoxicpreconditioning promotes autophagy of mesenchymal stem cells and protects them from apoptosis[J].Sci China Life Sci,2014,57(2):171.
[2] Huang K,Liu P,Li X,et al.Neural progenitor cells from human induced pluripotent stem cells generated less autogenous immune response[J].Sci China Life Sci,2014,57(2):162.
[3] 李朝政,许佳明,王烨,等.鹿茸多肽诱导心肌干细胞分化作用及对心肌细胞特征性MHC基因表达的影响[J].吉林中医药,2014,34(8):825.
[4] 廖联明,郑友生,江敏,等.黄芪甲苷促进心肌干细胞分化的作用研究[J].中华细胞与干细胞杂志:电子版,2011,1(1):52.
[5] 刘博武,吕安林,黄炜,等.四种诱导剂诱导骨髓间充质干细胞向心肌样细胞的分化[J].中国组织工程研究,2012,16(14):2 471.
[6] 李朝政,徐岩,黄晓巍.鹿茸多肽对神经细胞损伤修复的研究进展[J].中国老年学杂志,2016,36(3):763.
[7] 王彤,万智,黄辉,等.大鼠心肌干细胞的体外分离培养和生物学特性鉴定[J].岭南急诊医学杂志,2008,13(2):81.
[8] 陈少贤,刘晓颖,林秋雄,等.三七总皂苷抑制心肌细胞凋亡的作用机制研究[J].热带医学杂志,2010,10(1):11.
[9] 丁志,杨松林.间充质干细胞生物学特性及其分化潜能[J].中国组织工程研究,2011,15(1):147.
[10] 高平,孙占胜,王伯珉,等.骨髓间充质干细胞诱导成神经元样细胞移植治疗脊髓损伤[J].中国组织工程研究,2013,17(23):4 256.
[11] 于海生,王宁.促进骨髓间充质干细胞增殖方法的研究进展[J].中国药房,2014,25(37):3 533.
[12] 张晓琼,凌斌,孙洁.关于骨髓间充质干细胞向心肌样细胞分化的诱导剂研究概况[J].心血管康复医学杂志,2014,123(6):683.
[13] 李普.外源性基因Nkx2.5、GATA-4转染兔BMSCs与心肌细胞共培养后治疗心肌梗死的实验研究[D].石家庄:河北医科大学,2014.
[14] 侯红,吕安林,达晶,等.人心脏干细胞向心肌细胞分化的研究[J].生物医学工程研究,2015,34(3):182.
[15] 陈立朋,晏平,郭天柱,等.心肌干细胞移植心肌梗死区12周后的心电生理稳定性及室颤阈值改善效应[J].中国组织工程研究,2015,19(10):1 516.
Study on the Mechanism of Differentiation from Cardiac Stem Cells into Cardiac Cells Induced by Cornu Corvi Polypeptides
WANG Yanling1,HUANG Xiaowei2,LI Zhe1,HE Lu1,XU Yan2,QU Xiaobo2(1.Basic Medical College,Jilin University,Changchun 130021,China;2.School of Pharmacy,Changchun University of TCM,Changchun 130117,China)
OBJECTIVE:To explore the mechanism of differentiation from cardiac stem cells(CSCs)into cardiac cells induced by Cornu Corvi polypeptides.METHODS:CSCs were isolated from SD rats,and cultured to P3 generation after identification and then divided into blank control group,5-azacitidine induction group(3 μmol/L),Cornu Corvi polypeptides induction group(800 μg/ml)and combination induction group.Except blank control group was cultured with culture solution containing 3% FBS,other groups were cultured with culture solution containing relevant derivant for 14 d.The expression of cTnT was determined by immunohistochemical method;the expression of cTnT,ATF-2 and MEF-2C were determined by immunoblot assay;mRNA expression of cTnT,Nkx2.5 and GATA4 were detected by RT-PCR.RESULTS:CSCs were prepared successfully with purity>97%.Compared with blank control group(cTnT being negative),cTnT of induction groups were positive,and the protein expression of cTnT,ATF-2 and MEF-2C and mRNA expression of cTnT,Nkx2.5 and GATA4 were all increased(P<0.05).Compared with 5-azacitidine induction group,the protein expression of cTnT and MEF-2C and mRNA expression of cTnT and GATA4 were decreased in Cornu Corvi polypeptide groups(P<0.05);the protein expression of cTnT,ATF-2 and MEF-2C and mRNA expression of cTnT and GATA4 were all increased in combination induction group(P<0.05).CONCLUSIONS:Cornu Corvi polypeptides can induce differentiation of CSCs into cardiac cells by promoting the expression of Nkx2.5,GATA4,ATF-2,MEF-2C and other transcription factors.
Cornu Corvi polypeptides;Cardiac stem cells;Cardiac cells;Differentiation
R361+.3
A
1001-0408(2016)34-4780-04
2016-03-16
2016-06-06)
(编辑:邹丽娟)
吉林省中医药科技项目(No.2014ZD6);吉林省卫生计生科研计划项目(No.2015Z062)
*高级实验师,硕士。研究方向:细胞结构与功能。电话:0431-85619783。E-mail:wangyanl@jlu.edu.cn
#通信作者:教授,博士。研究方向:中药药理学。电话:0431-86172508。E-mail:quxiaobo0504@hotmail.com
DOI 10.6039/j.issn.1001-0408.2016.34.09

