不同分数抑菌浓度解读标准评估抗真菌药物体外联合效应比较
吴伟伟 王千 龚杰 万喆 王爱平 李若瑜
(北京大学第一医院皮肤性病科 北京大学真菌和真菌病研究中心,北京 100034)
·论著·
不同分数抑菌浓度解读标准评估抗真菌药物体外联合效应比较
吴伟伟 王千 龚杰 万喆 王爱平 李若瑜
(北京大学第一医院皮肤性病科 北京大学真菌和真菌病研究中心,北京 100034)
目的 明确酮康唑联合特比萘芬或萘替芬相互作用模式,评估不同分数抑菌浓度解读标准对判断抗真菌药物体外联合效应的影响。方法 参考CLSI微量液基稀释法M27-A3和M38-A2方案,采用棋盘微量稀释法对100株分离自临床真菌病患者的菌株进行酮康唑与特比萘芬或奈替芬体外联合药敏试验,包括皮肤癣菌,念珠菌和马拉色菌。采用不同分数抑菌浓度解读标准评估酮康唑与特比萘芬或奈替芬体外联合效应,A标准定义为:FICI≤0.5为协同作用,0.5
抗真菌药物;联合;药敏实验;分数抑菌浓度
[Chin J Mycol,2016,11(2):85-89]
近年来随着真菌感染临床病例不断增多及抗真菌药物的广泛应用,真菌对抗真菌药物的耐药现象,特别是唑类药物的耐药现象也日渐严重,而抗真菌药物的开发却相对缓慢,因此抗真菌药物联合应用则为真菌病患者提供了更多的治疗选择。临床实践表明抗真菌药物联合应用确实可对部分单一药物治疗无效的患者取得良好效果[1-4],但如何选择合适的抗真菌药物进行联用是临床医师面临的难题。棋盘法是最为常用的体外测定抗真菌药物联合效应的方法,分数抑菌浓度 (fractional inhibitory concentration index,FICI)则是最为常用解释抗真菌药物相互作用的模型,但其自身也存在缺点,如长期以来不同文献对于FICI自身解读尚存在多种标准[5-8]。酮康唑、特比萘芬和萘替芬是唑类和丙烯胺类抗真菌药物的典型代表,临床广泛应用,但酮康唑与特比萘芬或萘替芬联合用药的实验资料极为有限。因此,为明确酮康唑与特比萘芬或萘替芬的联合应用价值,并评价不同分数抑菌浓度解读标准对抗真菌药物联合效应评估的影响,我们根据CLSI M38-A2[9]和M27-A3[10]方案,采用棋盘微量稀释法对近期国内临床分离到的100株真菌病患者致病菌株 (皮肤癣菌、念珠菌及马拉色菌)进行酮康唑与特比萘芬或萘替芬体外联合药敏实验,并采用不同分数抑菌浓度判断标准进行联合效应评估。
1 材料和方法
1.1 受试菌株
100株受试真菌系北京大学真菌和真菌病研究中心保藏菌株,分离自临床真菌病患者,均经形态学和核糖体内转录间隔区 (ribosomal internal transcribed spacer (ITS) region)序列分析鉴定,其中包括皮肤癣菌属45株 (红色毛癣菌20株,趾间毛癣菌10株,絮状表皮癣菌、犬小孢子菌和石膏样小孢子菌各5株),念珠菌属40株 (白念珠菌25株,光滑念珠菌、热带念珠菌和近平滑念珠菌各5株),马拉色菌属15株 (糠秕马拉色菌12株,厚皮马拉色菌3株)。质控菌株为美国菌种保藏中心提供的近平滑念珠菌ATCC-22019和红色毛癣菌ATCC-MYA-4439。
1.2 抗真菌药
酮康唑、特比萘芬和萘替芬,均为标准试剂级粉剂。酮康唑购自Sigma-Aldrich公司 (St.Louis,USA,批号为SLBK7327V),特比萘芬和萘替芬购自中国食品药品检定研究院 (北京,中国,批号分别为100563-201402,100823-20501)。
1.3 培养基
皮肤癣菌和念珠菌培养基使用RPMI-1640液体培养基,称取34.53 g MOPS (三氮吗啡啉丙璜酸)和10.4 g RPMI-1640,加900 mL蒸馏水溶解后用pH计调整pH至7.0,定容至1 000 mL,过滤除菌并置于4℃储存备用。马拉色菌培养基使用Leeming-Nortman固体培养基和改良Leeming-Nortman液态培养基。Leeming-Nortman固体培养基包含1%蛋白胨、0.5%葡萄糖、0.1%酵母浸膏、0.4%牛胆汁盐、0.1%甘油、0.05%单硬脂酸甘油酯、2%橄榄油、0.05%吐温-60、1%全脂牛奶、1.2%琼脂、0.5%放线菌酮和0.05%氯霉素[11]。改良Leeming-Nortman液态培养基包含0.1%葡萄糖、0.1%蛋白胨、0.8%牛胆汁盐、0.2%酵母浸膏、0.1%甘油、0.5%吐温-60、3%橄榄油和50 μg/mL氯霉素[12]。
1.4 真菌药敏试验
药物储存液制备 采用100%二甲基亚砜 (DMSO)溶解稀释3种抗真菌药物至储存液浓度为1.6 mg/mL,置于无菌聚乙烯小瓶-70℃存储备用。
药敏板制备 实验前使用RPMI-1640或改良Leeming-Nortman液体培养基将3种药物储存液进行倍比稀释,获得4倍于终浓度的药液。药敏板第1列与第H行相交孔 (即左下角孔)为生长对照孔,第1列及第H行 (除生长对照孔外)为单药药敏试验区,第2~11列及A~G行交集处为联合药敏试验区,第12列为空白对照孔。采用棋盘法,将稀释后药液分别加入到96孔药敏板 (12×8)中,取酮康唑、特比萘芬或萘替芬各稀释浓度药液50 μL依次加入A~G行或1~11列各孔。使得皮肤癣菌时,酮康唑最终浓度范围为0.03~2 μg/mL,特比萘芬或萘替芬最终浓度范围为0.000 25~0.125 μg/mL;念珠菌时,酮康唑最终浓度范围为0.015~8 μg/mL,特比萘芬或萘替芬最终浓度范围为0.125~8 μg/mL;马拉色菌时,酮康唑最终浓度范围为0.004~2 μg/mL,特比萘芬或萘替芬最终浓度范围为0.5~32 μg/mL。药敏板制备密封后置于-20℃冰箱贮存备用。
菌悬液制备 ①试验前将受试皮肤癣菌菌株接种在马铃薯葡萄糖培养基 (PDA)上30℃培养4~5 d使其活化。取1 mL无菌0.85%盐水覆盖菌落,轻轻用移液器尖端摩擦菌落制成菌悬液。将菌悬液吸至无菌试管中静置10 min,取上清液振荡15 s,血细胞计数器计数孢子,再用RPMI-1640液体培养基调整为终浓度菌悬液 (1~3)×103CFU/mL。②试验前将受试念珠菌菌株在沙氏固体培养基 (SDA)上连续转种2次,以保证其纯度和活力,随后35℃培养24 h;将受试马拉色菌菌株接种在Leeming-Nortman固体培养基连续传代培养2次,第2次32℃传代培养4 d。从培养基中挑取5个大约1 mm的菌落,用5 mL无菌0.85%盐水混悬。震荡15 s,混匀菌悬液。在530 nm波长的比浊仪上,用无菌0.85%盐水调整菌悬液到0.5个麦氏比浊度。震荡混匀菌悬液,再用RPMI-1640液体培养基或改良Leeming-Nortman液体培养基调整为终浓度菌悬液 (0.5~2.5)×103CFU/mL。
菌悬液接种 试验当天向已制备好的药敏板每孔各加入100 μL稀释好的2倍于终浓度的菌悬液 (空白对照孔除外)。
培养 接种后的药敏板置于湿盒内,皮肤癣菌、念珠菌和马拉色菌分别在35℃培养5~7 d、48 h和3~5 d。每天观察生长情况,以阳性对照孔生长良好为准。
结果判读 按照CLSI M27-A3和M38-A2制定的标准进行结果判读。只有当生长对照生长良好且质控菌株最小抑菌浓度 (minimal inhibitory concentrations,MIC)值在规定范围内时,方认为试验成功,可进行结果判读。所有试验均进行2次。同一菌株MIC值在2次试验不超过2个稀释度时认为相同。MIC判读标准均定为与生长对照相比生长明显抑制 (80%)的最低药物浓度。
1.5 联合用药效果评价
采用分数抑菌浓度 (fractional inhibitory concentration index,FICI)表示,即联合用药时药物的MIC值分别除以单独用药时药物MIC值的商之和,表示为:FICI=MIC A联合/MIC A单独+MIC B联合/MIC B单独。
药物之间的相互作用解释为:A标准:FICI≤0.5为协同作用,0.5
2 结 果
酮康唑与特比萘芬或萘替芬体外药敏实验联合效应分析详见表1和表2。根据A标准或B标准对联合药敏结果进行解读可得到较为一致的结果:酮康唑与特比萘芬或萘替芬联用对各种皮肤癣菌,均未显示出明显协同效应;酮康唑与特比萘芬联用对白念珠菌表现为明显协同效应,对热带念珠菌和近平滑念珠菌表现为部分协同效应,对光滑念珠菌无协同作用;酮康唑与萘替芬联用对近平滑念珠菌显示部分协同效应,对白念珠菌、热带念珠菌和光滑念珠菌无明显协同作用。酮康唑与特比萘芬联用对两种马拉色菌均表现出明显协同效应,酮康唑与萘替芬联用对糠秕马拉色菌无明显协同作用,对厚皮马拉色菌则表现为部分协同效应。根据C标准则可解读为:酮康唑与特比萘芬或萘替芬联用对各种皮肤癣菌均显示出部分协同效应。酮康唑与特比萘芬联用对白念珠菌和近平滑念珠菌表现为明显协同效应,对光滑念珠菌和热带念珠菌表现为部分协同效应。酮康唑与萘替芬联用对近平滑念珠菌显示明显协同效应,对白念珠菌、热带念珠菌和光滑念珠菌表现为部分协同作用。酮康唑与特比萘芬或萘替芬联用均对两种马拉色菌均表现出明显协同效应。
3 讨 论
近年来研究表明,单独长期应用抗真菌药物可能导致真菌产生耐药性[13-14],而多种不同作用机理抗真菌药物联合可能通过增强药物各自抗菌活性,减少各自用量以及各自不同作用部位药效累积作用,从而增强疗效,同时减少或延迟耐药的产生[15-16]。唑类药物和丙烯胺类药物分别作用于真菌麦角固醇合成的不同靶点,故联用时可能发挥协同效应。多项实验研究已经证实特比萘芬与唑类药物联用可产生协同作用[17-20],但关于酮康唑与特比萘芬或萘替芬的联合体外药敏研究资料仍然很少。
目前联合药敏实验FICI自身解读存在多种标准,其中对于协同和拮抗效应的定义较为一致。协同效应为两种药物联合应用时产生的积极相互作用,发挥大于各自效应单纯相加所产生的抑制效应。拮抗则为两种药物联合应用时产生的消极相互作用,显著低于药物单独检测时的抑制效应。但对于“无相互作用”的定义则存在争议,诸如“相加”“无关”“独立”和“自主”等仍然被广泛使用。然而,许多已经发表用于确定抗真菌药物相互作用的标准过于宽松,导致协同或拮抗效应的临床相关性存在不确定性。除此以外,绝大多数关于抗菌剂联合效应的报告将无相互作用分为两类,即相加和无关,则使得相互作用的解释更为复杂。当联合应用的效果为所检测药物单独效应之和时可定义为相加,而无关则表示为联合效应仅仅表现为两种药物中较为有效药物的效应。目前而言,绝大多数学者认为在相加和无关之间并无实质性不同,主张当FICI值略微高于或低于1.0的理论临界值时,实际上预示着药物间并无相互作用[21]。因此,定义FICI≤0.5为协同作用,0.5
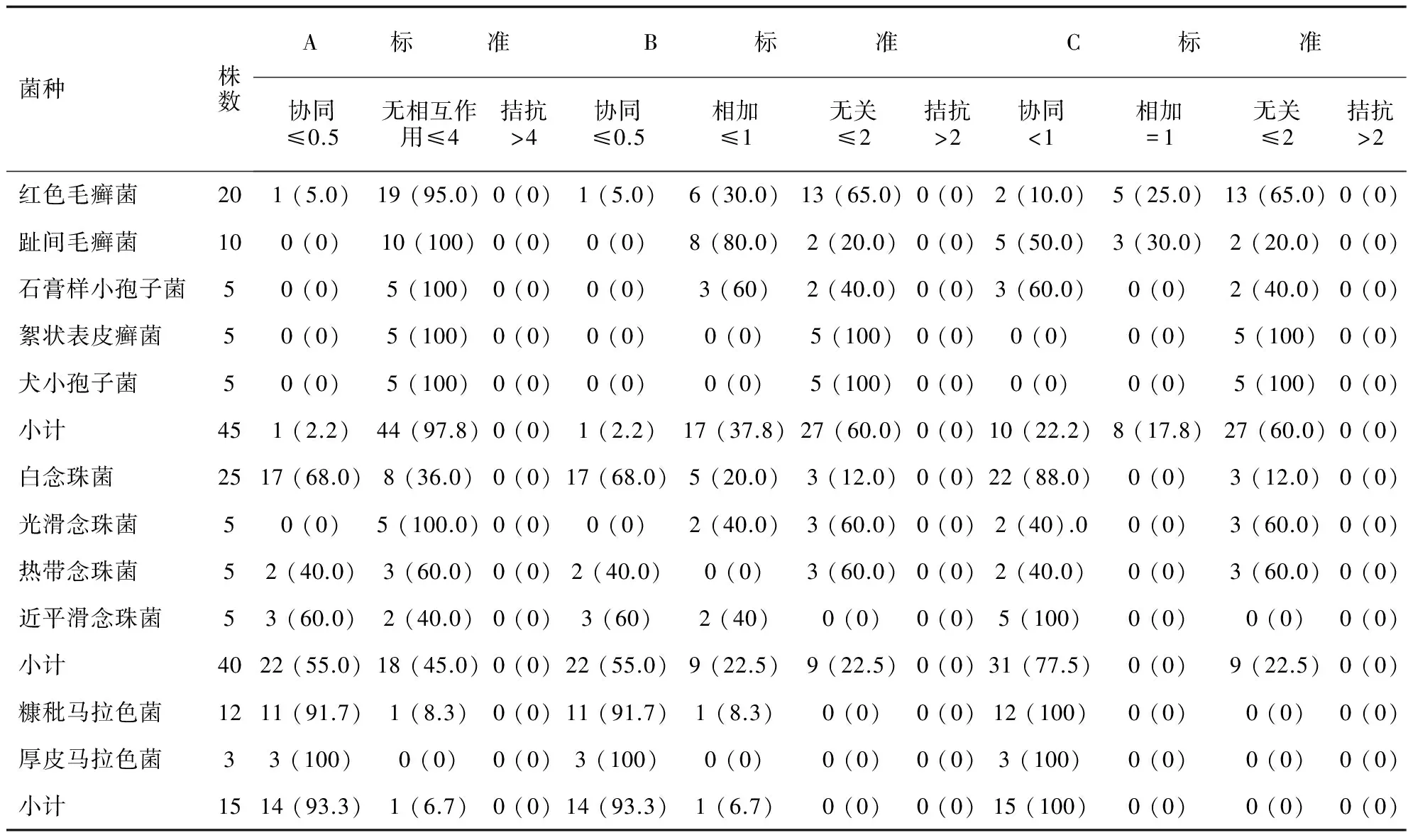
表1 酮康唑与特比萘芬体外药敏实验联合效应分析
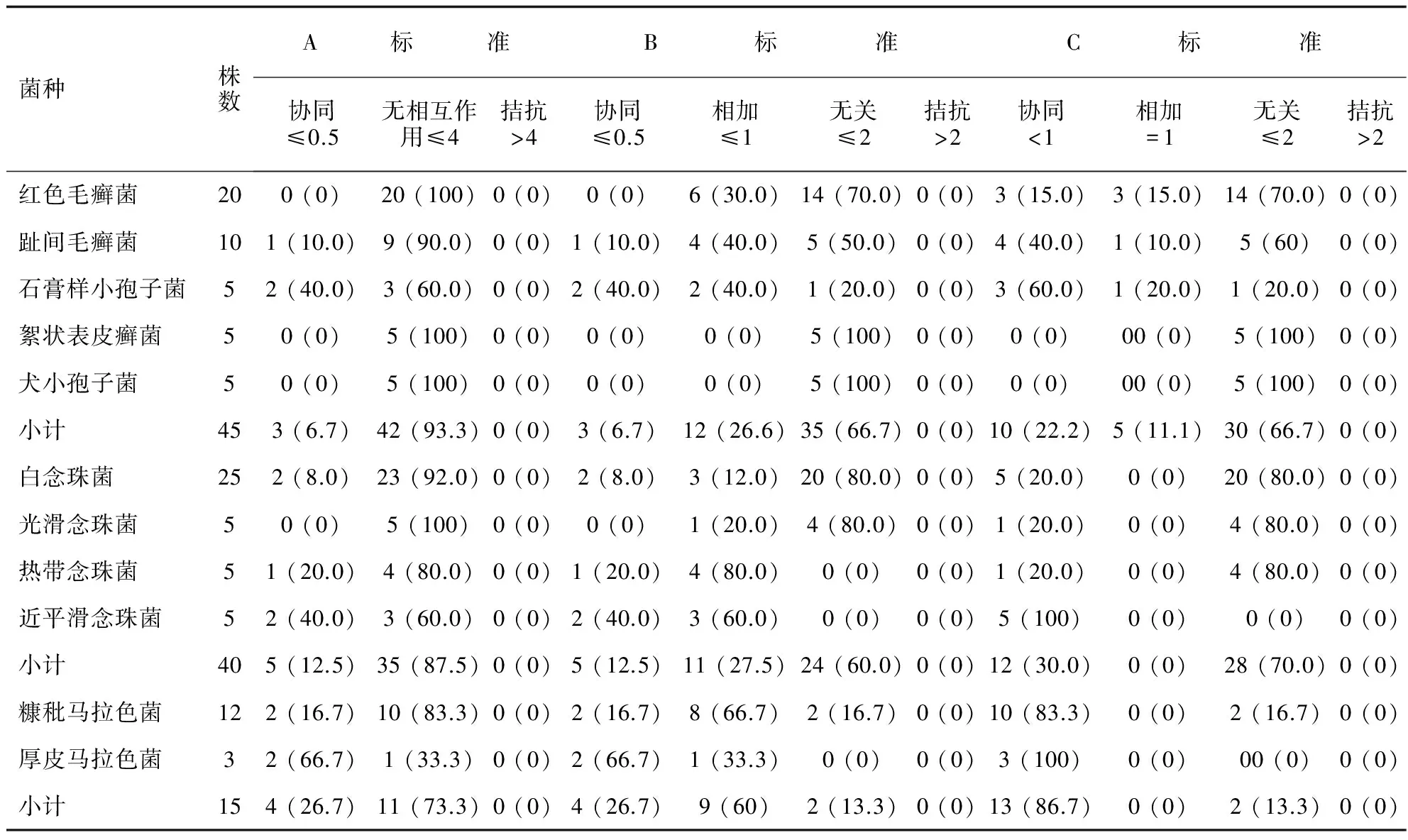
表2 酮康唑与萘替芬体外药敏实验联合效应分析
本研究结果显示,对A标准与B标准而言,酮康唑与特比萘芬或萘替芬联合,对不同菌种的抗菌协同和拮抗效应比例均无改变,A标准中无相互作用比例为B标准中相加与无关比例之和;对于C标准而言,酮康唑与特比萘芬或萘替芬联合,对不同菌种的抗菌拮抗效应无改变,而抗菌协同效应比例较A标准与B标准明显增加。根据C标准进行解读则会明显扩大抗菌协同效应。因此,采用A标准对抗真菌药物体外联合抗菌效应结果进行解读可能更为合理。
综上所述,本研究表明不同FICI解读标准对抗真菌药物体外联合抗菌效应评估可产生不同的解读结果,定义FICI≤0.5为协同作用,0.5
致谢 本研究由西安杨森制药有限公司赞助。
[1] Hosokawa K,Yamazaki H,Mochizuki K,et al.Successful treatment ofTrichosporonfungemiain a patient with refractory acute myeloid leukemia using voriconazole combined with liposomal amphotericin B[J].Transpl Infect Dis,2012,14(2):184-187.
[2] Ogawa T,Takezawa K,Tojima I,et al.Successful treatment of rhino-orbital mucormycosis by a new combination therapy with liposomal amphotericin B and micafungin[J].Auris Nasus Larynx,2012,39(2):224-228.
[3] Zhang J,Xi L,Lu C,et al.Successful treatment for chromoblastomycosis caused byFonsecaeamonophora:a report of three cases in Guangdong,China[J].Mycoses,2009,52(2):176-181.
[4] Bhat SV,Paterson DL,Rinaldi MG,et al.Scedosporiumprolificansbrain abscess in a patient with chronic granulomatous disease:successful combination therapy with voriconazole and terbinafine[J].Scand J Infect Dis,2007,39(1):87-90.
[5] Berenbaum MC.A method for testing for synergy with any number of agents[J].J Infect Dis,1978,137(2):122-130.
[6] Li Y,Wan Z,Li R.Invitroactivities of nine antifungal drugs and their combinations againstPhialophoraverrucosa[J].Antimicrob Agents Chemother,2014,58(9):5609-5612.
[7] Tamura T,Asahara M,Yamamoto M,et al.Invitrosusceptibility of dermatomycoses agents to six antifungal drugs and evaluation by fractional inhibitory concentration index of combined effects of amorolfine and itraconazole in dermatophytes[J].Microbiol Immunol,2014,58(1):1-8.
[8] Nguyen MH,Barchiesi F,McGough DA,et al.Invitroevaluation of combination of fluconazole and flucytosine againstCryptococcusneoformansvar.neoformans[J].Antimicrob Agents Chemother,1995,39(8):1691-1695.
[9] Clinical and Laboratory Standards Institute.Reference Method for Broth Dilution Antifungal Susceptibility Testing of Filamentous Fungi;Approved Standard,2nd ed.CLSI document M38-A2[S].Clinical and Laboratory Standards Institute,Wayne,PA,2008.
[10] Clinical and Laboratory Standards Institute.Reference Method for Broth Dilution Antifungal Susceptibility Testing of Yeasts;Approved Standard,3rd ed.CLSI document M27-A3[S].Clinical and Laboratory Standards Institute,Wayne,PA,2008.
[11] Leeming JP,Notman FH.Improved methods for isolation and enumeration ofMalasseziafurfurfrom human skin[J].J Clin Microbiol,1987,25(10):2017-2019.
[12] Miranda KC,de Araujo CR,Costa CR,et al.Antifungal activities of azole agents against theMalasseziaspecies[J].Int J Antimicrob Agents,2007,29(3):281-284.
[13] Evans EG.Resistance ofCandidaspecies to antifungal agents used in the treatment of onychomycosis:a review of current problems[J].Br J Dermatol,1999,141(Suppl 56):33-35.
[14] Czaika V,Tietz HJ,Schmalreck A,et al.Antifungal susceptibility testing in chronically recurrent vaginal candidosis as basis for effective therapy[J].Mycoses,2000,43( Suppl 2):45-50.
[15] Gupta AK,Kohli Y.Invitrosusceptibility testing of ciclopirox,terbinafine,ketoconazole and itraconazole against dermatophytes and nondermatophytes,andinvitroevaluation of combination antifungal activity[J].Br J Dermatol,2003,149(2):296-305.
[16] Cuenca-Estrella M.Combinations of antifungal agents in therapy--what value are they?[J].J Antimicrob Chemother,2004,54(5):854-869.
[17] Yu J,Li R,Zhang M,et al.Invitrointeraction of terbinafine with itraconazole and amphotericin B against fungi causing chromoblastomycosis in China[J].Med Mycol,2008,46(7):745-747.
[18] Zhang X,Huang H,Feng P,et al.Invitroactivity of itraconazole in combination with terbinafine against clinical strains of itraconazole-insensitiveSporothrixschenckii[J].Eur J Dermatol,2011,21(4):573-576.
[19] Scheid LA,Mario DA,Kubica TF,et al.Invitroactivities of antifungal agents alone and in combination against fluconazole-susceptible and -resistant strains ofCandidadubliniensis[J].Braz J Infect Dis,2012,16(1):78-81.
[20] Ahmed SA,Kloezen W,Fahal AH,et al.Invitrointeraction of currently used azoles with terbinafine againstMadurellamycetomatis[J].Antimicrob Agents Chemother,2015,59(2):1373-1374.
[21] Odds FC.Synergy,antagonism,and what the chequerboard puts between them[J].J Antimicrob Chemother,2003,52(1):1.
Comparision of different interpretation criterions of fractional inhibitory concentration for evaluating theinvitrocombined effect of antifungal agents
WU Wei-wei,WANG Qian,GONG Jie,WAN Zhe,WANG Ai-ping,LI Ruo-yu
(DepartmentofDermatologyandVenereology,PekingUniversityFirstHospital,ResearchCenterforMedicalMycology,PekingUniversity,Beijing100034,China)
Objective To determine the interaction pattern of ketoconazole combined with terbinafine or naftifine,and to evaluate the effects of different interpretation criterions of fractional inhibitory concentration index (FICI) for theinvitrocombined effect of antifungal drugs.Methods According to CLSI M38-A2 and M27-A3,a checkerboard broth microdilution method was performed to investigate theinvitroactivities of ketoconazole in combination with terbinafine or naftifine against 100 clinical strains isolated from patients with mycosis,including dermatophyte,CandidaandMalassezia.Different criterion for the interpretation of fractional inhibitory concentration were employed to evaluate theinvitrocombined effect of ketoconazole in combination with terbinafine or naftifine.Standard A:synergy is defined by FICI≤0.5,antagonism by FICI>4,and no interaction by FICI>0.5,but≤4;Standard B:synergy is defined by FICI≤0.5,additive by FICI>0.5,but≤1,no interaction by FICI>1,but≤2,and antagonism by FICI>2;Standard C:synergy is defined by FICI≤1,additive by FICI=1,no interaction by FICI>1,but≤2,and antagonism by FICI>2.Results Standard A had good consistency with Standard B,Standard C is relatively lenient.According to Standard C,the interpretation might significantly expand the range of synergy.Conclusions The interpretation criterion of fractional inhibitory concentration (Synergy is defined by FICI≤0.5,antagonism by FICI>4,and no interaction by FICI>0.5,but≤4) has the advantage of simplicity,convenience and good consistence,and it is worthy of clinical application.
antifungal agents;combination;susceptibility testing;fractional inhibitory concentration
吴伟伟,男 (汉族),博士研究生在读.E-mail:vigorwu@126.com
李若瑜,E-mail:mycolab@126.com
R 978.5
A
1673-3827(2016)11-0085-05
2015-09-08 [本文编辑] 王 飞

