瓜类果斑病菌的检测与防治进展
曾海娟, 吴淑燕, 邱 实, 李建武, 翟绪昭, 宋春美, 刘 箐
(上海理工大学 医疗器械与食品学院,上海 200093)
瓜类果斑病菌的检测与防治进展
曾海娟, 吴淑燕, 邱 实, 李建武, 翟绪昭, 宋春美*, 刘 箐*
(上海理工大学 医疗器械与食品学院,上海 200093)
瓜类果斑病菌可引起西瓜、甜瓜等葫芦科植物患病,可通过种子远距离传播,是一种常见的瓜类采后果实腐烂的病原菌。该病害具有发病迅速、传播速度快等特点,一旦感染会对瓜类产量带来巨大损失,因而田间病菌的检测与诊断及早期预防十分重要。本文系统地综述了国内外瓜类果斑病菌的免疫学检测方法、分子生物学检测方法及防治等研究进展。
瓜类果斑病菌;检测;防治;进展
瓜类果斑病是一种严重的细菌性病害,20世纪80年代后期该病害在美国数个州的西瓜上出现破坏性爆发而受到广泛关注,自此,瓜类细菌性果斑病在世界范围内传播开来。其病原为革兰阴性菌的嗜酸菌属燕麦种西瓜亚种(Acidovoraxavenaesubsp.citrulli, Aac),是一种具有高度破坏性的种传病菌[1]。到目前为止,并无可以完全抵抗该病菌的商业化培育品种[2]。瓜类果斑病菌又称西瓜斑菌,它可以引起西瓜、甜瓜、南瓜等葫芦科植物患病,据报道,在番茄、茄子等茄科植物的种子中也检测到了该病原菌[3],它可侵染果实、植株及种子,主要依靠带菌种子传播,使幼苗患病,出现褐色坏死斑。带菌果实在采后贮藏运输过程中会感染健康果实,表面出现水渍状斑点,最终导致整个果实腐烂,严重影响瓜类产量。 由于果斑病菌引起的病害具有发病迅速、爆发性强、传播速度快等特点,一旦感染会给瓜类产量带来巨大损失,成为影响我国瓜类生产的主要病害之一。因而,果斑病菌的快速、高灵敏度检测方法的建立,对于指导田间预防、病害控制具有重要的现实意义。
1 检测方法
在细菌的常规检测方法、免疫学检测方法、分子生物学检测方法中,常规检测方法周期较长,操作较繁琐。目前,用于果斑病菌的检测方法研究最多的是免疫学方法及分子生物学方法,与常规法相比,具有快速、高效、简便等优点。
1.1 免疫学检测技术材料
免疫学检测技术是应用最广泛的一种方法,抗体特异性识别并结合相应的抗原是免疫学检测的基础,该方法具有特异、精确等优点,但检测灵敏度较低。目前用于检测果斑病菌的免疫学技术主要有酶联免疫吸附测定(Enzyme-Linked Immunosorbent Assay, ELISA)、免疫磁性微球法(Immunomagnetic Microspheres,IMMS)、胶体金免疫层析试纸条(Colloidal Gold Immunochromatography assay strip, GICA strip)等。
1.1.1 酶联免疫吸附测定 ELISA为免疫学中的经典实验,具有操作简便、相对特异性较强等优点。Himananto等[4]建立了双抗夹心法ELISA检测果斑病菌,采用与瓜类细菌性果斑病菌近缘的丛毛单胞菌科(Comamonadaceae)、其他植物病原菌、病葫芦中的细菌、西瓜种子中的腐生菌均无交叉反应的瓜类细菌性果斑病菌的特异性单克隆抗体,可成功地将带菌株与健康株分开,与间接ELISA法相比提高了检测的灵敏度。在对比试验中[5],将果斑菌的多克隆抗体与双抗夹心法ELISA相结合检测时,灵敏度仅有单克隆抗体的1/10。
1.1.2 免疫磁性微球技术 免疫磁性微球或称免疫磁珠(Immunomagnetic Beads,IMB)是包被有抗体或具有抗体结合功能的磁性微球,当它与含有靶物质的样品混合孵育时,可与靶物质特异性地结合而形成具有磁响应性的复合物,此复合物可被磁场滞留,从而与样品中其他杂质分离。Charlermroj等[6]将免疫磁性微球与荧光抗体相连,用于捕获相应的病原菌,建立了植物病菌的多通道检测方法,并对瓜类细菌性果斑病菌在内的4种植物病原菌同时进行检测,可准确、灵敏地检测出4种菌,检测时间为1 h,低于ELISA的4 h,该方法可大大缩短检测时间。
1.1.3 胶体金免疫试纸 胶体金免疫试纸应用于植物病原菌的检测国内外早有报道,如孙艳秋等[7]制备胶体金试纸检测黄瓜细菌性角斑病,操作简便,检测时间短,且样品不需要前处理。现有文献报道的用于检测西瓜斑菌的试纸条主要是Agdia公司的胶体金试纸,如冯建军等[8]使用该试纸条检测瓜类果斑病菌,灵敏度为106cfu/mL,适于田间病害的快速检测及诊断。目前国内外并无相关文献报道西瓜斑菌抗体制备及胶体金试纸的研制,预测在抗体制备及试纸研制方面可能会有较大的市场。免疫学方法利用了抗原抗体结合的特异性,ELISA应用最广泛;免疫磁性微球技术与ELISA相比缩短了检测时间;胶体金试纸条检测时间最短,约5~10 min即可出现结果,但容易出现假阳性。这3种方法检测灵敏度约为105~106cfu/mL,有待提高。免疫学方法一般需要相应的特异性抗体,而抗体的制备、纯化过程较为繁琐,周期较长,需要大量人力物力。因此,迫切需要建立高灵敏度、特异性强的检测方法,以满足微量植物病原菌快速检测的需要。
1.2 分子生物学检测技术
1.2.1 基于 PCR的检测方法 目前用于检测的PCR方法主要有常规PCR、免疫PCR(Immune PCR, Im-PCR)、实时荧光定量PCR(Real-time PCR)。以PCR为基础的检测方法需要特异性的引物,不同的DNA序列可设计不同特异性的寡核苷酸引物。董明明等[9]将Aac胶体金免疫层析(GICA)方法与PCR相结合,解决了试纸条的假阳性,提高了检测结果的准确性。王婧等[10]以Aac BOX短重复序列的PCR产物设计两对引物BX-L1/BX-R5和BX-L1/BX-S-R2,建立巢式PCR(nested-PCR)方法,该引物可将Aac与其近源种燕麦嗜酸菌卡特莱兰亚种(A.avenaesubsp.Cattleyae)、魔芋假单胞菌(A.avenaesubsp.konjaci)及其他不相关菌株区分开,检测灵敏度为4.7×10 cfu/mL,比直接PCR灵敏度高出1 000倍。
免疫PCR是利用抗原抗体反应的特异性和PCR扩增反应的极高灵敏性而建立的一种微量抗原检测技术。采用免疫捕捉PCR法及常规PCR法检测果斑病菌时[11],灵敏度分别为50~100 cfu/mL和104cfu/mL,免疫捕捉PCR法检测少量瓜种的最适浸提液为3-N-吗啡啉乙磺酸(MOPS)[12],该方法具有准确、快速、灵敏、成本低等优点。免疫磁性分离PCR(IMS-PCR),不受西瓜种子中PCR抑制因素的影响。研究表明[13],IMS-PCR对西瓜种子浸泡液的最低检出限为10 cfu/mL。Bahar等[14]以Aac的ERIC和BOX-PCR序列设计引物BX-S,采用IMS-PCR检测果斑病菌,可检测出5 000粒种子中0.02 %的带菌种子,IMS-PCR法在检测果斑病菌上具有高效、高灵敏度等优点。
实时荧光定量PCR技术于1996年由美国Applied Biosystems公司推出,由于该技术不仅实现了PCR从定性到定量的飞跃,而且与常规PCR技术相比具有特异性强、灵敏度高、重复性好、高通量、自动化程度高等优点[15]。Zhao等[16]采用选择性培养基EBB及EBBA的琼脂平板对果斑菌进行富集后,结合real-time PCR建立了real-time BIO-PCR(enrichment PCR),该方法对EBBA培养的瓜类细菌性果斑病菌的检测灵敏度为1 cfu/mL。Real-time PCR与PCR相比,不需要凝胶电泳,避免了溴化乙锭的污染,检测速度较快。
1.2.2 等温核酸扩增技术 目前,等温扩增技术在检测病原菌方面国外已有较多文献报道,Oya等[17]采用膜过滤(membrane filtration)及环介导等温扩增法(loop-mediated isothermal amplification, LAMP)检测西瓜斑菌,以基因hrpG-hrpX的序列设计引物进行特异性扩增,对种子浸泡液的检测灵敏度为103cfu/mL,整个过程仅需2 h,可用于快速、准确地检测西瓜、甜瓜种子。Zhang等[18]采用等温的DNA扩增系统建立了交叉引物扩增(Cross-priming amplification, CPA),该反应需要链置换DNA聚合酶,扩增过程不需要热变性及剪切酶,该方法检测果斑菌纯培养物的灵敏度为3.7×103cfu/mL,具有快速方便、灵敏特异,不需要精密仪器等优点,适于自然感染的西瓜种子的检测。
1.2.3 核酸探针及核酸传感器 采用探针及传感器检测西瓜斑菌的检测方法,特异性强、灵敏度高。吴晶等[19]筛选特异性分子靶标,设计了用于检测果斑菌的padlock探针,该探针只能从目标菌扩增出100 bp大小的片段,非目的菌不能扩增出片段,探针的灵敏度为10 pg。将探针与正向斑点杂交技术(Macroarray)相结合,建立了能够同时检测多份样品的分子检测技术。Tian等[20]以16S~23S转录间隔区核糖体的DNA序列建立锁式探针和斑点免疫印记法检测瓜类果斑病菌,探针灵敏度为100 fg,可准确检出0.1%人工感染的西瓜种子。运用传感器方法检测果斑病菌,主要是由生物、化学、物理等学科交叉衍生而来的。Zhao等[21]采用金纳米颗粒标记寡核苷酸,研制出检测瓜类果斑病菌的DNA传感器,该传感器对目标DNA定性检测的最低检出限为4 nmol/L,半数定量检测的最低限为0.48 nmol/L,且检测DNA序列时不需要后续处理,成为潜在的现场快速检测DNA序列的有效工具。
1.2.4 生物芯片 可视基因芯片将特定的分子结合转变成可以直接通过肉眼观察到的信号,无需复杂的检测设备,张靓等[22]用该方法检测瓜类果斑病菌在内的6种瓜类种传细菌,以细菌纯培养液为模板,利用多重PCR扩增,目标菌检测灵敏度可达103~104cfu/mL,可用于种子上多目标菌株的同步筛查,具有高灵敏度、高通量等特点。熊亮斌等[23]应用蛋白宏阵列检测西瓜细菌性果斑病菌,检测灵敏度为2.3×105cfu/mL。与传统ELISA法相比,本方法只需1/12的捕获抗体,1/8的检测时间,检测结果肉眼可判断,极大简化了操作难度,降低了成本。熊亮斌等[24]建立了改良DAS-Dot-ELISA法检测果斑病菌,以硝酸纤维素膜为载体,对Dot-ELISA法的封闭条件、包被抗体浓度、点样量等反应条件进行优化,灵敏度达1.9×105cfu/mL,该方法与微孔板ELISA吻合率平均达99.0%。
1.2.5 质谱分析方法 Kajiwara等[25]采用限制性内切酶获取果斑病菌DNA中的PCR引物,进行热变性后直接采用基质辅助激光解吸电离飞行时间质谱(Matrix-Assisted Laser Desorption/ Ionization Time of Flight Mass Spectrometry, MALDI-TOF-MS)进行分析,整个过程仅需1 h,具有检测时间短、成本低、可自动化等优点。各种基因扩增技术在病原菌检测上的研究越来越多,基于PCR的检测方法灵敏度较高,但需要精密的热循环仪器;等温扩增技术在恒温下即可完成扩增,对仪器要求降低;生物芯片作为一种高通量的检测方法,可用于多种病原菌的检测,缩短了检测时间。各种检测方法比较见表1。
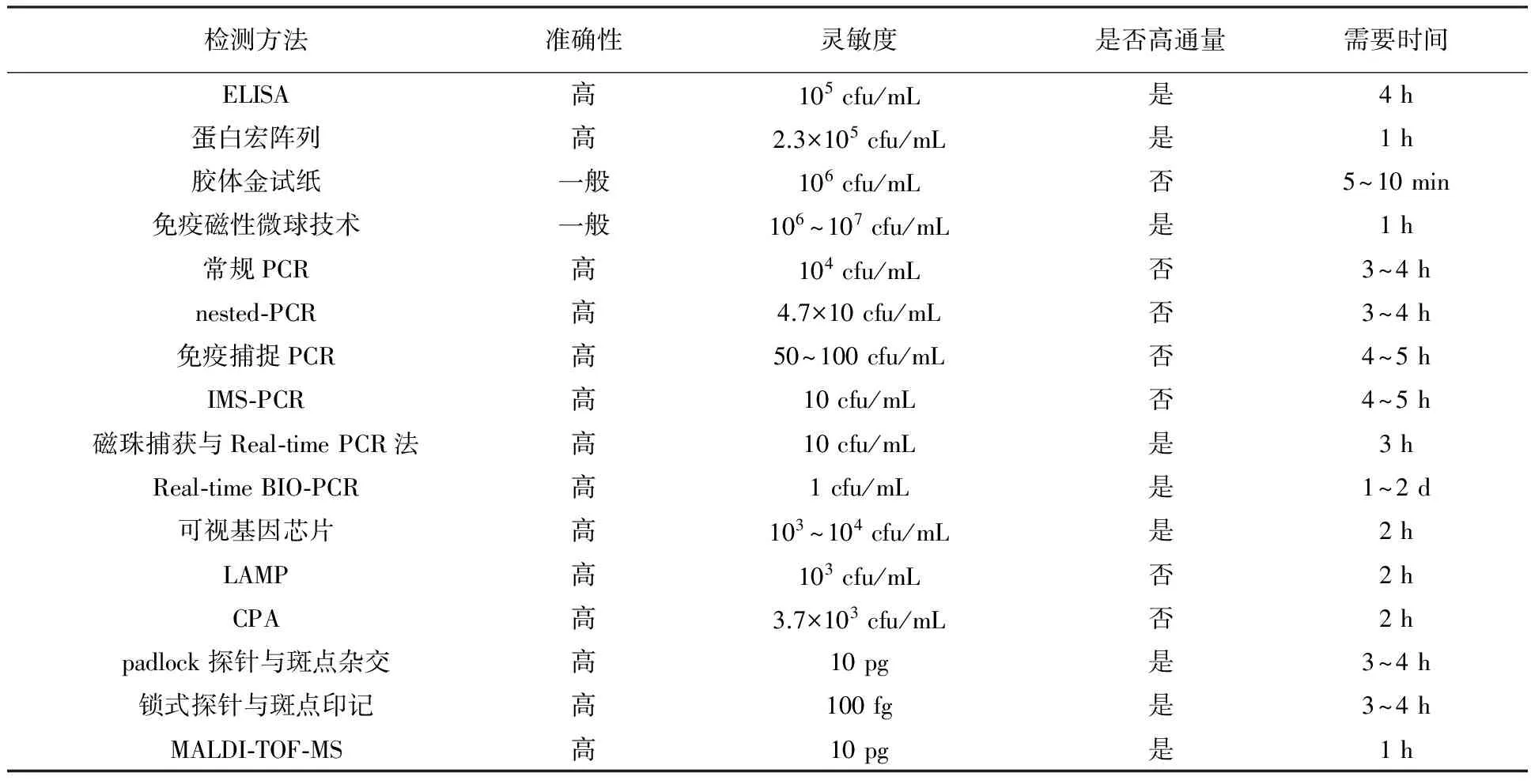
表1 各种检测方法比较
2 防 治
瓜类果斑病菌是一种具有高度破坏力的种传病菌。有报道表明[26],健康西瓜籽苗若在开花期感染果斑菌,则果实中的种子会带菌。目前可用于防治瓜类果斑病的方法主要有种子处理、化学防治、利用拮抗菌的生物防治。
2.1 种子处理
由于带菌种子可实现远距离传播,生产上必须加强对开花期植株监控,加强种子带菌率检测,并对种子适当处理,以减少种苗得病概率。
据报道,种子的快速干燥能有效控制带菌种子幼苗果斑病的发生[27],种子干热处理也可降低感染率。Kubota 等[28]对感染果斑菌的西瓜、甜瓜、冬瓜、南瓜等种子采用不同的温度及时间进行干热处理,甜瓜、黄瓜等小种子85 ℃处理3~5 d较合适,而冬瓜、葫芦等大种子对干热比较敏感。壳聚糖A在浓度为0.40 mg/mL处理种子时,可显著抑制果斑菌的生长,且壳聚糖A的抗菌活性受浓度及培养时间的影响[29]。播种前带菌种子采用40%甲醛100倍液浸种1 h,4 %盐酸处理20 min,酸性电解水浸泡30 min,对西瓜幼苗的防效较好,对西瓜种子的发芽和幼苗的生长影响较小[30-32]。
2.2 化学防治
目前报道的用于防治果斑菌的化学药剂主要有质量分数为47%加瑞农可湿性粉剂,质量分数90%的新植霉素可溶性粉剂、农用链霉素、DT杀菌剂,质量分数为20%的二氯异氰尿酸钠可湿性粉剂750倍液、可杀得(氢氧化铜)2 000干悬浮剂800倍液,质量分数为25%的叶枯唑可湿性粉剂750倍液,体积分数为12%的松脂酸铜乳油800倍液。
王中武等[33]比较了药液浸种法、苗期喷雾法、果实发病初期喷雾法的防治效果,关键用药时期为苗期,其次为果实发病初期,可用于补充防治,浸种法最不理想。最可靠的药剂为加瑞农和新植霉素,防效均超过80%。陈海燕等[34]评估了5种药剂在防治瓜类细菌性果斑病上的药效,二氯异氰尿酸钠防效最好为65.5%,可杀得、叶枯唑可湿性粉、链霉素和松脂酸铜乳油防治效果均在50%以上,在生产上可轮换使用。
2.3 生物防治
目前报道的可防治瓜类细菌性果斑病的拮抗菌主要有荧光假单胞菌 (Pseudomonasfluorescens)、稻种病原菌(Acidovoraxavenaesubsp.Avenae, AAA)、酵母菌。采用AAA处理的种子具有较强的抑菌作用,可减少96.5%果斑菌的传播,AAA及荧光假单胞菌在开花期处理植株后的感染率分别为24.1%和13.8%,而PBS处理后感染率为60%[35],可见,开花期进行防治可有效降低种子带菌率。Wang等[36]从植物的叶子及花中分离到的463株酵母菌中有24株在琼脂平板上可以拮抗果斑菌,其中异常毕赤酵母(PichiaanomalaKurtzman)可形成大于18 mm的抑菌圈,喷洒时可降低果斑菌发生率及发病的严重程度。Conceição等[37]采用叶面喷洒硅和红酵母(Rhodotorulaaurantiaca),对果斑菌的抑制效果高于苯并噻二唑,在29 d内对果斑菌有抑制效果。目前防治果斑菌最常见的方法是种子处理,但会降低种子的发芽率,其中化学防治可能会导致环境中存在药物残留,生物防治效果比较理想,但如稻种病原菌可能会对其他植物存在威胁,需继续探索生防菌的安全性。不同防治方法比较见表2。

表2 不同防治方法比较
3 小 结
瓜类果斑病菌是一种毁灭性的种传细菌,该病菌抗干旱能力非常强,能够在种子表面存活4~5个月[38],少量的幼苗感染就可能造成病害大面积爆发。检测果斑病菌的方法中,ELISA法应用最普遍,但该法灵敏度相对较低。免疫学方法大都需要特异性的单克隆抗体,而抗体制备过程十分繁琐;基于PCR的检测方法灵敏度较高,但需要精密的热循环仪器,对人员也有一定的操作要求,尚未广泛应用于实际的田间检测,因而需继续探索更加快速、灵敏、实用的检测方法。
目前普遍认为防治果斑病菌最根本的方法是选育抗病品种。郑喜清等[39]发现抗病品种种皮的蜡质含量与感病品种种皮的蜡质含量存在显著性差异,抗病品种高于感病品种。Carvalho等[40]评估了不同基因型的西瓜种子在不同的生长阶段对瓜类细菌性果斑病的抵抗能力,基因型为BGCIA 979、BGCIA 34、Sugar Baby在多数的生长阶段表现出较高的抵抗力,可用于培育抗果斑病的品种。生产上应加强种子检疫,尽量保证流入市场的种子是无菌的。播种前种子进行处理,幼苗期采用化学药剂或生物拮抗菌叶面喷洒预防,及时检测,若发现病情应及时施药。同时应加强对生防菌防治机理研究及瓜类抗病机制研究,推动更加环保、有效的防治方法的研制及高抗病品种的选育。
[1] Bahar O, Burdman S. Bacterial fruit blotch: a threat to the cucurbit industry[J]. Israel Journal of Plant Sciences, 2010, 58(1): 19-31.
[2] Bahar O, Kritzman G, Burdman S. Bacterial fruit blotch of melon: screens for disease tolerance and role of seed transmission in pathogenicity[J]. European journal of plant pathology, 2009, 123(1): 71-83.
[3] Rane K K, Latin R X. Bacterial fruit blotch of watermelon: Association of the pathogen with seed[J]. Plant disease, 1992, 76(5): 509-512.
[4] Himananto O, Thummabenjapone P, Luxananil P, et al. Detection ofAcidovoraxavenaesubsp.citrulliin plant samples using enzyme-linked immunosorbent assay[J]. Journal of ISSAAS(International Society for Southeast Asian Agricultural Sciences)(Philippines), 2009, 15(1): 160-161.
[5] Himananto O, Thummabenjapone P, Luxananil P, et al. Novel and highly specific monoclonal antibody toAcidovoraxcitrulliand development of ELISA-based detection in cucurbit leaves and seed[J]. Plant Disease, 2011, 95(9): 1172-1178.
[6] Charlermroj R, Himananto O, Seepiban C, et al. Multiplex detection of plant pathogens using a microsphere immunoassay technology[J]. PLoS one, 2013, 8(4): e62344.
[7] 孙艳秋, 赵奎华, 曹远银, 等. 免疫胶体金试纸条快速检测黄瓜细菌性白枯病菌[C]. 中国植物病理学会论文集, 2011, 41(2): 131-138.
[8] 冯建军, 许勇, 李健强. 免疫凝聚试纸条和 TaqMan 探针实时荧光 PCR 检测西瓜细菌性果斑病菌比较研究[J]. 植物病理学报, 2006, 36(2): 102-108.
[9]董明明, 张甜甜, 魏梅生, 等. 利用GICA-PCR快速检测瓜类细菌性果斑病菌[J]. 植物检疫, 2011, (1): 36-38.
[10]王婧, 毕阳, 朱艳,等. 巢式PCR快速检测西瓜细菌性果斑病菌[J]. 中国农业科学, 2014, 47(2): 284-291.
[11]Xiao W, Le Z, Fu-Shou X, et al. Immuno-capture PCR method for detectingAcidovoraxavenaesubsp.citrullifrom watermelon[J]. Chinese Journal of Agricultural Biotechnology, 2007, 4(2): 173-179.
[12]徐福寿, 王笑, 谢关林, 等. 免疫捕捉 PCR 法检测西瓜种子带细菌性果斑病菌[J]. 果树学报, 2008, 25(2): 215-218.
[13]Walcott R R, Gitaitis R D. Detection ofAcidovoraxavenaesubsp.citrulliin watermelon seed using immunomagnetic separation and the polymerase chain reaction[J]. Plant Disease, 2000, 84(4): 470-474.
[14]Bahar O, Efrat M, Hadar E, et al. New subspecies-specific polymerase chain reaction-based assay for the detection ofAcidovoraxavenaesubsp.citrulli[J]. Plant Pathology, 2008, 57(4): 754-763.
[15]钟江华, 张光萍, 柳小英. 实时荧光定量 PCR 技术的研究进展与应用[J]. 氨基酸和生物资源, 2011, 33(2): 68-72.
[16]Zhao T, Feng J J, Sechler A, et al. An Improved Assay for detection ofAcidovoraxavenaesubsp.citrulliin watermelon and melon seed[J]. Seed Science and Technology, 2009, 37(2): 337-349.
[17]Oya H, Nakagawa H, Saito N, et al. Detection ofAcidovoraxavenaesubsp.citrullifrom seed using LAMP method[J]. Japanese Journal of Phytopathology (Japan), 2008, 74(4): 304-310.
[18]Zhang J, Tian Q, Zhu S, et al. Rapid on-site detection ofAcidovoraxcitrulliby cross-priming amplification[J]. Molecular and cellular probes, 2012, 26(4): 175-176.
[19]吴晶. 利用padlock探针从瓜种子中检测西瓜噬酸菌[D].南京: 南京农业大学, 2011.
[20]Tian Y, Zhao Y, Bai S, et al. Reliable and Sensitive Detection ofAcidovoraxcitrulliin Cucurbit Seed Using a Padlock-Probe-Based Assay[J]. Plant Disease, 2013, 97(7): 961-966.
[21]Zhao W J, Lu J, Ma W, et al. Rapid on-site detection ofAcidovoraxavenaesubsp.citrulliby gold labeled DNA strip sensor[J]. Biosensors and Bioelectronics, 2011, 26(10): 4241-4244.
[22]张靓, 田茜, 刘凤权, 等. 六种重要瓜类种传细菌可视基因芯片筛查方法研究[J]. Human Genome Sequencing in Disease Prevention and Treatment, 2013, 21(1): 120-126.
[23]熊亮斌, 高丽萍, 刘箐, 等. 应用蛋白宏阵列快速检测西瓜细菌性果斑病菌[J]. 植物病理学报, 2011, 41(4): 432-436.
[24]熊亮斌,刘箐,王天昌,等.改良DAS-Dot-ELISA检测西瓜细菌性果斑病菌[J].微生物学通报,2010,37(10):1551-1556.
[25]Kajiwara H, Sato M, Suzuki A. Detection ofAcidovoraxavenaesubsp.citrulliusing PCR and MALDI-TOF MS[J]. Journal of Electrophoresis, 2012, 56(1): 13-17.
[26]Dutta B, Gitaitis R, Smith S, et al. Interactions of Seedborne Bacterial Pathogens with Host and Non-Host Plants in Relation to Seed Infestation and Seedling Transmission[J]. PloS one, 2014, 9(6): e99215.
[27]宋顺华, 吴萍, 孟淑春, 等. 种子处理对西瓜细菌性果斑病的防治效果[J]. 中国瓜菜, 2013, 26(3): 5-9.
[28]Kubota M, Hagiwara N, Shirakawa T. Disinfection of Seeds of Cucurbit Crops Infested withAcidovoraxcitrulliwith Dry Heat Treatment[J]. Journal of Phytopathology, 2012, 160(7-8): 364-368.
[29]Li B, Shi Y, Shan C, et al. Effect of chitosan solution on the inhibition ofAcidovoraxcitrullicausing bacterial fruit blotch of watermelon[J]. Journal of the Science of Food and Agriculture, 2013, 93(5): 1010-1015.
[30]Feng J, Li J, Randhawa P, et al. Evaluation of seed treatments for the eradication ofAcidovoraxavenaesubsp.citrullifrom melon and watermelon seeds[J]. Canadian Journal of Plant Pathology, 2009, 31(2): 180-185.
[31]牛庆伟, 孔秋生, 黄远, 等. 不同药剂处理对西瓜细菌性果斑病带菌种子的影响[J]. 长江蔬菜, 2013, (22): 79-82.
[32]马雅敏, 吴萍, 孙小武, 等. 瓜类细菌性果斑病菌种子检疫性消毒方法的筛选[J]. 湖南农业科学, 2013, (9): 91-94.
[33]王中武, 吴广成. 西瓜细菌性果斑病药剂防治试验[J]. 北方园艺, 2009, (1): 109-110.
[34]陈海燕, 陈绵才, 秦双, 等. 海南甜瓜细菌性果斑病田间药效试验[J]. 长江蔬菜, 2012, (2): 62-64.
[35]Fessehaie A, Walcott R R. Biological control to protect watermelon blossoms and seed from infection byAcidovoraxavenaesubsp.citrulli[J]. Phytopathology, 2005, 95(4): 413-419.
[36]Wang X, Li G, Jiang D, et al. Screening of plant epiphytic yeasts for biocontrol of bacterial fruit blotch (Acidovoraxavenaesubsp.citrulli) of hami melon[J]. Biological Control, 2009, 50(2): 164-171.
[37]Conceição C S, Felix K C S, Mariano R L R, et al. Combined effect of yeast and silicon on the control of bacterial fruit blotch in melon[J]. Scientia Horticulturae, 2014, 174: 164-170.
[38]李艳嫦, 孔静月, 吴九玲, 等. 西瓜细菌性果斑病菌在不同场所存活期的检测[J]. 华中农业大学学报, 2012, (3): 332-336.
[39]郑喜清, 胡俊, 胡宁宝, 等. 不同哈密瓜品种对细菌性果斑病的抗性与蜡质的关系[J]. 内蒙古农业大学学报(自然科学版), 2007, 28(2): 132-134.
[40]Carvalho F C Q, Santos L A, Dias R C S, et al. Selection of watermelon genotypes for resistance to bacterial fruit blotch[J]. Euphytica, 2013, 190(2): 169-180.
Advances in Detection and Prevention of Melons Fruit Spot Pathogen
ZENG Hai-juan, WU Shu-yan, QIU Shi, LI Jian-wu, ZHAI Xu-zhao, SONG Chun-mei, LIU Qing
(Schl.ofMed.Instrum’t&FoodEngin.,Uni.ofShanghaiforSci. &Technol.,Shanghai200093)
Fruit spot pathogen of melons can cause watermelon, melon and other cucurbits to ill, it can be spread a long-distance by seeds and also is a common pathogen of postharvest decay. The disease has features of rapid onset, fast propagation and others. Once infected will bring huge losses on melon yield. Therefore, early detection and diagnosis and prevention of bacteria in the field are very important. The article systematically reviewed the progress of immunological detection methods, molecular biology detection methods and prevention of bacterial fruit spot pathogen of melons at home and abroad.
melons fruit spot pathogen; detection; prevention; progress
上海市科委高校能力建设项目(13430502400);“科技创新行动计划”长三角科技联合攻关领域项目(15395810900);上海市研究生教育创新计划
曾海娟 女,博士研究生。研究方向为食品安全快速检测技术。Tel:021-65710369,E-mail:zenghaijuan12@126.com
2015-02-10;
2015-05-05
Q939.95
A
1005-7021(2016)01-0100-06
10.3969/j.issn.1005-7021.2016.01.017
* 通讯作者。刘箐 男,教授,博士生导师。研究方向为食源性致病菌致病机理及快速检测技术。
Tel:021-65710369,E-mail:liuq@usst.edu.cn
宋春美 女,博士。研究方向为食品安全快速检测技术。Tel:021-65710369,E-mail:zhiya007@163.com

