瓜类白粉病的生物防治研究进展
柯 杨, 朱海云, 李 勃, 马 瑜* , 李英梅, 张 锋
(1. 陕西省微生物研究所,陕西 西安 710043;2.中国科学院 西安分院,陕西 西安 710043;3. 陕西省动物研究所,陕西 西安 710043)
瓜类白粉病的生物防治研究进展
柯 杨1, 朱海云1, 李 勃2, 马 瑜1*, 李英梅3, 张 锋3
(1. 陕西省微生物研究所,陕西 西安 710043;2.中国科学院 西安分院,陕西 西安 710043;3. 陕西省动物研究所,陕西 西安 710043)
白粉病是危害瓜类作物最为严重的一种气传病害,引起该病的病原菌为单囊壳白粉菌Podosphaeraxanthii(synonymPodosphaerafusca)和二孢白粉菌Golovinomycescichoracearum(synonymErysiphecichoracearum),其中对Podosphaeraxanthii的报道较为常见。主要概述了瓜类白粉病病原菌的分类地位、病理特征和生物防治方面的研究进展,重点阐述了微生物源生防制剂和植物源生防制剂对瓜类白粉病的防治成果,并对当前研究与应用中存在的问题进行了探讨,为该病的深入研究和有效防治提供参考。
瓜类白粉病;病原菌;生物防治
瓜类作物(cucurbit),特指葫芦科(Cucurbitaceae)植物中常见的瓜果和蔬菜作物,包括:黄瓜、甜瓜、西瓜、西葫芦、南瓜等。瓜类作物作为人类主要的食用植物具有悠久的栽培历史,但长期大面积的种植也一直饱受各类病虫害的危害。据统计,目前已知的引起瓜类作物的病害超过200种[1-2],但从发生频率、分布范围以及影响程度来看,白粉病对于瓜类作物的危害最严重[2-3]。单囊壳白粉菌Podosphaeraxanthii(synonymPodosphaerafusca)和二孢白粉菌Golovinomycescichoracearum(synonymErysiphecichoracearum)是引起瓜类白粉病的两种主要病原真菌,其中,又以Podosphaeraxanthii的报道较为常见。这两种真菌在地理分布上有所不同,P.xanthii主要分布在热带和温带地区,G.cichoracearum主要流行于欧洲大陆,这一差异是由于P.xanthii相对于G.cichoracearum的喜温性造成的[4]。瓜类白粉病原是营活体寄生的真菌,通常生长在植物的表面,但可通过穿透表皮细胞形成附着胞和在寄主组织中产生吸器来获取营养[5]。白粉病病原菌活体寄生的这一特点,使得其在实验室内无法通过营养培养基获得纯培养,给研究人员对它的遗传学和分子生物学研究带来诸多不便。与其他种类的白粉病一样,瓜类白粉病的主要症状也表现在侵害叶片表面、叶柄和茎部,较少出现在果实上。在生产中,目前仍然依赖化学农药对其进行防治,但化学品的长期使用使得病原菌普遍产生不同程度的抗性,给防治造成了困难。同时,由此导致的化学农药的过量使用也给农业生态环境带来了许多负面影响。因此,开发高效、低毒、环境友好的新型防治技术已成为产业界和学术界共同关注的焦点[6]。本文就瓜类白粉病病原菌的分类地位、病理学特征及近年来针对其开展的生物防治研究进行了系统总结,以期为我国瓜类白粉病的防治研究提供一些参考。
1 分类地位
目前,国际上对于引起瓜类作物发生白粉病的主要病原菌还没有一个公认的标准化定名。这些病原菌已有的命名包括:Sphaerothecafuliginea、Sphaerothecafusca、Podosphaerafusca或Podosphaeraxanthii。研究人员基于扫描电镜和分子生物学实验结果,将Sphaerotheca属缩减为与Podosphaera同义,Sphaerothecafuliginea与Podosphaeraxanthii、Sphaerothecafusca同物异名的观点已经得到了广泛的接受[7-8]。基于真菌学有性世代形态分类研究,P.xanthii自身所具有的大子囊座和巨大孔子囊可将其与P.fusca区分开来[8-9],但这种形态学特征具有可塑性,很难评估物种内部这些特征的自然变化情况,因而对于很多真菌学家而言,单凭形态学的物种概念显然很难让人信服。P.xanthii也存在这样的状况,根据形态学特征来定义这一物种存在两个问题。首先,在田间条件下,闭囊壳很少被观察到[10];其次,尽管可以在实验室条件下诱导闭囊壳的产生,但无性繁殖所获得的子囊孢子不能引起瓜类的感染[10-11]。此外,尽管研究人员已经可以获得一些基于ITS序列的分子片段数据,但这些数据仍无法作为分子鉴定的确证。因为,用系统发育分析的方法来鉴定真菌不能简单依赖于基于单个基因的种系发生,而是需要多基因的联合谱系分析。因此,将P.xanthii与P.fusca二者进行区分依然存在争议,仍有很多研究人员认为P.xanthii是P.fusca.的同义词[1]。
2 病理特征
P.fusca引起的症状非常容易识别,肉眼可见叶面、叶柄和幼茎上存在由菌丝和分生孢子组成的白色粉末聚集(图1)。在适宜的环境条件下,随着病情的进展,病原真菌可布满整个叶面。白粉病病原菌吸收植物的营养,降低它的光合作用,使得叶片变得黄萎乃至枯干(图2),严重的情况下可以导致整个植株的死亡。尽管瓜类植物的果实很少被白粉病病原菌直接侵害,但果实会因为染病植株叶片早衰导致的生长受限而发育畸形、产斑,最终导致产量和品质降低。

图1 南瓜叶片白粉病染病症状[12]Fig.1 Powdery mildew disease symptoms on pumpkin leafA:叶片背面白粉病早期感染;B:叶面白粉病感染A:Early powdery mildew infection on lower leaf surface;B:Established powdery mildew infection on upper leaf surface
P.fusca具有与其他白粉病病原菌相似的无性生殖世代。其经典的发育过程是:侵染易感宿主后,分生孢子产生短的萌发管,初级分化型附着胞产生在萌发管的末端,从而在表皮细胞内形成初级吸器。在初级分化胞或者另一个分生孢子孔,初级菌丝形成次级附着胞,从而形成次级吸器。随后,初级菌丝分支形成次级菌丝。直接来源于次级菌丝分生孢子梗作为形态学上的区分结构。在每个分生孢子梗的顶端,5~10个分生孢子聚集成串。其中,次级菌丝纠缠在一起和分生孢子共同形成植株表面的白色菌丝体,是白粉病的典型症状[13]。

图2 甜瓜叶片白粉病病情进展Fig.2 Progression of powdery mildew disease on melon leaf
P.fusca是雌雄异体的真菌,只有在两种相反交配型的菌丝相遇时才进行有性生殖。有性生殖的过程中,产生一种称为chasmothecium的子实体,在P.fusca中,该子实体只包含一个含有8个子囊孢子或有性孢子的子囊果。通常情况下,chasmothecia被认为是可以抵御不良环境的菌体形式。尽管相关研究不多,但导致疾病爆发的子囊孢子被认为与无性分生孢子非常类似。在全球范围内,主要的瓜类栽培区很少能观察到chasmothecia的存在。正是由于这个原因,病原体的发病率和病原体有性世代与流行病学的相关性研究仍有待深入[10]。

图3 Podosphaera fusca的主要生活史(重修[14])Fig.3 Life cycle of Podosphaera fusca
3 生物防治
生物农药是由来源于植物、动物、微生物和矿物中的自然物质构成的制剂。美国环境保护协会(the US Environmental Protection Agency,USEPA)基于所采用的活性成分的类型,将生物农药分为三大类:生物化学农药、植物杀虫剂和微生物农药[15]。Copping等[16]将生物农药分为天然产物和微生物两大类。天然产物包含微生物来源、高等植物来源和动物来源三大类;微生物包含病毒、细菌、真菌和原生生物。在世界范围内,关于生物农药这一术语,并没有形成一个的统一的认识。因此,国际生防剂制造协会(International Biocontrol Manufacturer’s Association,IBMA)和生物防治国际组织(International Organization for Biological Control,IOBC)提议用生防制剂这一术语来替代生物农药。并将生防制剂分为四大类:①macrobials(如寄生蜂的卵,食蚜蝇蛹);②微生物;③天然产物;④化学信息素(insect behavior-modifying agents)[17]。不管如何定义,在瓜类白粉病的防治中,生物制剂主要为微生物来源和植物来源。
3.1 微生物源生防制剂
微生物对瓜类白粉病的抑制可通过重寄生作用来实现。如白粉寄生孢(Ampelomyces)作为一种真菌寄生物,可抑制白粉病有性和无性孢子繁殖,破坏白粉病菌丝体、分生孢子梗及未成熟子囊座[18-19]。此外,玫烟色拟青霉(Paecilomycesfumosoroseus)也可通过重寄生作用,来侵入破坏黄瓜病害的菌丝体,抑制白粉病病原菌的生长[20]。Gafni等[21]研究发现,内生酵母菌(Pseudozymaaphidis)通过产生可寄生于白粉病病原菌菌丝和孢子上的菌丝体,来抑制病原菌生长。
其次,微生物对白粉病的抑制也可通过拮抗作用来实现。Romero等[22]的研究发现,枯草芽胞杆菌(Bacillussubtilis)对甜瓜白粉病病原菌P.fusca的拮抗作用是通过代谢产生的脂肽类物质(主要是伊枯草菌素和丰原素)来实现的。Gafni等[21]研究还发现,P.aphidis代谢产物的粗提物可用作抗生物质抑制白粉病孢子的萌发。
同时,经外界因子诱导后,植物自身体内产生的植物诱导抗病性(induced resistance)也会对白粉病产生抗性,主要包括由生物或非生物刺激寄主植物所产生的系统获得抗性(SAR)和依赖于植物激素调节的诱导系统抗性(ISR)两种类型。通过枯草芽胞杆菌(B.subtilisMBI600)产物BU EXP 1216S诱导哈密瓜抗白粉病实验发现,BU EXP 1216S不仅可以降低白粉病病情,还可使植株的茎增粗,提高叶片叶绿素的含量和增加植株的鲜重[23]。而García-Gutiérrez等发现,枯草芽胞杆菌(B.subtilisUMAF6639)对甜瓜白粉病的抗性则是通过依赖于茉莉酮酸和水杨酸调节通路的诱导系统抗性来实现。其中,脂肽类表面活性素(surfactin lipopeptide)是激发免疫反应的主要决定因素[24]。
此外,将生防制剂与其他制剂联用,可以提高生物防治的效果。Tesfagiorgisa等通过研究生物防治剂和可溶性硅对西葫芦白粉病的影响发现,在温室条件下,所有的生防制剂对白粉病病原菌均有抑制作用,其防效最高可达90%,硅对白粉病的防效高达35%,二者联用可提升大部分生防制剂的效果;在田间条件下,生防制剂和硅联合使用同样可降低白粉病发生。其中,细菌生防制剂和硅的作用在25 ℃以上减弱,而真菌生防制剂较好的适用于较高温度(25~30 ℃)[25]。同样,将B.subtilis和白粉寄生孢(Ampelomycesquisqualis)与杀真菌剂联用防治西葫芦白粉病显示,B.subtilis和嘧菌酯联用比单独使用这两者的效果好,类似的协同效果也出现在A.quisqualis与腈菌唑的联用中[26]。其他相关的研究参见表1[27-33]。
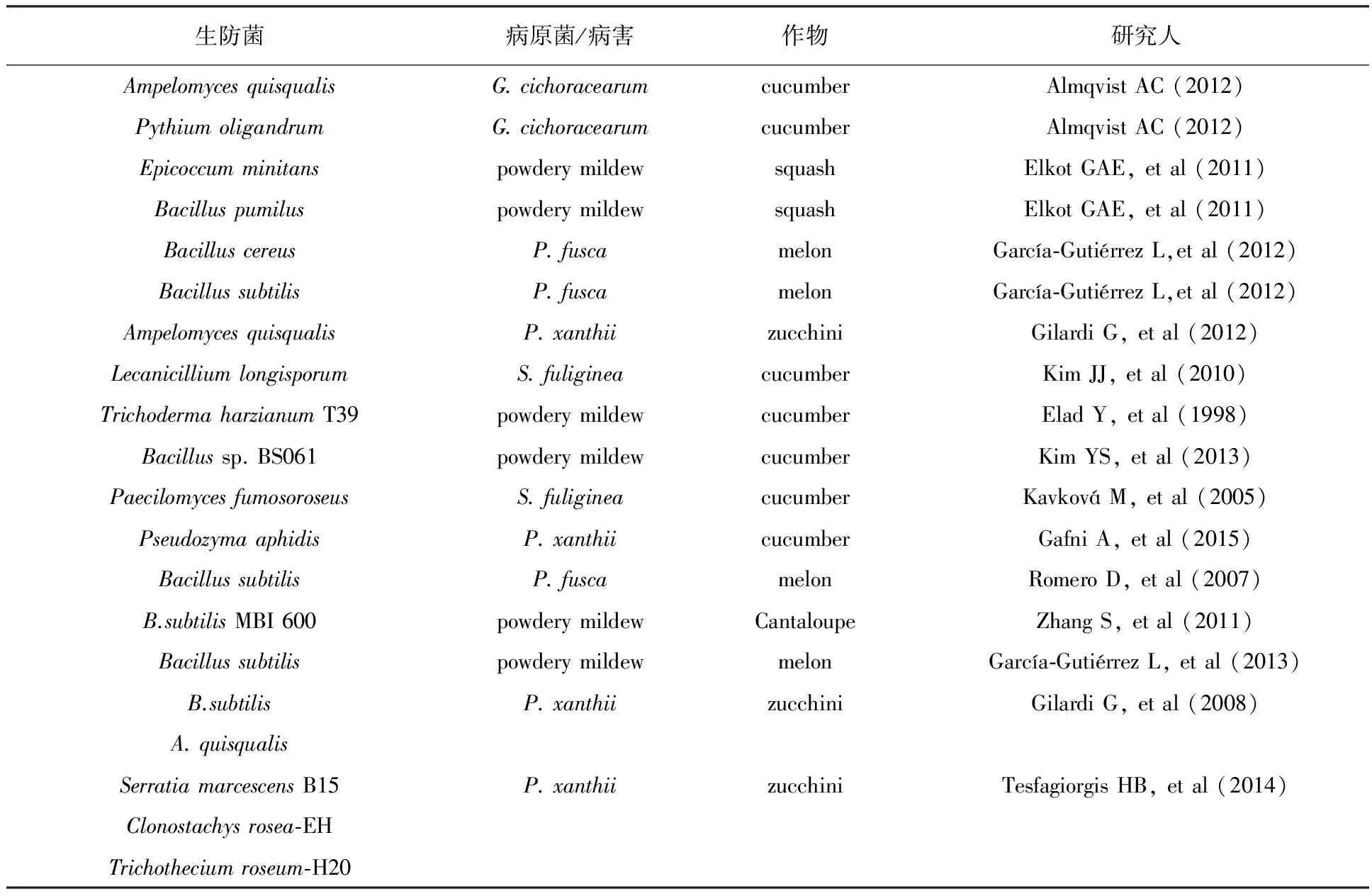
表1 瓜类白粉病微生物防治研究进展概况
3.2 植物源生防制剂
将植物含有的某些活性抗菌物质或可诱导寄主植物增强对病原菌抗性的物质的有效成分提取加工而成的植物源杀菌剂,可有效抑制病原菌生长发育或杀死病原菌。其活性成分种类较多,包括生物碱类、类黄酮类、蛋白质类、有机酸类和酚类化合物等。研究发现,蛇床子素(osthol)可诱导植物体内几丁质酶(chitinase)和过氧化物酶(peroxidase)的积累,增强几丁质酶基因转录,诱导植株对南瓜白粉病产生抗性反应,对南瓜白粉病具有预防、防治作用,且病原菌可介导蛇床子素增强叶片中PAL活性[34]。D-松醇(D-pinitol)具有激活植物先天免疫系统组件的能力,使黄瓜叶片中酚类物质、谷氨酸脱羧酶、黄酮类及叶绿素的含量增加,提高抗氧化酶活性,激活相关抗性基因以增强植株对P.xanthii的抗性,可用于防治黄瓜白粉病[35]。Roberti的研究表明,鱼腥藻BEA0300B水提取物可通过西葫芦中的SA依赖的防御应答的早期激活,使植物体内几丁质酶、过氧化物酶、β-1,3-葡聚糖酶得到积累,对P.xanthii直接产生抗性[36]。Aubel等[37]发现植物与COS-OGA接触后会触发水杨酸(SA)信号转导途径,引发防御反应,其对黄瓜白粉病病原体没有直接毒性作用,不能降低其发病率,但可减少病害危害。Jaulneau等[38]通过研究不同浓度的石莼(Ulvaarmoricana)提取物对于黄瓜白粉病的抑制作用,表明该提取物可降低发病率、减轻病情。张铉哲等[39]利用不同类型植物油制剂对温室栽培黄瓜进行白粉病的预防和治疗也取得了较好的防治效果。其他相关的研究参见表2[40-47]。

表2 瓜类白粉病植物防治研究进展概况
3.3 其他来源生防制剂
刘琴等[48]以生物诱抗剂为诱导剂研究其对白粉病的预防效果及抗性诱导过程中一些抗病相关酶活性的变化表明,施用诱抗剂可提高黄瓜叶片中防御相关酶活性,防病效果与诱抗剂浓度及施用次数正相关。Medeiros等[49]用西葫芦作供试植物研究发现,牛奶可通过在孢子附近沉积抑制其萌发,对病原菌分生孢子梗和分生孢子造成损害,与此同时促进具有控制疾病潜力的真菌和细菌群落形成,与其对病原的预防效果相较,其防病效果更佳,但与农药相较不显著。Naidu等[50]研究表明,使用堆肥茶可以使白粉病病原菌孢子萌发率降低,但是添加微生物后堆肥茶的效果更好。
4 问题与展望
白粉病是瓜类作物栽培中的最主要威胁之一,尽管培育瓜类抗病品种和开发新型杀菌剂的工作从未中断,但对其防治依然主要依赖化学杀菌剂的使用。对于种植者而言,利用经济有效的方法来持续控制病害的发生依然是当前最迫切的需求。因此,尽管化学杀菌剂的应用对于生态环境和生物的生存具有很大的负面影响,但是由于其成本低、见效快等特点,仍在全球范围内(尤其是发展中国家)被广泛应用。近年来,随着绿色防控技术的发展和消费者对于食品安全问题的日益关注,广谱、低毒、环境友好型的防治技术越来越受到市场的欢迎,用生物防治手段替代化学防治手段已经成为一种具有吸引力的选择。
目前,对于瓜类白粉病的生物防治主要限于实验室和温室试验,真正能够广泛应用于大田的生物防治手段不多。针对瓜类白粉病生物防治的研究现状,今后的研究应致力于从微观角度进一步理清瓜类白粉病病原菌的病原菌分类学、致病性及病原菌与植物互作的机制,为开发对瓜类白粉病病原菌具有针对性,且可应用于生产实际的生防制剂提供理论依据和技术支持。
[1] McGrath MT. Diseases of cucurbits and their management[M]//Diseases of Fruits and Vegetables Volume I.Springer Netherlands,2004:455-510.

[3] Martínez-Cruz J, Romero D, Dávila JC, et al. ThePodosphaeraxanthiihaustorium, the fungal Trojan horse of cucurbit-powdery mildew interactions[J]. Fungal Genet Biol, 2014, 71:21-31.
[4] Miazzi M, Laguardia C, Faretra F. Variation inPodosphaeraxanthiion cucurbits in Southern Italy [J]. Journal of Phytopathology, 2011, 159(7-8): 538-545.
[5] McGrath MT. Fungicide resistance in cucurbit powdery mildew: experiences and challenges [J]. Plant disease, 2001, 85(3): 236-245.
[6] 柯杨, 马瑜, 沈莹华, 等. 冬凌草内生细菌的分离鉴定及其对植物病害的生防作用[J]. 微生物学杂志, 2013,33(1): 20-24.
[7] Cohen R, Burger Y, Katzir N. Monitoring physiological races ofPodosphaeraxanthii(syn.Sphaerothecafuliginea), the causal agent of powdery mildew in cucurbits: Factors affecting race identification and the importance for research and commerce [J]. Phytoparasitica, 2004, 32(2): 174-183.
[8] Braun U, Shishkoff N, Takamatsu S. Phylogeny ofPodosphaerasect.Sphaerothecasubsect.Magnicellulatae(Sphaerothecafuligineaauct. s.lat.) inferred from rDNA ITS sequences-a taxonomic interpretation[J]. Schlechtendalia, 2001, 7: 45-52.
[9] Braun U, Takamatsu S. Phylogeny ofErysiphe,Microsphaera,Uncinula(Erysipheae) andCystotheca,Podosphaera,Sphaerotheca(Cystotheceae) inferred from rDNA ITS sequences-some taxonomic consequences[J]. Schlechtendalia, 2000, 4: 1-33.
[10]McGrath MT. Heterothallism inSphaerothecafuliginea[J]. Mycological Society of America, 1994, 86(4): 517-523.
[11]Bardin M, Nicot PC, Normand P, et al. Virulence variation and DNA polymorphism inSphaerothecafuliginea, causal agent of powdery mildew of cucurbits[J]. European Journal of Plant Pathology, 1997, 103(6): 545-554.
[12]Elaine R. Powdery Mildew in Cucurbits[EB/OL]. http://www.omafra.gov.on.ca/english/crops/organic/news/2012/2012-08a8.htm, 2013-01-09/2015-02-05.
[13]Pérez-García A, Olalla L, Rivera E, et al. Development ofSphaerothecafuscaon susceptible, resistant, and temperature-sensitive resistant melon cultivars[J]. Mycological Research, 2001, 105(10): 1216-1222.
[14]Davis RM, Gubler WD, Koike ST. Pest Notes: Powdery Mildew on Vegetables[EB/OL]. http://www.ipm.ucdavis.edu/PMG/PESTNOTES/pn7406.html, 2014-04-25/2015-02-10.
[15]USEPA. What are Biopesticides?[EB/OL]. http://www.epa.gov/oppbppd1/biopesticides/whatarebiopesticides.htm, 2015-02-07/2015-02-10.
[16]Copping LG, Menn JJ. Biopesticides: a review oftheir action, applications and efficacy[J]. Pest Manag Sci, 2000, 56(8): 651-676.
[17]Mishra J, Tewari S, Singh S, et al. Biopesticides: Where We Stand?[M]. Plant Microbes Symbiosis: Applied Facets. Springer India, 2015: 37-75.
[18]Kiss L, Pintye A, Zséli G. Microcyclic conidiogenesis in powdery mildews and its association with intracellular parasitism byAmpelomyces[J]. Eur J Plant Pathol, 2010, 126(4): 445-451.
[19]Kiss L. Chapter 3 Intracellular mycoparasites in action: Interactions between powdery mildew fungi andAmpelomyces[M]. British Mycological Society Symposia Series, Academic Press, 2008, 27: 37-52.
[20]KavkováM, Curn V.Paecilomycesfumosoroseus(Deuteromycotina:Hyphomycetes) as a Potential mycoparasite onSphaerothecafuliginea(Ascomycotina:Erysiphales)[J]. Mycopathologia, 2005, 159: 53-63.
[21]Gafni A, Calderon CE, Harris R, et al. Biological control of the cucurbit powdery mildew pathogenPodosphaeraxanthiiby means of the epiphytic fungusPseudozymaaphidisand parasitism as a mode of action[J]. Front Plant Sci, 2015, 6:132.
[22]Romero D, de Vicente A, Rakotoaly RH, et al. The iturin and fengycin families of lipopeptides are key factors in antagonism ofBacillussubtilistowardPodosphaerafusca[J]. Mol Plant Microbe Interact, 2007, 20(4): 430-440.
[23]Zhang S, Vallad GE, White TL, et al. Evaluation of microbial products for management of powdery mildew on summer squash and cantaloupe in Florida[J]. Plant Disease, 2011, 95(4): 461-468.
[24]García-Gutiérrez L, Zeriouh H, Romero D, et al. The antagonistic strainBacillussubtilisUMAF6639 also confers protection to melon plants against cucurbit powdery mildew by activation of jasmonate-and salicylic acid-dependent defence responses [J]. Microb Biotechnol, 2013, 6(3): 264-274.
[25]Tesfagiorgis HB, Laing MD, Annegarn HJ. Evaluation of biocontrol agents and potassium silicate for the management of powdery mildew of zucchini[J]. Biological Control, 2014, 73: 8-15.
[26]Gilardi G, Manker DC, Garibaldi A, et al. Efficacy of the biocontrol agents Bacillus subtilis andAmpelomycesquisqualisapplied in combination with fungicides against powdery mildew of zucchini[J]. Journal of Plant Diseases and Protection, 2008, 115(5): 208.
[27]Almqvist AC. Biological control of powdery mildew in greenhouse produced cucumber-an evaluation of two microbiological control agents [D].SLU, 2012
[28]Elkot GAE, Soliman A., Derbalah H. Use of cultural filtrates of certain microbial isolates for powdery mildew control in Squash[J]. Journal of Plant Protection Research, 2011, 51(3): 252-260.
[29]García-Gutiérrez L, Romero D, Zeriouh H, et al. Isolation and selection of plant growth-promoting rhizobacteria as inducers of systemic resistance in melon[J]. Plant and Soil, 2012, 358(1-2): 201-212.
[30]Gilardi G, Baudino M, Garibaldi A, et al. Efficacy of biocontrol agents and natural compounds against powdery mildew of zucchini[J]. Phytoparasitica, 2012, 40(2): 147-155.
[31]Kim JJ, Goettel MS, Gillespie DR. Evaluation ofLecanicilliumlongisporum, Vertalec®against the cotton aphid,Aphisgossypii, and cucumber powdery mildew,Sphaerothecafuligineain a greenhouse environment[J]. Crop Protection, 2010, 29(6): 540-544.
[32]Elad Y, Kirshner B, Yehuda N, et al. Management of powdery mildew and gray mold of cucumber byTrichodermaharzianumT39 andAmpelomycesquisqualisAQ10[J]. BioControl, 1998, 43(2): 241-251.
[33]Kim YS, Song JG, Lee IK, et al.Bacillussp. BS061 Suppresses Gray Mold and Powdery Mildew through the Secretion of Different Bioactive Substances[J]. Mycobiology, 2013, 41(3):164-166.
[34]Zhiqi Shi, Fei Wang, Wei Zhou, et al. Application of Osthol Induces a Resistance Response Against Powdery Mildew in Pumpkin Leaves[J]. Int. J. Mol. Sci, 2007, 8: 1001-1012.
[35]Jia Chen, Fernandez D, Dan Dan Wang, et al. Biological control mechanisms of D-pinitol against powdery mildew in cucumber[J]. Physiological and Molecular Plant Pathology, 2014, 88: 52-60.
[36]Robert R, Galletti S, Burzi PL, et al. Induction of defence responses in zucchini (Cucurbitapepo) byAnabaenasp. water extract[J]. Biological Control, 2014, Accepted Manuscript.
[37]Aubel GV, Buonatesta R, Cutsem PV. COS-OGA: A novel oligosaccharidic elicitor that protects grapes and cucumbers against powdery mildew[J]. Crop Protection, 2014, 65: 129-137.
[38]Jaulneau V, Lafitte C, Corio-M, et al. An Ulva armoricana extract protects plants against three powdery mildew pathogens [J]. European Journal of Plant Pathology, 2011, 131(3):393-401.
[39]张铉哲, 姚亮亮, 徐生军, 等. 三种植物油生物农药对黄瓜白粉病的防治效果[J].东北农业大学学报, 2010, 41(6): 23-27.
[40]Choi GJ, Lee SW, Jang KS, et al. Effects of chrysophanol, parietin, and nepodin ofRumexcrispusonbarley and cucumber powdery mildews[J].Crop Protection, 2004, 23(12): 1215-1221.
[41]Jia Chen, Guang-Hui Dai. Effect of d-pinitol isolated and identified fromRobiniapseudoacaciaagainst cucumber powdery mildew[J]. Scientia Horticulturae, 2014, 176: 38-44.
[42]Candido V, Campanelli G, Viggiani G, et al. Melon yield response to the control of powdery mildew by environmentally friendly substances[J]. Scientia Horticulturae, 2014, 166:70-77.
[43]Daayf F, Schmitt A, Belanger RR. The effects of plant extracts ofReynoutriasachalinensison powdery mildew development and leaf physiology of long English cucumber[J]. Plant disease, 1995, 79(6): 577-580.
[44]Bardin M, Schmitt A, Nicot P. Diversity in the effect of an extract fromFallopiasachalinensison isolates of cucurbit powdery mildews grown on melon[J]. Inducedresistance in plants against insect and disease, 2013, 88: 93-97.
[45]Nawal H. Mohamed, Abeer M. El-Hadidy. Studies of Biologically Active Constituents ofVerbascumeremobiumMurb. and its Inducing Resistance against some Diseases of Cucumber [J]. Egypt. J. Phytopathol., 2008, 36(1-2): 133-150.
[46]Morsy SM, Drgham EA, Mohamed G. M. .Effect of Garlic and Onion Extracts or their Intercropping on Suppressing Damping-off and Powdery Mildew Diseases and Growth Characteristics of Cucumber[J]. Egypt. J. Phytopathol., 2009, 37(1): 35-46.
[47]Kim JC, Choi GJ, Lee SW, et al. Screening extracts ofAchyranthesjaponicaandRumexcrispusfor activity against various plant pathogenic fungi and control of powdery mildew[J]. Pest Manag Sci, 2004, 60(8): 803-808.
[48]刘琴, 吴毅歆, 薛原, 等. 一种生物诱抗剂防治黄瓜白粉病效果及对诱导酶的影响[J]. 中国农学通报, 2013, 29(36): 367-371.
[49]Medeiros FHV, Bettiol W, Souza RM, et al. Microorganisms, application timing and fractions as players of the milk-mediated powdery mildew management[J]. Crop Protection, 2012, 40: 8-15.
[50]Naidu Y, Meon S, Siddiqui Y. In vitro and in vivo evaluation of microbial-enriched compost tea on the development of powdery mildew on melon[J]. BioControl, 2012, 57(6): 827-836.
Advances in Bio-Control of Cucurbits Powdery Mildew
KE Yang1, ZHU Hai-yun1, LI Bo2, MA Yu1, LI Ying-mei3, ZHANG Feng3
(1.ShaanxiProv.Inst.ofMicrobiol.,Xi’an710043; 2.Xi’anBranchAcad.ofCAS,Xi’an710043;3.ShaanxiProv.Inst.ofZool.Xi’an710043)
Powdery mildew is the most serious air-borne disease that spoils cucurbitaceous crops. The causes of the disease werePodosphaeraxanthii(synonymPodosphaerafusca) andGolovinomycescichoracearum(synonymErysiphecichoracearum), of bothP.xanthiiis more commonly reported. Advances in the taxonomic status, pathological features, and biocontrol of cucurbits powdery pathogens were summarized in this paper. The key points is to elaborate the research achievements of bio-control with microbial and botanical resources against cucurbits powdery. The present existing problems in current studies and application were also discussed, providing references for the further research and effective control of this disease.
cucurbits powdery; pathogen; biocontrol
国家十二五支撑计划项目(2014BAD14B06);陕西省农业攻关计划项目(2014K02-10-01,2015NY038,2015NY042);
柯杨 女,硕士,助理研究员。主要从事植物真菌病害的生物防治研究。E-mail: keyang-bio@163.com
* 通讯作者。女,博士,副研究员。主要从事植物真菌病害的生物防治研究。E-mail:mayu08518@163.com
2015-03-06;
2015-05-29
Q939.95;S432.4
A
1005-7021(2016)01-0106-07
10.3969/j.issn.1005-7021.2016.01.018
陕西省科学院应用基础研究专项(2013K-14,2015K-11);西安市现代农业创新计划项目(NC1314(2))

