乙异羟肟酸与U、Np、Pu配合物的结构和热力学性质的密度泛函理论研究
吕洪彬,左 臣,晏太红,郑卫芳
中国原子能科学研究院 放射化学研究所,北京 102413
乙异羟肟酸与U、Np、Pu配合物的结构和热力学性质的密度泛函理论研究
吕洪彬,左 臣,晏太红,郑卫芳
中国原子能科学研究院 放射化学研究所,北京 102413
采用密度泛函理论(DFT),在B3LYP/RECP/6-31G(d,p)水平对U(Ⅵ)、U(Ⅳ)、Np(Ⅳ)、Pu(Ⅳ)与乙异羟肟酸(AHA)摩尔比为1∶1和1∶2配合物的结构和热力学参数进行了研究。结构计算发现,M-O键键长随原子序数增加而减短,对配合物进行自然轨道分析(NBO)发现, M和AHA的摩尔比为1∶1的配合物中M-O键是明显的离子键,共价成分很少,在1∶2配合物中M-O键共价成分增加。对配位反应的热力学参数进行计算发现,金属离子与AHA配合物的稳定性依次为Pu(Ⅳ)>Np(Ⅳ)>U(Ⅳ)>U(Ⅵ),理论计算结果与实验测量得到的稳定常数顺序一致。
乙异羟肟酸;密度泛函理论;铀;镎;钚
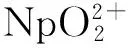
本工作拟对U(Ⅵ)、U(Ⅳ)、Np(Ⅳ)、Pu(Ⅳ)与乙异羟肟酸(AHA)1∶1和1∶2(摩尔比,下同)配合物的结构和热力学参数进行研究。
1 计算方法和基组
所有的计算均采用密度泛函理论(DFT),利用Gaussian 09软件包[9]进行计算。选取B3LYP杂化泛函进行不考虑自旋-轨道耦合的标量相对论计算。对钚原子的计算考虑相对论效应,对内层电子采用相对论有效核势(RECP),在进行结构优化和自由能计算时,采取德国斯图加特大学相对论赝势基组,这个基组包含60个中心电子的赝势。对C、H、O、N等原子采取6-31G(d, p)全电子基组[10]。有研究结果表明,采用B3LYP/RECP/6-31G(d, p)的理论计算方法对锕系元素及其与有机配体形成的配合物进行计算得到的结果是可信的[11]。所有的结构优化均在气相环境中采用B3LYP/RECP/6-31G(d, p)理论计算方法进行。在优化结构的基础上,采用相同方法对振动频率进行计算,在气相环境中得到配合物的自由能以及零点能。
2 计算结果和讨论
2.1 U(Ⅵ)、U(Ⅳ)、Np(Ⅳ)、Pu(Ⅳ)与AHA 1∶1和1∶2配合物的结构优化结果

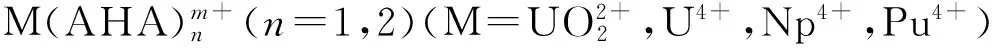

红色代表O,蓝色代表N,黑色代表C,白色代表H图1 MP2/aug-cc-pvDZ方法优化得到的AHA酮式结构的Z型(a)和E型(b)异构体的结构和能量 Fig.1 Optimized structure and energy of (Z)-AHA(a) and (E)-AHA(b) by MP2/aug-cc-pvDZ method

绿色代表U,深绿色代表Np,黄色代表Pu,红色代表O,蓝色代表N,黑色代表C,白色代表H图的DFT优化结构Fig.
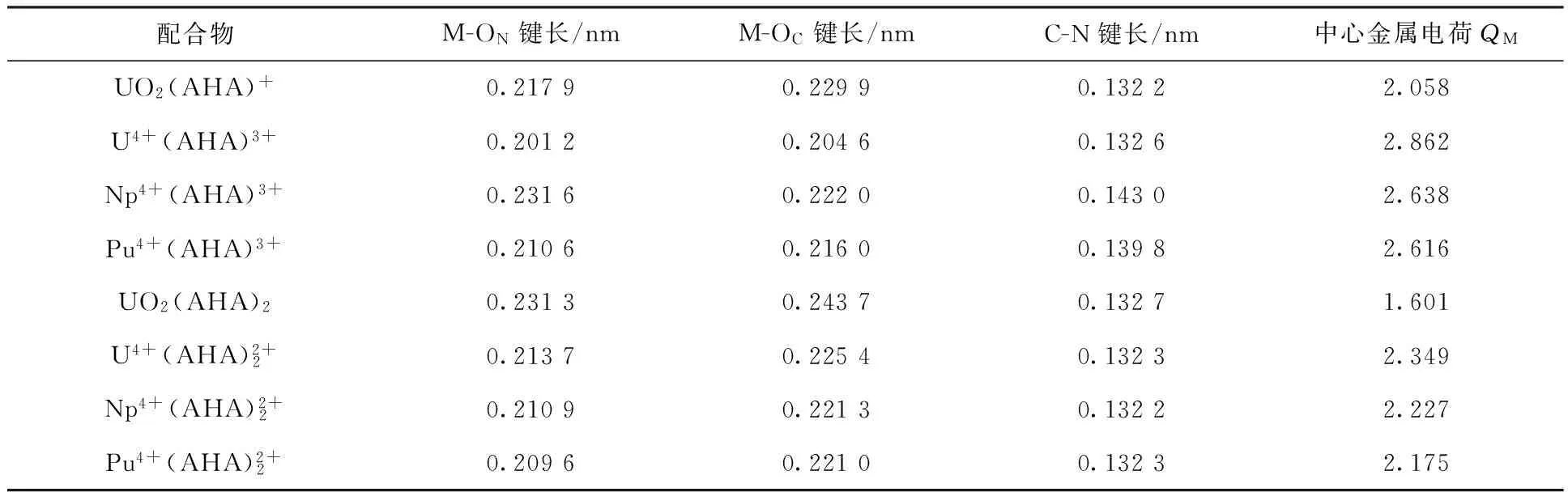
配合物M-ON键长/nmM-OC键长/nmC-N键长/nm中心金属电荷QMUO2(AHA)+0.21790.22990.13222.058U4+(AHA)3+0.20120.20460.13262.862Np4+(AHA)3+0.23160.22200.14302.638Pu4+(AHA)3+0.21060.21600.13982.616UO2(AHA)20.23130.24370.13271.601U4+(AHA)2+20.21370.22540.13232.349Np4+(AHA)2+20.21090.22130.13222.227Pu4+(AHA)2+20.20960.22100.13232.175

2.2 U(Ⅵ)、U(Ⅳ)、Np(Ⅳ)、Pu(Ⅳ)与AHA 1∶1和1∶2配合物自然轨道分析(NBO)


(a):■——r=1∶1,□——r=1∶2;(b):■——U(Ⅵ),●——U(Ⅳ),▲——Np(Ⅳ),△——Pu(Ⅳ)图与AHA结合后M-O键键长(a)和中心金属电荷(b)的变化Fig.
对金属离子和配合物中的金属离子电荷进行计算比较,也可以显示配位过程中金属离子与配体之间的相互作用的强弱。在1∶1配合物中,配位之后U(Ⅵ)的电荷从2.81降低到2.06,下降了0.75,U、Np、Pu的电荷从4.0分别下降到2.86、2.64和2.62,电荷下降分别为1.14、1.36和1.34,随着原子序数的增大,中心离子电荷下降增大,说明中心离子和AHA之间的电荷转移成分更多,相互作用更强。在1∶2配合物中,配位之后U(Ⅵ)的电荷从2.81降低到1.60,共下降1.21,U、Np、Pu的电荷从4.0分别下降到2.35、2.25和2.18,电荷下降了1.65、1.75和1.82,说明1∶2配合物中,中心金属离子与AHA的相互作用比1∶1的配合物中更强。
2.3 U(Ⅵ)、U(Ⅳ)、Np(Ⅳ)、Pu(Ⅳ)与AHA 1∶1和1∶2配位的结合能计算和讨论


基团ΔG1/(kJ·mol-1)ΔG2/(kJ·mol-1)lgβ1lgβ2UO2+2-125.0613.27.93[12]14.58[12]U(Ⅳ)-2501.4-3125.5Np(Ⅳ)-2571.5-3095.812.46[13]/11.34[14]/11.78[15]22.22[13]Pu(Ⅳ)-2692.5-3407.914.20[16]/13.00[14]/12.72[15]24.1[16]
3 结 论
利用B3LYP密度泛函理论方法,采用Gaussian 09程序和相对论赝势基组,对U(Ⅵ)、U(Ⅳ)、Np(Ⅳ)、Pu(Ⅳ)与AHA以1∶1和1∶2的摩尔比例进行配位的结构和能量进行计算。结构计算发现,随着原子序数的增大,M-O(AHA)键键长逐渐减小。对配合物进行NBO分析,发现1∶1的配合物中M-O(AHA)键是典型的离子键,而在1∶2的配合物中M-O(AHA)键的共价键成分开始增加。对配位反应的热力学参数进行计算,结果表明,金属离子与AHA结合的自由能顺序为Pu(Ⅳ)>Np(Ⅳ)>U(Ⅳ)>U(Ⅵ),这与实验测得的稳定常数大小顺序一致。
[1] Taylor R J, May I, Denniss I S, et al. The development of chemical separation technology for an advanced purex process[C]∥RECOD’ 98. France, 1998: 417-424.
[2] Kelly J, Savage C. Advanced fuel cycle initiative program plan[R]. May 1, 2005, Advanced Fuel Cycle Initiative, Washington, DC.
[3] Taylor R J, May I, Wallwork A L, et al. The applications of formo- and aceto-hydroxamic acids in nuclear fuel reprocessing[J]. J Alloys Compd, 1998(271-273): 534-537.
[4] Tkac P, Paulenova A. The effect of acetohydroxamic acid on extraction and speciation of plutonium[J]. Sep Sci Technol, 2008, 43(9): 2670-2683.
[5] May I, Taylor R J, Brown G. The formation of hydrophilic Np(Ⅳ) complexes and their potential application in nuclear fuel reprocessing[J]. J Alloys Compd, 1998(271-273): 650-653.
[6] Tkac P, Matteson B, Bruso J, et al. Complexation of uranium(Ⅵ) with acetohydroxamic acid[J]. J Radioanal Nucl Chem, 2008, 277(1): 31-36.
[7] Mattesona B S, Tkac P, Paulenova A. Complexation chemistry of zirconium(Ⅳ), uranium(Ⅵ), and iron(Ⅲ) with acetohydroxamic acid[J]. Sep Sci Technol, 2010(45): 1733-1742.
[8] 王东琪,Wilfred F van Gunsteren.锕系计算化学进展[J].化学进展,2011,23(7):1566-1581.
[9] Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 09, Revision A.1[R]. USA: Gaussian, Inc. Wallingford, CT, 2009.
[10]Kuchile W, Dolg M, Stoll H, et al. Energy-adjusted pseudopotentials for the actinides. parameter sets and test calculations for thorium and thorium molecules[J]. J Chem Phys, 1994, 100(100): 7535-7542.
[11]Xiao C L, Wu Q Y, Wang C Z, et al. Quantum chemistry study of uranium(Ⅵ), neptunium(Ⅴ), and plutonium(Ⅳ,Ⅵ) complexes with preorganized tetradentate phenanthrolineamide ligands[J]. Inorg Chem, 2014, 53(20): 10846-10853.

[13]Andrieux F P L, Boxall C, May I, et al. The hydrolysis of hydroxamic acid complexants in the presence of non-oxidizing metal ions 2: neptunium(Ⅳ) ions[J]. J Solution Chem, 2008, 37: 215-232.
[14]常志远,江浩.乙异羟肟酸与Np(Ⅳ)、Pu(Ⅳ)配合物稳定常数的测定[J].核化学与放射化学,1999,21(3):193-198.
[15]郑卫芳,常志远.乙异羟肟酸的合成及其与Pu(Ⅳ),Np(Ⅳ)配合物稳定常数的测定[J].核化学与放射化学,2001,23(1):1-6.
[16]Carrott M J, Fox O D, Taylor R J, et al. Solvent extraction behavior of plutonium(Ⅳ) ions in the presence of simple hydroxamic acids[J]. Solvent Extr Ion Exch, 2007, 25: 723-745.
Density Functional Theoretical Analysis of Complexes of AHA and U, Np and Pu
LU Hong-bin, ZUO Chen, YAN Tai-hong, ZHENG Wei-fang
China Institute of Atomic Energy, P. O. Box 275(26), Beijing 102413, China
The geometry and thermodynamic properties of complexes of acetohydroxamic acid(AHA) and U, Np and Pu (1∶1 and 2∶1) were studied by using density functional theory(DFT) at B3LYP/RECP/6-31G(d,p) level. The structure studies show the shortening of M-O bond in complexes along with the increasement of atomic number. NBO analysis show the M-O bonds in the complexes with the mole ratio 1∶1 of M and AHA are representative ionic bonds. However, the M-O bonds in 1∶2 complexes are partial covalent bond components. Thermodynamic property studies reveal the order of the stability of metal AHA complexes is Pu(Ⅳ)>Np(Ⅳ)>U(Ⅳ)>U(Ⅵ). The experiment results are agreement with the theoretical studies.
acetohydroxamic acid; density functional theory; uranium; neptunium; plutonium
2016-05-24;
2016-11-08
吕洪彬(1985—),男,黑龙江密山人,博士,助理研究员,核燃料循环与材料专业
O634.12
A
0253-9950(2016)06-0342-05
10.7538/hhx.2016.38.06.0342

