羊草形态及生物量分配可塑性对土壤供磷能力的响应研究
郭丰辉,侯向阳*,丁勇,李西良 ,武自念,王珍,胡静,李新乐 ,马文静,赵劲博
(1.中国农业科学院草原研究所,国家牧草改良中心,内蒙古 呼和浩特 010010;2.中国林业科学研究院沙漠林业实验中心,内蒙古 磴口 015200)
羊草形态及生物量分配可塑性对土壤供磷能力的响应研究
郭丰辉1,侯向阳1*,丁勇1,李西良1,武自念1,王珍1,胡静1,李新乐2,马文静1,赵劲博1
(1.中国农业科学院草原研究所,国家牧草改良中心,内蒙古 呼和浩特 010010;2.中国林业科学研究院沙漠林业实验中心,内蒙古 磴口 015200)
植物形态及生物量分配变化是天然草原退化过程中的主要表现之一,通过研究植物形态及生物量分配对环境的响应规律有助于揭示草原退化及植被演替的内在机理。本试验研究了羊草形态、生物量累积及分配对土壤供磷能力的可塑性响应。试验采用有效磷含量低于3 mg P2O5/kg的土壤设置0,30,90,180 mg P2O5/kg 4个磷肥添加梯度,形成4种具有不同供磷能力的土壤,用于对羊草植株的培养,并于后期进行各项指标的测定。结果表明,1)土壤供磷能力的减弱明显减小了羊草的株高、各构件生物量,表现为高磷添加量显著高于低磷添加量,株高、叶生物量、茎生物量、根生物量、总生物量的降低幅度分别达到了14%,50%,51%,79%,63%。 2)羊草个体形态及生物量分配对土壤供磷能力的响应并不完全一致,生物量累积对供磷量的敏感度最大,生物量分配次之,形态的敏感度最差,可塑性指数分别为0.58,0.31,0.19;单个性状指标以根干重最为敏感,可塑性指数达到了0.79。3)相关分析表明,羊草地上干重与叶宽、节间数、株高达到了极显著水平,此3个形态指标对羊草地上生物量的贡献率分别为30%,27%,26%,是形态指标中解释羊草地上生物量产生差异的主要因子。本试验在课题组前期研究的基础上,进一步从个体水平上探索羊草对土壤供磷能力的响应,与课题组前期试验结果相结合,可有助于探索天然草原退化和植被演替的内在原因。
羊草;土壤供磷能力;表型可塑性;可塑性指数
表型可塑性与植物对环境的适应能力、外来物种的入侵能力、物种的进化及生态系统中植被的演替息息相关[1-4]。植物在不同生存环境下的可塑性响应可以提高其入侵能力、拓宽其生存范围。通过研究植物对环境因子(包括养分、水分、光照、温度、二氧化碳等非生物因子及生物因子)的可塑性响应有助于揭示自然界中物种入侵、植被演替等现象的内在机理[5-8]。近些年有关植物表型可塑性的研究主要集中于植物对环境因子的可塑性响应与外来物种入侵能力、生态幅、物种进化的关系等方面[9-12]。也有学者研究了植被演替过程中植物的个体行为,试图通过植物的个体行为来探讨植被演替的机理[13-14],有关植物个体行为对环境的响应及其在生态系统中所起到的作用越来越受到人们的关注。
天然草原是陆地生态系统的重要组成部分,其功能的多样性对于维持全球的生态平衡具有重要作用[15]。近几十年来,由于人类的干扰及气候环境的变化等因素,天然草原退化严重,表现为生产力降低、生态功能减弱等[16]。植物可以通过可塑性变化来适应其生长环境的改变,不同物种可塑性能力存在差异[17-18],这从一定程度上导致了植物不同的适应能力,进而影响到了天然草原植被的演替[13, 18-19]。鉴于植物表型可塑性在物种生存、群落演替中的重要作用,过去许多学者针对天然草原植物对放牧、土壤养分、土壤水分及种群密度等环境因素的表型可塑性做了大量研究,试图通过对草原退化过程中植物的可塑性响应来揭示草原退化的原因。李西良等[3]、安慧[20]、李金花等[21]都对放牧干扰下植物的形态及生物量分配可塑性做了研究,发现放牧可以改变植物的高度、茎叶及生物量分配等性状,而植物也可以通过形态可塑性的响应来适应放牧干扰;沙米(Agriophyllumsquarrosum)对土壤养分、水分和种群密度3个环境因子均有表型可塑性响应,但以对土壤养分的响应幅度最大[22]。总之,表型可塑性是草原生态系统植物个体的一种普遍行为,其对维持天然草原的组成结构与功能具有重要作用。
中国北方草原在退化过程中,土壤有效磷含量呈降低的趋势,致使其成为该生态系统植物生长的限制因子[23]。同时,近些年来由于环境的污染,氮沉降量加大[24-25],这种氮输入的增加一方面可以缓解天然草原植物的氮限制[26],另一方面也打破了植物对养分的需求平衡,而使得植物更易受到其他养分如磷元素的限制[27-28]。而当土壤有效磷含量成为限制因子时,植物一方面可以通过生理可塑性来适应磷的限制,如增加根系酸性磷酸酶、质子及有机酸的分泌量来提高根基土壤有效磷的浓度[29];另一方面,植物也可以发生形态可塑性,通过增加比叶面积、叶片大小来响应土壤供磷能力的变化[30]。已有研究表明羊草(Leymuschinensis)在草原退化过程中会出现植株变矮、茎秆变短、叶片变短等小型化响应[3,13,18-19],其对过度放牧的可塑性响应越来越受到人们的重视。
之前有关羊草对环境的可塑性研究大都是在群落水平下针对多个环境因子对羊草产生的综合影响,不能确定过度放牧下羊草对每个环境因子的可塑性响应。课题组前期研究表明,羊草茎质量、总质量、茎高、株高、叶面积等为对放牧响应的敏感性状,而叶片数、茎粗、叶宽等较为稳定,为惰性性状;茎长、株高、叶面积、叶长等性状的投影重要性指标大于1,对地上生物量变化的解释率为68.6%,是导致长期放牧下羊草个体生物量降低的主要因子。本试验在课题组前期关于放牧干扰下羊草的可塑性响应的基础上,通过室内控制试验来研究羊草对土壤供磷能力的可塑性响应,试图揭示1)羊草对土壤供磷能力的可塑性响应规律;2)土壤供磷能力改变羊草个体地上生物量的驱动因子;3)结合课题组前期关于放牧对羊草形态可塑性的研究结果,尝试初步探讨土壤供磷能力在天然草原退化演替中的可能作用。
1 材料与方法
1.1 试验材料
试验于2015年5月初至7月初在农业部沙尔沁牧草资源重点野外科学观测试验站温室进行。为了有效研究土壤中磷元素对天然草原植物所起的作用,避免其他营养成分偏离正常水平而对试验造成影响,试验所用土壤采自于中国农业科学院廊坊试验基地,该土壤有效磷含量长期严重缺乏(该土壤有效磷含量为3.00 mg P2O5/kg,据徐明岗等[31]研究当土壤有效磷含量低于5 mg P2O5/kg时即为亏缺状态),而其他养分水平相对正常[32]。土壤的基本理化性质为:全磷0.56 g/kg、全氮0.66 g/kg、有效磷3.00 mg P2O5/kg、碱解氮51.36 mg/kg、有机质1.11%、pH 7.50。将所有土壤充分混匀、过筛、风干,然后装入直径为18 cm的花盆,每盆2.25 kg风干土。为了保证羊草种子基因的一致性,减小处理内的变异性,羊草种子选用变异性较小的吉生4号,由试验站羊草资源圃提供。
1.2 试验方法
磷处理设置0,30,90,180 mg P2O5/kg四个梯度,每个处理6个重复,磷肥选用过磷酸钙。将装好土的花盆按照其施磷梯度计算好施磷量(每盆含风干土2.25 kg),然后将每盆所添加的磷肥充分与土壤混匀,最后给每盆浇同等量的水(第一次浇透为止,之后保持土壤最大持水量的45%左右)。
挑选大小一致的饱满羊草种子进行种植,每盆均匀地撒下25粒种子,敷一层薄土。待出苗15 d左右间苗,每盆留长势基本相同的幼苗12株。在羊草生长期间,定期对每盆浇同等量的水(根据植物不同生长时期,浇水量略有改变,幼苗期为促进其根系的生长浇水量少于其他时期),同时拔除花盆里所出现的少量杂草。
1.3 样品采集与数据测定
生长到60 d时收获,此时羊草处于生长旺盛时期的末期,生长速度明显减慢。收获时将花盆打破,轻轻地抖掉根系上面的土壤,然后将每株的根系分开,并洗净。首先对植物的形态指标进行测定,从每盆的12株中随机选取3株进行测定,这样每个处理需对18个单株进行测定。利用游标卡尺测量羊草的叶宽及节间粗,对每片叶及每一节间进行测定后取平均值;利用钢尺对植物的株高、节间长、叶长进行测定。待所有形态指标测量结束后,对每株进行根、茎、叶的分离,并置于60 ℃烘箱烘干,然后称重。
1.4 数据处理
本研究中的性状指标包括形态性状:株高(plant height, PH)、节间数(internode number, SN)、节间长(internode length, SL)、节间粗(internode thick, SD)、叶长(leaf length, LL)、叶宽(leaf width, LW)、节间长/节间粗(internode length/internode thick, SLD)、叶长/叶宽(leaf length/leaf width, LLW);生物量累积性状:叶干重(leaf mass, LM)、茎干重(stem mass, SM)、根干重(root mass, RM)、地上干重(aboveground biomass mass, ABM)、总干重(total mass, TM);生物量分配性状:叶生物量比(leaf mass distribution, LMD)、茎生物量比(stem mass distribution, SMD)、根生物量比(root mass distribution, RMD),LMD、SMD、RMD分别为LM/TM、ABM/TM、RM/TM。

利用Excel 2010进行数据整理及简单的数据分析,利用SPSS 19.0进行方差分析和相关分析,利用Sigmaplot 12.0作图。方差分析法分析羊草各个性状在不同处理间的差异显著性,进行Duncun多重比较,数据以平均值±标准误差表示;相关分析利用Pearson相关法,分析部分性状之间的相关性,并在0.05水平上进行显著性检验。
2 结果与分析
2.1 羊草对土壤供磷能力的形态可塑性响应
随着土壤供磷能力的增强,羊草株高增高、节间数增多、叶片宽度增大而长度没有变化,其中株高及节间数在不同处理间达到了显著水平(P<0.05),叶片宽度在最低土壤供磷水平条件下显著小于最高土壤供磷水平(P<0.05),叶片长度在每个处理间差异不显著;羊草的节间长度、节间粗及节间长/节间粗、叶长/叶宽对土壤供磷能力产生了一定程度的响应,其中节间长、节间长/节间粗随着供磷能力的增强呈增大趋势,而节间粗、叶长/叶宽呈减小趋势,这4个性状指标在部分处理间也达到了显著水平(P<0.05)(图1)。

图1 羊草形态可塑性(平均值±标准误差)Fig.1 The morphological plasticity of L. chinensis (mean±SE) P0、P1、P2、P3分别代表磷添加量0、30、90、180 mg P2O5/kg。不同小写字母表示差异显著(P<0.05)。PH:株高;SN:节间数;SL:节间长;SD:节间粗;LL:叶长;LW:叶宽;SLD:节间长/节间粗;LLW:叶长/叶宽;下同。P0、P1、P2、P3 are the phosphorus concent 0, 30, 90, 180 mg P2O5/kg. Different small letters indicate significant differences (P<0.05). PH: Plant height; SN: Internode number; SL: Internode length; SD: Internode thick; LL: Leaf length; LW: Leaf width; SLD: Internode length/Internode thick; LLW: Leaf length/ Leaf width; The same below.
2.2 羊草生物量累积及分配对土壤供磷能力的可塑性响应
在生物量累积方面,随着土壤供磷能力的增强,羊草各构件生物量呈增高趋势。当土壤供磷能力最强时,叶干重、茎干重、根干重、地上干重和总干重均显著高于其他处理(P<0.05);最低供磷能力的各生物量累积指标均显著低于其他处理。随着土壤供磷能力的改变,生物量分配规律明显,在最低供磷能力下,羊草的叶生物量比及茎生物量比均显著小于其他处理,地下生物量比显著高于其他处理,各磷添加的处理之间差异不显著(P<0.05)(图2)。
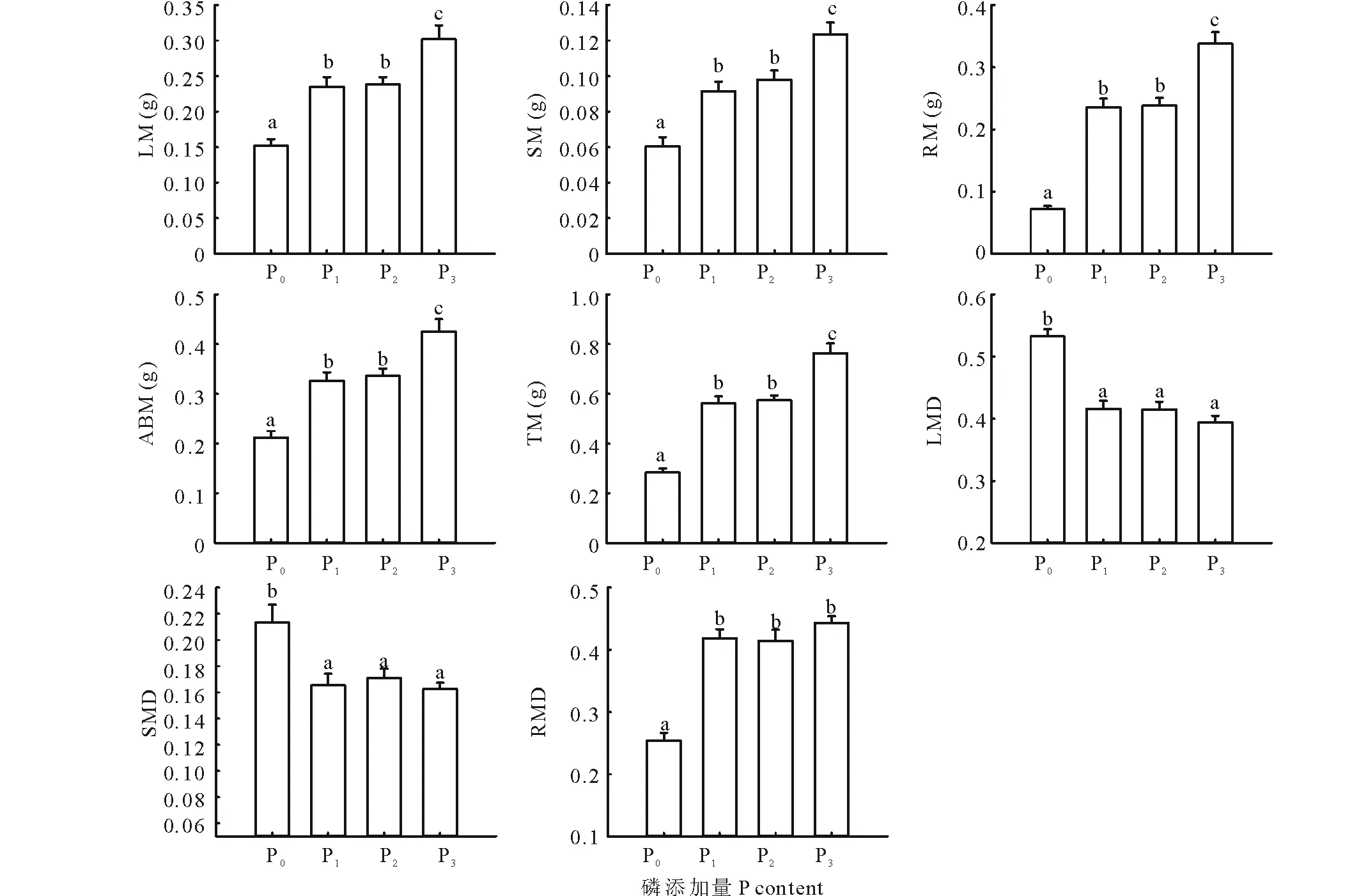
图2 羊草生物量积累及分配可塑性(平均值±标准误差)Fig.2 The plasticity of biomass accumulation and distribution of L. chinensis(mean±SE) LM:叶干重;SM:茎干重;RM:根干重;ABM:地上干重;TM:总干重;LMD:叶生物量比;SMD:茎生物量比;RMD:根生物量比;下同。LM: Leaf mass; SM: Stem mass; RM: Root mass; ABM: Aboveground biomass; TM: Total mass; LMD: Leaf mass ratio; SMD: Stem mass ratio; RMD: Root mass ratio; The same below.
2.3 羊草各性状指标对土壤供磷能力的敏感度
为了比较羊草各性状指标对土壤供磷能力敏感度的差异,对其各性状可塑性指数进行了排序。结果表明,羊草可塑性指数最大的性状为根干重(0.79);羊草的生物量累积指标可塑性指数平均值、生物量分配指标可塑性指数平均值、形态指标可塑性指数平均值分别为0.58,0.31,0.19,也就是说以其生物量累积对供磷量的敏感度最大,生物量分配次之,形态的敏感度最差(图3)。
2.4 植株大小与形态指标之间的关系
以地上干重及株高表示植株个体的大小,分析了植株个体大小与各形态指标之间的相关关系。结果表明羊草形态性状均与植株个体大小呈正相关关系,存在协同变化关系。羊草株高、节间数、叶宽与地上干重相关性达到了极显著水平,节间数、节间长、叶宽与高也达到了极显著水平(表1)。
为判断羊草各形态指标对其地上生物量影响的大小,利用偏最小二乘法确定了各性状因子的变量投影重要性指标(VIP),并计算了各形态指标对地上生物量的贡献率。结果表明,在6个羊草个体的形态性状中叶宽、节间数及株高的VIP都大于1,分别为1.48,1.36,1.28,是羊草个体地上生物量的主要影响因子。各形态指标对地上生物量贡献率的大小比较为LW>SN>PH>SD>SL>LL(图4)。其中叶宽、节间数、株高3个形态性状对羊草地上生物量的贡献率总和为83%,是解释羊草个体地上生物量形成和变化的主要指标,而节间粗、节间长、叶长的贡献率相对要低一些(总和为17%)(图4)。

图3 羊草可塑性指数排序Fig.3 Sorting of the plasticity index of L. chinensis
表1 羊草植株个体大小与其形态性状的相关性分析
Table 1 The correlation of morphological trait and plant size forL.chinensis

性状TraitPHSNSLSDLLLWABM0.588**0.629**0.1770.190-0.0270.688**PH10.538**0.494**-0.0970.1940.343**
注:数字代表相关系数,**代表显著性(P<0.01)。
Note: The number is correlation index, ** indicates significant (P<0.01).

图4 羊草个体地上生物量与形态指标的投影重要性指标(VIP)(A)及各形态指标贡献率(B)Fig.4 The variable importance in projection values (VIP)(A) and the contribution rate of morphological traits to aboveground biomass(B)
3 讨论
课题组前期研究了羊草个体形态及个体生物量对过度放牧的响应,结果表明,羊草对放牧干扰存在非常明显的可塑性,是过度放牧下天然草原生物量减小、植被演替的原因之一[3]。过度放牧造成的土壤有效磷含量的降低是草原退化的表现之一,加之最近几年环境中氮沉降的加剧,土壤供磷能力对植物生长的限制越来越受到人们的重视[23-25]。为了研究土壤供磷能力在过度放牧下草原退化过程中的作用,在课题组关于放牧下羊草的可塑性响应研究的基础上,本试验针对土壤供磷能力对羊草生长的影响进行了研究。结果表明,羊草的生长对土壤供磷能力非常敏感,表现为株高降低、各构件生物量减少,随着土壤供磷能力的减弱,羊草单株生物量和株高分别降低了63%和14%,地下、茎、叶生物量分别降低了79%、51%、50%,结合放牧干扰下土壤有效磷含量状况的变化,推测土壤供磷能力的减弱可能是过度放牧造成天然草原生产力降低、植被演替的原因之一。
天然草原植物在过度放牧干扰下,植株个体变矮、叶片变短变窄、节间缩短、丛幅变小、根系分布浅层化,表现为植株矮小化[13,18]。有研究表明,在放牧干扰下,羊草株高、叶长、节间长为敏感性状,茎粗、叶宽及叶片数的敏感性相对较低[3,13,34-36],这与羊草植株个体形态对土壤供磷能力的响应规律有所不同。本研究结果表明随着土壤供磷能力的改变,羊草个体株高、节间数、叶宽、节间粗为敏感性状,叶长、节间长为惰性性状。羊草个体形态对放牧的响应更多反映的是羊草对由于放牧而引起的多种改变了的环境因子的响应,是一种“复合式响应”,也是草原退化后植株个体形态的一种表现形式,而土壤供磷能力只是多个环境因子中的一个因子。因此,羊草植株个体形态对土壤供磷能力及对过度放牧响应规律的差异可能是由于在天然草原生态系统中,羊草的生长受到多种生物和非生物因素的影响,植物需要通过资源整合来实现各个性状之间的权衡,从而在各种环境因素影响下表现出一个最优的生长状况[37-41],因此其对单一环境因素的响应与其对多个因素的响应可能会出现非常大的差异。本研究结果与其他研究中所出现的差异也反映出草原生态系统中土壤供磷能力之外的各种环境因子,包括放牧啃食与践踏、水分、光照、氮素营养等,都可能会对植物个体形态的影响产生作用,甚至有可能存在耦合作用。必须指出的是磷元素主要对植物的发育产生影响,而氮元素主要对植物的伸长生长产生影响,这可能是羊草对过度放牧和对土壤供磷能力的形态可塑性响应规律出现差异的原因之一,因此,氮元素可能在天然草原退化过程中起着重要的作用[30]。在复杂的生态系统中分别针对植物个体形态在单一环境因子与多环境因子下进行可塑性研究,更有助于阐明植物形态变化在天然草原生态系统中的作用,进而揭示天然草原退化的内在机理。
植物在不同环境下同化物分配的差异反映了其对环境变化的响应方式及适应策略[42-43]。在草原退化过程中,植物会将更多的光合产物分配到地下,同时在地上增加对叶片等光合器官的分配,以增大捕获光资源的能力,提高光合速率,增强植物的养分吸收能力,保证其在放牧干扰下的生存和再生[44-45]。大量研究表明土壤养分条件的改善可以增加植物干物质的产量、降低根冠比率,增加同化物向地上部的分配[46-49]。但是本研究表明随着土壤供磷能力的增强,植物向茎叶的同化物分配减少,向根的分配增加,这与很多养分添加试验的结果并不一致。一个可能的原因是羊草属于根茎型多年生禾草,在天然草原其繁殖主要靠根茎的无性繁殖,在土壤供磷能力差时优先分配光合器官以提高光合能力,在土壤供磷能力强时优先分配给地下的繁殖器官,增加根茎节间数,提高其种群密度,以保证其繁殖能力,因此这种现象是羊草的一种繁殖策略。另外一种可能是这种现象是羊草对磷素养分的一种适应策略,在土壤供磷能力差时可以将更多的光合产物分配给地上以提高光合能力,而在地下通过改变根系形态、增加根系吸收面积,以最少的根部生物量获得最大的养分吸收面积。有关羊草在土壤养分影响下的资源分配规律及其他的适应策略还有待进一步研究。
在环境梯度下,很多植物的各个性状之间均具有协同变化的特征[50]。课题组前期研究发现放牧干扰下羊草的各个性状之间存在明显的协同变化趋势,随着羊草株高的降低,茎叶各性状也出现了降低的趋势,且株高与各性状指标之间存在显著的相关性[3]。本研究表明羊草地上生物量分别与株高、节间数、叶宽,羊草株高分别与节间数、节间长、叶宽的相关性均达到了极显著水平,也就是说在土壤供磷能力梯度下羊草的个体大小与部分形态指标之间存在协同变化规律。偏最小二乘法分析发现叶宽、节间数、株高对羊草个体地上生物量的贡献率分别为30%,27%,26%,此3个形态指标为导致羊草个体地上生物量在不同土壤供磷能力下发生差异的主要驱动因子。放牧干扰下驱动羊草地上生物量减少的形态指标为茎长、株高、叶长[3],因此,土壤供磷能力可能只是放牧干扰对羊草的影响途径之一,放牧对天然草原的作用还会受到氮、水分等其他因素的影响。
4 结论
1)土壤有效磷含量的匮乏明显减小了羊草的植株高度、各构件生物量,造成了羊草个体植株的矮小化。
2)虽然羊草在土壤磷元素匮乏下表现出植株变矮,生物量减小的矮小化现象,但是其个体形态、生物量分配对土壤供磷能力的响应与课题组前期研究的羊草对放牧干扰的响应有所不同。
3)不同土壤供磷能力条件下,羊草的叶宽、节间数、株高是驱动其个体生物量的主要因子,对羊草个体地上生物量的贡献率分别为30%,27%,26%,这与放牧对羊草生物量的驱动因子并不一致。
[1] Mou P, Jones R H, Tan Z,etal. Morphological and physiological plasticity of plant roots when nutrients are both spatially and temporally heterogeneous. Plant and Soil, 2013, 364(1/2): 373-384.
[2] Hu Q P, Guo Z H, Li C Y,etal. Advance at Phenotypic Plasticity in plant responses to abiotic factors. Scientia Silae Sinicae, 2008, (5): 135-142.
[3] Li X L, Hou X Y, Wu X H,etal. Plastic responses of stem and leaf functional traits inLeymuschinensisto long-term grazing in a meadow steppe. Chinese Journal of Plant Ecology, 2014, (5): 440-451.
[4] Kattia Palacio-Lopez B B. The ubiquity of phenotypic plasticity in plants: A synthesis. Ecology & Evolution, 2015, 5(16):3389-3400.
[5] Xie Y H, Yu D, Geng X H. Effects of elevated CO2concentration on phenotypic physiological and biochemical characteristics of submersed plant potamogeton crispus leaf. Acta Phytoecologica Sinica, 2003, 27(2): 218-222.
[6] Sheng H Y, Li W C, Chang J. Comparison of plasticity of seedling growth of two umbellaceae species in response to light intensity. Acta Ecologica Sinica, 2006, (6): 1854-1861.
[7] Chen S Y, Zhang J L, Jia P,etal. Impact of neighborhood effects on adaptive plasticity of plant height under light competition environment. Journal of Lanzhou University: Natural Sciences, 2009, (6): 76-81.
[8] Tao Y, Zhang Y M, Quan Y W,etal. Morphology and biomass characteristics of ephemeroid plantAlliumpallasiiand their relationships in junggar basin, China. Journal of Desert Research, 2012, (5): 1328-1334.
[9] Geng Y P, Zhang W J, Li B,etal. Phenotypic plasticity and invasiveness of alien plants. Biodiversity Science, 2004, (4): 447-455.
[10] Li X H, Li X L, Jiang D M,etal. A comparative study of the individual biomass and modular biomass of 70 herbaceous species found in the Horqin Sandy Land. Arid Zone Research, 2009, 26(2): 56-62.
[11] Zhang W H, Li H, Li J X,etal. Individual and modular biomass dynamics ofKingdoniauninflorapopulation in Qinling Mountain. Chinese Journal of Applied Ecology, 2003, (4): 530-534.
[12] Zhu J D, Meng T T, Ni J,etal. Within-leaf allometric relationships of mature forests in different bioclimatic zones vary with plant functional types. Chinese Journal of Plant Ecology, 2011, (7): 687-698.
[13] Wang W, Liang C Z, Liu Z L,etal. Analysis of the plant individual behaviour during the degradation and restoring succession in steppe community. Acta Phytoecologica Sinica, 2000, 24(3): 268-274.
[14] Connell J H, Slatyer R O. Mechanisms of succession in natural communities and their role in community stability and organization. American Naturalist, 1977, 111: 1119-1144.
[15] Bai Y F, Han X G, Wu J G,etal. Ecosystem stability and compensatory effects in the Inner Mongolia grassland. Nature, 2004, 431: 181-184.
[16] Zhang Z H. Silent crisis-desertification and degeneration of grassland. Pratacultura Science, 2000, 17(2): 10-12.
[17] Mcconnaughay K, Coleman J S. Biomass allocation in plants: ontogeny or optimality? A test along three resource gradients. Ecology, 1999, 80(8): 2581-2593.
[18] Liu Z L, Wang W. The discussion about the mechanism of degradation and restoring succession in Inner Mongolia. Journal of Arid Land Resources and Environment, 2002, 16(1): 84-91.
[19] Wang W, Liang C Z, Liu Z L,etal. Mechanism of degradation succession inLeymuschinensis+Stipagrandissteppe community. Acta Phytoecologica Sinica, 2000, (4): 468-472.
[20] An H. Effect of grazing on morphological plasticity and biomass allocation of dominant species in desert steppe. Journal of Arid Land Resources and Environment, 2014, (11): 116-121.
[21] Li J H, Li Z Q. Clonal morphological plasticity and biomass allocation pattern ofArtemisiafrigidaandPotentillaacaulisunder different grazing intensities. Acta Phytoecologica Sinica, 2002, (4): 435-440.
[22] Huang H X, Zhao X Y, Zhang H X. Responses ofAgriophyllumsquarrosumphenotypic plasticity to the changes of soil nutrient and moisture contents and population density. Chinese Journal of Plant Ecology, 2008, (12): 2593-2598.
[23] An Y, Han G D. The difference between the grass and soil in different stage of grassland deterioration. Grassland and China, 1999, (4): 31-36.
[24] Clark C M, Tilman D. Loss of plant species after chronic low-level nitrogen deposition to prairie grasslands. Nature, 2008, 451: 712-715.
[25] Yang Y, Ji C, Ma W,etal. Significant soil acidification across northern China’s grasslands during 1980s-2000s. Global Change Biology, 2012, 18(7): 2292-2300.
[26] Aber J D, Nadelhoffer K J, Steudler P,etal. Nitrogen saturation in northern forest ecosystems. Bioscience, 1989, 39(6): 286-378.
[27] Bobbink R, Hicks K, Galloway J,etal. Global assessment of nitrogen deposition effects on terrestrial plant diversity: a synthesis. Ecological Applications, 2010, 20(1): 30-59.
[28] Menge D N, Field C B. Simulated global changes alter phosphorus demand in annual grassland. Global Change Biology, 2007, 13(12): 2582-2591.
[29] Liu N N, Tian Q Y, Zhang W H. Comparison of adaptive strategies to phosphorus-deficient soil between dominant speciesArtemisiafrigidaandStipakryloviiin typical steppe of Nei Mongol. Chinese Journal of Plant Ecology, 2014, (9): 905-915.
[30] Bai X, Cheng J H, Zheng S X,etal. Ecophysiological responses ofLeymuschinensisto nitrogen and phosphorus additions in a typical steppe. Chinese Journal of Plant Ecology, 2014, 38(2): 103-115.
[31] Xu M G, Li J M. Plant Nutrition Elements of Soil Chemistry[M]. Beijing: Graduate School of Chinese Academy of Agricultural Sciences, 2005.
[32] Li X L. Effects of Irrigation and Phosphorus Fertilizer Application for Consecutive Years on Alfalfa Yield and Soil Environment[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014.
[33] Valladares F, Wright S J, Lasso E,etal. Plastic phenotypic response to light of 16 congeneric shrubs from a Panamanian rainforest. Ecology, 2000, 81(7): 1925-1936.
[34] Wu N E, Hai T. The effects of grazing on the morphological characteristics ofLeymuschinensisand soil physical and chemical properties in typical grassland. Journal of Inner Mongolia Agricultural University: Natural Science Edition, 2015, (4): 71-76.
[35] Zhao W. Physio-ecological Responses ofLeymuschinensisto Overgrazing and Clipping[D]. Beijing: Chinese Academy of Agricultural Sciences, 2006.
[36] Yu Y J. The Changes in Eco-physiological and Epigenetic Features ofLeymuschinensisin Responses to Warming and Nitrogen Addition[D]. Changchun: Northeast Normal University, 2014.
[37] Li X L, Liu Z Y, Hou X Y,etal. Plant functional traits and their trade-offs in response to grazing: a review. Chinese Bulletin of Botany, 2015, 50(2): 159-170.
[38] He M, Huang J H. Influence of grazing on seed production ofCaraganamicrophylla. Chinese Bulletin of Botany, 2010, (1): 59-65.
[39] Chen H J. The Response of Reproductive Characteristics and Ecological Stoichiometry of Main Plant Population to Stocking Rate in Inner Mongolia Desert Steppe[D]. Hohhot: Inner Mongolia Agricultural University, 2011.
[40] Bai Y, Wu J, Clark C M,etal. Grazing alters ecosystem functioning and C∶N∶P stoichiometry of grasslands along a regional precipitation gradient. Journal of Applied Ecology, 2012, 49(6): 1204-1215.
[41] Frank D A. Ungulate and topographic control of nitrogen: phosphorus stoichiometry in a temperate grassland; soils, plants and mineralization rates. Oikos, 2008, 117(4): 591-601.
[42] Smith S E. Variation in response to defoliation between populations ofBoutelouacurtipendulavar.caespitosa(Poaceae) with different livestock grazing histories. American Journal of Botany, 1998, 85(9): 1266-1272.
[43] Geber M A, Watson M A, de Kroon H. Development and resource allocation in perennial plants: The significance of orgon preformation[M]//Plant Resource Allocation. New York: Academic Press, 1997.
[44] Ren H Y, Zhen S X, Bai Y F. Effects of grazing on foliage biomass allocation of grassland communities in Xi Lin River Basin, Inner Mongolia. Chinese Journal of Plant Ecology, 2009, 33(6): 1065-1074.
[45] Roy J, Winner W E, Pell E J. Response of Plants to Multiple Stresses[M]. USA: Academic Press, 2012.
[46] Weigelt A, Bol R, Bardgett R D. Preferential uptake of soil nitrogen forms by grassland plant species. Oecologia, 2005, 142(4): 627-635.
[47] Wang S P, Wang Y F, Chen Z Z,etal. Sulphur concentration of soils and plants and its requirement for ruminants in the Inner Mongolia steppe of China. Grass and Forage Science, 2001, 56(4): 418-422.
[48] Reich P B, Buschena C, Tjoelker M G,etal. Variation in growth rate and ecophysiology among 34 grassland and savanna species under contrasting N supply: a test of functional group differences. New Phytologist, 2003, 157(3): 617-631.
[49] Ping X Y, Zhou G S, Sun J S. Advances in the study of photosynthate allocation and its controls. Chinese Journal of Plant Ecology, 2010, (1): 100-111.
[50] Hodge A. The plastic plant: root responses to heterogeneous supplies of nutrients. New Phytologist, 2004, 162(1): 9-24.
[2] 胡启鹏, 郭志华, 李春燕, 等. 植物表型可塑性对非生物环境因子的响应研究进展. 林业科学, 2008, (5): 135-142.
[3] 李西良, 侯向阳, 吴新宏, 等. 草甸草原羊草茎叶功能性状对长期过度放牧的可塑性响应. 植物生态学报, 2014, (5): 440-451.
[5] 谢永宏, 于丹, 耿显华. CO2浓度升高对沉水植物菹草叶表型及生理生化特征的影响. 植物生态学报, 2003, 27(2): 218-222.
[6] 盛海燕, 李伟成, 常杰. 伞形科两种植物幼苗生长对光照强度的可塑性响应. 生态学报, 2006, (6): 1854-1861.
[7] 陈书燕, 张甲林, 贾鹏, 等. 光竞争条件下邻域效应对植物高生长可塑性的影响. 兰州大学学报: 自然科学版, 2009, (6): 76-81.
[8] 陶冶, 张元明, 全永威, 等. 准噶尔荒漠小山蒜的形态与生物量特征及其相互关系. 中国沙漠, 2012, (5): 1328-1334.
[9] 耿宇鹏, 张文驹, 李博, 等. 表型可塑性与外来植物的入侵能力. 生物多样性, 2004, (4): 447-455.
[10] 李雪华, 李晓兰, 蒋德明, 等. 科尔沁沙地70种草本植物个体和构件生物量比较研究. 干旱区研究, 2009, (2): 200-205.
[11] 张文辉, 李红, 李景侠, 等. 秦岭独叶草种群个体和构件生物量动态研究. 应用生态学报, 2003, (4): 530-534.
[12] 祝介东, 孟婷婷, 倪健, 等. 不同气候带间成熟林植物叶性状间异速生长关系随功能型的变异. 植物生态学报, 2011, (7): 687-698.
[13] 王炜, 梁存柱, 刘钟龄, 等. 草原群落退化与恢复演替中的植物个体行为分析. 植物生态学报, 2000, 24(3): 268-274.
[16] 张自和. 无声的危机——荒漠化与草原退化. 草业科学, 2000, 17(2): 10-12.
[18] 刘钟龄, 王炜. 内蒙古草原退化与恢复演替机理的探讨. 干旱区资源与环境, 2002, 16(1): 84-91.
[19] 王炜, 梁存柱, 刘钟龄, 等. 羊草+大针茅草原群落退化演替机理的研究. 植物生态学报, 2000, (4): 468-472.
[20] 安慧. 放牧干扰对荒漠草原优势植物形态可塑性及生物量分配的影响. 干旱区资源与环境, 2014, (11): 116-121.
[21] 李金花, 李镇清. 不同放牧强度下冷蒿、星毛委陵菜的形态可塑性及生物量分配格局. 植物生态学报, 2002, (4): 435-440.
[22] 黄迎新, 赵学勇, 张洪轩, 等. 沙米表型可塑性对土壤养分、水分和种群密度变化的响应. 应用生态学报, 2008, (12): 2593-2598.
[23] 安渊, 韩国栋. 不同退化梯度草地植物和土壤的差异. 中国草地, 1999, (4): 31-36.
[29] 刘娜娜, 田秋英, 张文浩. 内蒙古典型草原优势种冷蒿和克氏针茅对土壤低磷环境适应策略的比较. 植物生态学报, 2014, (9): 905-915.
[30] 白雪, 程军回, 郑淑霞, 等. 典型草原建群种羊草对氮磷添加的生理生态响应. 植物生态学报, 2014, 38(2): 103-115.
[31] 徐明岗, 李菊梅. 植物营养元素的土壤化学[M]. 北京: 中国农业科学院研究生院, 2005.
[32] 李新乐. 连续多年灌水施磷肥对紫花苜蓿产量和土壤环境的影响[D]. 北京: 中国农业科学院, 2014.
[34] 乌尼尔, 海棠. 放牧对典型草原羊草形态特征及土壤理化性质的影响. 内蒙古农业大学学报: 自然科学版, 2015, (4): 71-76.
[35] 赵威. 羊草对过度放牧和刈割的生理生态响应[D]. 北京: 中国科学院研究生院(植物研究所), 2006.
[36] 于英杰. 增温和施氮导致羊草生理生态与表观遗传变化[D]. 长春: 东北师范大学, 2014.
[37] 李西良, 刘志英, 侯向阳, 等. 放牧对草原植物功能性状及其权衡关系的调控. 植物学报, 2015, 50(2): 159-170.
[38] 何茂, 黄建辉. 放牧对小叶锦鸡儿种子产量的影响. 植物学报, 2010, (1): 59-65.
[39] 陈海军. 荒漠草原主要植物种群繁殖性状及化学计量特征对载畜率的响应[D]. 呼和浩特: 内蒙古农业大学, 2011.
[44] 任海彦, 郑淑霞, 白永飞. 放牧对内蒙古锡林河流域草地群落植物茎叶生物量资源分配的影响. 植物生态学报, 2009, 33(6): 1065-1074.
[49] 平晓燕, 周广胜, 孙敬松. 植物光合产物分配及其影响因子研究进展. 植物生态学报, 2010, (1): 100-111.
Plasticity of plant morphology and biomass allocation ofLeymuschinensisunder different phosphorus conditions
GUO Feng-Hui1, HOU Xiang-Yang1*, DING Yong1, LI Xi-Liang1, WU Zi-Nian1, WANG Zhen1, HU Jing1, LI Xin-Le2, MA Wen-Jing1, ZHAO Jin-Bo1
1.InstituteofGrasslandResearchofChineseAcademyofAgricultureSciences,NationalForageImprovementCenter,Hohhot010010,China; 2.ExperimentalCenterofDesertForestryofChinaAcademyofForestry,Dengkou015200,China
Changes in plant morphology and biomass allocation are the main factors in the natural grassland degradation process. Studying the responses of plant morphology and biomass allocation under different conditions could help to reveal the mechanism of grassland degradation. We conducted a pot experiment and evaluated the morphological responses and biomass accumulation and allocation ofLeymuschinensisunder different phosphorus (P) conditions. The treatments consisted of 0, 30, 90, and 180 mg P2O5/kg added to soil to provide four different P-availability conditions for cultivation ofL.chinensis. The results showed that: 1) plant biomass and height were reduced under low-P availability, and were significantly increased under higher-P availability. Plant height, leaf biomass, stem biomass, root biomass, and total biomass were 14%, 50%, 51%, 79%, and 63% lower, respectively, under low-P availability than under high-P availability. 2) Plant morphology and biomass allocation showed different responses to P availability. Biomass accumulation was the most sensitive to P conditions, and morphology was the least sensitive; the plasticity indexes were 0.58, 0.31, and 0.19, respectively, for biomass accumulation, allocation, and morphology. The most sensitive single trait indicator was root dry mass with the plasticity index of 0.79. 3) The correlations between aboveground dry mass and leaf width, internode number, and plant height were all significant. Understanding the responses ofL.chinensisto different P conditions can help to reveal the mechanisms of vegetation succession and degradation in the grassland ecosystem.
Leymuschinensis; P conditions of soil; phenotypic plasticity; plasticity index
10.11686/cyxb2016061
http://cyxb.lzu.edu.cn
2016-03-01;改回日期:2016-04-12
国家重点基础研究发展计划(973计划)(2014CB138806),“十二五”国家科技支撑计划(2012BAD12B02),内蒙古自治区自然科学基金重大项目(2015ZD02),中央级科研院所基本科研业务费项目(1610332015001)和国家自然基金(31502008)资助。
郭丰辉(1987-),男,山东滨州人,硕士。E-mail:guofhui@163.com*通信作者Corresponding author. E-mail: houxy16@126.com
郭丰辉, 侯向阳, 丁勇, 李西良, 武自念, 王珍, 胡静, 李新乐, 马文静, 赵劲博. 羊草形态及生物量分配可塑性对土壤供磷能力的响应研究. 草业学报, 2016, 25(12): 53-62.
GUO Feng-Hui, HOU Xiang-Yang, DING Yong, LI Xi-Liang, WU Zi-Nian, WANG Zhen, HU Jing, LI Xin-Le, MA Wen-Jing, ZHAO Jin-Bo. Plasticity of plant morphology and biomass allocation ofLeymuschinensisunder different phosphorus conditions. Acta Prataculturae Sinica, 2016, 25(12): 53-62.

