籽粒苋与青贮玉米混贮品质及微生物特性研究
陶雅,李峰,高凤芹,徐春城,孙启忠*
(1.中国农业科学院草原研究所,内蒙古 呼和浩特 010010;2.中国农业大学工学院,北京 100083)
籽粒苋与青贮玉米混贮品质及微生物特性研究
陶雅1,2,李峰1,高凤芹1,徐春城2,孙启忠1*
(1.中国农业科学院草原研究所,内蒙古 呼和浩特 010010;2.中国农业大学工学院,北京 100083)
以籽粒苋和全株玉米为原料,按不同比例10∶0(T1)、7∶3(T2)、5∶5(T3)、3∶7(T4)、0∶10(T5)混合青贮, 60 d后,检测青贮材料的发酵品质以及青贮前、后营养成分、微生物种类、数量变化,并分析乳酸菌多样性,以明确添加玉米对改善籽粒苋青贮发酵品质和微生物特性的作用,为籽粒苋青贮饲料的开发利用提供有效途径。结果表明,籽粒苋单独青贮品质不佳,通过添加玉米可显著降低青贮材料pH和氨态氮/总氮的值,提高干物质和总有机酸含量,当玉米添加比例超过50%时,青贮品质良好。在青贮发酵乳酸菌群演替过程中优势菌群的种类和数量决定青贮饲料的乳酸/乙酸,是影响发酵品质的主要因素之一。乳酸球菌中的肠球菌、乳球菌和类肠膜明串珠菌产酸能力强,是青贮发酵的启动菌株,乳杆菌则是青贮稳定期的主要菌群。
籽粒苋;玉米;青贮品质;微生物特性
籽粒苋(Amaranthushypochondriacus)又名千穗谷,为一年生草本植物,起源于中美洲和东南亚的热带和亚热带地区,中国也是籽粒苋的原产地之一。其适应性强、种植范围广,在我国主要栽培于云南、四川、江西、黑龙江、内蒙古、河北等省(自治区),面积达20多万hm2[1],是一种粮饲兼用型的牧草。籽粒苋产量高、抗病力强、适口性好、营养价值高[2-3]、分枝再生能力强,适于多次刈割,且由于富含蛋白质和氨基酸,茎叶和籽实中粗蛋白质含量分别为17.7%~27.1%和30%以上[4],可视为一种优质的蛋白饲料资源,具有良好的开发应用前景。
籽粒苋可以青饲,也可调制干草或制作成青贮饲料,通过青贮加工,能够改善籽粒苋的营养成分和适口性,提高消化吸收率,延长保存期,缓解饲草季节性短缺的问题。目前,籽粒苋青贮的系统研究报道较少,仅限于一些基础性的试验研究[5-7],籽粒苋蛋白含量高,难以单独青贮,通过混合青贮改善其青贮品质研究也鲜有报道。玉米(Zeamays)是最为常见的青贮原料,含糖量高,青贮成功率及青贮品质较高[8],因此探讨添加玉米对改善籽粒苋青贮品质的影响,对籽粒苋资源的开发利用具有十分重要的意义。
本试验旨在研究籽粒苋与全株玉米按不同比例混贮的效果以及青贮前后微生物特性及乳酸菌多样性,为籽粒苋青贮饲料的开发利用提供参考。
1 材料与方法
1.1 试验地概况
试验地位于内蒙古鄂尔多斯市达拉特旗树林召镇,中国农业科学院草原研究所鄂尔多斯沙地改良试验站(N 40°19′、E 109°59′、海拔1030~1060 m),属中温带大陆性季风气候,干旱,多风沙,年均气温6.5 ℃,最低气温-32.3 ℃,最高气温38.3 ℃,无霜期156 d,年降水量240~360 mm,全年蒸发量2130.2 mm。试验地土壤为沙壤土,有灌溉条件。
1.2 试验材料
青贮原料收获于2013年8月28日,试验所用材料为先玉696全株玉米(播种期2013年5月13日),于蜡熟期自试验田取样。籽粒苋采自试验地边缘,于结实期取样,青贮原料营养成分见表1。
表1 籽粒苋与玉米青贮原料营养成分
Table 1 Nutrition content compositions ofA.hypochondriacusand corn

青贮原料Ensilagematerials干物质Drymatter(DM,%)粗蛋白Crudeprotein(CP,%DM)可溶性碳水化合物Watersolublecarbohydrate(WSC,%DM)酸性洗涤纤维Aciddetergentfiber(ADF,%DM)中性洗涤纤维Neutraldetergentfiber(NDF,%DM)籽粒苋A.hypochondriacus28.3915.443.6334.6856.18玉米Corn30.247.266.8125.0450.35
1.3 试验设计
采用单因素完全随机试验设计,共设5个处理,每个处理3个重复(表2)。
表2 试验设计
Table 2 Experimental design

处理TreatmentsT1T2T3T4T5籽粒苋∶玉米A.hypochondriacus∶Corn10∶07∶35∶53∶70∶10
1.4 青贮调制
将玉米和籽粒苋切短至2~3 cm,按试验设计的重量比充分混合均匀,装入聚乙烯袋,每袋约300 g,设3次重复,用真空包装机抽成真空并封口,室温条件下贮藏60 d后开封取样分析。
1.5 营养成分及青贮品质分析
称取20 g青贮样品,加入180 mL去离子水,充分搅拌至均匀,置于4 ℃冰箱,24 h后取出,依次用4层纱布和定性滤纸过滤,取浸提液,用于pH、有机酸和氨态氮的测定。用雷磁PHS-3C pH计测定pH[9];用高效液相色谱仪[SHIMADZU LC-10A 型;色谱柱:Shodex Rspak KC-811S-DVB gel Column(8 mm×300 mm);检测器:SPD-M10AVP;流动相:3 mmol/L高氯酸;流速:1 mL/min;进样量:5 μL;柱温:50 ℃;检测波长:210 nm]测定乳酸、乙酸、丙酸和丁酸的含量[10];采用苯酚-次氯酸钠比色法测定氨态氮含量[11]。
剩余青贮样品于60 ℃烘干48 h,测定初水分含量,将烘干样品粉碎并过1 mm筛备用。干物质测定采用常规烘箱烘干法[12];可溶性碳水化合物测定采用蒽酮-硫酸比色法[13];粗蛋白质测定采用凯氏定氮法(GB/T6432-94KDY-9820);中性洗涤纤维和酸性洗涤纤维测定采用范氏(Van Soest)法。
1.6 微生物菌群分析
采用稀释平板涂布法对各处理新鲜材料和青贮材料中微生物菌群进行计数,乳酸菌分离选用MRS培养基,大肠杆菌分离选用BLB培养基,好养细菌分离选用NA培养基,酵母菌和霉菌分离选用PDA培养基。称取5 g待测样品,放入装有45 mL无菌水的三角瓶内,置于摇床振荡30 min,将得到的溶液继续用无菌水稀释,并吸取10-1、10-3和10-5三个稀释度涂平板,置于37 ℃恒温培养箱内培养,其中MRS培养基上的菌落于厌氧环境下培养,48 h后对各平板上的菌落数进行计测。MRS、NA和PDA培养基购自广东环凯微生物科技有限公司,BLB培养基购自日水制药株式会社。
1.7 乳酸菌多样性分析
1.7.1 乳酸菌的分离与纯化 挑取MRS培养基上生长的典型菌落,在MRS平板上反复划线分离,直到获得该菌的纯培养。对获得的各菌株进行革兰氏染色[14]和过氧化氢酶试验[15]。凡是呈革兰氏阳性、过氧化氢酶阴性的菌株,均认为是疑似乳酸菌,保存备用。
1.7.2 乳酸菌的生理生化特征 在不同温度(10、15、40、45 ℃)、pH(3.0、3.5、4.0、4.5、5.0、7.5、8.0)和NaCl浓度(3.0%和6.5%)条件下生长试验参照Pang等[16]的方法进行。乳酸菌发酵葡萄糖产气试验参照凌代文等[15]的方法进行。
1.7.3 乳酸菌菌株的16S rDNA序列分析 乳酸菌DNA的提取按照天根细菌全基因组DNA 提取试剂盒说明进行。以提取菌株的DNA为模板,对菌株16S rDNA基因片段进行扩增,应用引物序列27f: 5′-AGAGTTTGATCCTGGCTCAG-3′和1492r:5′-AAGTCGTAACAAGGTAACC-3′,由上海桑尼生物科技有限公司提供。PCR反应体系(50 μL)为:2×Taq PCR MasterMix 25 μL,引物27f和1492r(10 μmol/L)各2 μL,模板2 μL,加ddH2O补足至50 μL。PCR扩增程序为:94 ℃预变性5 min;94 ℃,变性50 s;55 ℃,退火50 s;72 ℃,延伸2 min,30个循环后,72 ℃延伸10 min,4 ℃保存。PCR扩增产物在1.5%琼脂糖凝胶上电泳检测,PCR扩增片段约为1500 bp,将PCR产物送上海桑尼生物科技有限公司进行双向测序。
1.8 数据分析
采用SPSS 16.0软件进行统计分析,作单因素方差分析,并作Duncan多重比较。利用Blast检索系统在GenBank 数据库和EzTaxon 数据库中对测序获得的所有菌株序列信息进行比对,选择适当数量与目的基因序列同源性相对较高的标准菌株16S rDNA序列,与测定菌株的16S rDNA序列共同用MEGA5.1软件构建系统进化树。
2 结果与分析
2.1 添加玉米对改善籽粒苋青贮营养成分的效果
经60 d 青贮发酵后,籽粒苋单贮(T1)的DM和WSC显著低于玉米单贮(P<0.05),二者按不同比例混贮(T2、T3、T4)中,随着玉米添加量的提高,DM和WSC的含量显著升高(P<0.05),T2与T3组WSC含量差异不显著。籽粒苋单贮(T1)的CP和ADF含量显著高于玉米单贮(T5)(P<0.05),CP的含量随玉米在混贮中的比例增加而降低,其中T2组CP含量显著高于其他混贮处理组(P<0.05),ADF和NDF含量在各比例的混贮处理组中没有显著差异(表3)。
2.2 添加玉米对籽粒苋青贮发酵品质的影响
不同比例添加玉米对籽粒苋青贮发酵品质的影响见表4,T2、T3组乳酸含量显著高于其他处理组(P<0.05),T1组乳酸含量最低。籽粒苋单贮(T1)、玉米单贮(T5)以及T4组乙酸含量显著高于其他混贮处理组(P<0.05),而T2和T3组间乙酸含量无显著差异。添加玉米显著降低了籽粒苋青贮发酵后的pH 值(P<0.05),且随玉米添入量的增加,pH 值呈下降趋势。籽粒苋单贮(T1)中氨态氮/总氮显著高于其他处理组(P<0.05),为6.60%,随玉米在青贮中的比例增加,氨态氮占总氮的百分比显著降低(P<0.05)。除籽粒苋单贮(T1)中检测出少量丙酸外,其他处理组中均未检测到丙酸和丁酸。
表3 籽粒苋与玉米不同比例混贮营养成分
Table 3 Nutrition content compositions ofA.hypochondriacusand corn mixed silage in different proportions

处理Treatments干物质DM(%)粗蛋白CP(%DM)可溶性碳水化合物WSC(%DM)酸性洗涤纤维ADF(%DM)中性洗涤纤维NDF(%DM)T121.52±0.61e16.01±0.52a2.37±0.08d34.04±0.30a50.79±1.03abT225.61±0.40d12.36±0.39b3.91±0.09c29.58±0.78b51.86±0.48aT326.55±0.28c10.43±0.22c4.19±0.03c28.46±0.86b50.83±0.89abT427.46±0.08b9.81±0.41c5.11±0.02b28.88±0.11b50.80±0.52abT529.94±0.07a7.04±0.37d6.05±0.35a26.31±1.31c50.00±0.16b
注:同列不同字母表示差异显著(P<0.05)。下同。
Note: Means with different letters in the same column are significantly different(P<0.05). The same below.
表4 籽粒苋与玉米不同比例混贮发酵品质
Table 4 Fermentation quality ofA.hypochondriacusand corn mixed silage in different proportions

处理TreatmentspH乳酸Lacticacid(%DM)乙酸Acetic(%DM)丙酸Propionicacid(%DM)丁酸Butyricacid(%DM)氨态氮/总氮NH3-N/TN(%)T14.40±0.14a6.11±0.04c1.77±0.14a0.02±0.02-6.60±0.03aT24.11±0.01b7.68±0.00a1.17±0.13b--5.71±0.13bT33.96±0.02bc7.30±0.11a1.15±0.08b--5.91±0.04bcT43.93±0.01c6.74±0.33b1.74±0.06a--5.45±0.16cdT53.88±0.01c6.64±0.01b1.75±0.01a--5.48±0.06d
2.3 籽粒苋与玉米不同比例混贮可培养微生物计数
籽粒苋与玉米按不同比例混合,新鲜样品中可培养微生物种类和数量见图1,新鲜样品上附着的乳酸菌数量为2.10×105~1.05×107cfu/g FM,大肠杆菌的数量为7.00×106~5.10×107cfu/g FM,好氧细菌的数量为3.85×107~7.45×107cfu/g FM,酵母菌的数量为6.50×106~2.70×107cfu/g FM,霉菌的数量为0~2.00×104cfu/g FM。附着微生物中数量最多的是好氧细菌,其次是大肠杆菌和酵母菌,之后是乳酸菌,霉菌数量最少。玉米表面附着的微生物总数及乳酸菌数量均高于籽粒苋,随着玉米混入比例的增加,各处理样品中乳酸菌数量呈增长趋势。
经过青贮发酵后,乳酸菌数量达到4.40×107~2.90×109cfu/g FM,好氧细菌和酵母菌的数量变化较小,分别为1.13×106~2.2×109cfu/g FM和1.63×106~2.50×108cfu/g FM,大肠杆菌和霉菌在各处理中均未检出。青贮样品中乳酸菌、好氧细菌和酵母菌的数量较多,大肠杆菌和霉菌消失。籽粒苋经青贮发酵后,乳酸菌大量繁殖,由105cfu/g FM,上升到107cfu/g FM,玉米单贮和其他混贮处理中乳酸菌数量均为107cfu/g FM左右(图2)。
2.4 添加玉米对籽粒苋青贮中乳酸菌生物多样性的影响
2.4.1 乳酸菌的生理生化特征 从籽粒苋与玉米不同比例混合青贮新鲜样品中分离出乳酸菌6株,分别命名为YM1~YM6,从青贮样品中分离出乳酸菌10株,分别命名为YMS1~YMS10,各菌株生理生化特征见表5。所有菌株均表现为革兰氏阳性和过氧化氢酶阴性,其中菌株YMS1、YMS2、YMS3、YMS5、YMS8、YMS9、YMS10为杆菌,其余菌株为球菌。菌株YM1、YMS1、YMS2、YMS3、YMS5、YMS8、YMS9、YMS10发酵葡萄糖会产生CO2,为异型发酵乳酸菌,而YM2、YM3、YM4、YM5、YM6、YMS4、YMS6、YMS7为同型发酵乳酸菌。大部分菌株能够在10和40 ℃的环境条件下生长,菌株YM6、YMS2、YMS8、YMS10可以在温度为5 ℃的环境条件下正常生长,在45 ℃下,仅有菌株YM1不能生长。在含3.0% NaCl 的环境中,菌株YM1生长微弱,其他菌株均可正常生长,而在含6.5% NaCl 的环境中仅有YMS3和YMS10能够正常生长。多数菌株可在pH 值为5.0~8.0的范围内生长,但不能在pH值为3.0的环境中生长。

图1 籽粒苋与玉米按不同比例混合新鲜样品中微生物计数Fig.1 Microbiological analysis of fresh sample of A. hypochondriacus and corn mixed silage in different proportions

图2 籽粒苋与玉米按不同比例混贮样品中微生物计数Fig.2 Microbiological analysis of silage sample of A. hypochondriacus and corn mixed silage in different proportions
2.4.2 乳酸菌16S rDNA 序列分析以及系统发育树构建 将各菌株测序获得的16S rDNA 序列信息在 NCBI 数据库和EzTaxon数据库中进行 Blast相似性比对,结果见表6。所有序列与数据库中同源性最高序列的相似性均高于99.0%。
由系统发育树(图3)可以看出,16株乳酸菌隶属于Enterococcus、Lactococcus、Lactobacillus和Leuconostoc4个属。Enterococcus包括菌株YM2、YM5、YM6和YMS7,其中YM6与Enterococcusmundtii构成一个分支,相似度达99.79%;菌株YM2、YM5和YMS7与Enterococcuscasseliflavus的系统进化位置最接近,处于同一进化分支上,相似度均高于99.50%。菌株YM3、YM4、YMS4和YMS6隶属于Lactococcus,并共同与Lactococcuslactissubsp.lactis构成一个进化分支,相似度均在99.00%以上。16S rDNA 基因序列同源性比对显示,有7个菌株隶属于Lactobacillus,分属于4个种或亚种,其中YMS1和Lactobacillusrossiae构成一个分支,序列相似度为99.93%;YMS2、YMS8、YMS9与Lactobacillusbrevis处于同一进化分支上,相似度均在99.90%以上;YMS5和Lactobacilluspentosus构成一个分支,序列相似度达到100.00%;YMS3和YMS10与Lactobacillusplantarumsubsp.plantarum的系统进化位置最接近,相似度均达100.00%。Leuconostoc仅包含菌株YM1,与Leuconostocpseudomesenteroides处于同一进化分支上,相似度为99.93%。
经过青贮发酵过程,各处理乳酸菌在种类和数量上均产生了变化(表6、图3),新鲜样品上附着的基本都是乳酸球菌,包括Enterococcus、Lactococcus和Leuconostoc,而存在于青贮样品中的既有乳酸球菌,也有乳酸杆菌,在青贮材料中,T1组仅存在Lactobacillus的两个种,其中Lactobacillusplantarumsubsp.plantarum的数量多于Lactobacillusbrevis,为该组的优势种;T2组存在Enterococcus、Lactococcus和Lactobacillus,其中Enterococcuscasseliflavus和Lactobacillusbrevis在数量上占优势,是该组的优势种;Lactococcus和Lactobacillus均存在于T3组中,其中Lactobacilluspentosus为该组的优势种;T4和T5中仅存在Lactobacillus一个属的乳酸菌,综合可见在青贮样品中乳酸杆菌为优势种类。
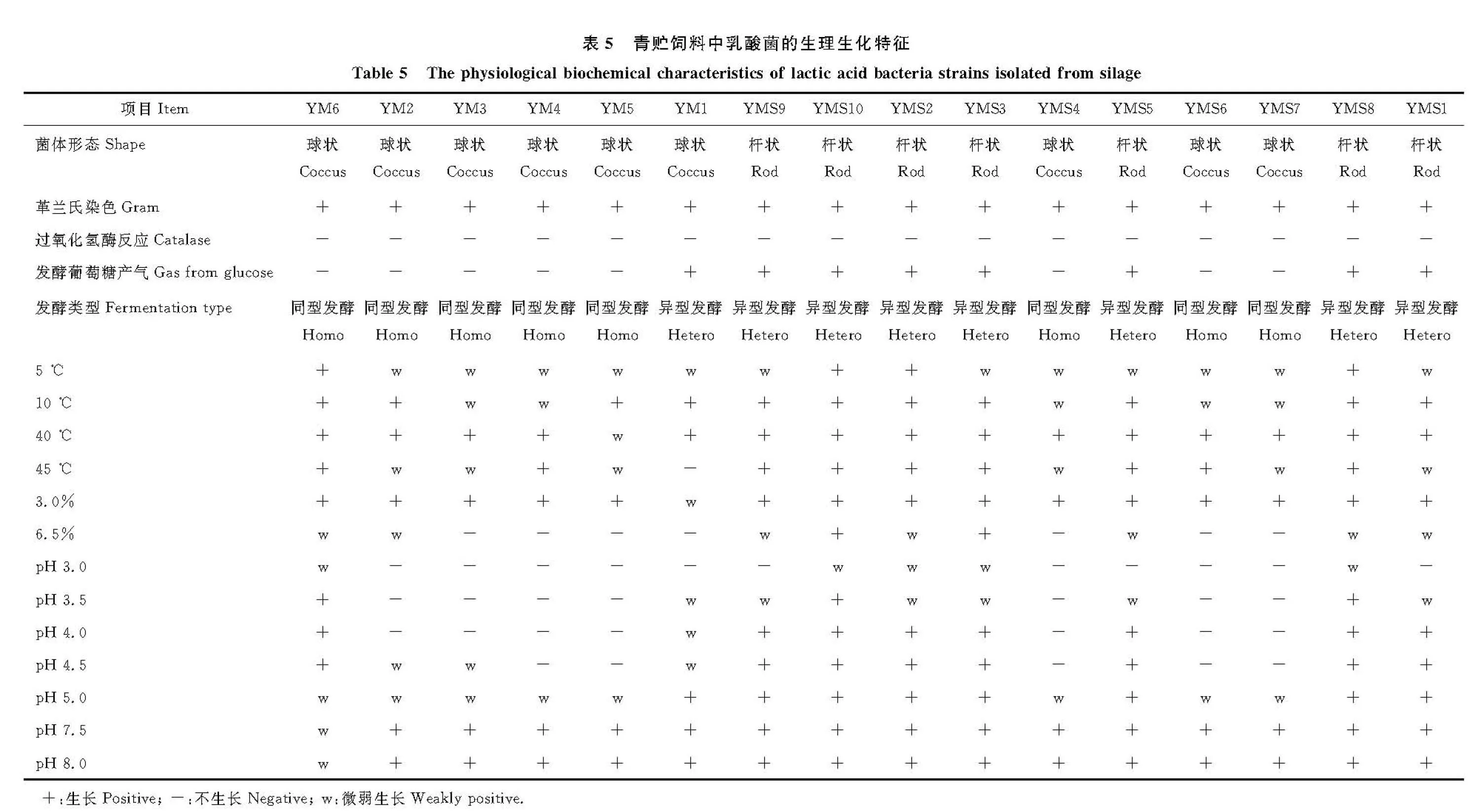
表6 乳酸菌株 16S rDNA 序列Blast比对结果
Table 6 Blast results of 16S rDNA sequences of lactic acid bacteria strains
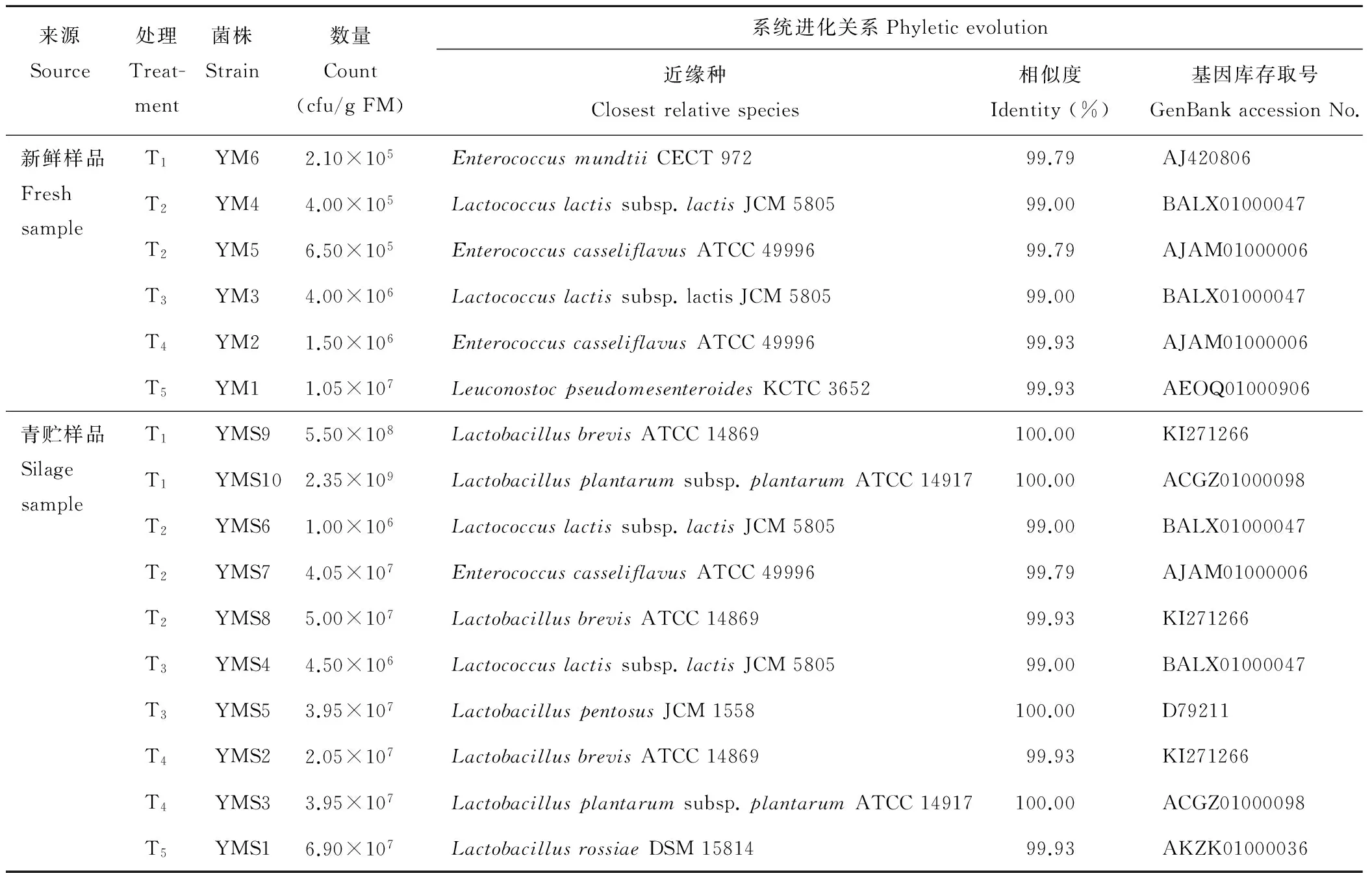
来源Source处理Treat-ment菌株Strain数量Count(cfu/gFM)系统进化关系Phyleticevolution近缘种Closestrelativespecies相似度Identity(%)基因库存取号GenBankaccessionNo.新鲜样品FreshsampleT1YM62.10×105EnterococcusmundtiiCECT97299.79AJ420806T2YM44.00×105Lactococcuslactissubsp.lactisJCM580599.00BALX01000047T2YM56.50×105EnterococcuscasseliflavusATCC4999699.79AJAM01000006T3YM34.00×106Lactococcuslactissubsp.lactisJCM580599.00BALX01000047T4YM21.50×106EnterococcuscasseliflavusATCC4999699.93AJAM01000006T5YM11.05×107LeuconostocpseudomesenteroidesKCTC365299.93AEOQ01000906青贮样品SilagesampleT1YMS95.50×108LactobacillusbrevisATCC14869100.00KI271266T1YMS102.35×109Lactobacillusplantarumsubsp.plantarumATCC14917100.00ACGZ01000098T2YMS61.00×106Lactococcuslactissubsp.lactisJCM580599.00BALX01000047T2YMS74.05×107EnterococcuscasseliflavusATCC4999699.79AJAM01000006T2YMS85.00×107LactobacillusbrevisATCC1486999.93KI271266T3YMS44.50×106Lactococcuslactissubsp.lactisJCM580599.00BALX01000047T3YMS53.95×107LactobacilluspentosusJCM1558100.00D79211T4YMS22.05×107LactobacillusbrevisATCC1486999.93KI271266T4YMS33.95×107Lactobacillusplantarumsubsp.plantarumATCC14917100.00ACGZ01000098T5YMS16.90×107LactobacillusrossiaeDSM1581499.93AKZK01000036
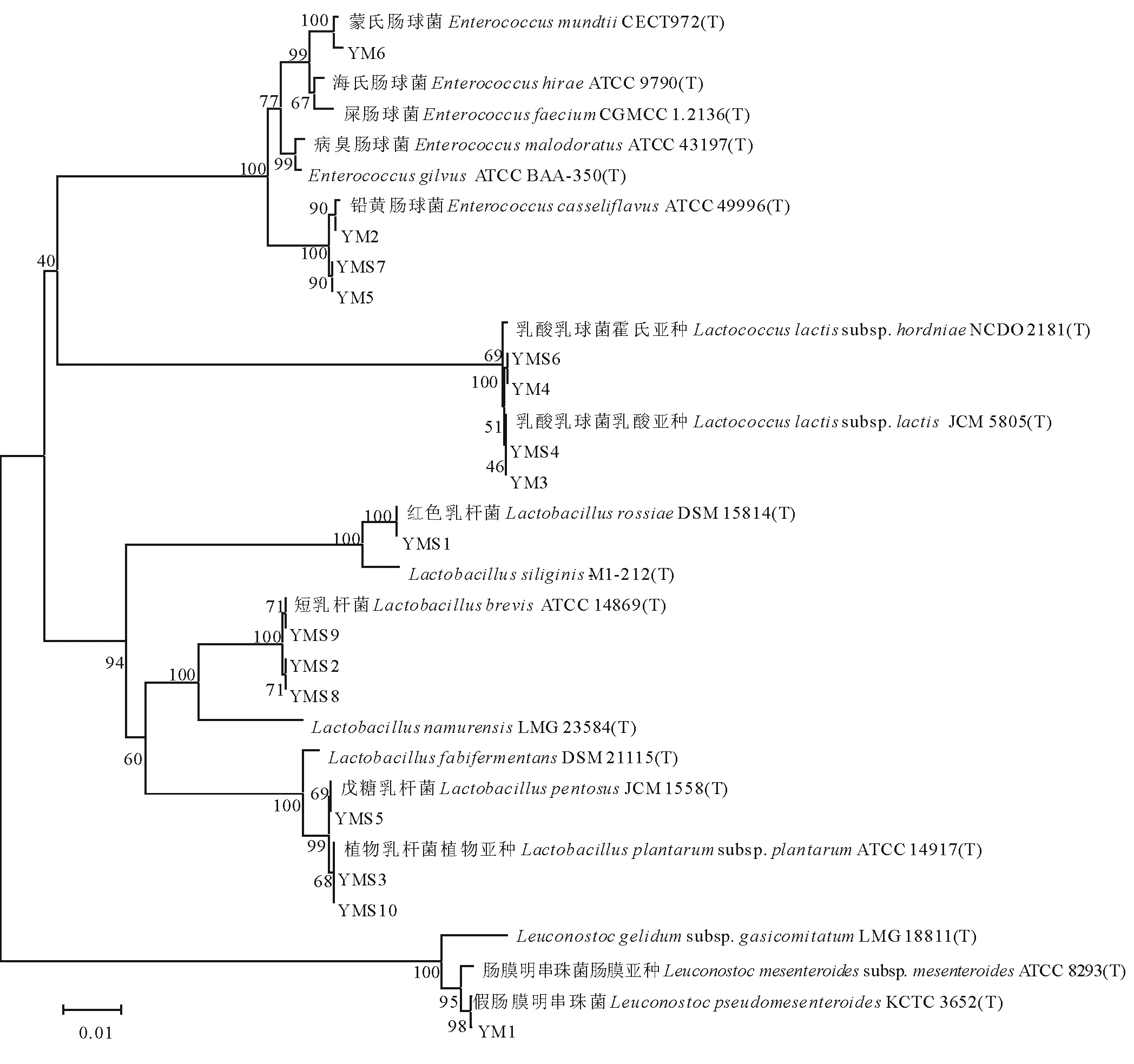
图3 基于 16S rDNA 序列分析结果的系统发育树Fig.3 Phylogenetic tree based on the 16S rDNA sequences
3 讨论
青贮成功与否受原料水分、糖分、附着微生物以及制作时压实程度等因素的影响[17],高水分且蛋白质含量高的饲草青贮成功率较低,一般需通过混贮、低水分青贮或添加剂改善青贮品质[18-20]。本试验以不同比例籽粒苋和全株玉米进行青贮调制,与玉米混贮后青贮体系的pH和氨态氮/总氮含量显著降低,且随着玉米添加量增加,pH和氨态氮/总氮含量逐渐下降,当玉米添加量大于50%时,青贮体系pH 值降低到4.0以下,发酵品质优良。这是由于籽粒苋WSC含量低,水分含量高,发酵底物缺乏,不利于乳酸菌生长繁殖,添加玉米可有效提高WSC的含量,促进乳酸菌发酵,快速形成理想的酸性环境,有效抑制有害微生物的活动,减少不良发酵产物的形成。
庄益芬等[21-22]分别将象草和水葫芦与玉米混贮,通过提高WSC含量使青贮品质得到有效提高,其中乳酸含量随着混贮中玉米比例的增加而显著增加,但乙酸含量则显著减少。乳酸和乙酸都是乳酸菌的发酵产物,同型发酵乳酸菌经糖代谢产生单一乳酸,异型发酵乳酸菌除产生乳酸外还会产生部分乙酸,由于乳酸除了可作为乳酸发酵的产物外,当氧气进入发酵体系,它也可以被酵母菌和霉菌所利用,促进该菌的繁殖引起霉变或二次发酵[23],但是如果体系中存在一定的乙酸,通过维持体系的酸性环境,可以抑制二次发酵,防止青贮饲料腐败变质[24]。本试验中籽粒苋单贮(T1组)乳酸含量显著低于其他处理组,但是T2和T3组中的乳酸含量却显著高于T4和T5组,且T2和T3组中的乙酸含量显著低于T1、T4和T5组,这是因为T1、T4和T5组青贮材料中仅检测到Lactobacillus一个属的乳酸菌,这些乳酸菌均属于异型发酵乳酸菌,发酵产物除了形成乳酸外还会形成乙酸,Li等[25]研究发现全株玉米青贮,接种L.buchneri后乳酸含量降低,乙酸含量升高。T2和T3组中除检测到Lactobacillus外还检测到了Enterococcus和Lactococcus的3个种,这3种乳酸菌属于同型发酵乳酸菌,碳源发酵产物只有乳酸,由此可见青贮体系中的乳酸和乙酸含量不仅与WSC的含量密切相关,也与青贮发酵过程乳酸菌菌群演替中优势菌群的种类和数量密不可分。
青贮发酵过程是各种微生物共同作用的结果,在整个青贮过程中微生物的种类和数量发生动态变化[26]。通常青贮原料中大肠杆菌、好氧细菌、酵母菌、霉菌等好氧性微生物数量较多,经青贮发酵,随着厌氧和酸性环境的形成,好养的和不耐酸的微生物逐渐减少,乳酸菌占优势。蒋慧等[27]研究骆驼刺与苜蓿混贮前后乳酸菌和酵母菌的变化,发现与青贮原料相比,青贮后乳酸菌数量升高,酵母菌数量降低,与苜蓿单贮相比混贮处理乳酸菌含量高,酵母菌含量低。本试验中,经青贮发酵乳酸菌数量增加,大肠杆菌和霉菌消失,而酵母菌数量变化较小。这可能是因为酵母菌在厌氧条件下好氧种类逐渐被厌氧种类所取代,酵母菌能通过发酵糖获取能量[28],且酵母菌耐酸性也较强[29],因此厌氧和酸性环境并没有抑制其生长。玉米上附着的乳酸菌数量高于籽粒苋,但是籽粒苋单贮后乳酸菌数量却高于玉米单贮及混贮处理,这可能是由于乳酸菌本身也会受到酸性条件的抑制,当乳酸菌发酵时乳酸浓度不断积累,环境中pH降低到一定范围,对乳酸菌造成酸胁迫,乳酸菌数量和活性都会降低[30],籽粒苋单贮pH没有降到理想范围,乳酸菌生活力高于各混贮处理组。
从籽粒苋与玉米不同比例混合青贮新鲜样品中分离出乳酸菌6株,鉴定为Leuconostocpseudomesenteroides、Enterococcuscasseliflavus、Lactococcuslactissubsp.lactis、Lactococcuslactissubsp.hordniae和Enterococcusmundtii5个种。从青贮样品中分离出乳酸菌10株,鉴定为Lactobacillusrossiae、Lactobacillusplantarumsubsp.plantarum、Lactobacillusbrevis、Lactococcuslactissubsp.lactis、Lactobacilluspentosus、Lactococcuslactissubsp.hordniae、Enterococcuscasseliflavus7个种。由各处理乳酸菌种类及数量可以看出,在青贮新鲜样品中乳酸球菌为优势种类,经过青贮发酵后,乳酸杆菌演替为优势菌群,且青贮前是同型发酵乳酸菌占优势,而到青贮发酵后期,以异型发酵乳酸菌为主。在青贮前期产酸能力较强的乳酸球菌包括肠球菌、片球菌、乳球菌、明串珠菌等往往作为发酵启动菌株[31],在青贮的发酵期及稳定期,乳杆菌逐渐占据优势, 成为最后发酵的主要菌群[32]。詹发强等[33]研究玉米青贮乳酸菌动态变化,发现乳杆菌属和片球菌属在发酵前期一直存在,都是青贮玉米发酵的启动菌, 但发酵后期乳杆菌属成为主要菌群,本试验结果与此基本一致。
4 结论
青贮发酵过程是各种微生物共同作用的结果,乳酸菌群演替过程中优势菌群的种类和数量决定了青贮饲料的乳酸/乙酸,是影响发酵品质的主要因素之一。乳酸球菌中的肠球菌、乳球菌和类肠膜明串珠菌产酸能力强,为青贮发酵的启动菌株,乳杆菌则为青贮稳定期的主要菌群。基于目前研究,籽粒苋单独青贮品质不佳,当与青贮玉米混贮,且青贮玉米比例不低于50%时,效果良好,可作为籽粒苋青贮利用的有效途径。
[1] Yue S X, Sun H L. Research and Development ofAmaranthushypochondriacusin China[M]. Beijing: China Agriculture Press, 1993: 27-44.
[2] Wang W Z, Zhang L H, Li X Q,etal. Feed value ofAmaranthushypochondriacus. China Feed, 2000, 21: 32.
[3] Zhang F F, Jiang Y P, Cao Y J,etal. Feed value and application on poultry ofAmaranthushypochondriacus. Poultry Science, 2014, (3): 6-8.
[4] Zhou C C. Cultivation, ensilage and feeding method ofAmaranthushypochondriacus. Cultivation Technical Advisor, 2014, (4): 49-50.
[5] Wang B P, Yu Z, Xu Q F,etal. Effects of different additives on the quality ofAmaranthushypochondriacussilage. Animal Husbandry & Veterinary Medicine, 2011, (6): 45-47.
[6] Wang S X, Duan X H, Yin S F,etal. The ground silage experiment ofAmaranthushypochondriacus. Animals Breeding and Feed, 2010, (4): 52-53.
[7] Shi B K. The silage quality of singleAmaranthushypochondriacusand mixed with corn. Contemporary Animal Husbandry, 2007, (8): 42-43.
[8] Feng P. Effect of Varieties and Cultivation Techniques on Maize Yield and Silage Quality[D]. Beijing: Chinese Academy of Agriculture Science, 2011.
[9] Han K J, Collins M, Vanzant E S,etal. Bale density and moisture effects on alfalfa round bale silage.Crop Science, 2004, 44(3): 914-919.
[10] China Forge Research System. Management Technical Manual of Forge Standardized Production[M]. Beijing: Science Press, 2014: 67-73.
[11] Broderica G A, Kang J H. Auto mated simultaneous determination of ammonia and amino acids in ruminal fluid andinvitromedia. Dairy Science, 1980, 33: 64-75.
[12] Zhang L Y. Analysis and Quality Test Technology of Feed[M]. Beijing: China Agriculture University Press, 2007: 53-56, 67-78.
[13] McDonald D, Henderson A R. Determination of water-soluble carbohydrates in grass. Journal of the Science of Food and Agriculture, 1964, 15: 395-398.
[14] Du P. The Experimental Techniques in Dairy Microbiology[M]. Beijing: China Light Industry Press, 2008.
[15] Ling D W, Dong X Z. The Experimental Techniques in Identification of Lactic Acid Bacteria[M]. Beijing: China Light Industry Press, 1999.
[16] Pang H L, Zhang M, Qin G Y,etal. Identification of lactic acid bacteria isolated from corn stovers. Animal Science Journal, 2011, 82: 642-653.
[17] Yu Z, Sun Q Z. Technology of Forge Grass Silage[M]. Beijing: China Agriculture University Press, 2011.
[18] Wang L, Sun Q Z, Zhang H J. A study on quality of mixed silage of alfalfa and corn. Acta Prataculturae Sinica, 2011, 20(4): 202-209.
[19] Liu H, Bu D P, Lv Z W,etal. Effects of wilting and additives on fermentation quality of alfalfa (Medicagosativa) silage. Acta Prataculturae Sinica, 2015, 24(5): 126-133.
[20] Shi H L, Liu H, Ma C H. Effects of drying time on silage quality ofMedicagosativa. Pratacultural Science, 2013, (8): 1278-1283.
[21] Zhuang Y F, Liao H Z, Chen X Z,etal. A study on efficiency of napier grass and maize straw mixed silages. Pratacultural Science, 2012, (6): 1002-1006.
[22] Zhuang Y F, Zhang W C, Chen X Z,etal. Effects of mixed ratio on efficiency of mixed silage of water hyacinth and corn straw. Chinese Agricultural Science Bulletin, 2010, 18: 32-34.
[23] McDonald P, Henderson A, Heron S. The Biochemistry of Silage[M]. 2nd.Welton, Lincoln, UK: Chalcombe Publications, 1991.
[24] Moon N J. Inhibition of the growth of acid tolerant yeasts by acetate, lactate and propionate and their synergistic mixtures. Journal of Applied Bacteriology, 1983, 55(3): 453-460.
[25] Li Y, Nishino N. Effects of inoculation ofLactobacillusrhamnosusandLactobacillusbuchnerion fermentation, aerobic stability and microbial communities in whole crop corn silage. Grassland Science, 2011, 57(4): 184-191.
[26] Zhang H J. The Dynamic Changes of Microbial Flora in Forage Silage and Identification and Screening of Lactic Acid Bacteria Species Isolated from Forage Silage[D]. Beijing: Chinese Academy of Agriculture Science, 2011.
[27] Jiang H, Fang L, Zhou X L,etal. Improve alfalfa silage quality by addingAlhagisparsifoliashap in initial bloom stage. Transactions of the Chinese Society of Agricultural Engineering, 2014, 17: 328-335.
[28] Pahlow G, Muck R E, Driehuis F,etal. Microbiology of Ensiling[M]//Buxton D R, Muck R E, Harrison J H. Silage science and technology. Madison, Wisconsin, USA: American Society of Agronomy, 2003: 31-93.
[29] Davidson P M, Taylor T M. Chemical Preservatives and Natural Antimicrobial Compounds[M]//Doyle M P, Beuchat L R. Food microbiology: fundamentals and frontiers. 3rd. Washington, D.C.: ASM Press, 2007: 713-746.
[30] Pieterse B. Transcriptome Analysis of the Lactic Acid and NaCl-stress Response ofLactobacillusplantarum(Thesis)[D]. Nederland: Wageningen Universit, 2006: 1-154.
[31] Zhang D W. Isolation and Screening of Lactic Acid Bacteria and the Application in Maize Straw Silage[D]. Zhengzhou: Zhengzhou University, 2007.
[32] College of Animal Science, Zhejiang Agricultural University. Silage quality evaluation standard (trial implementation). China Feed, 1996, 21: 5-7.
[33] Zhan F Q, Bao H F, Cui W D,etal. Dynamic changes of lactic acid bacteria during a 15-day ensilage of corn. Microbiology China, 2010, (6): 834-838.
[1] 岳绍先, 孙鸿良. 籽粒苋在中国的研究与开发[M]. 北京:中国农业出版社, 1993: 27-44.
[2] 王文正, 张丽华, 黎秀卿, 等. 籽粒苋的饲用价值. 中国饲料, 2000, 21: 32.
[3] 张芬芬, 蒋银屏, 曹玉娟, 等. 籽粒苋的饲用价值及其在家禽中的应用. 家禽科学, 2014, (3): 6-8.
[4] 周传臣. 籽粒苋的种植、青贮及饲喂的方法. 养殖技术顾问, 2014, (4): 49-50.
[5] 王保平, 玉柱, 许庆方, 等. 不同添加剂对籽粒苋青贮品质的影响. 畜牧与兽医, 2011, (6): 45-47.
[6] 王世雄, 段新慧, 尹尚芬, 等. 籽粒苋地面青贮试验. 养殖与饲料, 2010, (4): 52-53.
[7] 石帮科. 籽粒苋单独青贮和与青玉米秸混贮效果. 当代畜牧, 2007, (8): 42-43.
[8] 冯鹏. 品种与栽培技术对玉米产量及青贮质量的影响[D]. 北京: 中国农业科学院, 2011.
[10] 国家牧草产业技术体系. 牧草标准化生产管理技术规范[M]. 北京: 科学出版社, 2014: 67-73.
[12] 张丽英. 饲料分析及饲料质量检测技术[M]. 北京: 中国农业大学出版社, 2007: 53-56, 67-78.
[14] 杜鹏. 乳品微生物学实验技术[M]. 北京: 中国轻工业出版社, 2008.
[15] 凌代文, 东秀珠. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999.
[17] 玉柱, 孙启忠. 饲草青贮技术[M]. 北京: 中国农业大学出版社, 2011.
[18] 王林, 孙启忠, 张慧杰. 苜蓿与玉米混贮质量研究. 草业学报, 2011, 20(4): 202-209.
[19] 刘辉, 卜登攀, 吕中旺, 等. 凋萎和不同添加剂对紫花苜蓿青贮品质的影响. 草业学报, 2015, 24(5): 126-133.
[20] 史卉玲, 刘慧, 马春晖. 晾晒时间对初花期紫花苜蓿青贮发酵品质的影响. 草业科学, 2013, (8): 1278-1283.
[21] 庄益芬, 廖惠珍, 陈鑫珠, 等. 象草与玉米秸秆混合青贮效果的研究. 草业科学, 2012, (6): 1002-1006.
[22] 庄益芬, 张文昌, 陈鑫珠, 等. 混合比例对水葫芦与玉米秸秆混合青贮效果的影响. 中国农学通报, 2010, 18: 32-34.
[26] 张慧杰. 饲草青贮微生物菌群动态变化与乳酸菌的鉴定筛选[D]. 北京: 中国农业科学院, 2011.
[27] 蒋慧, 方雷, 周小玲, 等. 添加初花期骆驼刺改善苜蓿青贮品质. 农业工程学报, 2014, 17: 328-335.
[31] 张大伟. 乳酸菌的分离鉴定及其在玉米秸秆青贮中的应用[D]. 郑州: 郑州大学, 2007.
[32] 浙江农业大学动物科学学院. 青贮饲料质量评定标准(试行). 中国饲料, 1996, 21: 5-7.
[33] 詹发强, 包慧芳, 崔卫东, 等. 玉米青贮过程中乳酸菌动态变化. 微生物学通报, 2010, (6): 834-838.
Fermentation quality and microbial characteristics ofAmaranthushypochondriacus-corn mixed silage
TAO Ya1,2, LI Feng1, GAO Feng-Qin1, XU Chun-Cheng2, SUN Qi-Zhong1*
1.GrasslandResearchInstitute,ChineseAcademyofAgriculturalScience,Huhhot010010,China; 2.CollegeofEngineering,ChinaAgriculturalUniversity,Beijing100083,China
The fermentation quality and microbial characteristics of mixed silage made fromAmaranthushypochondriacusand corn were evaluated in this study. The two components (A.hypochondriacusand corn) were mixed at five different ratios: 10∶0 (T1), 7∶3 (T2), 5∶5 (T3), 3∶7 (T4), and 0∶10 (T5). After 60 days of fermentation, the silage quality was evaluated, and its nutritional composition, microbial community structure, quantity of lactic acid bacteria, and proportion of fresh material and silage were analyzed. The overall aim was to find a practical use forA.hypochondriacusmaterials. The results showed that the fermentation quality ofA.hypochondriacuswas poor. With the addition of corn, the pH value and NH3-N to total nitrogen ratio decreased significantly, and the dry matter (DM) and total acid content increased. When the proportion of corn in the mixture exceeded 50%, the fermentation quality was significantly improved. The lactic acid to acetic acid ratio, which is one of the main factors affecting fermentation quality, was affected by the succession of dominant lactic acid bacteria species and their quantities in silage.Enterococcus,Lactococcus, andLeuconostocspecies, which have a strong ability to produce acids, were the main species at the start of fermentation, andLactobacilluswas the main group of lactic acid bacteria in the stable phase.
Amaranthushypochondriacus; corn; fermentation quality; microbial characteristics
10.11686/cyxb2016187
http://cyxb.lzu.edu.cn
2016-05-09;改回日期:2016-08-04
中央公益性行业(农业)科研专项经费项目(201203042)和中国农业科学院创新工程(CAAS-ASTIP-IGR 2015-02)资助。
陶雅(1982-),女,内蒙古呼和浩特人,助理研究员,硕士。E-mail: taoya2001@126.com*通信作者Corresponding author. E-mail: sunqz@126.com
陶雅, 李峰, 高凤芹, 徐春城, 孙启忠. 籽粒苋与青贮玉米混贮品质及微生物特性研究. 草业学报, 2016, 25(12): 119-129.
TAO Ya, LI Feng, GAO Feng-Qin, XU Chun-Cheng, SUN Qi-Zhong. Fermentation quality and microbial characteristics ofAmaranthushypochondriacus-corn mixed silage. Acta Prataculturae Sinica, 2016, 25(12): 119-129.

