外源一氧化氮(NO)对低温胁迫下南瓜幼苗氧化损伤的保护效应
吴旭红,吕成敏,冯晶旻
(1.齐齐哈尔大学生命科学与农林学院,黑龙江 齐齐哈尔 161006;2.齐齐哈尔市卫生监督所,黑龙江 齐齐哈尔 161005)
外源一氧化氮(NO)对低温胁迫下南瓜幼苗氧化损伤的保护效应
吴旭红1*,吕成敏1,冯晶旻2
(1.齐齐哈尔大学生命科学与农林学院,黑龙江 齐齐哈尔 161006;2.齐齐哈尔市卫生监督所,黑龙江 齐齐哈尔 161005)
探讨外源 NO 供体硝普钠(SNP)对冷害胁迫下南瓜生长和氧化损伤的内在机制。以南瓜银辉2号和青栗为材料,通过室内人工模拟低温逆境的方法,研究 SNP(100 μmol/L)对冷害胁迫下南瓜幼苗生长、叶绿体色素含量、有机渗透调节物质含量及活性氧代谢的影响。结果表明,冷害导致南瓜幼苗活性氧积累增加,膜质过氧化加剧,光合色素含量下降,渗透调节能力降低,从而显著抑制南瓜幼苗的生长;正常生长条件下, SNP显著提高了超氧化物歧化酶(SOD)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)活性,显著增加幼苗地上和地下部干重及谷胱甘肽(GSH)、过氧化氢(H2O2)、类胡萝卜素和氨基酸总量;8 ℃/5 ℃(昼/夜)的低温胁迫下,叶面喷施外源100 μmol/L NO供体硝普钠(SNP),促进了植株生长和干物质积累,显著提高了叶片SOD、POD、APX 和GR的活性以及Pro和可溶性糖含量,减少了H2O2和膜脂过氧化产物丙二醛(MDA)的积累;外源NO明显提高了南瓜叶片叶绿素、类胡萝卜素含量、抗坏血酸(ASA)、GSH和可溶性蛋白及氨基酸总量。低温胁迫下,外源NO通过促进抗氧化酶活性、抗氧化剂及有机渗透调节物质含量的提高,降低H2O2和MDA的积累,保护了细胞膜结构的稳定性,维持了冷害下南瓜幼苗碳氮代谢的正常进行,增强了南瓜的抗冷性。试验条件下,NO对银辉2号的促进作用大于青栗。
南瓜;冷害胁迫;一氧化氮;光合色素;活性氧代谢;有机渗透调节物质
一氧化氮(nitric oxide,NO)作为植物内源性兼具生理效应和生物毒性的氧化还原信号分子,参与了从种子萌发、幼苗生长到成熟及细胞程序性死亡(programmed cell death,PCD)等整个生命过程中多种生理过程的调节[1]。南瓜(Cucurbitamoschata)起源于中南美洲的热带地区,属典型的冷敏感植物,在东北、西北、华北的蔬菜生产过程中,由于早春的低温冷害及气温回暖后的倒春寒都对南瓜苗期发育产生影响,进而严重影响南瓜产量和品质。提高南瓜苗期耐冷性是三北地区针对气候特点减害、避害的有效途径。因此,研究低温胁迫与南瓜幼苗耐冷性的关系,探索提高南瓜苗期抗御低温冷害的能力具有重要意义。低温冷害会造成膜系统损伤、细胞脱水、光合机构破坏、酶活下降、代谢紊乱、生长受阻,严重时致植株死亡,是危害农业生产的主要自然灾害之一[2]。已有研究表明,由于NO可以激活鸟苷酸环化酶(cGC),升高体内cGMP水平,因此,在细胞内信号转导途径中,不仅对植物的形态建成、器官发育及成熟和衰老等过程起调控作用[3-4],而且作为胞内和胞间信号分子,介导了基因表达、抗病、对环境胁迫的逆境响应等多种生理过程[5-6]。杨美森等[2]以冷敏感性不同的棉苗为材料,发现外源NO能显著提高棉花叶片保护酶活性及抗氧化剂含量,维持较高的PSⅡ光化学活性,降低MDA和H2O2含量,增强棉苗对冷害胁迫的适应性。吴锦程等[7]报道了外源NO通过上调保护酶活性,提高渗透调节物质含量,提高了枇杷幼果的抗寒性。此外,通过促进拟南芥(Arabidopsisthaliana)NIA1基因的表达,诱导内源性NO合成,增加Pro积累,增强植物抗冻性[8]及激活盐胁迫下苜蓿种子的抗氧化系统,减轻盐胁迫对蒺藜苜蓿(Medicagotruncatula)种子的伤害,促进种子萌发的效应也已被证实[9]。NO对逆境下禾谷类、牧草及部分蔬菜如番茄、黄瓜、辣椒的生理生化响应的研究较多,而目前NO对冷胁迫下冷敏感的作物——南瓜幼苗生长发育、生理代谢的研究较少。本试验针对黑龙江省乃至东北地区南瓜生产中面临的苗期低温冷害,以两种耐冷性不同的南瓜幼苗为试验材料,以内源性植物生长调节剂“NO”为调控手段,研究外源施加后对冷胁迫下南瓜幼苗生长、抗氧化系统及光合等生理特性的影响,探讨外源NO对提高南瓜抗冷性的生理生化机制,为在高寒地区有效防御南瓜发育早期的低温冷害提供理论依据和技术支撑。
1 材料与方法
1.1 材料和试剂
以南瓜品种“银辉2号” (C.moschataYinhui 2)和“青栗” (C.maximaQingli)为试材,由齐齐哈尔市种子经销处提供。
试验所用NO供体为硝普钠[Na2Fe(CN)5](sodium nitroprusside,SNP),购自Sigma公司,纯度为98.5%。先配制成100 mmol/L 母液,4 ℃保存,用时按所需浓度稀释。
1.2 试验设计
1.2.1 试材培育 试验于2014年3-7月在齐齐哈尔大学生物化学实验室进行。精选饱满均匀一致的南瓜种子,先经0.1%的KMnO4消毒,25 ℃下浸泡8 h后进行催芽。待露白后,将发芽一致的种子播于细砂经清水浸泡1 h、高温灭菌(130 ℃,3 h)、定量称重的花盆中(8粒/盆),维持人工气候培养箱中环境为(25 ℃/20 ℃±2 ℃,光周期14 h/10 h循环,相对湿度50%~60%),出苗后每隔2 d浇灌1/2 Hoagland营养液300 mL。待幼苗3片真叶全展时,从人工气候箱中取出转为自然培养,2周后,每盆保留生长整齐一致的两品种幼苗5株,各20盆。
1.2.2 试验处理 当幼苗长至4~5片真叶时,将其随机分为4组:其中2组喷施清水,2组喷施SNP(NO供体)。分别于每天8:30和14:30叶面喷施2次,每次喷施量为10 mL/盆。以叶片正反面都无溶液滴下为宜,喷后以保鲜膜覆盖盆上部2 h,共处理7 d。每处理20株苗,每次取样5株,3次重复。
试验共设4个处理:分别为处理T1(对照):正常生长条件(23 ℃/18 ℃)+叶喷清水;处理T2:正常生长条件(23 ℃/18 ℃)+叶喷100 μmol/L的SNP;处理T3:冷害(8 ℃/5 ℃)+叶喷清水;处理T4:冷害(8 ℃/5 ℃)+叶喷100 μmol/L的SNP。温度是根据黑龙江省西北部南瓜苗期气候特点以及前期试验设定。SNP浓度是在预实验效果的基础上筛选出的最佳浓度。于处理7 d后取3片真叶进行ROS生成、保护酶活性、抗氧化物质含量、渗透调节物质代谢及叶绿素含量等各项生理生化指标的测定。最后5株苗做生长量和干物质积累测定。
1.3 测定项目和方法
1.3.1 幼苗生长及鲜重、干重的测定 轻取幼苗,用卷尺量取茎基部到生长点的距离为株高(精确到1 mm)。之后将地上、地下部分分开,迅速用蒸馏水洗净并吸干表面水分,称取鲜重后,110 ℃烘箱杀青10 min,之后转至75 ℃烘干至恒重,称干重。地上部鲜重和干重以5株幼苗的平均值表示,单位为g/株。
1.3.2 膜脂过氧化及活性氧(ROS)的生成测定 超氧阴离子自由基(O2-·)产生速率参照王爱国等[10]的方法;用二甲酚橙法测定 H2O2(μmol/g FW)含量[11];用硫代巴比妥酸(TBAD)比色法测定MDA(nmol/g)含量[12]。
1.3.3 抗氧化酶活性和抗氧化物质含量的测定 超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)及谷胱甘肽还原酶(glutathione reductase,GR)活性按照Pinheiro等[13]的方法;过氧化物酶(POD)活性用愈创木酚法[11];抗坏血酸(ascorbic acid,ASA)和谷胱甘肽(glutathione,GSH)参照朱为民等[14]的方法定量。
1.3.4 有机溶质含量的测定 脯氨酸含量的测定采用酸性茚三酮比色法、可溶性糖含量用蒽酮比色法、可溶性蛋白用考马斯亮蓝法、氨基酸总量用茚三酮显色法测定[12]。
1.3.5 光合色素含量的测定 采用丙酮乙醇混合液提取,比色法测定叶绿素a(chl a)、叶绿素b(chl b)和类胡萝卜素(caro)含量[12]。
1.4 统计分析
试验数据采用平均数±SE表示,在Microsoft Excel 2003进行常规统计,用SPSS 17.0统计分析软件进行方差分析,检验其差异显著性。
2 结果与分析
2.1 外源NO对冷害胁迫下南瓜幼苗生物积累量的影响
生长受抑甚至停滞、生物积累量下降是低温胁迫下植物最直观的生理响应,且抑制程度可反映出植物的受害程度。表1可见,T3处理,南瓜幼苗株高、地上部和根系鲜、干重均明显下降。银辉2号和青栗株高分别比T1降低了19.60%和26.47%。鲜重和干重则分别降低了18.76%和16.84%,33.71%和26.45%(P<0.05),说明低温冷害显著抑制了南瓜幼苗的生长发育,且品种间比较,青栗受冷害的影响更加严重。T2处理,两品种株高和地上部鲜重与T1无显著变化,但根系干重及银辉2号的根系鲜重均显著高于对照(P<0.05),显示叶喷100 μmol/L的SNP具有促进南瓜幼苗根系发育的作用。T4处理,银辉2号株高和地上、下部干重分别比T3提高了19.73%、18.67%和35.00%;青栗分别提高了11.13%、16.90%和27.78%,达差异显著水平,表明T4处理可以减轻低温冷害对南瓜幼苗生长的抑制作用。品种间比较,SNP对银辉2号生物积累量的增加效果优于青栗。
表1 外源NO对冷害胁迫下南瓜幼苗生长的影响
Table 1 Effects of NO on the growth of pumpkin seedlings under low temperature stress (mean±SE)

品种Cultivars处理Treatments株高Plantheight(cm)地上部鲜重Freshweightofshoot(g/plant)根系鲜重Freshweightofroot(g/plant)地上部干重Shootdryweight(g/plant)根系干重Rootdryweight(g/plant)青栗QingliT113.56±0.41a10.36±0.24a2.01±0.12a0.94±0.07b0.27±0.04bT213.74±0.30a10.67±0.15a2.08±0.05a1.10±0.10a0.31±0.02aT39.97±0.19c6.65±0.11c1.55±0.07c0.71±0.02d0.18±0.01dT411.08±0.22b8.07±0.20b1.70±0.14b0.83±0.09c0.23±0.03c银辉2号Yinhui2T112.86±0.12a8.69±0.17a1.76±0.17b0.87±0.14b0.24±0.03cT212.97±0.09a8.73±0.08a1.82±0.11a0.92±0.13a0.30±0.04aT310.34±0.25c6.80±0.13c1.69±0.24c0.75±0.03c0.20±0.01dT412.38±0.17b8.25±0.06b1.74±0.19b0.89±0.12b0.27±0.04b
注:同列数据后不同小写字母表示差异显著(P<0.05)。下同。
Note: Values with different lowercases within the same column are significantly different (P<0.05). The same below.
2.2 外源NO对冷害胁迫下南瓜幼苗叶片O2-·生成速率和H2O2及MDA含量的影响
T2处理对南瓜叶片O2-·生成速率无明显影响(表2),但叶片H2O2含量均显著升高,银辉2号和青栗分别比T1增加了56.93%和43.55%,银辉2号MDA含量下降(P<0.05)。冷胁迫下,两品种叶片O2-·生成速率和H2O2含量均显著增加,分别达正常生长条件的1.97、2.02倍和2.89、2.58倍。MDA含量达到峰值,且青栗MDA绝对增加量明显大于银辉2号,表明在逆境下组织自动氧化速率加大,过氧化过程加剧进行。T4处理,银辉2号和青栗O2-·生成速率和MDA含量分别比T3降低了29.11%、40.59%和25.60%、28.49%(P<0.05),银辉2号H2O2含量降幅25.20%,青栗降幅达35.76%。说明SNP能缓解冷害导致的膜脂过氧化损伤,有效阻止由乙醛和甲酸乙酯在碱作用下的缩合作用而引起的蛋白质、核酸等大分子的交联聚合反应,大幅度提高细胞膜的稳定性和完整性。品种间比较,NO对银辉2号降低MDA积累导致细胞毒性的效应较青栗显著。
表2 外源NO对冷害胁迫下南瓜幼苗叶片MDA、H2O2含量和O2-·生成速率的影响
Table 2 Effects of NO on contents of MDA and H2O2, production rate of O2-·in leaves of pumpkin seedlings under low temperature stress

处理TreatmentProductionrateofO2-·[nmol/(gFW·min)]银辉2号Yinhui2青栗QingliH2O2content(μmol/gFW)银辉2号Yinhui2青栗QingliMDAcontent(nmol/g)银辉2号Yinhui2青栗QingliT10.384±0.009c0.407±0.019c1.342±0.032d1.224±0.041d8.891±0.120c9.104±0.025cT20.351±0.012c0.436±0.048c2.106±0.008c1.757±0.022c6.686±0.087d10.975±0.141cT30.759±0.020a0.824±0.036a3.873±0.026a3.168±0.003a19.935±0.432a24.316±0.578aT40.538±0.043b0.613±0.005b2.897±0.057b2.035±0.110b11.844±0.034b17.389±0.623b
2.3 外源NO对冷害胁迫下南瓜幼苗叶片抗氧化酶活性及ASA和GSH含量的影响
幼苗遭受冷害7 d后,两品种SOD活性均显著高于对照(表3),银辉2号和青栗分别上调了29.28%和20.01%(P<0.05)。而T4处理,SOD活性分别达T1的2.17和1.82倍,较T3提高了68.23%、51.34%。POD活性品种间比较,无论是正常生长状态还是逆境及外源因子处理,银辉2号均低于青栗,但T3处理,两品种POD活性都大幅增加。T4处理,进一步上调了叶片POD活性,银辉2号和青栗的绝对增加值分别达到49.18%和36.86%,品种之间呈明显差异。CAT活性与SOD、POD在两品种上的表现不同,T3处理CAT活性分别较T1降低了29.54%、39.76%,T4处理仅较冷害下提高了13.44%、9.99%,仍显著低于T1和T2处理。
表3 外源NO对冷害胁迫下南瓜幼苗叶片SOD、POD和CAT活性的影响
Table 3 Effects of exogenous NO on activities of SOD, POD and CAT in leaves of pumpkin seedlings under low temperature stress

处理TreatmentSODactivity(U/gFW)银辉2号Yinhui2青栗QingliPODactivity(U/gFW)银辉2号Yinhui2青栗QingliCATactivity(U/gFW)银辉2号Yinhui2青栗QingliT195.88±2.38d82.42±1.67d35.86±0.24d43.92±0.87d35.27±1.16a38.58±2.46aT2142.65±4.56b118.11±3.87b46.76±1.58c59.60±1.24c34.68±2.15a37.84±0.87aT3123.95±7.23c98.91±1.78c65.33±2.35b77.22±1.16b24.85±1.66c23.24±1.78bT4208.52±6.61a149.69±4.25a97.46±3.21a105.68±2.34a28.19±2.31b25.33±1.12b
T3处理,银辉2号和青栗APX活性仅为T1的66.89%、76.72%(P<0.01),GR活性分别上调了52.88%、18.24%,品种之间及银辉2号和T1之间达差异显著水平(P<0.05)。T4处理,两品种APX活性分别比T3提高了74.39%、67.09%;GR活性均显著高于T1和T3处理。品种间比较,银辉2号T4处理GR活性较T3上调了37.14%,增幅大于青栗(24.94%),由于GR是胞内将GSSG还原为GSH的关键酶,其活力的提高表明清除ROS能力的提升。外源SNP显著提高了冷胁迫下南瓜叶片SOD、POD、APX和GR活性,但对CAT活性影响较小(表4)。
T2处理显著提高了两品种GSH含量,分别高于对照35.93%、21.94%,但对ASA含量无明显影响。T3处理使ASA含量大幅降低,分别只为对照的76.95%、64.51%;GSH含量升高,银辉2号增幅(18.14%)大于青栗(7.48%)。T4处理,ASA、GSH含量分别达T3的2.06、1.33和1.72、1.29倍,并且显著高于T1(P<0.05)。从绝对增长量和增幅来看,对银辉2号的效应更加明显(表4)。
表4 外源NO对冷害胁迫下南瓜幼苗叶片APX和GR活性及ASA、GSH 含量的影响
Table 4 Effects of exogenous NO on activities of APX and GR and contents of ASA, GSH in leaves of pumpkin seedlings under low temperature stress

处理TreatmentAPXactivity[nmol/(min·gFW)]银辉2号Yinhui2青栗QingliGRactivity[nmol/(min·gFW)]银辉2号Yinhui2青栗QingliASAcontent(μg/gFW)银辉2号Yinhui2青栗QingliGSHcontent(nmol/gFW)银辉2号Yinhui2青栗QingliT14.32b3.05b12.84d13.16c73.71b76.67b35.88d30.90cT24.85a3.76a22.37b17.67b75.88b73.68b48.77b37.68bT32.89c2.34c19.63c15.56c56.72c49.46c42.39c33.21cT45.04a3.91a26.92a19.44a117.09a84.89a56.56a42.87a
2.4 外源NO对冷害胁迫下南瓜幼苗叶片叶绿体色素含量的影响
叶绿素是光合作用中最有效和最重要的色素,其含量在一定水平上影响南瓜苗期同化外源物质和进行光合积累的能力,并最终影响南瓜的产量。T3处理显著降低了两品种Chl a 、Chl b 及类胡萝卜素(Caro)含量,并使Chl a/b显著下降。T2处理对Chl a 、Chl b及总量无显著影响,但提高了Caro含量。T4处理显著提高了两品种Chl a 、Chl b含量,并使Chl a/b显著上升。青栗分别提高了73.14%、62.22%、6.73%;银辉2号增幅则达到83.22%、70.21%、7.64%。从光合色素的种类比较,Caro在T3处理下的降幅小于Chl a+b的降幅,T4处理则均达峰值,由于Caro既是光合色素,又是内源性的非酶系统ROS清除剂,此时发挥了淬灭活性氧的作用(表5)。
2.5 外源NO对冷害胁迫下南瓜幼苗叶片可溶性蛋白、可溶性糖、脯氨酸和游离氨基酸含量的影响
脯氨酸既是渗透调节物质,又是抗氧化物质。正常生长条件下,植物体内脯氨酸的含量较低,但在低温、干旱、盐碱等逆境时,脯氨酸大量积累,且积累指数与植物的抗逆性有关,所以,脯氨酸可作为植物抗逆性的一项重要生化指标[15]。银辉2号和青栗脯氨酸含量T3处理比T1分别上调了85.24%、60.03%。T4处理进一步促进了脯氨酸的积累,青栗和银辉2号T4比T3分别提高了25.22%和42.34%。冷胁迫刺激促进了两南瓜品种叶片可溶性糖的积累,T4处理,银辉2号可溶性糖的升幅(47.09%)高于青栗(16.62%),T3和T4之间达差异显著水平(P<0.05)。可溶性蛋白是植物体内生化反应的重要溶质,与作物生长、发育、成熟、抗逆性密切相关[5]。从表6可以看出,T2处理叶片游离氨基酸含量显著降低,可溶性蛋白含量变化不大;T3则明显降低了两指标的含量水平。T4处理,银辉2号可溶性蛋白和氨基酸总量分别较T3上调了37.12%、76.00%;而青栗仅提高了27.79%、68.18%,NO提高低温胁迫下南瓜叶片可溶性蛋白和氨基酸的效应银辉2号强于青栗。
表5 外源NO对冷害胁迫下南瓜叶片叶绿体色素含量的影响
Table 5 Effects of NO on photosynthetic pigment in leaves of pumpkin seedlings under low temperature stress
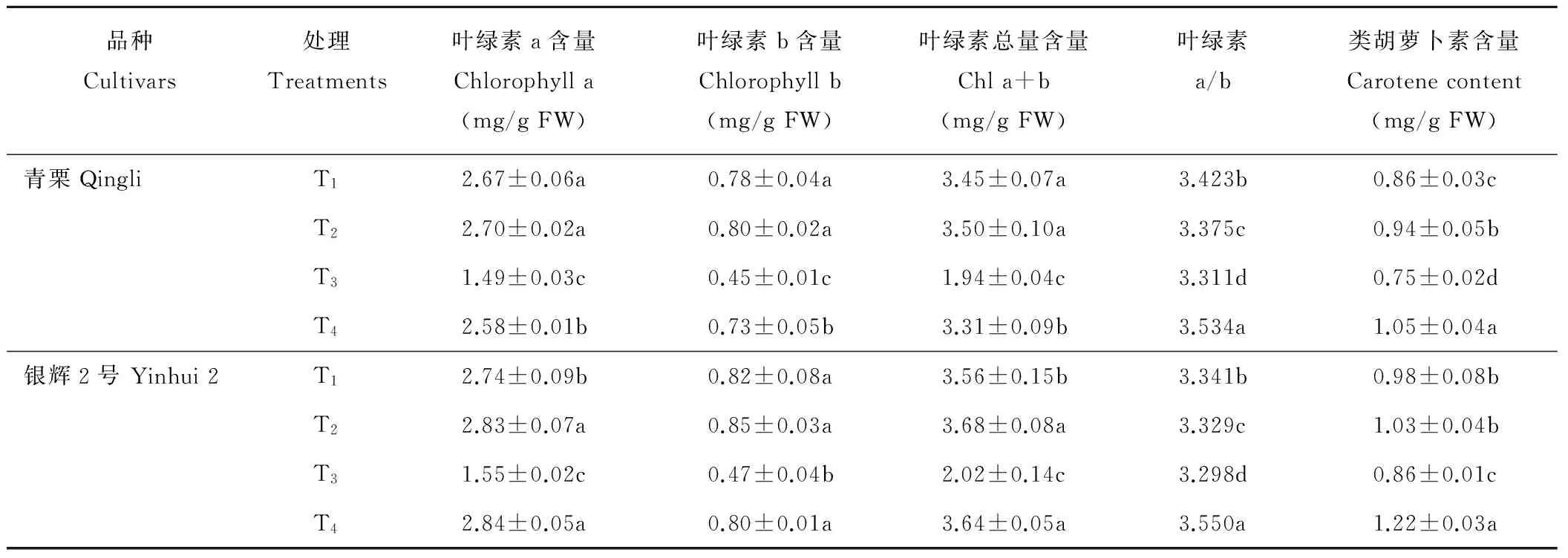
品种Cultivars处理Treatments叶绿素a含量Chlorophylla(mg/gFW)叶绿素b含量Chlorophyllb(mg/gFW)叶绿素总量含量Chla+b(mg/gFW)叶绿素a/b类胡萝卜素含量Carotenecontent(mg/gFW)青栗QingliT12.67±0.06a0.78±0.04a3.45±0.07a3.423b0.86±0.03cT22.70±0.02a0.80±0.02a3.50±0.10a3.375c0.94±0.05bT31.49±0.03c0.45±0.01c1.94±0.04c3.311d0.75±0.02dT42.58±0.01b0.73±0.05b3.31±0.09b3.534a1.05±0.04a银辉2号Yinhui2T12.74±0.09b0.82±0.08a3.56±0.15b3.341b0.98±0.08bT22.83±0.07a0.85±0.03a3.68±0.08a3.329c1.03±0.04bT31.55±0.02c0.47±0.04b2.02±0.14c3.298d0.86±0.01cT42.84±0.05a0.80±0.01a3.64±0.05a3.550a1.22±0.03a
表6 外源NO对冷害胁迫下南瓜叶片渗透调节物质含量的影响(平均数±SE)
Table 6 Effects of exogenous NO on organic osmoregulation substance in leaves of pumpkin seedlings under chilling stress (mean±SE)

品种Cultivars处理Treatments可溶性蛋白Solubleprotein(mg/gFW)可溶性糖Solublesugar(mg/gFW)脯氨酸Proline(μg/gFW)游离氨基酸总量Freeaminoacid(mg/gFW)青栗QingliT127.45±1.26a2.15±0.08c7.93±0.26c0.33±0.01bT228.37±0.28a2.33±0.02c8.24±0.05c0.26±0.04cT315.69±1.55c3.97±0.03b12.69±0.38b0.22±0.02dT420.05±0.76b4.63±0.09a15.88±0.15a0.37±0.03a银辉2号Yinhui2T125.87±0.89b2.38±0.01c7.32±0.11c0.39±0.02bT228.14±0.65a2.56±0.04c7.96±0.42c0.31±0.05cT316.38±1.34d3.95±0.09b13.58±0.17b0.25±0.03dT422.46±0.39c5.81±0.03a19.33±0.56a0.44±0.06a
3 讨论
低温作为一种影响植物生长和分布的较为普遍的逆境因子,是喜温性蔬菜生长、产量和品质的重要限制因素。吸胀冷害下紫花苜蓿种子H2O2及O2-·显著积累,SOD、CAT活力降低,根系活力下降[16]。也有研究表明,外源NO能显著缓解低温对黄瓜幼苗生长的抑制作用,提高叶绿素含量,加强了对光能的吸收和利用[17]。本试验结果表明,低温导致南瓜幼苗生物积累量明显下降,分析其可能原因为,ROS增加,过氧化伤害导致膜结构受损,光合碳同化产物减少,氧化磷酸化解偶联使维持生长能耗增加,游离氨基酸总量和可溶性蛋白减少。在形态建成过程中,C/N代谢受阻,尤其是碳架不足等原因而抑制了南瓜生长。外源NO显著增加了冷害逆境下两品种南瓜幼苗植株的生物积累量,不同程度缓解和减轻了冷害对两品种幼苗生长的抑制作用。植物在低温驯化过程中发生许多生理生化变化,最明显的就是膜脂相的改变。研究发现,NO可通过质外体直接作用于细胞壁组分,使细胞壁松弛,并且能作用于膜的脂质双层,增强膜的流动性,在维持细胞内环境稳定的前提下,增强了与外界的物质交换、养分吸收和信息传递,增强了南瓜苗期的抗冷性,从而促进细胞扩展和植株生长[18]。
冷害下,需氧植物体内ROS代谢失衡,伴随着NADPH和ATP的产生,质膜上NADPH氧化酶与O2反应生成过量的O2-·,诱发膜脂过氧化,使膜结构受损、细胞脱水、离子外渗、酶活下降,进而引起代谢紊乱、生长受阻[19]。试验发现,两品种南瓜叶片在低温逆境中O2-·和H2O2大量生成,H2O2可抑制质膜上的内向K+通道,引起膨压降低,导致气孔关闭,进而降低叶绿体内的CO2含量,从而使光合磷酸化受阻,更多的电子激活分子氧,产生更多的氧自由基,加剧了膜脂过氧化,并积累过氧化产物MDA,进一步导致ROS代谢紊乱。由于NO能诱导单子叶植物紫露草(Tradescantiasp.)和双子叶植物蚕豆的气孔孔径减小,H2O2介导激发子和ABA来诱导气孔关闭,推测二者在调控气孔运动、诱导防御基因表达等方面存在协同效应和有互补作用[20]。前人对冷胁迫下不同植物酶促系统保护酶活性的变化及非酶体系ASA、GSH含量进行了相关研究。肖强等[21]证实,NO可通过提高水稻(Oryzasativa)叶片中SOD、CAT活性及根系中SOD、CAT、GPX活性来降低和缓和盐胁迫导致的氧化损伤。Uchida等[22]研究表明,NO还可能作为信号分子上调GR活性,在胞内的氧化还原体系中使GSSG不断还原再生为GSH,为清除ROS提供持续的还原力。本试验中,SNP无论是单独处理还是复合冷胁迫,APX活性都大幅升高,而CAT活力水平两品种均低于对照,可能与NO作为正效应物与APX中的血红素铁结合,通过酶分子构象的改变提高了其活力有关[23],而H2O2可与CAT形成一种复合物而使其钝化,这种CAT的钝化形式可显著抑制CAT活力[24],这与赵萌等[16]的研究结果是一致的。复合SNP后ASA的大幅升高说明ASA-GSH循环也参与了逆境下ROS的调节。GSH是ASA合成的关键酶双脱氢抗坏血酸还原酶的底物,NO使冷害下南瓜叶片GSH含量提高的同时也提高了ASA的含量。ASA也是APX的底物,且在APX作用下,以GSH为质子供体,以NADPH为还原力,将H2O2还原为H2O,GR也通过NADPH将GSSG还原为GSH。故研究认为,NO诱导的南瓜叶片GSH的高表达,引发了冷胁迫逆境下APX活力的上调和ASA的合成。
叶绿体是植物光合作用的重要场所,低温冷害下,ROS大量产生,对植物光合机构产生伤害。本研究发现,低温胁迫下,由于ROS的代谢失衡,会直接影响叶绿体类囊体膜的透性和流动性,使叶绿体形态改变、叶绿体色素含量下降;并且Chl a的降解速率快于Chl b,这是因为类囊体膜是最易受到低温伤害的生物膜,由于类囊体内膜超微结构的破坏,使在类囊体上进行的光化学反应受阻,由Chl a构成的PSⅡ反应中心的光合电子传递、光合磷酸化解偶联之故。外施NO后显著提高了叶绿素、类胡萝卜素的含量,这与杨美森等[2]、陈银萍等[25]在人工模拟低温逆境下,在棉苗和玉米上的研究结果一致。NO外施后,两品种南瓜叶片Chl a 、Chl b降解速率基本一致,且处理叶片比对照具有更多的天线色素,光合机构能更有效地通过光化学反应吸收利用光能。推测NO抑制了叶绿酸酶的活性,降低了叶绿素的降解;同时通过降低ROS和MDA的生成减轻了对南瓜叶片叶绿体结构的破坏和光合器官的损伤。
逆境均会导致渗透胁迫,植物体通过代谢积累一些小分子的有机溶质来进行渗透调节,缓解逆境造成的损伤。碳氮代谢是植物体内重要的两大代谢途径,冷害下光合功能的衰退首先导致光合碳同化产物可溶性糖含量下降。同时植物体内脯氨酸的积累也一定程度上反映了抗逆性的高低。冷害复合SNP处理,银辉2号可溶性糖的迅速积累,显示了比青栗更强的渗透保护能力。本研究结果显示,冷害处理南瓜叶片可溶性蛋白的合成明显受抑,含量降低。推测在低温胁迫下,叶片内蛋白水解酶活力下降,蛋白质的降解受阻,导致氨基酸总量降低,同时由于光合碳同化能力下降,碳架缺乏蛋白质合成的原料不足,进一步降低了可溶性蛋白的含量。外源SNP处理后,显著提高了冷胁迫下南瓜叶片的可溶性蛋白和氨基酸含量,可能与NO提高了南瓜早期氮代谢关键酶——硝酸还原酶、谷氨酰胺合成酶及谷氨酸合酶的活性有关,其分子机制有待于进一步研究。
4 结论
低温抑制了南瓜幼苗光合色素的合成,加剧了膜脂过氧化作用,使植株生长受阻,生物积累量下降。正常生长条件叶片喷施SNP,一定程度上提高了游离氨基酸和H2O2含量,促进了地下部干物质的积累和类胡萝卜素的合成,显著提高了两品种南瓜幼苗的SOD、POD、 APX、GR活性。低温胁迫下,外源NO处理显著降低了ROS和MDA的生成,SOD、POD、APX活性大幅升高,并通过增强光合色素合成促进了早期碳氮代谢产物——可溶性蛋白、可溶性糖、脯氨酸及游离氨基酸的积累,促进了幼苗生长。抗氧化物质ASA、GSH含量的大幅提高,也说明外源NO可通过与内源H2O2发挥协同效应和互补作用激活逆境应答,增强了南瓜幼苗的耐冷性。
[1] Fan H F, Guo S R, Jiao Y S,etal. The effects of exogenous nitric oxide on growth, active oxygen metabolism and photosynthetic characteristics in cucumber seedlings under NaCl stress. Acta Ecologica Sinica, 2007, 27(2): 546-553.
[2] Yang M S, Wang Y F, Gan X X,etal. Effects of exogenous nitric oxide on growth, antioxidant system and photosynthetic characteristics in seedling of cotton cultivar under chilling injury stress. Scientia Agricultura Sinica, 2012, 45(15): 3058-3067.
[3] Besson-Bard A, Gravot A, Richaud P,etal. Nitric oxide contributes to cadmium toxicity inArabidopsisby promoting cadmium accumulation in roots and by-regulating genes related to iron uptake. Plant Physiology, 2009, 149(3): 1302-1315.
[4] Li H Y, Li C G, Guan L J,etal. Effect of Nitric oxide (NO) on heat-shock-induced chilling tolerance in maize seedlings. Jiangsu Journal of Agricultural Sciences, 2009, 25(3): 503-507.
[5] Liu J X, Wang J C, Wang R J,etal. Exogenous nitric oxide elevated alkali tolerance ofAvenanudaseedlings. Acta Prataculturae Sinica, 2015, 24(8): 110-117.
[6] Cui X M, Wu X B, Li X Y,etal. Responses of growth, functional enzyme activity in biomembrane of tomato seedlings to excessive copper, cadmium and the alleviating effect of exogenous nitric oxide. Plant Nutrition and Fertilizer Science, 2011, 17(2): 349-357.
[7] Wu J C, Chen W J, Cai L Q,etal. Effects of exogenous nitric oxide on anti-oxidation capacities in young loquat fruits under low temperature stress. Scientia Silvae Sinicae, 2010, 46(9): 73-78.
[8] Zhao M G, Chen L, Zhang L L,etal. Nitric reductase-dependent nitric oxide production is involved in cold acclimation and freezing tolerance inArabidopsis. Plant Physiology, 2009, 151: 755-767.
[9] Liu W Y, Yang H W, Wei X H,etal. Effects of exogenous nitric oxide on seed germination, physiological characteristics and active oxygen metabolism ofMedicagotruncatulaunder NaCl stress. Acta Prataculturae Sinica, 2015, 24(2): 85-95.
[10] Wang A G, Luo G H. Quantitative relation between the reaction of hydroxylamine and superoxide anion radicals in plants. Plant Physiology Communication, 1990, 26(2): 55-57.
[11] Zhang Z L, Qu W Q, Li X F. Laboratory Guide of Plant Physiology[M]. 4rd ed. Beijing: Higher Education Press, 2009: 221-222.
[12] Li H S. Plant Physiological and Biochemical Principle and Technology[M]. Beijing: Higher Education Press, 2000.
[13] Pinheiro H A, Da Matta F M, Chaves A R M,etal. Drought tolerance in relation to protection against oxidative stress in clones ofCoffeacanephorasubjected to long-term drought. Plant Science, 2004, 167: 1307-1314.
[14] Zhu W M, Ding H D, Qi N M,etal. Effects of Cd2+stress on ascorbate-glutathione cycle metabolism tomato seedlings. Acta Agriculturae Boreali-Sinica, 2005, 20(3): 50-53.
[15] Zhang X W, Dong Y J, Qiu X K,etal. Effects of exogenous Nitric oxide on seed germination, seedling growth and antioxidant enzyme activities of several plant species. Plant Nutrition and Fertilizer Science, 2012, 18(2): 397-404.
[16] Zhao M, Wei X H. Effects of nitric oxide onMedicagosativaseed germination under imbibitional chilling. Acta Prataculturae Sinica, 2015, 24(4): 87-94.
[17] Fan H F, Du C X, Zhu Z J. Effects of exogenous nitric oxide on plant growth, membrane lipid peroxidation and photosynthesis in cucumber seedling leaves under low temperature. Acta Agriculturae Zhejiangensis, 2011, 23(3): 538-542.
[18] Wu X X, Chen J L, Zha D S,etal. Effects of exogenous nitric oxide on reactive oxygen metabolism in tomato seedlings under NaCl stress. Plant Nutrition and Fertilizer Science, 2009, 15(2): 422-428.
[19] Dong H Z, Li W J, Tang W,etal. Quality and leaf senescence of cotton grown at varying sowing dates and plant densities in the Yellow River Valley of China. Field Crops Research, 2006, 98: 106-115.
[20] Liu X, Zhang S Q, Lou C H. The sources of nitric oxide and its relationship to other signals in plants. Plant Physiology Communications, 2003, 39(5): 513-518.
[21] Xiao Q, Chen J, Wu F H,etal. Effects of exogenous nitric oxide donor SNP on contents of chlorophyll and free proline, activity of antioxidative enzyme in rice seedlings under NaCl stress. Acta Agronomica Sinica, 2008, 34(10): 1849-1853.
[22] Uchida A, Jagendorf A T, Hibino T. Effects of hydrogen peroxide and nitric oxide on both salt and heat stress tolerance in rice. Plant Science, 2002, 163(3): 515-523.
[23] Zheng C F, Jiang D, Dai T B,etal. Effects nitroprusside, a nitric oxide donor, on carbon and nitrogen metabolism and the activity of the antioxidation system in wheat seedlings under salt stress. Acta Ecologica Sinica, 2010, 30(5): 1174-1183.
[24] Hertwig B, Streb P, Feierabend J. Light dependence of catalase synthesis and degradation in leaves and the influence of interfering stress conditions. Plant Physiology, 1992, 100(4): 1547-1553.
[25] Chen Y P, Wang X M, Yang Z J,etal. Effects of nitric oxide on seed germination and physiological reaction of maize seedlings under low temperature stress. Journal of Agro-Environment Science, 2012, 31(2): 270-277.
[1] 樊怀福, 郭世荣, 焦彦生, 等. 外源一氧化氮对NaCl胁迫下黄瓜幼苗生长、活性氧代谢和光合作用的影响. 生态学报, 2007, 27(2): 546-553.
[2] 杨美森, 王雅芳, 干秀霞, 等. 外源一氧化氮对冷害胁迫下棉花幼苗生长、抗氧化系统和光合特性的影响. 中国农业科学, 2012, 45(15): 3058-3067.
[5] 刘建新, 王金成, 王瑞娟, 等. 外源一氧化氮提高裸燕麦幼苗的耐碱性. 草业学报, 2015, 24(8): 110-117.
[6] 崔秀敏, 吴小宾, 李晓云, 等. 铜、镉毒害对番茄生长和膜功能蛋白酶活性的影响及外源NO的缓解效应. 植物营养与肥料学报, 2011, 17(2): 349-357.
[7] 吴锦程, 陈伟建, 蔡丽琴, 等. 外源NO对低温胁迫下枇杷幼果抗氧化能力的影响. 林业科学, 2010, 46(9): 73-78.
[9] 刘文瑜, 杨宏伟, 魏小红, 等. 外源 NO调控盐胁迫下蒺藜苜蓿种子萌发生理特性及抗氧化酶的研究. 草业学报, 2015, 24(2): 85-95.
[10] 王爱国, 罗广华. 植物的超氧自由基与羟胺反应的定量关系. 植物生理学通讯, 1990, 26(2): 55-57.
[11] 张志良, 瞿伟菁, 李小方. 植物生理学实验指导[M]. 第四版. 北京: 高等教育出版社, 2009: 221-222.
[12] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[14] 朱为民, 丁海东, 齐乃敏, 等. Cd2+胁迫对番茄幼苗抗坏血酸-谷胱甘肽代谢的影响. 华北农学报, 2005, 20(3): 50-53.
[15] 张秀玮, 董元杰, 邱先奎, 等. 外源一氧化氮对不同作物种子萌发幼苗生长及抗氧化酶活性的影响. 植物营养与肥料学报, 2012, 18(2): 397-404.
[16] 赵萌, 魏小红. 吸胀冷害下外源NO对紫花苜蓿种子萌发及抗氧化性的影响. 草业学报, 2015, 24(4): 87-94.
[17] 樊怀福, 杜长霞, 朱祝军. 外源NO对低温胁迫下黄瓜幼苗生长、叶片膜脂过氧化和光合作用的影响. 浙江农业学报, 2011, 23(3): 538-542.
[18] 吴雪霞, 陈建林, 查丁石, 等. 外源一氧化氮对NaCl 胁迫下番茄幼苗活性氧代谢的影响. 植物营养与肥料学报, 2009, 15(2): 422-428.
[20] 刘新, 张蜀秋, 娄成后. 植物体内一氧化氮的来源及其与其它信号分子的关系. 植物生理学通讯, 2003, 39(5): 513-518.
[21] 肖强, 陈娟, 吴飞华, 等. 外源NO供体硝普钠(SNP)对盐胁迫下水稻幼苗中叶绿素和游离脯氨酸含量及抗氧化酶的影响. 作物学报, 2008, 34(10): 1849-1853.
[23] 郑春芳, 姜东, 戴廷波, 等. 外源一氧化氮供体硝普钠浸种对盐胁迫下小麦幼苗碳氮代谢及抗氧化系统的影响. 生态学报, 2010, 30(5): 1174-1183.
[25] 陈银萍, 王晓梅, 杨宗娟, 等. NO对低温胁迫下玉米种子萌发及幼苗生理特性的影响. 农业环境科学学报, 2012, 31(2): 270-277.
Protective effect of exogenous nitric oxide against oxidative damage in pumpkin seedlings under chilling stress
WU Xu-Hong1*, LV Cheng-Min1, FENG Jing-Min2
1.CollegeofLifeSciences,AgricultureandForestry,QiqihaerUniversity,Qiqihaer161006,China; 2.Qiqihaersanitarysupervisioninstitute,Qiqihaer161005,China
The effects of exogenous nitric oxide on growth and oxidative damage in pumpkin seedlings under low temperature stress were studied. Seedlings of two pumpkin cultivars, ‘Yinhui 2’ and ’Qingli’, were sprayed with the nitric oxide donor, sodium nitroprusside (SNP: 100 μmol/L) and their growth, chloroplast pigment content, organic osmoregulation substances content, and active oxygen metabolism under chilling stress were analyzed. Chilling stress significantly inhibited the growth of pumpkin seedlings as a result of increased active oxygen accumulation and lipid peroxidation, decreased photosynthetic pigment content, and reduced osmotic adjustment ability. Under normal growth conditions, the SNP treatment significantly increased the activities of superoxide dismutase (SOD), peroxidase (POD), ascorbate peroxidase (APX), and glutathione reductase (GR), and also significantly increased shoot dry weight, root dry weight, and the H2O2, free amino acid, glutathione, and carotene contents. Under chilling conditions (8 ℃ days/5 ℃ nights), seedlings sprayed with 100 μmol/L SNP showed significantly increased plant growth and dry matter accumulation and significantly increased SOD, POD, APX and GR activities in leaves, and reduced accumulation of H2O2and malondialdehyde (MDA). Exogenous SNP application increased the glutathione, chlorophyll, carotenoid, ascorbate, soluble protein, and total amino acid contents. Under chilling stress, exogenous SNP application reduced the accumulation of H2O2and MDA, and protected membrane stability by increasing antioxidant enzyme activities and the contents of organic osmoregulation and antioxidant substances. These physiological changes protected the stability of cell membrane structure, and maintained carbon and nitrogen metabolism in the seedlings under chilling conditions, thereby increasing the cold resistance of pumpkin. Under these conditions, Yinhui 2 was more responsive than Qingli to exogenous SNP.
pumpkin (Cucurbitamoschata); chilling injury; nitric oxide; photosynthetic pigments; active oxygen metabolism; organic osmotic adjustment substance
10.11686/cyxb2016052
http://cyxb.lzu.edu.cn
2016-02-01;改回日期:2016-04-01
吴旭红(1962-),女,黑龙江齐齐哈尔人,教授。E-mail:wvg25583681129@sina.com*通信作者Corresponding author.
吴旭红, 吕成敏, 冯晶旻. 外源一氧化氮(NO)对低温胁迫下南瓜幼苗氧化损伤的保护效应. 草业学报, 2016, 25(12): 161-169.
WU Xu-Hong, LV Cheng-Min, FENG Jing-Min. Protective effect of exogenous nitric oxide against oxidative damage in pumpkin seedlings under chilling stress. Acta Prataculturae Sinica, 2016, 25(12): 161-169.

