分散固相萃取/气相色谱-三重四极杆串联质谱测定蔬菜和水果中67种农药残留
甘静妮,程雪梅,莫晓君,何建安,吴春梅
(东莞市农产品质量安全监督检测所,广东 东莞 523000)
分散固相萃取/气相色谱-三重四极杆串联质谱测定蔬菜和水果中67种农药残留
甘静妮*,程雪梅,莫晓君,何建安,吴春梅
(东莞市农产品质量安全监督检测所,广东 东莞 523000)
建立了分散固相萃取/气相色谱-三重四极杆串联质谱法(QuEChERS/GC-MS/MS)同时测定蔬菜和水果中67种常规检测农药的分析方法。番茄样品用1%乙酸乙腈匀浆提取,经分散固相萃取剂净化后,采用气相色谱-三重串联四极杆串联质谱在多反应离子监测(MRM)模式下进行检测,外标法定量。结果表明,67种农药在0.005~0.24 μg/mL范围内呈良好的线性关系,相关系数(r2)均大于0.99;番茄、葱、通菜和橙子基质在0.02,0.06,0.12 mg/kg 3个加标水平下,67种农药的平均回收率为60.3%~119.8%,相对标准偏差(RSD)为0.5%~14.7%;方法的检出限(LOD)为0.000 1~0.003 mg/kg,定量下限(LOQ)为0.000 2~0.009 mg/kg。将该法应用于蔬菜、水果中农药残留检测,并与GC,GCP/GC-MS,LC-MS/MS方法进行对比,结果较为满意。该方法简便快捷、灵敏度高、选择性好,具有良好的重现性和稳定性,适用于日常蔬菜水果中农药多残留的快速筛查和确证检测。
气相色谱-三重四极杆串联质谱;分散固相萃取;蔬菜;水果;农药残留
随着人们对食品安全意识的不断提高,国家也加强了对蔬菜、水果中农药残留的监控,并且对很多农药的限量要求很低。为满足现代农药残留分析的要求,开发出更为高效快捷、价格低廉、准确可靠的农药残留检测方法的需求也日益突显。
目前多农药残留的检测手段有气相色谱法(GC)[1-4]、液相色谱法(LC)[5-7]、气相色谱-质谱法(GC-MS)[8-9]、液相色谱-串联质谱法(LC-MS/MS)[10-11]、气相色谱-串联质谱法(GC-MS/MS)[12-14]。由于受检测器的限制,GC和LC只能检测1类农药且抗干扰能力差。GC-MS虽比GC抗干扰能力强,但对较为复杂的基质其抗干扰能力有一定的局限性。LC-MS/MS虽灵敏度高、抗干扰能力强,但由于受LC的限制无法对一部分农药(如菊酯类农药)进行检测,而近年发展的GC-MS/MS灵敏度高、抗干扰能力强、可对挥发性农药进行多农药残留分析,与LC-MS/MS达到互补的效果。在样品前处理净化技术中,新兴的分散固相萃取净化技术(QuEChERS)较前几年国内实验室普遍使用的固相萃取净化技术(SPE)[15-18],具有更简便、快速、经济等特点。尽管目前已有一些基于QuEChERS技术与GC-MS/MS结合应用于蔬菜水果中农药残留分析的文献报道[19-30],然而针对葱这种基质复杂蔬菜的研究较少[31]。鉴于测定对象所涵盖的农药品种不同,本文利用分散固相萃取净化技术与GC-MS/MS结合,选取蔬菜中的叶菜类通菜、基质复杂类的葱以及酸、碱性基质的番茄和水果中的橙子,建立了蔬菜和水果中67种农药残留的同时分析方法。本方法简便快捷、灵敏度高、选择性好、重现性好,适用于日常的蔬菜水果中农药多残留的快速筛查和确证检测。
1 实验部分
1.1 仪器与试剂
Agilent 7890B型气相色谱仪-Agilent 7000C型三重四极杆质谱仪(美国Agilent公司);氮气吹干仪(美国Zymark公司),高速冷冻离心机(德国Sigma公司),多功能振荡器(德国IKA公司),涡旋混合器(美国VWR公司)。
丙酮、正己烷(农残级,德国Merck公司);农药标准品:甲胺磷、乙酰甲胺磷、氧乐果、仲丁威、灭线磷、治螟磷、久效磷、硫线磷、甲拌磷、α-666、乐果、克百威、β-666、五氯硝基苯、γ-666、特丁硫磷、地虫硫磷、二嗪磷、δ-666、抗蚜威、磷胺、乙烯菌核利、甲基对硫磷、甲霜灵、杀螟硫磷、马拉硫磷、毒死蜱、倍硫磷、对硫磷、三唑酮、水胺硫磷、三氯杀螨醇、噻虫嗪、甲基异硫磷、二甲戊乐磷、氟虫腈、硫环磷、稻丰散、喹硫磷、腐霉利、三唑醇、杀扑磷、丙溴磷、噻嗪酮、虫螨腈、硫丹、三唑磷、丙环唑、戊唑醇、克螨特、异菌脲、亚胺硫磷、联苯菊酯、甲氰菊酯、伏杀硫磷、氯氟氰菊酯、蝇毒磷、哒螨磷、氯菊酯、咪鲜胺、氟氯氰菊酯、氯氰菊酯、氟氰戊菊酯、氰戊菊酯、氟胺氰菊酯、苯醚甲环唑、溴氰菊酯,浓度均为1 000.0 μg/mL,均购自中国标准技术开发公司标样开发部。
1.2 标准储备液和工作液的配制
准确移取一定量的67种农药标准品,用丙酮作为溶剂,配制成4.0 μg/mL的混合标准储备溶液,在20 ℃下保存备用。根据实验需要,用丙酮稀释成所需浓度的标准工作溶液。
1.3 样品前处理
准确称取10.00 g打碎番茄样品,加入20.0 mL含1%乙酸的乙腈溶液,剧烈振摇1 min,再加入6 g无水MgSO4和1 g醋酸钠,涡旋1 min,以8 000 r/min高速离心5 min;准确移取6.0 mL离心后的上清液加到含2.0 mL甲苯的分散固相萃取试剂盒中,振荡30 s,以8 000 r/min高速离心1 min后,准确移取2.00 mL上清液氮吹近干,用丙酮定容至1.00 mL,过0.20 μm滤膜,供GC-MS/MS检测。
1.4 仪器条件
1.4.1 GC条件 色谱柱:HP-5 UI(两根15 m×250 μm×0.25 μm,美国Agilent公司);柱温采用程序升温:60 ℃保持1 min,以 40 ℃/min 升至120 ℃并保持1 min,再以5 ℃/min升至310 ℃;载气:高纯He(≥99.999%),恒流模式,柱1恒流速0.987 87 mL/min;柱2恒流速1.187 9 mL/min;进样口温度250 ℃;进样体积1 μL;进样方式:不分流;溶剂延迟4.5 min。
1.4.2 MS/MS条件 电离方式:电子轰击离子化(EI);电离能量:70 eV;离子源温度:280 ℃;四极杆温度:150 ℃;质谱接口温度:280 ℃;碰撞气流速:氮气1.5 mL/min;分析模式:MRM。
2 结果与讨论
2.1 提取溶剂的选择
蔬菜品种繁多、成分复杂,在目前的农药多残留分析中,常以丙酮、甲醇、乙腈、乙酸乙酯等作为提取溶剂。乙腈的通用性较强,对农药的提取效率较高并能有效减少油脂与色素对农药的干扰,因此本实验选择乙腈作为提取溶剂。而由于不同蔬菜的pH值均有不同,部分酸碱敏感型农药在不同的pH值环境中稳定性会受到影响,为提高方法定量的准确度,应保持提取液的pH值约在5.0~6.0范围内。使用缓冲盐体系提取的QuEChERS方法[32-33],可使样品提取液处于该pH值范围内,以提高酸碱敏感型农药的回收率。
本文考察了3种提取方法:①直接用乙腈提取;②采用20 mL 1% 乙酸乙腈-1.0 g柠檬酸钠-0.5 g柠檬酸二钠缓冲体系(约pH 5.5)提取;③采用20 mL 1%乙酸乙腈-1.5 g乙酸钠缓冲体系(约pH 5.0)进行提取。在空白番茄基质中添加60 μg/kg的67种农药,对比3种提取方法的回收率。
结果表明,采用方法①提取时,76%的农药组分的回收率为70%~120%,但甲胺磷、乙酰甲胺磷、五氯硝基苯、丙溴磷、异菌脲的回收率仅为45%~60%;采用方法②提取时,有14种农药(甲胺磷、乙酰甲胺磷、氧乐果、克百威、三羟基克百威、水胺硫磷、噻虫嗪、异菌脲、丙溴磷、亚胺硫磷、伏杀硫磷、氟氰戊菊酯、氯氟氰菊酯、溴氰菊酯)的回收率超过120%。而采用方法③提取时,回收率在70%~120%的农药组分最多,占农药总数的98%,该方法的萃取效果最好。因此,实验选择1%乙酸乙腈-1.5 g乙酸钠缓冲体系(约pH 5.0)进行提取。
2.2 分散固相萃取剂的优化
QuEChERS 方法中不同分散固相吸附剂对样品净化效果的影响也不尽相同,其中无水硫酸镁用于去除水分,PSA主要去除极性有机酸、糖类和脂类等极性物质,但对色素的净化效果并不理想。若对色素含量较大的蔬菜净化不干净,不仅易污染进样口以及离子源,还可能导致基质严重干扰待测农药。石墨化炭黑(GBC)可有效去除叶绿素等色素,但由于GBC表面具有特殊的六元环结构,对平面结构及对称结构类农药会产生吸附实验区。对于无水硫酸镁和PSA的用量,本文采用仪器提供的优化参数,即855 mg MgSO4和150 mg PSA。本实验还考察了GCB用量对实验结果的影响,结果显示,当GCB用量为45 mg时,提取液呈淡黄色透明。当GCB用量大于45 mg后,提取液虽呈无色,但同时也导致平面结构类农药的回收率偏低。因此实验选择GCB的用量为45 mg。
GCB对平面结构类农药存在吸附,而甲苯的加入可通过竞争关系有效地改善GCB对平面结构类农药的吸附。考察了不同比例的乙腈-甲苯(体积比3∶1,2∶1,1∶1)对平面结构类农药(六六六、五氯硝基苯、甲基对硫磷、蝇毒磷)提取回收率的影响。结果发现,加入甲苯并采用乙腈-甲苯(体积比3∶1)进行提取可有效地克服以上农药被GCB吸附的问题,其回收率从未添加甲苯时低于60%提高至85%以上,继续提高甲苯的加入比例对几种农药的回收率影响不显著。因此,实验选择甲苯的加入量为乙腈-甲苯(3∶1)。
2.3 GC-MS/MS条件的优化
采用全扫描模式对67种农药化合物标准品溶液进行扫描,确定各农药的保留时间,在各农药的质谱图中选取强度高且质荷比大的特征离子作为母离子,然后采用产物离子扫描模式,将各农药化合物的母离子打碎,并选择2或3个强度大、灵敏度高的离子作为子离子,最后采用MRM扫描模式,优化所选取子离子的碰撞能量,选出各自的最佳碰撞能量,结果见表1。图1为优化条件下0.04 mg/kg番茄基质加标的67种农药混合标准溶液的MRM总离子流色谱图(TIC)。

表1 67种农药的色谱保留时间、质谱条件、相关系数、检出限与定量下限
(续表1)

No.PesticideRetentiontime(min)Ionpair(m/z)Collisionenergy(E/V)r2LOD(mg/kg)LOQ(mg/kg)59Permethrin(氯菊酯)32074,323401831/1651∗,1831/153110,150998900009000360Prochloraz(咪鲜胺)323493100/698∗,1800/138015,100991700009000361Cyfluthrin(氟氯氰菊酯)333691629/1270∗,1629/9095,100999000009000362Cypermethrin(氯氰菊酯)339871630/1270∗,1649/9105,100998700006000263Flucythrinate(氟氰戊菊酯)34130,345231989/1570∗,1569/107110,150998100009000364Fenvalerate(氰戊菊酯)35497,358961670/1251∗,2249/11905,150998400006000265Fluvalinate(氟胺氰菊酯)35756,35902500/2000∗,2500/55020,200999600009000366Difenoconazole(苯醚甲环唑)364503228/2648∗,2649/202015,200999800009000367Deltamethrin(溴氰菊酯)36571,169382507/1720∗,2529/9305,1509981000090003
*quantitative ion;linear ranges of all pesticides:0.005-0.24 μg/mL

图1 0.04 mg/kg番茄空白基质加标的67种混合标准溶液的MRM总离子流色谱图
2.4 线性关系、检出限及定量下限
按“1.3”方法配制含量分别为0.005,0.01,0.04,0.08,0.12,0.24 μg/mL的系列混合基质匹配标准溶液,在“1.4”仪器条件下进行测定,以67种农药的峰面积(y)对其质量浓度(x,μg/mL)作标准曲线。结果显示,67种农药 0.005~0.24 μg/mL范围内均具有良好的线性关系(r2>0.99)。在空白基质中添加混合标准溶液,按“1.3”方法对样品进行处理,上机检测。以3倍信噪比(S/N=3)计算该方法的检出限(LOD)为0.000 1~0.003 mg/kg,以10倍信噪比(S/N=10)计算该方法的定量下限(LOQ)为0.000 2~0.009 mg/kg(见表1)。
2.5 回收率与精密度
选取番茄、葱、通菜以及橙子,分别在其空白样品中按0.02,0.06,0.12 mg/kg 3个添加水平进行加标回收实验,每个添加水平做6次平行,按“1.3”前处理方法和“1.4”上机条件进行检测,计算各农药的平均回收率和相对标准偏差。结果表明,在3个添加水平下番茄、葱、通菜和橙子中67种农药的平均回收率为60.3%~119.8%,相对标准偏差(RSD)为0.5%~14.7%。表2列出了番茄基质中3个添加水平的回收率和相对标准偏差。本方法稳定可靠,能满足农药残留分析方法的技术要求。
表2 67种农药在番茄基质中3个加标水平的回收率及相对标准偏差
Table 2 Recoveries and relative standard deviations(RSDs) for 67 pesticides in tomato spiked at three levels(%)
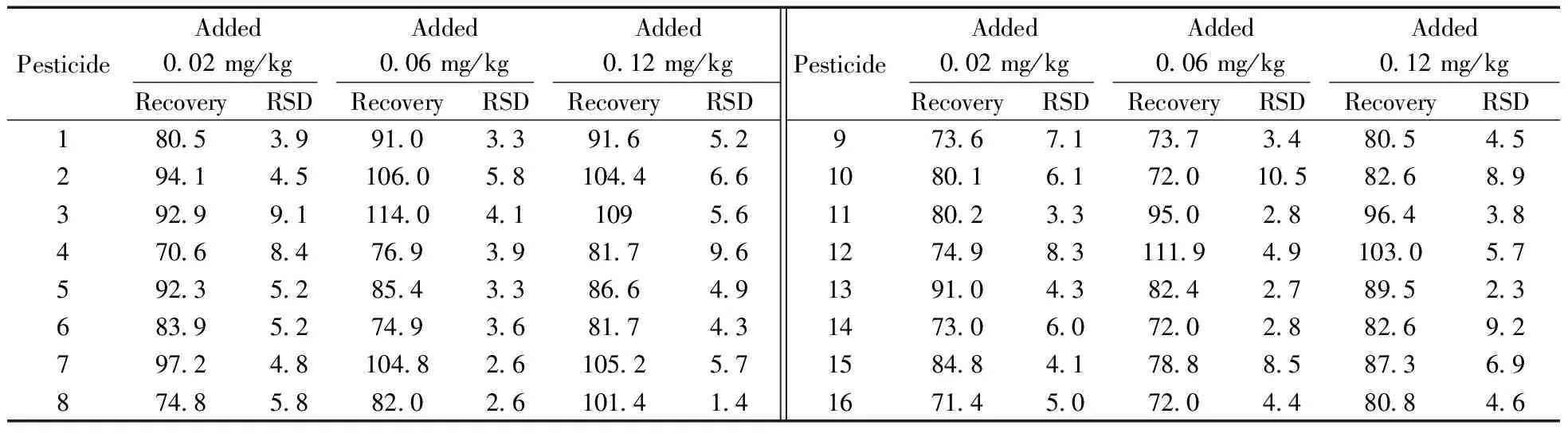
PesticideAdded002mg/kgAdded006mg/kgAdded012mg/kgRecoveryRSDRecoveryRSDRecoveryRSDPesticideAdded002mg/kgAdded006mg/kgAdded012mg/kgRecoveryRSDRecoveryRSDRecoveryRSD18053991033916522941451060581044663929911140411095647068476939817965923528543386649683952749368174379724810482610525787485882026101414973671737348054510801617201058268911802339502896438127498311194910305713910438242789523147306072028826921584841788858736916714507204480846
(续表2)
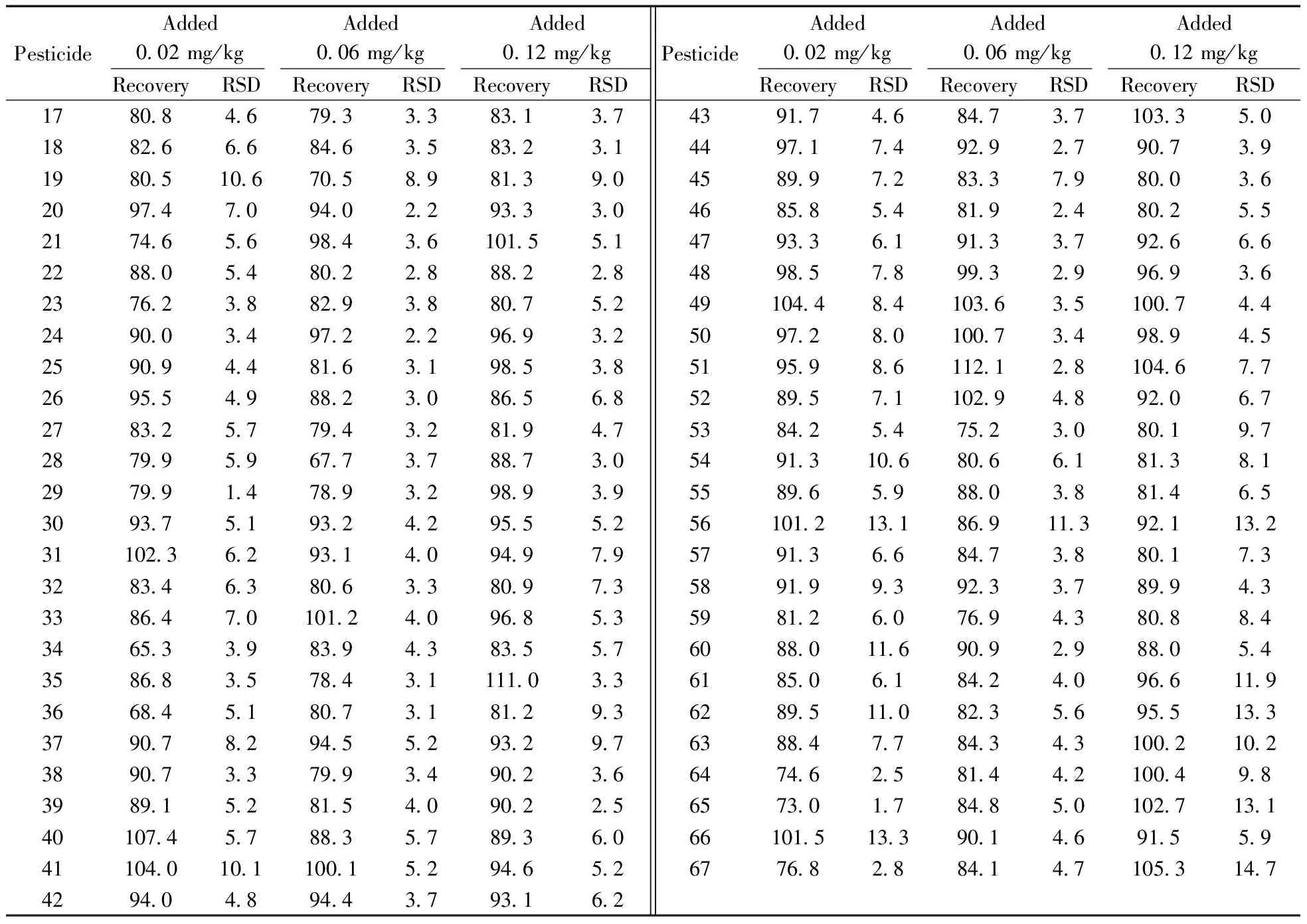
PesticideAdded002mg/kgAdded006mg/kgAdded012mg/kgRecoveryRSDRecoveryRSDRecoveryRSDPesticideAdded002mg/kgAdded006mg/kgAdded012mg/kgRecoveryRSDRecoveryRSDRecoveryRSD17808467933383137188266684635832311980510670589813902097470940229333021746569843610155122880548022888228237623882938807522490034972229693225909448163198538269554988230865682783257794328194728799596773788730297991478932989393093751932429555231102362931409497932834638063380973338647010124096853346533983943835573586835784311110333668451807318129337907829455293297389073379934902363989152815409022540107457883578936041104010110015294652429404894437931624391746847371033504497174929279073945899728337980036468585481924802554793361913379266648985789932996936491044841036351007445097280100734989455195986112128104677528957110294892067538425475230801975491310680661813815589659880388146556101213186911392113257913668473880173589199392337899435981260769438088460880116909298805461850618424096611962895110823569551336388477843431002102647462581442100498657301784850102713166101513390146915596776828841471053147
2.6 样品检测
将本文建立的方法应用于芹菜、丝瓜、茄瓜、白菜、苋菜、荷兰豆、萝卜等7种蔬菜以及橙子1种水果共48个样品的检测,部分样品中检出毒死蜱、三唑磷等农药残留。同时将检测样品分别采用NY/T 761-2008前处理方法GC上机,部分农药采用GB/T 19648-2006前处理方法CPC-GC/MS上机,部分农药采用GB/T 20769-2008 前处理方法 LC-MS/MS上机进行确认,结果发现,3种对比方法的实验结果与本方法一致。
3 结 论
本文建立了QuEChERS/GC-MS/MS同时测定不同基质蔬菜和水果中67种农药的方法。将其应用于蔬菜水果的检测,并与GC,GCP/GC-MS,LC-MS/MS方法进行比较,结果满意。该方法具有简便省时,试剂消耗少,灵敏度高,选择性好,抗干扰性强的特点,适用于蔬菜水果样品中67种农药的日常检测和确证。
[1] Zhu L P,Zhu T,Pan Y X,Sun J,Dong J.Chin.J.Anal.Chem.(朱莉萍,朱涛,潘玉香,孙军,董静.分析化学),2008,36(7):999-1003.
[2] Pan S Q,Sun J,Dong J,Liu Y Q,Ren F.Chin.J.Anal.Lab.(潘守奇,孙军,董静,刘永强,任芳.分析试验室),2010,29(1):115-118.
[3] Wang J H,Zhang Y B,Tang Z X,Liu X T.J.Instrum.Anal.(王建华,张艺兵,汤志旭,刘心同.分析测试学报),2005,24(1):100-102.
[4] Wu C H,Nie J Y,Li J,Li H F,Xu G F.FoodSci.(吴春红,聂继云,李静,李海飞,徐国锋.食品科学),2009,30(14):188-190.
[5] Tang Q Q,Li J,Fu A H,Zhang Y,Lü Y Y,Wu W,Xu C X.Chin.J.Anal.Lab.(唐庆强,李捷,傅爱华,张云,吕园园,吴文,许彩霞.分析试验室),2010,29:269-271.
[6] Li Y X,Xun C J,Zhao J H,Yang L H.Chin.J.Chromatogr.(李永新,孙成均,赵剑虹,杨柳桦.色谱),2006,24(3):251-255.
[7] Hao J Y,Luo X L,Tang Z G,Wang D J.J.Instrum.Anal.(郝家勇,罗小玲,唐宗贵,王东健.分析测试学报),2010,29(11):1169-1172.
[8] Su J F,Zhong M S,Chen J,Guo X,Chen J X,Liang Z,Liu J J.J.Instrum.Anal.(苏建峰,钟茂生,陈晶,郭昕,陈劲星,梁震,刘建军.分析测试学报),2015,34(6):625-638.
[9] Wu P G,Tan Y,Zhang J,Wang L Y,Tang J,Jiang W,Pan X D,Ma B J,Ni Z N,Wang T J.Chin.J.Anal.Chem.(吴平谷,谭莹,张晶,王立媛,汤鋆,姜维,潘晓东,马冰洁,倪竹南,王天娇.分析化学),2014,42(6):866-871.
[10] Li R,Chu D K,Zhang P J,Gao Y Q,Huang S Y.J.Instrum.Anal.(李蓉,储大可,张朋杰,高永清,黄思允.分析测试学报),2015,34(5):502-511.
[11] Ding M,Zhong D L,Tang F B,Fang W.Chin.J.Chromatogr.(丁明,钟冬莲,汤富彬,方伟.色谱),2013,31(2):117-121.
[12] Yao M D.Chin.J.HealthLab.Technol.(姚铭栋.中国卫生检验杂志),2014,24(5):2170-2173.
[13] Li P P,Cheng J,Le Y.J.Instrum.Anal.(李萍萍,程景,乐渊.分析测试学报),2015,34(4):421-427.
[14] Shi J W,Li J G,Wang Y F,Zhao Y G.Chin.J.Chromatogr.(施家威,李继革,王玉飞,赵永纲.色谱),2010,28(12):1137-1143.
[15] Wu F Q,Shen J C,Wu W D,Lan F.FoodSci.Technol.(吴凤琪,沈金灿,吴卫东,蓝芳.食品科技),2014,39(5):268-274.
[16] Zhao G H,Zhao J G.LifeSci.Instrum.(赵桂华,赵建国.生命科学仪器),2015,13:48-53.
[17] Wu Y,Jiang B,Zhang X B,Zhao W,Pan Z L,Li L L,Han F,Zu Y G,Wang Y.Envinmen.Chem.(吴岩,姜冰,张辛博,赵伟,潘仲乐,李丽丽,韩峰,祖元刚,王妍.环境化学),2016,35(1):225-228.
[18] Li N,Shi Z H,Pang G F,Fan C L.J.Instrum.Anal.(李南,石志红,庞国芳,范春林.分析测试学报),2011,30(5):513-521.
[19] Sun Y Y,Sun H,Dong Z L,Gao S J,Du M.FoodRes.Dev.(孙玉玉,孙浩,董振霖,高术杰,杜茂.食品研究与开发),2015,36(3):121-125.
[20] Gong J J,Sun X,Wang M L,Deng Z H,Song Y Q,Liu W L,Zhang M.J.FoodSaf.Qual.(宫俊杰,孙欣,王明林,邓泽慧,宋艳秋,刘文岭,张敏.食品安全质量检测学报),2016,7(1):338-344.
[21] Chu N M,Yang J Y,Chai Y,Kang Y Q,Zhang X M.SouthwestChin.J.Agric.Sci.(褚能明,杨俊英,柴勇,康月琼,张雪梅.西南农业学报),2015,28(3):1288-1294.
[22] Xie J J,Chen J,Li J,Yuan Z Y,Xie Y S.J.FoodSaf.Qual.(谢建军,陈捷,李菊,袁震宇,谢玉珊.食品安全质量检测学报),2013,4(1):82-88.
[23] Lu J W,Li R,Yang F,Liang Y H,Wang Y.Chin.J.HealthLab.Technol.(卢俊文,李蓉,杨芳,梁永洪,王勇.中国卫生检验杂志),2013,23(2):272-277.
[24] Xu P J,Gao X S,Tao B,Zhang H,Jiang S R.Chin.J.Anal.Chem.(许鹏军,高晓莎,陶晡,张红艳,江树人.分析化学),2008,36(11):1515-1520.
[25] Pang G F,Fan C L,Li Y,Kang J,Chang Q Y,Bu M N,Jin C L,Chen H.J.Instrum.Anal.(庞国芳,范春林,李岩,康健,常巧英,卜明楠,金春丽,陈辉.分析测试学报),2012,31(9):1017-1030.
[26] Wang H J,Xue Y W,Kang J,Peng X,Chang Q Y,Fan C L,Pang G F.Chin.J.Anal.Lab.(王慧君,薛亚薇,康健,彭兴,常巧英,范春林,庞国芳.分析试验室),2015,34(4):383-387.
[27] Li Y,Xiao L H,Ying G,Wang Y,Xie Y X,Li Q,Wang S H,Wang T J,Bi K S.Chin.J.Pharm.Anal.(李媛,肖丽和,殷果,王珏,谢耀轩,李清,王淑红,王铁杰,毕开顺.药物分析杂志),2013,33(4):661-668.
[28] Shi J W,Li J G,Wang Y F,Fan J Z.Chin.J.Chromatogr.(施家威,李继革,王玉飞,范建中.色谱),2012,30(6):602-612.
[29] Ma Z L,Zhao W,Li L Y,Zheng S N,Lin H,Zhang Y G,Gao Q Z,Liu S.Chin.J.Chromatogr.(马智玲,赵文,李凌云,郑姝宁,林桓,张延国,高青珍,刘肃.色谱),2013,31(3):228-239.
[30] Huang J R,Kong X H,Yao B H,He Q,Hao K T.Chin.J.Chromatogr.(黄江锐,孔祥虹,姚秉华,何强,郝开拓.色谱),2011,29(10):974-982.
[31] Zhou C M,Xu Y H,Zhang K,Yu L,Jiang S.FujianAnal.Test.(周长民,徐宜宏,张侃,于丽,蒋施.福建分析测试),2015,23(4):5-15.
[32] AOAC 2007.01.Pesticide Residues in Foods by Acetonitrile Extraction and Partitioning with Magnesium Sulfate:Gas Chromatography/Mass Spectrometry and Liquid Chromatography/Tandem Mass Spectrometry.
[33] BS-EN 15662-2008.Foods of Plant Origin—Determination of Pesticide Residues Using GC-MS and/or LC-MS/MS Following Acetonitrile Extraction/ Partitioning and Clean-up by Dispersive SPE—QuEChERS-Method.
Determination of 67 Pesticide Residues in Vegetables and Fruits by Gas Chromatography-Triple Quadrupole Mass Spectrometry withDispersive Solid Phase Extraction
GAN Jing-ni*,CHENG Xue-mei,MO Xiao-jun,HE Jian-an,WU Chun-mei
(Dongguan Institute of Supervision and Testing for Agricultural Product Quality Safety,Dongguan 523000,China)
An analytical method for the simultaneous determination of 67 pesticides in vegetables and fruits by gas chromatography-triple quadrupole mass spectrometry(GC-MS/MS) with dispersive solid phase extraction(QuEChERS).The samples were extracted with acetonitrile(containing 1% acetic acid),and then cleaned up with dispersive solid phase extraction.The extracts were determined by GC-MS/MS in multi-reaction monitoring(MRM) mode with the external standard method.The calibration curves of 67 pecitides were linear in the range of 0.005-0.24 μg/mL with correlation coefficients(r2) higher than 0.99.The average recoveries at spiked concentration levels of 0.02,0.06,0.12 mg/kg ranged from 60.3% to 119.8% with relative standard deviations(RSDs) of 0.5%-14.7%.The limits of detection(LOD) for the method were in the range of 0.000 1-0.003 mg/kg.The limits of quantitations(LOQs) were 0.000 2-0.009 mg/kg.The method was applied in the detection of pesticide residues of vegetables and fruits,and the result was more satisfactory comparing with that of GC,GCP/GC-MS,LC-MS/MS methods.The method showed the advantages of simplicity,quickness,high sensitivity,good selectivity,good reproducibility and stability,and was suitable for the analysis of pesticide residues in daily vegetables and fruits.
gas chromatography-triple quadrupole mass spectrometry(GC-MS/MS);dispersive-solid phase extraction(QuEChERS);vegetables;fruits;pesticide residues
2016-04-17;
2016-06-20
10.3969/j.issn.1004-4957.2016.12.003
O657.63;F767.2
A
1004-4957(2016)12-1528-07
*通讯作者:甘静妮,硕士,研究方向:农产品质量安全,Tel:0769-23166505,E-mail:gjn-0008@163.com

