康宁木霉AS3.2774纤维素酶CBHⅡ基因与乳酸菌非抗性穿梭表达载体的重组及在大肠杆菌中的表达
■刘 燕张宏福孙 哲 杨 琳 王瑞军
(1.内蒙古农业大学职业技术学院,内蒙古包头014109;2.中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室,北京100094;3.华南农业大学动物科技学院,广东广州510642;4.内蒙古农业大学动物科学学院,内蒙古呼和浩特010018)
纤维素酶是将纤维素水解成葡萄糖的一组酶的总称,试验证明,完全降解纤维素至少需要三类酶系:内切葡聚糖酶(EG)、外切葡聚糖酶(CBH)、β-葡萄糖苷酶(BG)。木质纤维素中的纤维素主要以结晶状态存在,其中CBH是纤维素水解酶系中唯一可以作用于结晶纤维素的酶组分,因而CBH在木质纤维素水解中的作用相当重要[1]。
丝状真菌木霉属可产生大量纤维素酶,酶系完全,分泌性较好。目前国内外研究较多的是里氏木霉,纤维素酶的各个组分在不同程度上已得到克隆,并且有些基因已在大肠杆菌和酵母中得到了表达[2]。但关于康宁木霉研究较少(Thomas,1988)[3];同时大部分分子生物学工作中,常以抗性基因作为克隆筛选的标记,这使得在农业和食品工业中应用的菌株,因可能含有位于质粒上的抗性基因,而造成耐药性,增加了耐药性基因向环境传播的可能性[4]。因此,构建饲料级可食性的非抗生素抗性标记的纤维素酶基因重组菌成为重要的研究方向之一。
本研究将康宁木霉AS3.2774纤维素酶CBHⅡ基因进行克隆和测序,与非抗生素抗性的、以thyA基因为选择标记的、可在乳酸菌和大肠杆菌之间穿梭表达的载体pW425t[5]进行重组,并转化入thyA基因缺陷型的大肠杆菌感受态E.coliX13中进行表达,为下一步pW425t-CBHⅡ在基因缺陷型的乳酸菌受体菌株中表达提供理论基础和试验依据。
1 材料与方法
1.1 材料
1.1.1 菌株与载体
康宁木霉AS3.2774、大肠杆菌DH5a分别购自中国农业科学院微生物研究所及Tiangen公司;克隆载体pMD18-T Simple Vector购自Takara公司;thyA基因缺陷型受体菌E.coliX13及表达载体pW425t均来自中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室。
1.1.2 培养基
PDA、Mendals基本培养基用于康宁木霉的培养。LB培养基,根据需要加入终浓度为100 μg/ml的氨苄青霉素或50 μg/ml的胸腺嘧啶核苷酸。
1.1.3 主要试剂
植物RNA快速提取试剂盒为普利莱基因技术有限公司产品;AMV Reverse Transcriptase XL、Ex Taq HS、Agarose Gel DNA Purification Kit、DNase I、SmaI、SphI、T4DNA ligase均为TaKaRa产品;质粒提取试剂盒、蛋白质Marker、DNA Marker为Tiangen产品;DL-苏氨酸、刚果红、胸腺嘧啶核苷酸、对硝基酚-β-D-纤维二糖苷(p-NPC)为Sigma产品。
1.2 方法
1.2.1 康宁木霉AS3.2774菌丝体的制备
挑取PDA平板培养基上一菌环孢子,接于250 ml三角烧瓶中的50 ml Mendels基本培养基,200 r/min、30 ℃,诱导培养4 d,4 000 r/min、10 min离心收集菌体,用生理盐水洗涤菌体3次,-70℃保存备用。
1.2.2 康宁木霉总RNA提取及引物设计
采用植物总RNA快速提取试剂盒提取总RNA,操作按照说明书进行,为防止DNA的污染,并用DN⁃ase I 37℃处理30 min,然后再纯化总RNA。根据Gene Bank中康宁木霉AS3.2774 CBHⅡ (DQ504304)的基因序列设计引物由上海生工公司合成。P1:5’-ATACCCGGGATG ATT GTC GGC ATT CTCACC-3’;P2:5’-TCGGCATGCTTA CAG GAA CGA TGG GTT TGC-3’(斜体部分别为SmaI、SphI酶切位点)。
1.2.3 RT-PCR扩增CBHⅡ基因
P1、P2为引物,总RNA为模板,RT-PCR扩增CBHⅡ基因。反转录反应体系及反应条件为:取6 μl mRNA,1 μl Oligodt,65 ℃加热5 min,迅速置于冰上冷却2 min,再依次加入MgCl24 μl,10×RT Buffer 2 μl,RNase Free dH2O 3 μl,dNTP Mixture(各 10 mM)1 μl,RNase Inhibitor 1 μl,AMV Reverse Transcriptase 1 μl。混匀反应液,42℃,1 h。
PCR反应体系(25 μl)及反应条件:5×PCR Buffer 5 μl,灭菌蒸馏水 13.75 μl,TaKaRa Ex TaqTM 0.25 μl,P1 0.5 μl,P2 0.5 μl,CDNA 2 μl,dNTP 3 μl。95 ℃5 min,预变性;94 ℃ 45 s,变性;53 ℃ 45 s,退火;72 ℃ 90 s,延伸,35个循环;72 ℃ 5 min,延伸。
1.2.4 CBHⅡ基因的克隆
通过DNA快速纯化/回收试剂盒得到目的片段CBHⅡ,将其连接于pMD18-T Simple Vector中,并转化感受态细胞DH5a,在含有X-Gal和IPTG的LB+Amp琼脂培养基平板上培养过夜。通过蓝白斑筛选、质粒大小、酶切鉴定及PCR鉴定证明重组克隆pMD18-T-CBHⅡ的获得及其正确性,最后将重组克隆菌送至北京奥科生物技术公司测序,DNAMAN软件分析。
1.2.5 pW425t-CBHⅡ重组表达载体的构建
用SmaI和SphI双酶切表达载体pW425t和重组质粒pMD18-T-CBHⅡ,胶回收,利用T4DNA连接酶将CBHⅡ片段连接至pW425t的SmaI和SphI多克隆位点之间,产物转化到thyA基因缺陷型的大肠杆菌感受态细胞E.coliX13中,在普通的LB固体培养基上培养,经酶切分析、PCR鉴定及生长功能弥补筛选,得到重组表达质粒pW425t-CBHⅡ。thyA基因缺陷的E.coliX13必须在加有外源胸腺嘧啶核苷(50 μg/ml)的LB培养基上恢复生长。
1.2.6 CBHⅡ基因在大肠杆菌中的表达
在普通LB液体培养基(未添加胸腺嘧啶核苷)中接种含有pW425t-CBHⅡ重组质粒的阳性菌株,200 r/min、37℃过夜培养。取2 ml上述菌液接种于100 mlLB中,37 ℃、250 r/min培养至OD600在0.6~0.8间,加入40 mmol/l DL-苏氨酸。每1 h取一次菌液,直到5 h,含空载体pW425t的E.coliX13以同样方法诱导作对照。
1.2.7 SDS-PAGE分析
对每一时间诱导得到的菌液统一调OD600值为0.7,分别取菌液1.0 ml,4℃离心收集菌体,用生理盐水洗涤2次,加入80 μl去离子水到沉淀菌体中,再加20 μl 5×SDS凝胶上样缓冲液,煮沸10 min在沸水中,离心10 min、15 000 r/min,参照分子克隆中SDSPAGE方法取上清液10 μl进行电泳。
1.2.8 重组pW425t-CBHⅡ大肠杆菌中CBHⅡ酶活的平皿检测
采用刚果红染色法[4]:用牙签将pW425t-CBHⅡ大肠杆菌转化子转移到涂布终浓度为5 mg/ml溶菌酶的LB琼脂平板上,37℃保温4 d;1 mg/ml的刚果红染色1 h,去掉染液,用1 mol/l的NaCl溶液洗涤平板1 h。
1.2.9 CBHⅡ酶解最适温度、pH值以及酶活力的测定
参照pNPC法[5],利用50 mmol/l、pH值5.0的醋酸钠缓冲液配2.5 mmol/l的pNPC溶液,取1 ml加入1 ml粗酶液,50℃保温30 min,终止反应用1%Na2CO31 ml,410 nm比色。酶活力用对硝基酚的生成量表示,每分钟水解pNPC产生1 μmol对硝基酚所需要的酶量定义为一个酶活力单位。
2 结果与分析
2.1 康宁木霉的总RNA提取(见图1)

图1 康宁木霉总RNA提取
电泳检测经抽提纯化好的康宁木霉AS3.2774总RNA,由图1可以看出,28 s与18 s条带完整性较好,条带清晰,明亮,锐利,没有基因组污染与降解现象,说明已提到质量较好的总RNA,可进行下一步反转录反应。
2.2 PCR扩增
利用设计好的引物,通过反转录PCR扩增CBHⅡ基因。电泳检测,扩增出与预期大小1.4 kb相符的条带,如图2。
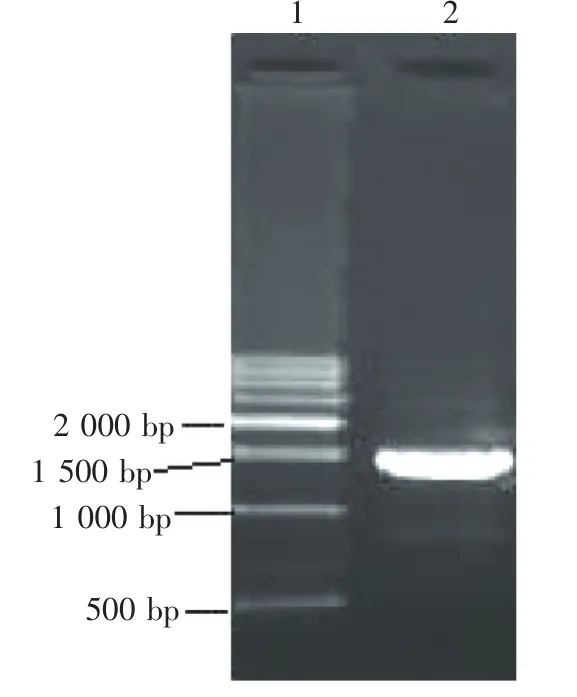
图2PCR扩增CBHⅡ基因
2.3 CBHⅡ基因的克隆及序列分析
将上述PCR产物经回收纯化,与pMD18-T Sim⁃ple载体连接转化DH5a,质粒小量提取,SmaI和SphI酶切鉴定、PCR鉴定证明挑取得6个白色菌落都为阳性菌,证明已获得重组克隆pMD18-T-CBHⅡ菌(如图3)。将阳性菌送北京奥科生物技术有限公司测序,经分析所得的CBHⅡ基因的开放阅读框架为1 413 bp,编码470个蛋白,其序列与Gene Bank发表的标准序列相比同源性达到99.86%。

图3 酶切鉴定重组克隆质粒
2.4 重组表达质粒的构建及鉴定
在普通LB液体培养基中培养生长功能弥补筛选获得的菌落,对筛选的8个菌落提取质粒,用SmaI和SphI酶切鉴定重组质粒,其中两个质粒菌株获得了约3.7 kb的pW425t片段和1.4 kb的插入片段,表明已构建出重组表达质粒pW425t-CBHⅡ(如图4)。
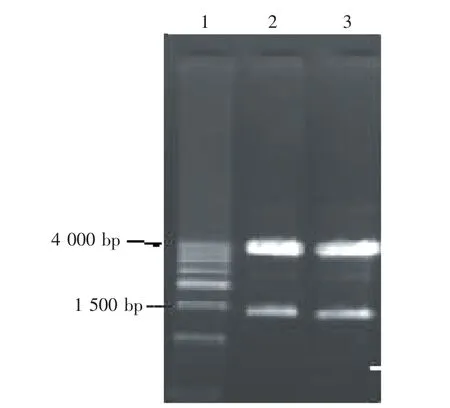
图4 酶切鉴定重组表达质粒pW425t-CBHⅡ
2.5 SDS-PAGE分析(见图5)

图5 CBHⅡ基因表达产物的SDS-PAGE电泳检测
上述鉴定为阳性克隆的菌株1利用SDS-PAGE分析在不同时间的表达情况。与对照组相比,阳性菌株在约49.6 kD处有一特异条带,与预期CBHⅡ蛋白的相对分子量相同,表明CBHⅡ蛋白得到表达,在1~5 h时间内,蛋白量有逐渐增加的趋势,6 h后基本达到稳定。
2.6 平皿检测转基因大肠杆菌CBHⅡ的酶活
刚果红染色洗涤后,发现菌落的周围出现了清晰的透明圈,说明转基因大肠杆菌具有分泌纤维素酶的功能(如图 6)。
2.7 CBHⅡ酶解最适温度和pH值的测定
研究表明:CBHⅡ酶活反应的最适温度为50℃,30~50℃时CBHⅡ的相对酶活逐渐升高,50℃最高,之后随着温度的升高相对酶活逐渐下降(如图7);CBHⅡ酶活反应的最适pH值为5.0,pH值从3.0~5.0时CBHⅡ的相对酶活逐渐升高,pH值为5.0时达到最高,之后随着pH值的继续升高,相对酶活逐渐下降(如图8)。并通过pNPC法测得温度50℃、pH值5.0时重组pW425t-CBHⅡ大肠杆菌CBHⅡ的酶活力为0.080 2 U/ml。
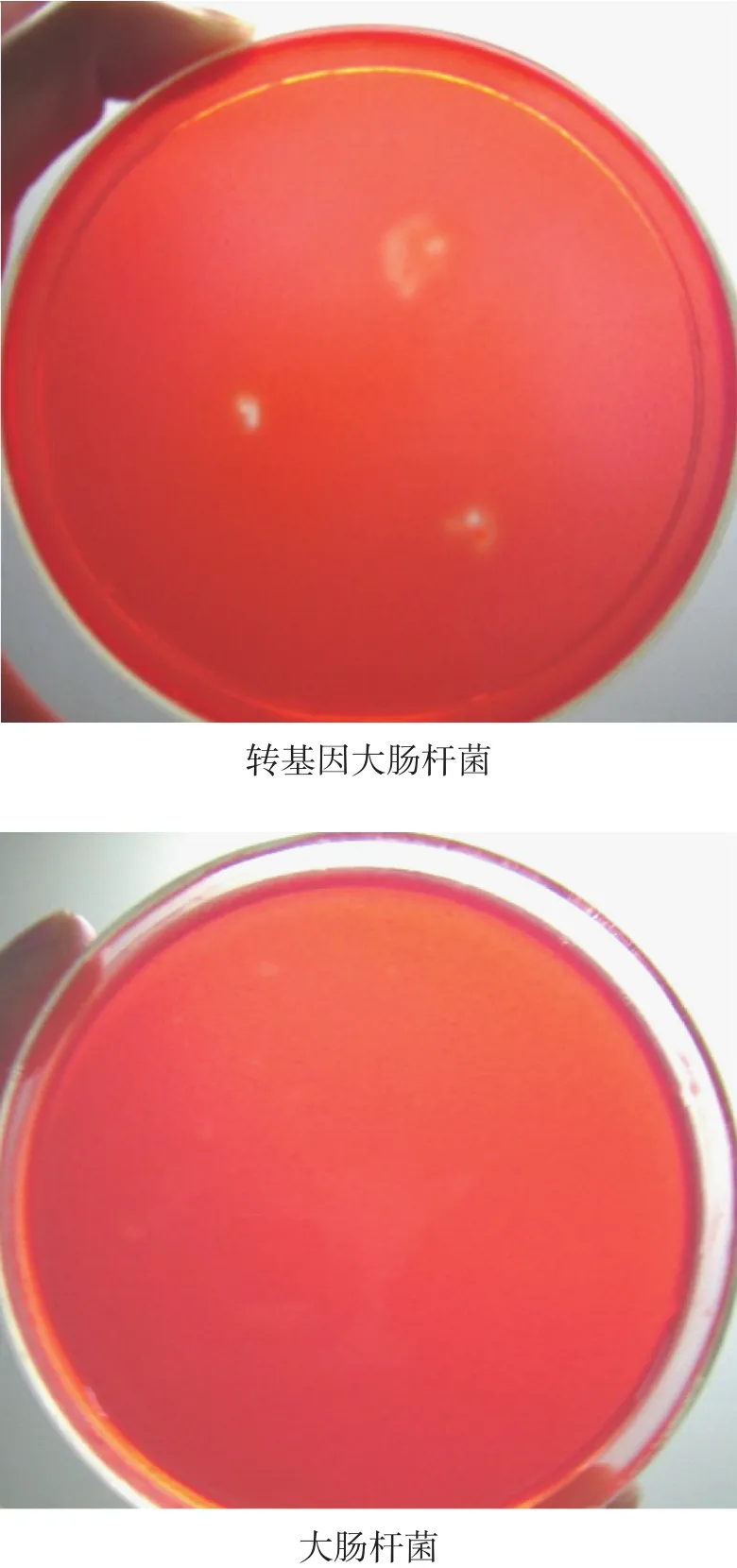
图6 转基因大肠杆菌刚果红染色产生的水解圈
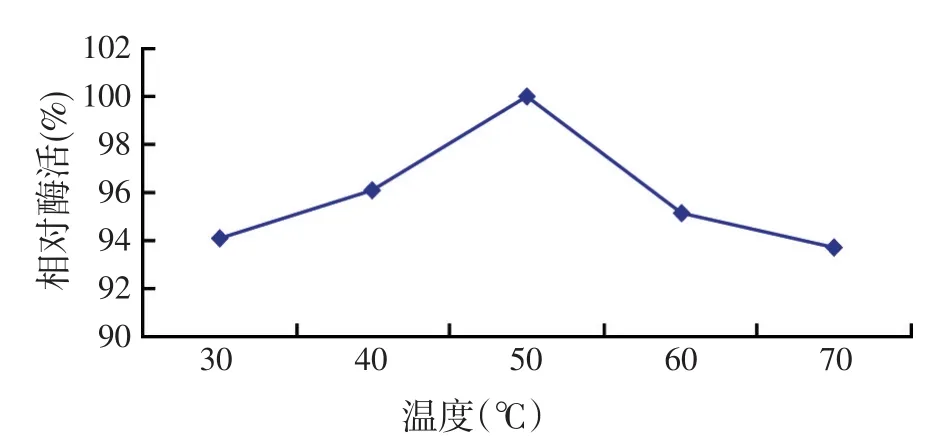
图7 温度对CBHⅡ酶活的影响
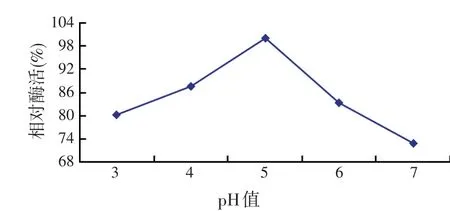
图8 pH值对CBHⅡ酶活的影响
3 讨论
本试验成功克隆了康宁木霉AS3.2774 CBHⅡ基因。祝令香等(2001)[6]克隆并测定了康宁木霉K801纤维素酶CBHⅡ基因序列。吴兴泉等(2006)[7]克隆并序列分析了康宁木霉CBHⅡ基因的cDNA序列。黄时海等(2011)[8]克隆了康宁木霉纤维素酶CBHI基因。这说明本研究的试验方法是可行的。
本研究在对CBHⅡ基因的克隆基础上,将其与非抗性的可在大肠杆菌和乳酸菌之间穿梭的以thyA基因为选择压力的表达载体pW425t连接,转化入thyA基因缺陷型大肠杆菌,并且成功表达。pW425t是在大肠杆菌和乳酸菌之间穿梭表达的载体,首先在大肠杆菌中表达重组表达质粒,原因是大肠杆菌具有培养方便、操作简单、遗传背景清楚、特别是应用氯化钙转化方法简单。同时,杨桂莲等(2010)[9]将瑞士乳杆菌胞外蛋白水解酶基因与非抗性表达载体pW425t重组并在thyA基因缺陷型大肠杆菌成功表达。这为本试验的研究提供了理论基础。
本研究为下一步pW425t-CBHⅡ在thyA基因缺陷性乳酸菌株中表达提供了依据,为构建食品饲料级的耐酸性的降解纤维素的基因工程乳酸菌奠定了基础,也为其它纤维素酶基因的克隆和表达提供了参考依据。

