脂多糖协同MSU诱导THP1分泌IL-1β和IL-18
丁利平,刘冬舟,黎 丽,黄 钟
1)深圳大学医学部,广东深圳 518060;2)深圳市人民医院暨南大学第二临床医学院风湿免疫科,广东深圳518020
【生物工程 / Bioengineering】
脂多糖协同MSU诱导THP1分泌IL-1β和IL-18
丁利平1,2,刘冬舟2,黎 丽1,黄 钟1
1)深圳大学医学部,广东深圳 518060;2)深圳市人民医院暨南大学第二临床医学院风湿免疫科,广东深圳518020
通过合成尿酸钠结晶(monosodium urate crystals, MSU)分析其对人外周血单核细胞系THP1的促炎作用,分别以 0、1.0、10.0和100.0μmol/L的MSU刺激THP1细胞4h,检测不同浓度的MSU对炎症体组分Nod 样受体蛋白3(Nod-like receptor protein 3, NLRP3)、半胱氨酸天冬氨酸特异性蛋白水解酶(caspase-1)及促炎因子白细胞介素-1β(interleukin-1β, IL-1β)和IL-18的信使核糖核酸(messenger ribonucleic acid, mRNA)表达的影响.为研究toll 样受体4(toll like receptor 4,TLR4)的配体脂多糖的作用,用1.0ng/mL的脂多糖(lipopolysaccharide, LPS)预刺激THP1细胞3h,再加100.0μmol/mL的MSU刺激细胞,通过实时荧光定量聚合酶链式反应及酶联免疫吸附试验,检测LPS对MSU诱导的促炎因子IL-1β和IL-18的mRNA及蛋白水平.研究发现,在THP1细胞中,100.0μmol/L的MSU即可显著激活炎症体的mRNA,但其对促炎因子IL-1β及IL-18的mRNA表达的诱导作用却不明显,加入1.0ng/mL LPS预刺激3h后,MSU诱导的THP1细胞IL-1β和IL-18的表达量显著增加.证明脂多糖对MSU诱导THP1细胞产生IL-1β 和IL-18有协同作用.
细胞免疫学;尿酸钠结晶;脂多糖;痛风;炎症体;白细胞介素-1β;白细胞介素-18
尿酸是人体的正常代谢物,主要由内源性(核酸)和外源性(食物摄入)嘌呤代谢所产生.体内的尿酸过高或排泄不畅,就容易与钠离子结合形成尿酸钠结晶(monosodium urate crystals,MSU),尿酸和尿酸盐结晶被认为是形成痛风的主要因素[1-3],因此,痛风也被认为是一种代谢性疾病.与尿酸相关的另一种代谢性疾病高尿酸血症也相当普遍[4],长期的高尿酸血症通常会诱发痛风,但高尿酸血症人群常伴随无症状期,只有部分人会发展为痛风[5-6],说明机体存在其他因素调控尿酸结晶形成和炎症活性.
toll 样受体4(toll like receptor 4, TLR4)表达于造血细胞及非造血细胞的表面,属于模式识别受体的家族成员,可识别来自病原体的外源性及内源性损伤相关的分子模式,并受内源性或外源性配体刺激物的激发导致急性或慢性炎症[7-8],TLR4通路是否参与痛风的发病尚不清楚.脂多糖(lipopolysaccharide,LPS)为革兰氏阴性细菌细胞壁的主要成分,可被TLR4识别[9].本实验以LPS为例,研究TLR4是否参与扩大MSU诱导的人外周血单核细胞系THP1的炎症反应,探讨THP1细胞的炎症体及促炎因子对不同浓度的MSU的响应,并研究LPS是否可作为MSU的协同刺激剂,对THP1细胞分泌促炎因子IL-1β和IL-18起到放大作用.
1 材料与方法
1.1 主要试剂与仪器
1640培养基及胎牛血清购自Gibco公司;尿酸购自Sigma公司;脂多糖LPS购自Sigma公司;细胞的核糖核酸(ribonucleic acid, RNA)提取试剂Trizol Reagent购自美国Invitrogen公司;反转录试剂盒购自Thermo公司;实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction, qPCR)所用的核酸绿色激发波长的染料SYBR Green试剂盒购自Bio-Rad;酶联免疫吸附测定(enzyme linked immunosorbent assay, ELISA)试剂盒购自eBioscience;生物安全柜购自香港力康Heal Force,CFX-96荧光定量PCR仪购自美国Bio-Rad,Epoch微量分光光度计购自美国Biotek公司.
1.2 MSU的制备
根据文献[10]方法稍加改进制备MSU:称取1.0g 尿酸和24.0g NaOH,溶解于200mL纯净水,使用HCl调节溶液pH值为7.2,120℃孵育6h,变为无热源的尿酸钠溶液,室温下冷却后弃上清,留沉淀物,经冷冻干燥机干燥后将结晶储存于4℃备用.
1.3 细胞的培养和处理
外周血单核细胞THP1细胞株购自中国科学院上海细胞生物研究所,培养液选用1640全培养基(含体积分数为10%的小牛血清、100U/mL的青霉素和100μg/mL的链霉素).将外周血单核细胞THP1于37℃、体积分数为5% 的CO2恒温培养箱中培养,隔天传代,取对数生长期细胞进行实验.细胞处理如下:将对数生长期的细胞换至无血清1640培养基中,将细胞分成3批进行处理.① 首批细胞用0、1.0、10.0和100.0μmol/mL浓度梯度的MSU刺激4h,刺激结束后细胞直接提RNA;② 第2批细胞分为4组,处理如下:第Ⅰ组:用100.0μmol/mL 的MSU刺激4h后提取RNA;第Ⅱ组:用1.0ng/mL的LPS刺激3h后提取RNA;第Ⅲ组:先用1.0ng/mL LPS刺激3h,再用100.0μmol/mL MSU刺激4h后提取RNA;第Ⅳ组:对照组,用无血清培养基培养细胞4h后提取RNA,每组实验重复6次.③ 第3批细胞分为4组,处理如下:第Ⅴ组:用100.0μmol/mL 的MSU刺激24h;第Ⅵ组:用1.0ng/mL的LPS刺激24h;第Ⅶ组、先用1.0ng/mL LPS刺激3h,再用100.0μmol/mL MSU刺激24h;第Ⅷ组:对照组,用无血清培养基培养细胞24h.然后将第Ⅴ组至第Ⅷ组细胞培养后离心,取细胞培养上清液保存于-80℃,用于后续ELISA实验测定上清细胞因子,每组实验重复 6次.
1.4 RNA提取及qPCR检测mRNA表达
细胞总RNA用Trizol提取后经分光光度计定量,将不同样品的RNA含量调整一致后,反转录为cDNA模板,于-20℃保存备用.实验所用引物序列见表1.

表1 人相关基因的引物序列Table 1 List of the sequences of human gene primers
表1引物经上海生物工程公司合成后按照Bio-Rad的SYBR体系进行qPCR扩增,PCR产物经过溶解曲线检验,将目的基因扩增产物与看家基因β-actin进行比较,经2-ΔΔct方法计算出该基因信使RNA (messenger RNA, mRNA)的相对表达量.
1.5 检测细胞培养上清液中蛋白的分泌
采用ELISA方法测定细胞上清液中分泌的炎性细胞因子白细胞介素-1β(IL-1β)和IL-18,参照文献[11]进行ELISA操作,于微量酶标仪上测定450nm外的光密度值(optical density, OD),记作D(450),每组实验重复6次.最后根据标准品读数绘制标准曲线,得到回归方程,根据方程式计算得出所测样品浓度,乘上稀释倍数,即为样品的实际浓度.
1.6 统计学方法
2 结果及分析
2.1 MSU对炎症体组分及促炎因子IL-1β和IL-18mRNA表达量的影响
提取第1批细胞的RNA,经反转录cDNA后,qPCR分别检测炎症体组分NLRP3、半胱氨酸天冬氨酸特异性蛋白水解酶(caspase-1),以及炎症细胞因子IL-1β和IL-18的mRNA表达,结果如图1,1)*表示P<0.05;2)**表示P<0.01;3)***表示P<0.0001. 当刺激THP1细胞的MSU浓度为10μmol/mL时,炎症体组分NLRP3和caspase-1的mRNA的表达即被激活,与对照组相比差异具统计学意义(P<0.05),且随MSU浓度的增加而增加,当MSU浓度为100μmol/mL时,NLRP3和caspase-1的mRNA表达量分别为对照组的3.7倍和2.9倍(P<0.01),如图1(a);当用浓度为10μmol/mL的MSU刺激THP1细胞4h,炎性细胞因子IL-1β及IL-18的mRNA表达量与对照组相比无显著性差异;当MSU浓度增至100.0μmol/mL时,刺激THP1细胞4h后,THP1细胞所表达的IL-1β mRNA 和IL-18mRNA分别为对照组的1.7倍和1.9倍,与对照组相比差异具统计学意义(P<0.05),如图1(b);当MSU浓度为1.0μmol/mL时,THP1细胞中炎症小体组分NLRP3、caspase-1及炎性细胞因子IL-1β和IL-18的mRNA表达与对照组相比均无显著性差异(P>0.05).
2.2 LPS协同MSU刺激对IL-1β和IL-18mRNA表达的影响
将第2批细胞提取的4组RNA经反转录cDNA后,qPCR检测IL-1β及IL-18的mRNA表达,结果如图2.第Ⅰ组和第Ⅱ组中,IL-1β的mRNA表达量分别为第Ⅳ组的1.6倍和2.1倍;而第Ⅲ组中IL-1β 的mRNA表达量为第Ⅳ组的6.5倍,与第Ⅰ组相比,差异具有显著性(P<0.0001),如图2(a) .第Ⅰ组和第Ⅱ组中,IL-18的mRNA表达量分别为第Ⅳ组的1.8倍和2.0倍;而第Ⅲ组中IL-18的mRNA表达量为第Ⅳ组的7.1倍,与第Ⅰ组相比,IL-18的mRNA表达量差异具有显著性(P<0.0001),如图2(b).

图2 脂多糖协同MSU诱导THP1促炎因子IL-1β和IL-18的mRNA相对表达量Fig.2 The mRNA relative expression of IL-1β and IL-18in THP1cells stimulated by MSU and LPS
2.3 LPS协同MSU刺激对IL-1β和IL-18蛋白表达的影响
将第3批细胞离心取上清液,ELISA检测THP1细胞上清液中IL-1β及IL-18的蛋白表达,结果如图3.处理后,第Ⅴ组与第Ⅵ组细胞上清中IL-1β 的蛋白表达量分别为(170.0±23.6)和(336.7±58.9) pg/mL;而第Ⅶ组IL-1β蛋白表达量为(1291.7±180.0) pg/mL,与第Ⅴ组相比差异具有显著性(P<0.0001),如图3(a) .第Ⅴ组与第Ⅵ组细胞上清液中IL-18的蛋白表达分别为(148.3±27.1) pg/mL和(240.0±35.2) pg/mL;而第Ⅶ组IL-18的蛋白表达量为(916.7±121.0) pg/mL,与第Ⅴ组相比差异具有显著性(P<0.0001),如图3(b).
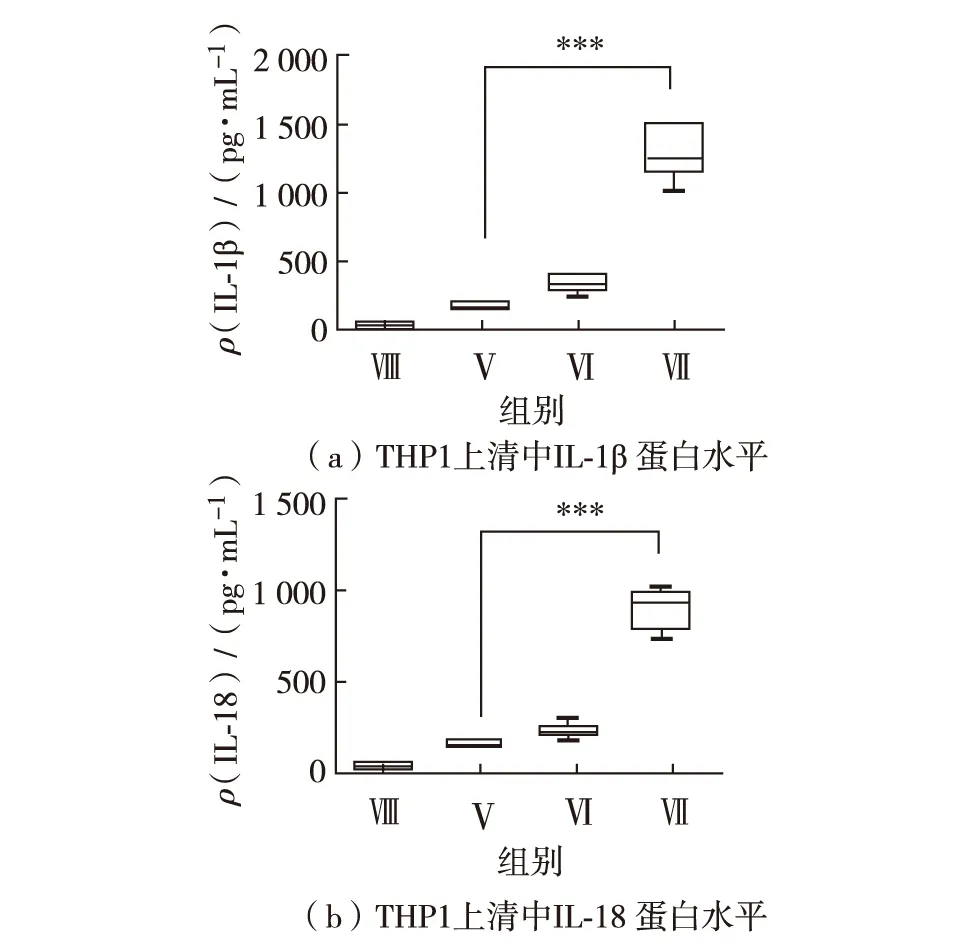
图3 LPS协同MSU诱导THP1促炎因子IL-1β 和IL-18的蛋白表达水平Fig.3 The protein levels of IL-1β and IL-18in THP1 cells stimulated by MSU and LPS
3 讨 论
自身炎症体疾病是由于炎症体调控子突变或过表达导致炎症体的激活而引起的疾病[12],以体内无高滴度的自身抗体和抗原特异T细胞的自发炎症为特征[13],痛风属于炎症体疾病的一种[14],是由于人体血液中尿素浓度过高形成尿素盐沉积在关节,软骨或其他软组织中形成结晶[15],导致炎症体的激活而引起的自限性炎症疾病[16].
MSU的促炎功能主要依赖于NLRP3炎症体的激活及对caspase-1的募集,炎症体通过中央分子支架直接或间接募集并激活非活性的蛋白酶原caspase-1[17].caspase-1的主要底物为细胞因子IL-1β和IL-18,活化后的caspase-1将IL-1β和IL-18前体切割加工后释放活性的细胞因子IL-1β和IL-18[18]. IL-1β募集和激活炎症白细胞通过周边组织扩大炎症,对于痛风急性炎症的启动起到关键性的作用[19]. IL-18的表达与痛风中的炎症活性呈正相关[20].这与本研究的MSU引起THP1细胞炎症体激活及IL-1β和IL-18基因表达结果相一致.
人体中的尿酸浓度升高并不都会引起痛风及过度炎症,如早期高尿酸血症患者并无症状和痛风发作[21],这说明单纯的尿酸增高不足以引起痛风,MSU需要有协同的刺激剂才能引起细胞炎症反应,本研究表明TLR4的配体LPS与MSU协同作用可以促使人单核细胞大量释放IL-1β和IL-18,THP1细胞经1.0ng/mL的LPS进行预刺激3h后再用MSU刺激,比单独用MSU刺激THP1细胞释放的IL-1β和IL-18显著升高.
结 语
综上研究表明,MSU虽然能引起炎症体的激活,但对刺激炎性细胞因子的形成作用却有限,外加微量的LPS预刺激可显著提高炎性细胞因子的释放,说明TLR4配体LPS参与了MSU诱导的单核细胞炎症的放大,因此,推测TLR4可能参与痛风的发生,这为痛风发病需要除MSU之外第二刺激物的假说提供了实验支持,为探索诱发痛风的第二刺激物提供了研究方向.
/ References:
[1] Hyndman D, Liu S, Miner J N.Urate handling in the human body[J].Current Rheumatology Reports,2016,18(6):34.
[2] Wang Z, Königsberger E.Solubility equilibria in the uric acidsodium urate-water system[J].Thermochim Acta, 1998, 310(2):237-242.
[3] Dalbeth N, Merriman T R, Stamp L K.Gout[J].Lancet,2016, 105(19):677-678.
[4] Abrahams M N.Gout and hyperuricaemia[J].South African Medical Journal,2015, 105(12): 1078.
[5] Ao J, Goldblatt F, Casson R J.Review of the ophthalmic manifestations of gout and uric acid crystal deposition[J].Clinical & Experimental Ophthalmology,2016,doi: 10.1111/ceo.12749.
[6] Neogi T.Asymptomatic hyperuricemia: perhaps not so benign?[J].Journal of Rheumatology,2008, 35(5): 734-737.
[7] Akira S,Takeda K.Toll-like receptor signaling[J].Nature Reviews Immunology,2004, 4(7): 499-511.
[8] Yu Li, Wang Liantang, Chen Shangwu.Endogenous toll-like receptor ligands and their biological significance[J].Journal of Cellular and Molecular Medicine,2010,14(11):2592-2603.
[9] Molteni M, Gemma S, Rossetti C.The role of toll-like receptor 4in infectious and noninfectious inflammation[J].Mediators Inflammation,2016,2016: 6978936.
[10] Murakami Y, Akahoshi T, Hayashi I, et al.Induction of triggering receptor expressed on myeloid cells 1in murine resident peritoneal macrophages by monosodium urate monohydrate crystals[J].Arthritis & Rheumatism,2006, 54(2): 455-462.
[11] 丁利平,黎 丽,刘冬舟,等.IL-37对白塞病患者单核细胞分泌炎症因子的影响[J].深圳大学学报理工版,2016, 33(5):447-451.Ding Liping, Li Li, Liu Dongzhou, et al.The anti-inflammatory effects of interleukin-37on active Behcet’s disease[J].Journal of Shenzhen University Science and Engineering,2016, 33(5):447-451.(in Chinese)
[12] McDermott M F, Aksentijevich I, Galon J, et al.Germline mutations in the extracellular domains of the 55kDa TNF receptor, TNFR1, define a family of dominantly inherited autoinflammatory syndromes[J].Cell, 1999,97(1): 133-144.
[13] Masters S L, Simon A, Aksentijevich I, et al.Horror autoinflammaticus: the molecular pathophysiology of autoinflammatory disease[J].Annunal Review Immunology,2009,27: 621-668.
[14] Martinon F.Mechanisms of uric acid crystalmediated autoinflammation[J].Immunological Reviews,2010,233(1):218-232.
[15] Sharon Y, Schlesinger N.Beyond joints: a review of ocular abnormalities in gout and hyperuricemia[J].Current Rheumatology Reports,2016,18(6): 1-8.
[16] Galon J, Aksentijevich I, McDermott M F, et al.TNFRSF1A mutations and autoinflammatory syndromes[J].Current Opinion Immunology,2000, 12(4): 479-486.
[17] Cohen G M.Caspases: the executioners of apoptosis[J].Biochemical Journal, 1997, 326( Pt1): 1-16.
[18] Keller M, Ruegg A,Werner S, et al.Active caspase-1is a regulator of unconventional protein secretion[J].Cell,2008, 132(5): 818-831.
[19] Pope R M, Tschopp J.The role of interleukin-1and the inflammasome in gout: implications for therapy[J].Arthritis & Rheumatism,2007, 56(10): 3183-3188.
[20] Cavalcanti N G, Marques C D L, Lins T U L E, et al.Cytokine profile in gout: inflammation driven by IL-6and IL-18?[J].Immunological Investigation,2016, 45(5): 383-395.
[21] Reuss-Borst M A.Hyperuricemia.When and how to treat?[J].Der Internist,2016, 57(2):194-201.
【中文责编:晨 兮;英文责编:艾 琳】
Synergistic action of LPS on production of IL-1β and IL-18induced by MSU in THP1cells
Ding Liping1,2, Liu Dongzhou2†, Li Li1†, and Huang Zhong1
1) School of Medicine, Shenzhen University, Shenzhen 518060, Guangdong Province, P.R.China2) Department of Rheumatology & Immunology, Shenzhen People’s Hospital,2nd Clinical Medical College of Jinan University, Shenzhen 518020, Guangdong Province, P.R.China
The synthesized monosodium urate crystals (MSU) was used for pro-inflammatory analyses in THP1cells.THP1cells were treated with 0, 1.0, 10.0and 100.0μmol/L MSU for 4h in order to analyze the effects of MSU on the expression of messenger ribonucleic acid (mRNA) of inflammasome Nod-like receptor protein 3(NLRP3), caspase-1and pro-inflammatory cytokines interleukin-1β (IL-1β) and IL-18.To investigate the role of lipopolysaccharide (LPS)-toll like receptor 4(TLR4) ligand, THP1cells were pre-treated with 1.0ng/mL LPS 3h, and then stimulated with 100.0μmol/mL MSU.The mRNA and protein expression of pro-inflammatory cytokines IL-1β and IL-18induced by LPS and MSU were detected using quantitative real-time polymerase chain reaction (qPCR) and enzyme linked immunosorbent assay (ELISA), respectively.The results show that 100.0μmol/L MSU could activate the mRNA expression of inflammasome, but has comparatively less effect on the mRNA expression of IL-1β and IL-18in THP1cells.The productions of IL-1β and IL-18were significantly amplified in THP1cells pretreated with 1.0ng/mL LPS for 3h before the MSU stimulation.Results suggest that MSU can act in synergy with LPS to enhance the release of IL-1β and IL-18in mononuclear cells.
cellular immunology; monopodium urate crystals; lipopolysaccharide; gout; inflammasome; interleukin-1β (IL-1β); interleukin-18(IL-18)
R 392
10.3724/SP.J.1249.2016.06566
中国博士后科学基金资助项目(2015M572370); 深圳市科技计划资助项目(JCYJ20130402092657775)
丁利平(1984—),女,深圳大学博士后研究人员.研究方向:自身免疫及炎症.E-mail: 13552432187@163.com
引 文:丁利平,刘冬舟,黎 丽,等.脂多糖协同MSU诱导THP1分泌IL-1β和IL-18[J].深圳大学学报理工版,2016,33(6):566-570.

