survivin和bcl-2双基因敲减对人舌癌裸鼠移植瘤的抑制作用*
饶国洲,娄 鸣,景 娟,牛 洁
1.西安交通大学口腔医院医学研究中心(西安710004),2.西安医学院口腔系(西安710021)
survivin和bcl-2双基因敲减对人舌癌裸鼠移植瘤的抑制作用*
饶国洲1,娄 鸣2,景 娟1,牛 洁1
1.西安交通大学口腔医院医学研究中心(西安710004),2.西安医学院口腔系(西安710021)
目的:探讨survivin和bcl-2单基因与双基因敲减后对舌癌裸鼠移植瘤成瘤性的影响。方法:将筛选含有转染survivin siRNA-Tca8113;bcl-2 siRNA-Tca8113;survivin/bcl-2 siRNA-Tca8113;Negative-siRNA-Tca8113细胞及未转染的Tca8113细胞分组进行培养,细胞数调成1×107细胞/ml接种于裸鼠左后肢股部,以无菌生理盐水做阴性对照,隔日观察裸鼠肿瘤发生情况,并测量肿瘤大小、体积。接种5周后处死并测量肿瘤体积大小、比较抑制结果及肿瘤组织切片HE染色病理分析。结果:肿瘤形成率显示空白对照、Lipofectamine和Negative-siRNA三组的裸鼠成瘤率100%,生长速度快、瘤体大;单基因敲减组(bcl-2 siRNA、survivin siRNA)和双基因敲减组(survivin/bcl-2siRNA)瘤体较空白对照组小,生长速度慢;双基因敲减组成瘤率低(66.6%),注射生理盐水的阴性对照组接种后未出现肿瘤。肿瘤生长曲线显示空白对照、Lipofectamine、Negative-siRNA 三组肿瘤生长速度明显快于单基因敲减和双基因敲减组,而双基因敲减组不仅成瘤延长,而且生长速度明显慢于单基因敲减组。肿瘤抑制率显示双基因敲减(84.5%)明显高于单基因敲减(67.6%和69.8%,P<0.05);肿瘤组织HE染色镜下可见:空白对照、Lipofectamine、Negative-siRNA组肿瘤呈浸润性生长,有大片坏死区,survivin和bcl-2基因敲减后的肿瘤组织与周围组织分界较清,未见明显浸润现象,肿瘤组织坏死区较少。结论:survivin和bcl-2基因敲减能有效抑制裸鼠移植瘤成瘤性,双基因敲减对裸鼠移植瘤抑制作用强于单基因敲减。
在本项目前期的实验研究中[1-4],针对survivin和bcl-2基因各设计4对RNA干扰序列,经筛选得到2条有效干扰序列分别转染到高表达survivin和bcl-2蛋白的Tca8113细胞中,筛选到稳定表达的转化子细胞。实验中观察到干扰后的细胞生长受到抑制且细胞发生凋亡,这种作用表现于双基因干扰效果优于单基因干扰的效果。这是在体外培养细胞中显示的结果,在体内的效果不得而知。为进一步研究RNA干扰下调survivin和bcl-2基因表达治疗口腔鳞癌的可行性,本实验以裸鼠为研究对象通过皮下注射经单基因和双基因敲减后的Tca8113细胞,探讨舌癌细胞移植瘤的成瘤能力及对肿瘤的抑制作用,以期为舌癌的基因治疗提供实验依据。
材料与方法
1 材 料 人舌癌细胞系Tca8113细胞株(本室保存);survivin siRNA-Tca8113,bcl-2 siRNA-Tca-8113,survivin/bcl-2 siRNA-Tca8113,Negave-siRNA-Tca8113(均为本文作者构建);18只4周龄BALB/C裸鼠(西安交大医学院动物中心提供),体重18~20 g,雌雄各半,分为六组每组3只,裸鼠在无特殊病原体条件(SPF)下饲养。CO2培养箱(Thermo);台式离心机(Sigma);恒温摇床(Fuma);台式低温高速离心机(Sigma);台式高速离心机(Sigma);RPMI1640培养基(Hyclon);胎牛血清(Gibco);显微镜(Nikon);HE染色液(自配)。
2 方 法 ①细胞培养:实验分为空白对照组;脂质体组(Lipofectamine);RNA阴性敲减组(Negative siRNA);单基因敲减组(survivin siRNA、bcl-2 siRNA);双基因敲减组(survivin/bcl 2 siRNA)。复苏各组细胞,细胞培养采用含10%胎牛血清、100 μg/ml双抗的RPMI1640培养基,置37 ℃,5% CO2培养箱中培养,待细胞生长80%消化传代培养。②裸鼠荷瘤试验:取以上各组1×107细胞/ml悬浮于0.2 ml无血清RPMI-1640培养液中,将裸鼠随机分成六组,每组3只,无菌条件下接种于裸鼠左后肢股部,以无菌生理盐水做阴性对照,隔日观察裸鼠肿瘤发生情况,并测量肿瘤大小、体积。接种5周后处死并测量肿瘤体积大小、比较抑制结果。肿瘤体积计算方法:肿瘤体积=肿瘤长径×肿瘤短径2×0.5。③肿瘤组织HE染色分析:组织固定包埋、切片脱蜡至水,苏木素染液染色5 min,自来水洗10 s,盐酸乙醇分化5 s,自来水洗20 s,返蓝20 s,自来水洗60 s,伊红染色液染色3 min,自来水洗5 s,显微镜下观察。
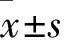
结 果
1 肿瘤形成率 空白对照、Lipofectamine和Negative-siRNA 三组的裸鼠接种9 d后可见局部肿瘤形成,成瘤率100%,生长速度快、瘤体大。单基因敲减组(bcl-2 siRNA 、survivin siRNA )分别于接种后16 d和17 d局部肿瘤形成,成瘤率100%,瘤体较空白对照组小,生长速度慢。双基因敲减组(survivin/bcl-2-siRNA)于接种后22 d,3只裸鼠中有2只局部肿瘤形成,成瘤率66.6%,且瘤体较单基因敲减组小,生长速度慢。注射生理盐水的阴性对照组接种后未出现肿瘤形成。从裸鼠外表观察,随着瘤体的增大其体质越来越消瘦且精神状态差,相反瘤体小体质和状态相对较好,阴性对照组体质健壮。
2 肿瘤生长曲线 见图1。以生长天数为横坐标,肿瘤体积为纵坐标绘制肿瘤生长曲线,空白对照、Lipofectamine、Negative-siRNA 三组肿瘤生长速度明显快于单基因敲减组及双基因敲减组(P<0.05),双基因敲减组不仅成瘤时间延长,而且生长速度明显慢于单基因敲减组(P<0.05)。
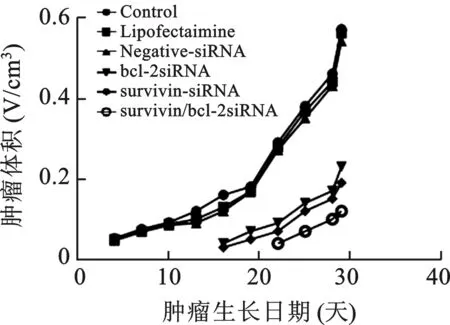
图1 不同处理组裸鼠皮下肿瘤生长曲线
3 肿瘤抑制率 见表1。

表1 不同处理组裸鼠皮下肿瘤生长重量及抑制率比较 (n=3)
注:与对照组比较,*P<0.05;与 bcl-2 siRNA、survivin siRNA比较,△P<0.05
肿瘤抑制率(%)=(对照组平均瘤重-治疗组平均瘤重)/对照组平均瘤重×100% 。结果显示基因敲减后的肿瘤重量明显低于空白组、Negative-siRNA和Lipofectamine组(P<0.05),双基因敲减组低于单基因敲减组的瘤体重量(P<0.05),单基因敲减组之间瘤体重量比较差异无统计学意义(P>0.05)。肿瘤抑制率显示双基因敲减组明显高于单基因敲减组(P<0.05)。
4 肿瘤组织病理 见图2。空白对照组、Lipofectamine组、Negative-siRNA组肿瘤呈浸润性生长,有大片坏死区。survivin和bcl-2基因敲减后的肿瘤组织与周围组织分界较清,未见明显浸润现象,肿瘤组织坏死区较少。

A: 对照组;B:Lipofectamine;C: Negative-siRNA;D:bcl-2 siRNA;E:survivin siRNA;F: survivin/bcl-2 siRNA
图2 不同处理组裸鼠皮下肿瘤组织(HE×200)
讨 论
基因敲减或称基因敲低(Gene knock-down),是利用双链小RNA高效、特异性降解细胞内同源mRNA,从而阻断体内靶基因的表达,使细胞出现靶基因缺失的表型。通过降解具有同源序列靶基因的mRNA以此达到阻止基因表达的目的。研究表明[5-6]:survivin和bcl-2是两种重要的肿瘤凋亡抑制基因,几乎在所有常见的肿瘤组织中过量表达。survivin抑制细胞凋亡机制是直接作用于Caspase,主要抑制终末效应器Caspase-3和 Caspase-7的活性或干扰Caspase-9的活性,阻断各种刺激诱导的下游细胞凋亡的共同通路[7-9]。bcl-2与survivin抑制细胞凋亡机制有所不同,bcl-2是通过干扰细胞色素C自线粒体的释放,从而阻断Caspase蛋白酶连锁反应的激活,survivin是在bcl-2的下游直接抑制Caspase蛋白酶。近年来有研究报道[10-12]:survivin与bcl-2在舌鳞癌细胞系Tca-8113细胞中高表达,表明survivin的表达与bcl-2有明显的相关性,且survivin单独或协同bcl-2抑制细胞凋亡[13]。survivin与bcl-2基因都是由无TATA的富含GC启动子调节的,转录激活均增强细胞的增殖。应用RNA干扰进行基因敲减技术抑制抗凋亡基因表达,这种靶向作用的特点是抑制肿瘤细胞增殖促进其凋亡,但对正常组织和细胞不受影响。因此,本研究针对survivin和bcl-2基因设计其靶向干扰序列以期达到基因治疗肿瘤的目的。
目前,还未见在舌鳞癌细胞系Tca8113细胞中敲减survivin和bcl-2两种基因的研究报道,本研究在前期实验中已经观察到survivin和bcl-2基因经敲减后Tca8113细胞生长增殖受到抑制及诱导发生凋亡[4]。本研究结果的肿瘤形成率显示,空白对照、Lipofectamine和Negative-siRNA三组的裸鼠接种9 d后可见局部肿瘤形成,成瘤率100%,生长速度快、瘤体大;bcl-2 siRNA 和survivin-siRNA 两组分别于接种后16 d和17 d局部肿瘤形成,成瘤率100%,瘤体较空白对照组小,生长速度慢;survivin/bcl-2siRNA双基因敲减组于接种后22 d,3只裸鼠中有2只局部肿瘤形成,成瘤率66.6%,且瘤体较单基因敲减组小,生长速度慢;注射生理盐水的阴性对照组接种后未出现肿瘤形成。另外,从裸鼠外表观察,随着瘤体的增大其体质越来越消瘦且精神状态差,相反瘤体小体质和状态相对较好,阴性对照组体质健壮。肿瘤生长曲线显示,空白对照组、Lipofectamine组、Negative-siRNA组肿瘤生长速度明显快于bcl-2siRNA和survivin siRNA组及survivin/bcl-2 siRNA双基因敲减组。双基因敲减组不仅成瘤延长,而且生长速度明显慢于单基因敲减组。肿瘤抑制率显示,双基因敲减(84.5%)明显高于单基因敲减(67.6和69.8%)后的肿瘤抑制率。肿瘤组织经HE染色病理分析显示,空白对照组、Lipofectamine组、Negative-siRNA组肿瘤呈浸润性生长并有大片坏死区。survivin和bcl-2基因敲减后的肿瘤组织与周围组织分界较清,未见明显浸润现象且肿瘤组织坏死区较少。实验结果提示,survivin和bcl-2基因在舌鳞癌细胞系Tca8113细胞中表达上调与该基因参与舌癌的发生过程及与舌癌细胞的增殖侵袭密切相关。经基因敲减后其成瘤率及恶性程度降低,表明survivin和bcl-2基因可作为舌癌基因治疗靶点的可行性。由此推测survivin与bcl-2基因有共同的转录激活机制,两者协同发挥抗凋亡作用[14],表明舌癌的发生发展与survivin和bcl-2基因过表达有关。实验结果证实肿瘤的发生发展涉及多个基因的参与及调控过程,双基因敲减要比单基因敲减的抑制作用好。
[1] 饶国洲.Bcl-2shRNA慢病毒表达载体的构建与鉴定[J].陕西医学杂志,2011,40(10):1281-1284.
[2] 饶国洲.BIRC5shRNA慢病毒表达载体的构建与鉴定[J].细胞与分子免疫学杂志,2011,27(7):767-769.
[3] 饶国洲.BIRC5、Bcl-2siRNA慢病毒表达载体最佳干扰序列的筛选[J].现代检验医学杂志,2011,26(6):33-36.
[4] 饶国洲. Survivin和bcl-2基因靶向siRNA对舌癌Tca-8113细胞生长抑制及诱导凋亡作用的影响[J]. 陕西医学杂志,2015,44(2):140-143.
[5] Sanz L,Garcia M,Arco JA,etal. Bcl-2 family gene modulation during spontaneous apoptosis of B-chronic lymphocytic leukemia cells[J].Biochem Biophys Res Commun,2004,315(3):562-567.
[6] Bokarewa M, Lindblad S, Bokarew D,etal.Balance between survivin,a key member of the apoptosis inhibitor family,and its specific antibodies determ ines erosivity in heum atoid arthritis[J].Arthritis Res Ther,2005,7(2):349-358.
[7] Du C,Fang M,Li Y,etal.Smac, a mitochondrial protein that promotes cytochrome c-dependent caspase activation by eliminating IAP inhibition[J].Cell,2000,102(1):33-42.
[8] Ikeguchi M,Yamaguchi K,Kaibara N. Survivin gene expression positively correlates with proliferative activity of cancer cells in esophageal cancer[J].Tumour Biol,2003,24(1):40-45.
[9] 赵 安,韩福生.凋亡抑制因子Survivin与肿瘤的研究进展[J].中华全科医学,2011,9(12):1939-1941.
[10] 徐亚娟,金志威,张艳秋,等.Survivin在舌鳞癌中的表达及意义[J].中国实验诊断学,2012,16(11):2094-2095.
[11] 王智明,管新明,孙 明,等. Survivin在舌鳞癌中的表达及其与bcl-2的相关性[J]].中国医科大学学报,2008,37(1):65-67.
[12] 籍丽莉. Survivin在口腔鳞状细胞癌中的表达及其与bcl-2,P53,bax表达之间的关系[J].现代口腔医学杂志,2007,21(4):410-413.
[13] Kawasaki H,Altieri DC, Lu CD,etal.Inhibition of apoptosis by survivin predicts shotter survival rates in colorectal cancer[J].Cancer Res,1998,58(22):5071-5074.
[14] Rohayem J,Diestelroetter P,Weigle B,etal.Antibody response to the tumor-associated inhibitor of apoptosis protein surviving in cancer patients[J].Cancer Res,2000,60(7):1815-1817.
(收稿:2016-05-08)
*陕西省科技攻关项目(2009K12-01)
舌肿瘤 基因, 肿瘤抑制 小鼠, 基因敲除 肿瘤 移植,同种
R739.86
A
10.3969/j.issn.1000-7377.2017.02.003

