木聚糖酶XynG1-1在毕赤酵母中的表达及发酵条件优化
王停停,郑宏臣,徐健勇,彭梦,刘逸寒,路福平,宋诙*
1(天津科技大学 生物工程学院,天津,300457) 2(中国科学院 天津工业生物技术研究所,工业酶国家工程实验室,天津,300308) 3(中国科学院 天津工业生物技术研究所,天津工业生物系统与过程重点实验室,天津,300308)
木聚糖酶XynG1-1在毕赤酵母中的表达及发酵条件优化
王停停1,2,郑宏臣2,3,徐健勇2,3,彭梦1,2,刘逸寒1,路福平1,宋诙2,3*
1(天津科技大学 生物工程学院,天津,300457) 2(中国科学院 天津工业生物技术研究所,工业酶国家工程实验室,天津,300308) 3(中国科学院 天津工业生物技术研究所,天津工业生物系统与过程重点实验室,天津,300308)
将来源于PaenibacilluscampinasensisG1-1的木聚糖酶编码基因成功整合到毕赤酵母GS115基因组上,构建了高产木聚糖酶XynG1-1的毕赤酵母工程菌。采用响应面法对该工程菌的发酵条件进行优化。首先使用Design-Expert软件进行Plackett Burman实验设计筛选出影响产酶量的3个主要因素,即甲醇含量、生物素含量和培养时间。在此基础上使用Design-Expert软件进行Box-Behnken实验设计,通过响应面分析得出优化的发酵培养条件为:甲醇含量2.28%,培养时间37.29 h,生物素4 mg/L,酵母粉20 g/L,蛋白胨20 g/L,YNB 30 g/L,装液量100 mL/L,转速250 r/min、温度28 ℃、磷酸缓冲液pH 6.0。经实验验证,优化后的培养条件下胞外重组酶活达到707.2 IU/mL,与响应面预测结果一致,较优化前木聚糖酶酶活提高了7.9倍,较原始菌株产酶量提高了19.8倍。经10 L发酵罐扩大培养之后,重组木聚糖酶的酶活达到2 703 IU/mL。因此,该研究有效提高了木聚糖酶XynG1-1的发酵产量,并且,该重组酶保持了良好的酶学性质,可为工业化生产及应用奠定基础。
毕赤酵母;木聚糖酶;响应面;发酵优化;酶学性质
木聚糖酶(1,4-β-D-xylanase;EC3.2.1.8)是目前研究最为广泛的半纤维素酶,也是一种重要的工业用酶,在造纸、食品、纺织、饲料等传统工业领域具有广阔的应用,随着生物技术的不断发展,木聚糖酶的应用领域不断扩大,其在医药、环境和能源等方面的应用也正逐步被开发[1-3]。木聚糖酶的来源非常广泛,主要存在于微生物、原生动物、甲壳类动物以及陆地植物组织中[4-5]。其中,微生物是木聚糖酶的最主要来源,约占所有来源的80%,其中,重要的木聚糖酶产生菌主要有:曲霉(Aspergilli)、木霉(Trichodermi)、青霉(Penicillium)、链霉菌(Streptomycetes)、芽胞杆菌(Bacillus)和瘤胃纤维菌(Rumihococci)等[6-9]。随着分子生物学技术的不断发展,越来越多的木聚糖酶基因成功得到外源表达,进而达到提高木聚糖酶产量的目的[10-11]。
毕赤酵母作为成熟的真核表达宿主具有诸多优点:首先,作为真核表达系统,具有糖基化、脂肪酰化、蛋白磷酸化等翻译后修饰加工功能;并且,一般外源蛋白基因整合到毕赤酵母染色体上,随染色体复制而复制,不易丢失,具有很好的遗传稳定性;最重要的是该系统表达水平高并具有成熟的发酵工艺,易放大,大规模工业化高密度生产的细胞干重可高达100 g/L以上[12-13]。目前,已有一些真核来源的木聚糖酶在毕赤酵母中成功表达。王丹丹等人将黑曲霉XZ-3X菌株来源的木聚糖酶基因转入毕赤酵母GS115中,在毕赤酵母中成功实现异源表达,经发酵条件优化后比酶活达到43 526.3 U/mg[14];袁冬华等人将橄榄绿链霉菌A1来源的木聚糖酶基因在毕赤酵母中表达,经响应面优化后的酶活达到了262.8 U/mL,将优化好的摇瓶发酵条件应用于7 L发酵罐,实现了木聚糖酶的高密度表达,酶活达到2 054.9 U/mL[15]。目前,关于细菌来源的木聚糖酶基因在毕赤酵母中表达的报道相对较少。
本研究前期筛选到1株产木聚糖酶的菌株PaenibacilluscampinasensisG1-1,该木聚糖酶具有很宽泛的pH稳定性,在酿酒及造纸等行业均有很好的应用潜力,将该木聚糖酶基因xynG1-1分别在原核宿主大肠杆菌和巨大芽孢杆菌中表达,发酵酶活分别为10.58 IU/mL和304.26 IU/mL,产量还有待提高[16-17]。因此,本文将木聚糖酶基因xynG1-1连接到真核表达载体pPIC-9k上,进而重组到毕赤酵母GS115的染色体上。通过响应面法对毕赤酵母工程菌表达木聚糖酶的发酵条件进行优化,并将最优发酵条件放大到10 L发酵罐,实现重组木聚糖酶的高密度发酵,为进一步提高木聚糖酶产量和大规模生产奠定基础。
1 材料和方法
1.1 材料
1.1.1 菌株
木聚糖酶原始菌株PaenibacilluscampinasensisG1-1由天津科技大学实验室保存。
1.1.2 试剂及培养基
酵母粉、蛋白胨:OXOID公司;D-葡萄糖、YNB、TRIS、木糖:Solarbio公司;NaOH:国药集团化学试剂有限公司;KH2PO4、K2HPO4:天津市风船化学试剂科技有限公司;生物素:BIO BASIC INC公司;桦木木聚糖:天津市光复精细化工研究所。
BMGY培养基:溶解10 g酵母粉,20 g蛋白胨于700 mL水中,高压灭菌20 min,冷至室温,加入下列混合液:100 mL 1 mol/L磷酸钾缓冲液pH 6.0,100 mL 10×YNB,100 mL 10×甘油,2 mL 500×生物素。BMMY培养基:溶解10 g酵母粉,20 g蛋白胨于700 ml水中,高压灭菌20 min,冷至室温,加入下列混合液:100 mL 1 mol/L磷酸钾缓冲液pH 6.0,100 mL 10×YNB,100 mL 10×甲醇,2 mL 500×生物素。YPD培养基:溶解10 g酵母粉,20 g蛋白胨于900 mL水中(配置固体培养基时加入20 g/L琼脂粉),高压灭菌20 min,加入100 mL 10×D。
1.1.3 仪器与设备
SKY-2111B全温培养摇床,天津亿诺科学仪器有限公司;MJX-100B-Z型培养箱,上海博讯实业有限公司医疗设备厂;Epoth 2TC微孔板分光光度计,美国伯腾仪器有限公司;BIOTECH-10BGZ-2全自动两联10 L发酵系统,上海保兴生物设备工程有限公司。
1.2 方法
1.2.1 毕赤酵母工程菌的构建
以P.campinasensisG1-1基因组为模板,设计引物PCR扩增木聚糖酶基因xynG1-1,PCR产物经EcoRI和NotI双酶切后,连接到pPIC-9k表达载体,得到重组质粒pPIC9k-xynG1-1,重组质粒经SacI线性化后,电转化到毕赤酵母GS115细胞中,应用AOX引物和木聚糖酶基因引物PCR验证转化子。
1.2.2 摇瓶培养
通过平板划线法将重组毕赤酵母接种至YPD固体培养基,30 ℃培养至单克隆出现,挑取单克隆菌落至BMGY培养基中,30 ℃、250 r/min培养至一定浓度。离心弃上清液,将菌体转移至等体积BMMY培养基中,28 ℃、250 r/min培养。每隔24 h取样1 mL,并添加相应含量甲醇。样品离心,将上清稀释适当倍数测定酶活,上清和沉淀分别存于-20 ℃。
1.2.3 Plackett-Burman实验
选取9个因素(甲醇含量、培养时间、生物素含量、酵母粉含量、蛋白胨含量、YNB含量、装液量、pH和温度)进行Plackett-Burman实验(因素水平设计见表1),以确定影响发酵产酶的重要因素
1.2.4 显著因素的单因素水平实验
对Plackett-Burman确定的3个主要因素A(甲醇含量)、B(培养时间)、C(生物素含量)进行单因素实验,确定3个因素的3个合适水平A、B、C(-1、0、1)。
1.2.5 响应面法优化发酵条件
根据A、B、C三个因素的最终选取结果,使用Design-Expert软件进行Box-Behnken设计3因素3水平实验,其他发酵条件保持一致,共选取17个试验点,包含12个析因点,5个零点重复,实验因素水平设计见表2。
1.2.6 10 L发酵罐放大培养
挑取重组毕赤酵母单克隆菌落于100 mL YPD液体培养基中,30 ℃、250 r/min培养至OD600nm=10左右,并将种子液加到含3 L初始培养基的10 L发酵罐中,发酵过程分为甘油单批培养,甘油分批补料培养和甲醇分批补料培养3个不同阶段。每隔一段时间取样并测OD600nm、细胞湿重和酶活,绘制菌体生长曲线,并进行蛋白检测。
1.2.7 木聚糖酶酶活测定
木聚糖酶活力测定使用DNS法[17]。取100 μL稀释适当倍数的酶液,加入100 μL 1%的桦木木聚糖底物溶液,60 ℃反应10 min,加入600 μL DNS终止反应,沸水浴10 min,测定540 nm处的吸光值。木聚糖酶活力单位的定义:以1%的可溶性桦木木聚糖为底物,在酶的最适反应条件下,每分钟分解木聚糖生成1 μmol 木糖所需酶量为1个酶活力单位(IU)。
1.2.8 重组木聚糖酶酶学性质测定
将发酵上清液稀释适当倍数,分别在40、45、50、55、60、65、70、75 ℃测定酶活,以最高酶活为100%,确定最适反应温度。将稀释适当倍数的酶液分别放置在50、55、60 ℃水浴锅中,每隔一段时间分别测定酶活,以初始酶活为100%,测定重组木聚糖酶的温度稳定性。
将发酵上清液用不同的pH(5、5.5、6、6.5、7、7.5、8、8.5)缓冲液稀释适当倍数,分别用相应pH的底物测定酶活,以最高酶活为100%,确定最适反应pH。将酶液分别用pH 6、6.5、7、7.5缓冲液稀释适当倍数,放置4 ℃冰箱,每隔一段时间测定酶活,以初始酶活为100%,测定重组木聚糖酶的pH稳定性。
2 结果与讨论
2.1 产木聚糖酶毕赤酵母工程菌的构建
按图1所示成功构建了毕赤酵母重组质粒pPIC9k-xynG1-1,质粒全长1 081 bp,将重组质粒经SacI 线性化后转化毕赤酵母GS115细胞中,得到128个转化子,经AOX引物和目的片段引物进行PCR验证,得到阳性转化子(图2),测序正确的为构建成功的产木聚糖酶XynG1-1的毕赤酵母工程菌。

图1 毕赤酵母重组质粒构建示意图Fig.1 Schematic diagram for construction of recombinant plasmid for P. pastoris
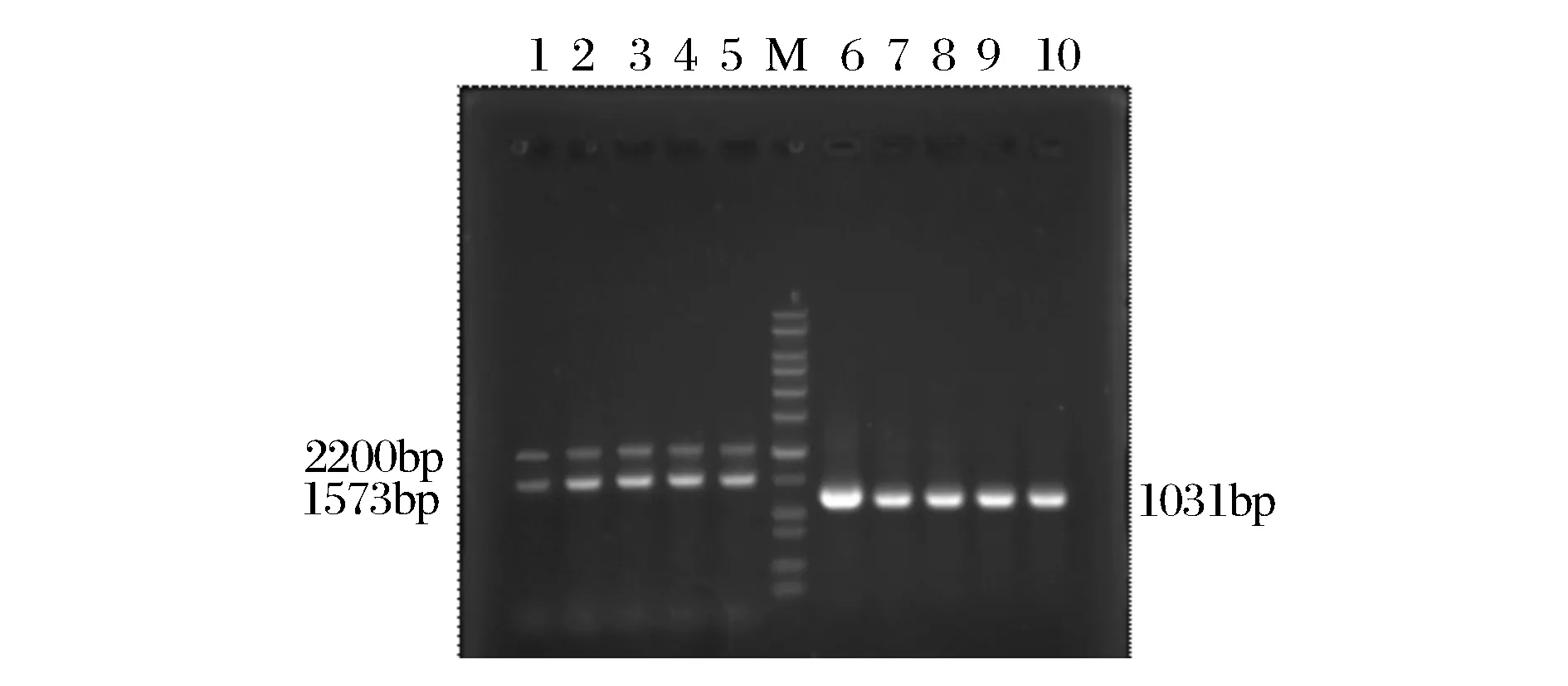
泳道1~5为AOX引物PCR结果,泳道6~10为木聚糖酶基因引物PCR结果图2 毕赤酵母转化子的PCR鉴定Fig.2 PCR analysis of P. pastoris transformants
2.2 重组毕赤酵母菌株发酵产酶的Plackett-Burman实验
依据Plackett-Burman实验设计,对发酵过程中的9个培养基成分进行考察,每个因素取高和低两个水平,实验结果如表1。各因素所代表的参数水平和方差分析结果如表2。研究的9个因素中,甲醇含量(A)、培养时间(B)、生物素含量(C)3个因素对重组木聚糖酶酶活产生显著影响。继而对3个显著性因素进行不同水平的单因素实验,而其他6个非显著性因素在后续实验过程中的取值由Plackett-Burman实验结果确定。各因素对产酶影响可用以下方程表示(其中A代表甲醇含量、B为培养时间、C为生物素含量、D为酵母粉含量、E为蛋白胨含量、F为YNB含量、G为装液量、H为pH值、I为温度):
酶活=362.38+38.08A+69.93B-34.01C+18.91D-14.89E+14.89F+35.52G+14.12H-28.33I
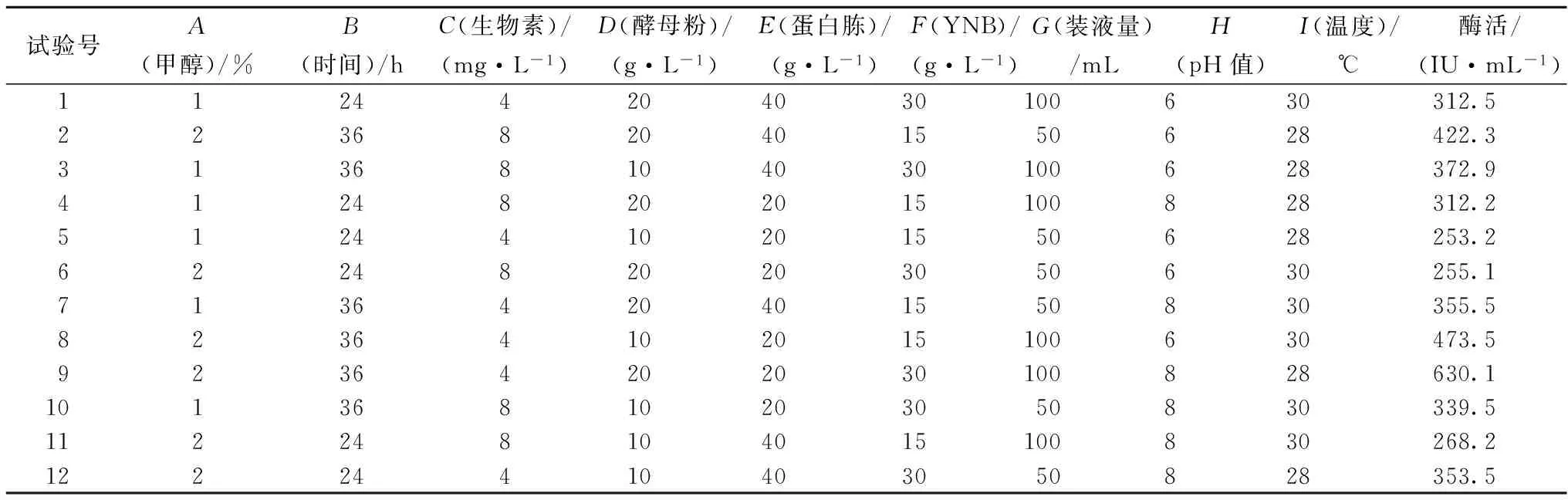
表1 Plackett-Burman实验设计及结果
方程的决定系数R2=0.988 9,说明方程的拟合程度较好。在后续试验过程中酵母粉、YNB和装液量3个因素在高点取值,而蛋白胨、温度和pH值3个因素在低点取值。进而继续3个显著因素最适条件的确定。
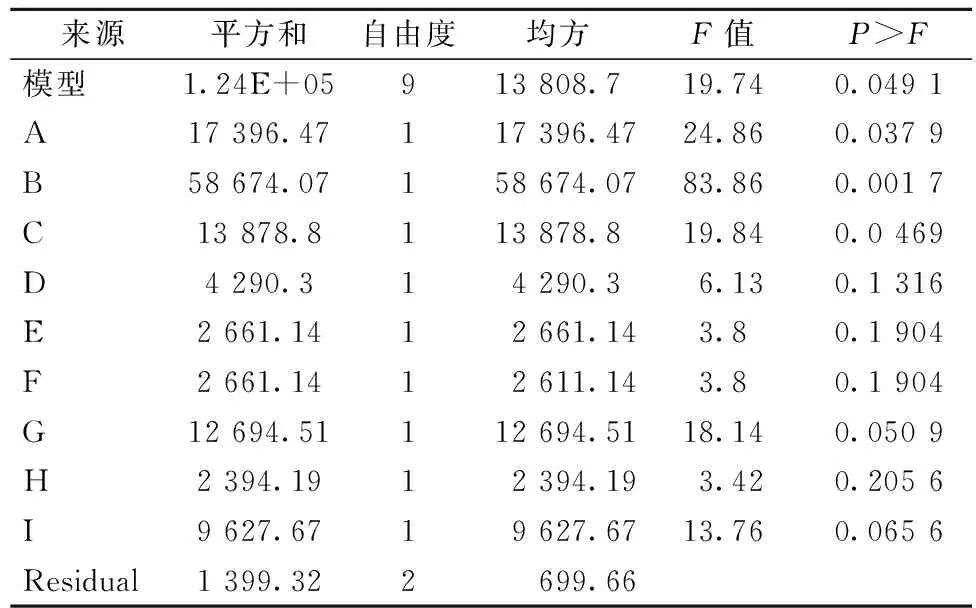
表2 偏回归系数及因素的显著性分析
2.3 单因素实验确定Box-Behnken实验的水平范围
在后续Box-Behnken实验设计过程中,需要确定3个显著性因素的3个水平(-1、0、1)。应用单因素实验测定不同甲醇含量、不同培养时间、不同生物素含量对重组木聚糖酶表达的影响。由图3a结果可见,在甲醇含量为2%时重组木聚糖酶酶活最大,甲醇含量为1%和4%时酶活明显降低,因此选取A(甲醇含量)因素的3个水平分别为1、2.5、4%;培养时间在36、60、84 h时酶活差距明显(图3b),从而确定B(培养时间)因素的3个实验水平;另外,对于因素C(生物素含量)的水平选择0 、2 、4 mg/L较为合适(图3c)。
2.4 响应面法优化发酵条件
根据2.2和2.3实验结果,用Box-Behnken软件设计3因素3水平试验,根据表3的实验结果,使用Design-Expert软件进行方差分析和二次回归拟合实验数据,回归方程变量分析见表4。

a-甲醇含量对重组木聚糖酶产量的影响;b-培养时间对重组木聚糖酶产量的影响;c-生物素含量对重组木聚糖酶产量的影响图3 显著影响因素的单因素水平实验Fig.3 The influences on xylanase yields by different levels of the three notable factors
以重组木聚糖酶酶活(R1)为响应面值,以A、B、C为自变量,拟合得到多元二次回归方程:
R1=506.16-46.27A-57.06B+13.09C+17.87AB+15.38AC-7.80BC-165.61A2-35.58B2+9.92C2
由回归方程系数显著性检验及方差分析可知,模型实验拟合良好,模型的p=0.004 8<0.05,说明该试验模型显著。决定系数R2=0.917 3,说明回归方程的拟合程度较好。由响应面回归分析和回归方程拟合绘制响应面图形(如图4)。

a-甲醇含量和培养时间对产酶量的影响;b-甲醇含量和生物素含量对产酶量的影响;c-培养时间和生物素含量对产酶量的影响图4 三个显著性因素之间的响应面实验Fig.4 The response surface experiments for the three significant factors
由图4可见,A、B、C三个影响因素之间存在极值点。进而对方程求导,得到模型的极值点,3个因子的最优试验点分别为甲醇含量2.28%、培养时间37.29 h、生物素含量4 mg/L,此时模型预测的极大值为562.1 IU/mL。
2.5 验证实验
在其余培养基成分和培养条件不变的情况下,对模型预测的最优条件(即甲醇含量2.28%、培养时间37.29 h、生物素含量4 mg/L)进行3组平行摇瓶发酵试验,测得最终重组木聚糖酶平均酶活为707.2 IU/mL,比预测酶活值偏大1.26%,取得了预期的优化效果。另外,与前期实验结果相比较,本实验获得的毕赤酵母工程菌表达木聚糖酶XynG1-1的水平较其原始菌株(35.72 IU/ml)提高了19.8倍[16],比该基因在大肠杆菌和巨大芽孢杆菌中表达水平分别高66.8倍和2.3倍[17],可见,对于该木聚糖酶基因xynG1-1来说,毕赤酵母可能是其目前最合适的表达宿主。
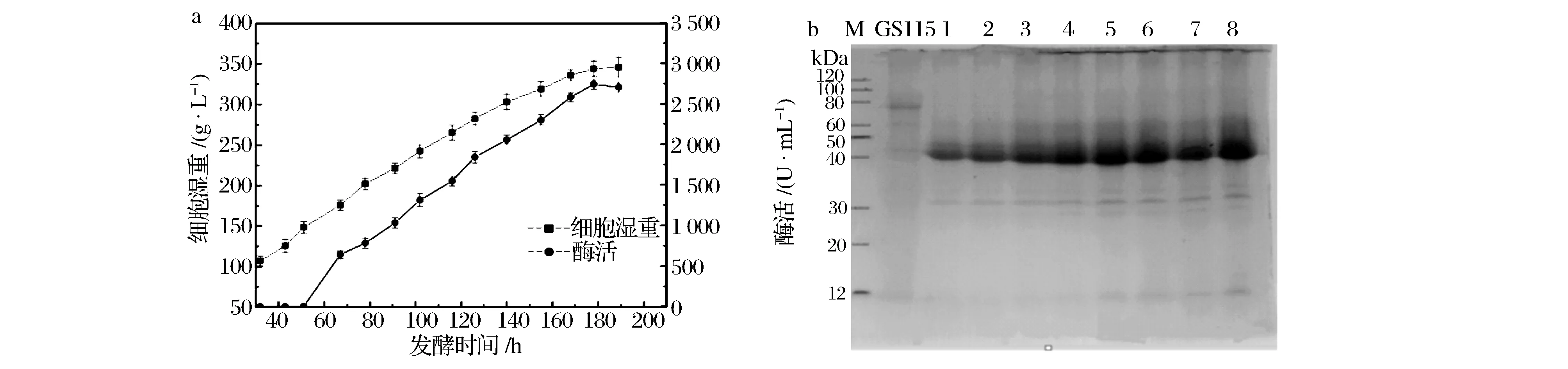
a-重组毕赤酵母工程菌生长曲线图;b-工程菌胞外蛋白电泳图。M-Marker,GS115: 毕赤酵母GS115原始菌对照;1~8:诱导1~8 d的工程菌胞外蛋白图5 10 L发酵罐实验结果Fig.5 Fermentation results in a 10 L fermentor
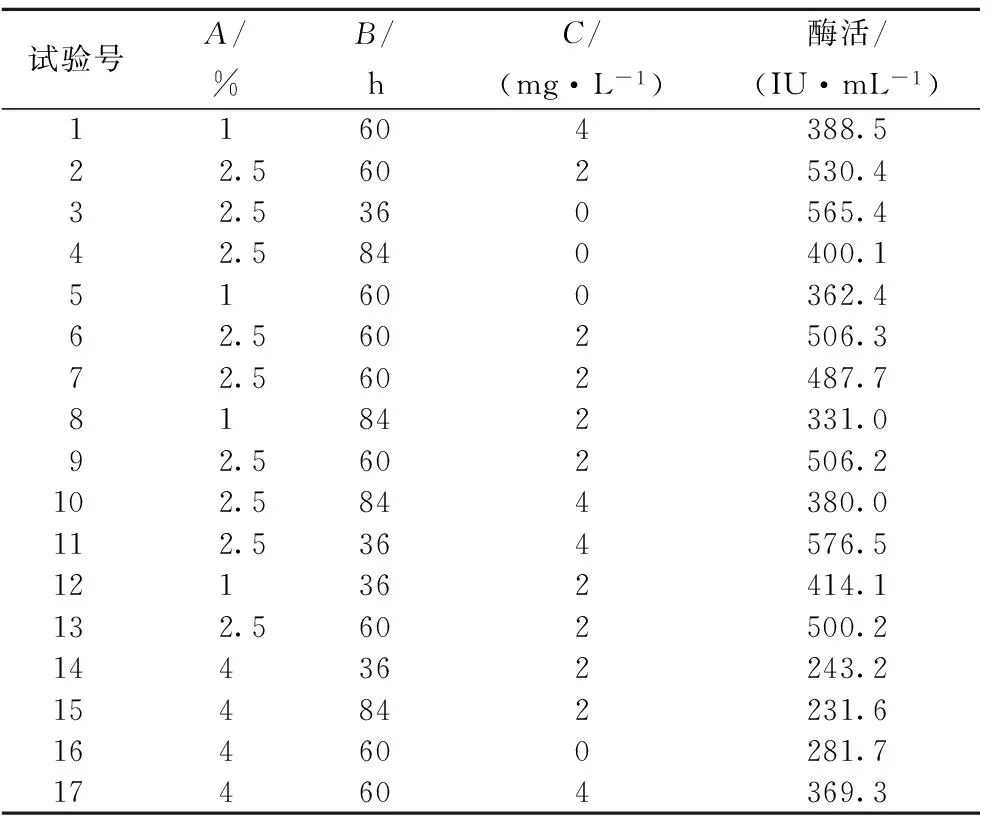
试验号A/%B/hC/(mg·L-1)酶活/(IU·mL-1)11604388.522.5602530.432.5360565.442.5840400.151600362.462.5602506.372.5602487.781842331.092.5602506.2102.5844380.0112.5364576.5121362414.1132.5602500.2144362243.2154842231.6164600281.7174604369.3
2.6 10 L发酵罐放大培养
在摇瓶发酵基础上,进行10 L发酵罐的放大培养,结果如图5所示。重组毕赤酵母发酵189 h时,菌体生长趋于稳定,细胞湿重达到346 g/L,重组木聚糖酶的酶活达到2 703 IU/mL,较摇瓶发酵酶活提高了3.8倍(如图5a)。重组木聚糖酶的蛋白大小为40 kDa左右,与预测的蛋白大小一致,而阳性对照GS115在此处没有蛋白表达,随着发酵时间的延长,表达的重组蛋白量增加。并且由图5b可见,重组木聚糖酶蛋白量占该毕赤酵母表达胞外蛋白90%以上,杂蛋白极少,具有良好的工业生产潜力。
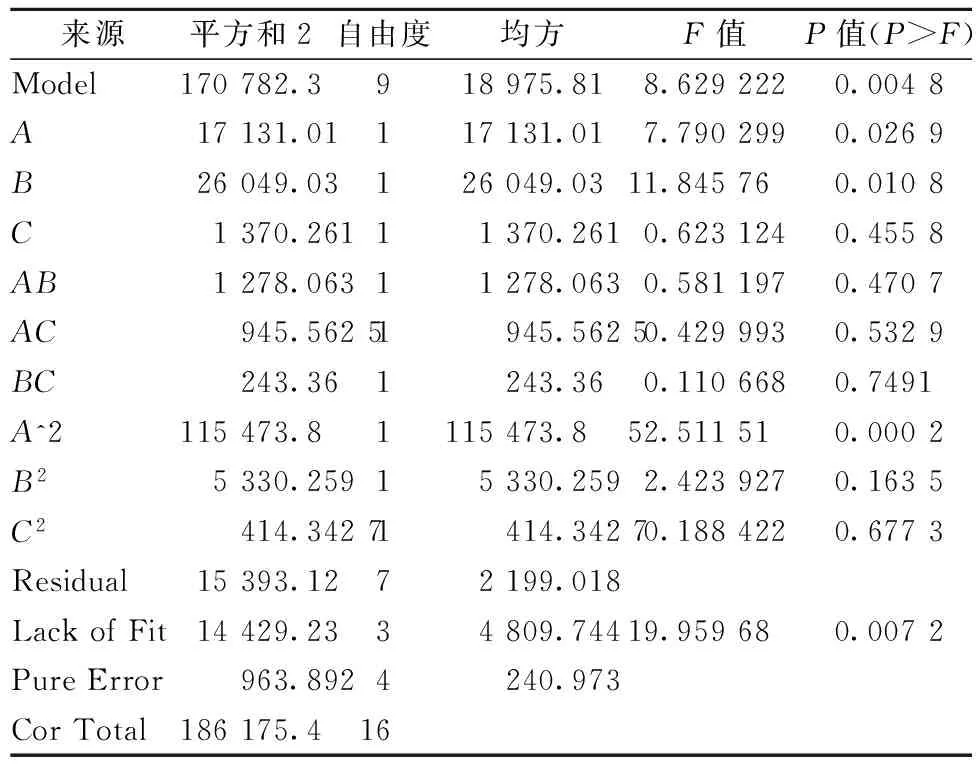
表4 回归方程变量分析
2.7 酶学性质
本研究还对重组木聚糖酶XynG1-1的酶学性质做了初步测定,重组木聚糖酶XynG1-1的最适作用温度是55 ℃(图6a)。在50、55 、60 ℃保温30 min剩余酶活分别为68%、61%和57%(图6b)。重组木聚糖酶XynG1-1的最适作用pH为6.5(图6c),该木聚糖酶在pH 6.0~7.5范围内具有极好的稳定性(图6d)。

a-不同温度对重组木聚糖酶活性的影响;b-重组木聚糖酶的温度稳定性;c-不同pH对重组木聚糖酶活性的影响;d-重组木聚糖酶的pH稳定性图6 重组木聚糖酶XynG1-1的酶学性质Fig.6 The enzymatic properties of the recombinant xylanase XynG1-1
3 结论
本研究将来源于P.campinasensisG1-1的木聚糖酶基因成功重组到毕赤酵母GS115基因组上,实现了组成型表达,响应面法发酵条件优化使得表达水平提高了7.9倍,优化后摇瓶表达水平达到707.2 IU/mL,分别是原始菌的19.8倍、大肠杆菌工程菌的66.8倍、巨大杆菌工程菌的2.3倍。可见木聚糖酶XynG1-1在毕赤酵母中的表达水平最高。经10 L发酵罐的高密度发酵培养,最终胞外酶活可达到2 703 IU/mL,结合其优良的酶学性质,本研究可显著推进木聚糖酶XynG1-1的产业化生产及应用进程。
[1] ZAFAR A, AFTAB M N, DIN Z U, et al. Cloning, expression, and purification of xylanase gene fromBacilluslicheniformisfor use in saccharification of plant biomass[J]. Appl Biochem Biotechnol, 2016 ,178(2):294-311.
[2] CASAS G A, STEIN H H. Effects of microbial xylanase on digestibility of dry matter, organic matter, neutral detergent fiber, and energy and the concentrations of digestible and metabolizable energy in rice coproducts fed to weanling pigs[J]. J Anim Sci, 2016 ,94(5):1 933-1 939.
[3] LI Y, GE X, SUN Z, et al. Effect of additives on adsorption and desorption behavior of xylanase on acid-insoluble lignin from corn stover and wheat straw[J]. Bioresour Techno, 2015,186:316-320.
[4] COLLINS T, GERDAY C, FELLER G. Xylanases, xylanase families and extremophilic xylanases[J]. FEMS Microbiol Rev, 2005, 29(1): 3-23.
[5] OKAZAKI F, OGINO C, KONDO A, et al. Expression, crystallization and preliminary X-ray diffraction studies of thermostable β-1,3-xylanase fromThermotoganeapolitanastrain DSM 4359[J]. Acta Crystallogr Sect F Struct Biol Cryst Commun, 2011, 67(Pt 7):7 797-81.
[6] 李宁. 链霉菌来源的木聚糖降解酶相关基因的克隆及酶学性质研究[D]. 北京:中国农业科学院博士学位论文, 2009.
[7] SUNNA A, ANTRANIHIAN G. Xylanolytic enzymes from fungi and bacteria[J]. Critical Reviews in Biotechnology, 1997, 17: 39-67.
[8] SUBRAMANIYAN S, PREMA P. Biotechnology of microbial xylanases: enzymology, molecular biology, and application[J]. Crit Rev Biotechnol, 2002, 22(1): 33-64.
[9] DOS SANTOS J A, VIEIRA J M, VIDEIRA A, et al. Marine-derived fungusAspergilluscf.tubingensisLAMAI 31: a new genetic resource for xylanase production[J]. AMB Express, 2016, 6(1):25.
[10] GUAN G Q, ZHAO P X, ZHAO J, et al. Production and partial characterization of an alkaline xylanase from a Novel FungusCladosporiumoxysporum[J]. Biomed Res Int, 2016, 2016:4575024.
[11] XU B, DAI L, LI J, et al. Molecular and biochemical characterization of a Novel Xylanase fromMassiliasp.: RBM26 isolated from the feces ofRhinopithecusbieti[J]. J Microbiol Biotechnol, 2016, 26(1):9-19.
[12] GHAFFAR A, KHAN SA, MUKHTAR Z, et al. Heterologous expression of a gene for thermostable xylanase fromChaetomiumthermophiluminPichiapastorisGS115[J]. Mol Biol Rep, 2011, 38(5):3 227-3 233.
[13] LI Y Y, ZHONG K X, HU A H, et al. High-level expression and characterization of a thermostable xylanase mutant fromTrichodermareeseiinPichiapastoris[J]. Protein Expr Purif, 2015 , 108:90-96.
[14] 王丹丹, 周晨妍, 朱新术等. 毕赤酵母工程菌发酵木聚糖酶条件的响应面优化[J]. 食品工业科技, 2016,37(2): 194-198.
[15] 袁冬华. 重组木聚糖酶的发酵及应用研究 [D]. 无锡:江南大学硕士学位论文, 2011.
[16] ZHENG Hong-chen, LIU Yi-han, LIU Xiao-guang, et al. Isolation, purification and characterization of a thermostable xylanase from a novel strainPaenibacilluscampinasensisG1-1[J]. Journal of Microbiology and Biotechnology, 2012, 22(7):930-938.
[17] ZHENG Hong-chen, LIU Yi-han, LIU Xiao-guang, et al. Overexpression of a Paenibacillus campinasensis xylanase inBacillusmegateriumand its applications to biobleaching of cotton stalk pulp and saccharification of recycled paper sludge[J]. Bioresource Technology, 2012, 125:182-187.
Expression of xylanase XynG1-1 inPichiapastorisand optimization of its fermentation conditions
WANG Ting-ting1,2,ZHENG Hong-chen2,3,XU Jian-yong2,3,PENG Meng1,2,LIU Yi-han1,LU Fu-ping1,SONG Hui2,3*
1(College of Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China) 2(Industrial Enzymes National Engineering Laboratory, Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China) 3(Key Laboratory of Tianjin IndustrialBiosystem and Process Engineering, Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China)
The gene encoding xylanase fromPaenibacilluscampinasensisG1-1 was successfully integrated into the genome ofPichiapastorisGS115, and engineeredP.pastorisfor high-yielding xylanase XynG1-1 was constructed. The fermentation conditions of the engineered bacteria were optimized by using the response surface method. Firstly, Plackett Burman design was carried out using Design-Expert software and three main factors influencing the yield of xylanase were screened out, which were content of methanol, content of biotin and incubation time. Then the Box-Behnken of Design-Expert software was used to design the experiment, the optimize culture conditions for fermentation were confirmed by the analysis of the response surface to be follows: yeast powder of 20 g/L, peptone of 20 g/L, YNB of 30 g/L, biotin of 4 mg/L, methanol content of 2.28%, liquid volume of 100 mL/L, incubation time of 37.29 h, rotational speed of 250 r/min, temperature 28 ℃, phosphate buffer pH 6.0. Verified by experiments, the extracellular recombined enzyme activity under the optimized cultivation condition was 707.2 IU/mL, which was consistent with the prediction of the response surface method and was 7.9-fold of the former xylanase enzyme activity and 19.8-fold of the enzyme activity produced by original strains. After enlarged culture in 10 L fermentation tank, the recombined xylanase enzyme activity reached 2 703 IU/mL. Therefore, this study effectively improved the fermentation yield of xylanase XynG1-1, and the recombinant enzyme retained better enzymology properties. It established foundation for the further industrial production and application of xylanase XynG1-1.
Pichiapastoris; xylanase; response surface; optimization of fermentation; enzymology properties
10.13995/j.cnki.11-1802/ts.201701007
硕士研究生(宋诙研究员为通讯作者,E-mail:song_h@tib.cas.cn)。
国家“863”计划(2014AA021302、2014AA021303);中国科学院重点部署项目(KFZD-SW-201-2A);天津市科技计划项目(13ZCDZSY05000)
2016-07-05,改回日期:2016-08-29

