冰片对梓醇及葛根素透过局灶性脑缺血模型大鼠血脑屏障作用的研究
吴俊杰+汪宏锦+杨帅+刘杨+徐晓玉

[摘要]該研究通过观察冰片是否具有促进梓醇、葛根素透过局灶性脑缺血模型大鼠血脑屏障的作用,及其是否与激活β2肾上腺素受体-eNOS-NO途径有关,从医学生物学作用角度阐释冰片“通窍引经”的传统功效及其机制。该研究采用大鼠大脑中动脉阻塞局灶性脑缺血模型,5 d后神经功能障碍评分达5分者为造模成功。将模型成功大鼠随机分为7组,用药前经统计学检验各组间无显著性差异后,灌服给予相应药物[梓醇45 mg·kg-1、 葛根素200 mg·kg-1、冰片200 mg·kg-1、布他沙明(Butoxamine,BTX)1.5 mg·kg-1]:模型组(M组,溶剂)、梓葛组(ZG组)、梓葛冰组(ZGB组)、梓冰组(ZB组)、葛冰组(GB组)、β2受体阻断剂+梓葛组(BTX+ZG组)、β2受体阻断剂+梓葛冰组(BTX+ZGB组),另设假手术组(S组,溶剂),每组10只。各组给药10 min后取材,采用UPLC-MS测定脑脊液中梓醇和葛根素含量,Western blot法测定脑组织中eNOS含量、β2受体表达,Griess法检测脑组织中NO含量。结果显示,与假手术组相比,造模大鼠神经功能得分均值均在5分以上,具有显著差异(P<0.05),显示造模成功。除假手术组外,经单因素方差分析,给药前各组之间的神经功能评分均无显著性差异。给药后与模型组相比,ZG组梓醇质量分数为26.673 μg·L-1,葛根素含量在检测限以下,脑组织中eNOS表达和NO含量、β2受体表达没有显著差异;与ZG组相比,ZGB组、ZB组、GB组脑脊液中梓醇质量分数增加至40~43 μg·L-1、葛根素质量分数增加至72~75 μg·L-1,脑组织中eNOS表达和NO含量、β2受体表达均有显著升高(P<0.05),显示冰片有促进作用;与ZG组相比,BTX+ZG组大鼠脑脊液中梓醇质量分数为21.401 μg·L-1,葛根素检测不出,2组无显著差异,显示BTX无抑制作用;与ZGB组相比,BTX+ZGB组脑脊液中梓醇质量分数32.826 μg·L-1、葛根素质量分数47.820 μg·L-1,脑组织中eNOS表达和NO含量均有显著下降(P<0.05),显示BTX有抑制作用。该研究说明冰片能够显著促进梓醇、葛根素透过局灶性脑缺血大鼠血脑屏障,其作用可被β2肾上腺素受体阻断剂布他沙明所阻断,其机制可能与上调β2肾上腺素受体从而促进eNOS表达,进而使NO含量升高有关。
[关键词]冰片; 梓醇; 葛根素; 血脑屏障通透性;β2受体; eNOS; NO
[Abstract]Previous studies showed that borneol could promote some drugs crossing through the blood-brain-barrier (BBB) at certain conditions. However, the mechanism has not been clarified yet. This study aimed to investigate the effect of bornrol on promoting catalpol and puerarin through BBB and explore the relevant mechanism. The focal cerebral ischemic rats were divided into 7 groups randomly and then were administered corresponding drugs: model group (M, solvent), catalpol-puerarin group (ZG, catalpol 45 mg·kg-1+puerarin 200 mg·kg-1), catalpol-puerarin-bornrol group(ZGB, catalpol 45 mg·kg-1+puerarin 200 mg·kg-1 +bornrol 200 mg·kg-1), catalpol-bornrol group(ZB, catalpol 45 mg·kg-1 +bornrol 200 mg·kg-1), puerarin-bornrol group(GB, puerarin 200 mg·kg-1 +bornrol 200 mg·kg-1), butoxamine-ZG group(BTX+ZG, butoxamine 1.5 mg·kg-1+ catalpol 45 mg·kg-1+puerarin 200 mg·kg-1), and butoxamine-ZGB group(BTX+ZGB, butoxamine 1.5 mg·kg-1+ catalpol 45 mg·kg-1+puerarin 200 mg·kg-1 +bornrol 200 mg·kg-1). Another 10 sham-operated rats were set as control (S). Ten minutes after the administration, the cerebrospinal fluid was taken to test the content of catalpol and puerarin, and the brain tissue was taken to test the expression ofβ2-adrenergic receptor, eNOS, and NO. Compared with the M group, the ZG group showed content of catalpol is 26.673 μg·L-1 and the content of puerarin is below the detection limit;the expression levels ofβ2-adrenergic receptor, eNOS and the contents of NO in brain tissue are no significant difference. Compared with the ZG group, the ZGB, ZB and GB groups showed significantly increased content of catalpol andpuerarin, as well as the expression ofβ2-adrenergic receptor, eNOS and NO in the brain tissue (P<0.05). The content of catalpol in BTX+ZG group changed non-significantly. Compared with the ZGB group, the BTX+ZGB group presented significantly decreased content of catalpol and puerarin and reduced expression of eNOS and NO in the brain tissue (P<0.05).The results demonstrated that borneol could dramatically promote catalpol and puerarin crossing through BBB in the focal cerebral ischemic rats. Moreover, the effect may be related to the up-regulation ofβ2-adrenergic receptor and the increasing expression of eNOS and NO.
[Key words]bornrol; catalpol; puerarin; blood-brain barrier;β2-adrenergic receptor; eNOS; NO
doi:10.4268/cjcmm20162117
冰片(1,7,7-三甲基-二环庚-2-醇)系龙脑香科植物龙脑香Dryobalanops aromatica Caertn F.树脂的加工品或菊科植物艾纳香Blumea balsamiferaDC.叶提取的结晶,或以樟脑、松节油等为原料,经化学方法合成的精制品片[1],性味辛、苦, 微寒,归心、脾、肺经,具有开窍醒神、清热止痛的功效[2]。现代药理学研究发现冰片具有抗炎[3]、抗菌[4]、镇痛[5]作用,并能增加血脑屏障(blood-brain barrier,BBB)的通透性,促进砷剂[6]、庆大霉素[7]等药物在脑中的转运从而提高药物生物利用度等,但对其机制的研究不多。
本实验以前期研究显示抗脑缺血有效[8-11]的梓醇、葛根素为载体,观察冰片是否能提高脑缺血模型大鼠脑脊液中梓醇、葛根素的含量,从而从医学生物学作用角度验证冰片“通窍引经”及“佐使有功”的传统功效记载。同时,检测脑组织中β2受体,eNOS,NO水平,并观察β2受体阻断剂对冰片的作用是否有阻断效应,以探求冰片“通窍引经”的生物学作用机制。
1 材料
赛龙100A高频电刀(北京市亚可康达医疗科技有限公司);130型双极电凝镊(武汉麦朗医疗科技有限公司);68001立体定位仪(深圳市瑞沃德生命科技有限公司);SHH-150L生化培养箱(重庆永生试验仪器厂);5417R台式高速离心机(德国Eppendorf生命科学有限公司);ELX800酶标仪(美国BioTek仪器有限公司);化学发光成像分析系统(上海天能科技有限公司)。
SPF级雄性SD大鼠120只,体重(200±25) g,购于重庆市中药研究院实验动物研究所,动物许可证号SCXD(渝)2012-0006,实验动物质量合格证号0003223,饲养于西南大学药学院SPF级实验动物中心,使用许可证号SYXK(渝)2014-0002。适应性喂养1周后进入实验,对大鼠进行筛选,去掉体重过轻、过重、行运迟缓及反应迟钝的动物。实验过程中善待实验动物,严格遵守实验动物科学与管理的有关规定。
冰片(重庆市和平药房,经西南大学齐红艺教授鉴定为龙脑香科植物龙脑香D.aromatica的精制品片,纯度99.4%);梓醇(安徽康辉药业,纯度99.8%);葛根素(四川玉鑫药业,纯度100%);水合氯醛(国药集团化学试剂有限公司);β2-AR抗体(0.2 mL/支,AD123114),一氧化氮合成酶-3(内皮型)抗体(0.2 mL/支,L8081801)均购于北京博奥森生物技术有限公司;Griess reagent(10 g/瓶,SLBC6343V),β2受体阻断剂布他沙明盐酸盐(butoxamine hydrochloride)(50 mg/瓶,MKBR6952V)均购于Sigma-Aldrich。
2 方法
2.1 主要药物溶液的配制
以47.5%乙醇溶液为溶剂,分别将冰片、梓醇、葛根素配制成药物溶液,其中冰片200 mg·kg-1、葛根素200 mg·kg-1、梓醇45 mg·kg-1;布他沙明(Butoxamine,BTX)配成生理盐水溶液(1.5 mg·kg-1)备用。
2.2 动物造模
取SD大鼠120只,参考文献资料采用改良Tamura法制备大鼠局灶性脑缺血模型[12-13]。大鼠3.5%水合氯醛麻醉后,俯卧位固定于脑立体定位仪上。剪毛消毒,沿右侧顶颞嵴切开大鼠头皮,切口约2 cm,钝性分离颞肌,充分暴露颞窝。用颅骨钻在鳞状骨前部打孔至有凹陷即可,使用小手术钳向前下方扩大骨窗,注意不要破坏硬脑膜。在大脑皮层表面,约在左眼和右耳的连线上,可以看到向上行走的大脑中动脉。使用玻璃分针轻轻上抬大脑,使大脑中动脉暴露更加充分。用双极电凝镊对大脑中动脉进行凝断(电凝强度为2,凝闭时间为2~3 s)。完成后伤口用青霉素处理,分别缝合肌肉和皮肤。
2.3 神经功能评分及分组
术后5 d后采用改良神经功能缺损评分 (modified neurological severity scores,mNSS)对造模大鼠进行功能评分[14-15]。mNSS评分包括运动、感觉、反射和平衡木4项测试,神经功能记分在0~18分 (0分为正常,最大神经功能缺损为18分)。评分在5分及5分以上分数的造模大鼠判定为造模成功。行为学檢查方法:由一个对试验实施过程不了解的观察者对大鼠进行行为学评测,评测续贯进行。如果大鼠在一次评测中出现恰当的行为,而以后却未出现,按前者记分。将造模成功的大鼠随机分为7组,模型组(M组)、梓葛组(ZG组)、梓葛冰组(ZGB组)、梓冰组(ZB组)、葛冰组(GB组)、β2受体阻断剂+梓葛组(BTX+ZG组)、β2受体阻断剂+梓葛冰组(BTX+ZGB组),每组10只大鼠,经用药前统计学检验各组间评分无显著性差异后给药。以仅暴露大脑中动脉,但不凝断的大鼠10只作为假手术组(S组)。
2.4 动物给药及取材
除假手术组及模型组外,其余各组模型大鼠分别灌胃给予相应药物及剂量,灌服药物体积为0.01 mL·g-1,β2受体阻断剂布他沙明腹腔注射30 min后再给药,剂量为1.5 mg·kg-1[16-17]。随后用3.5%水合氯醛麻醉大鼠,给药10 min后采集脑脊液(前期预实验结果表明,大鼠灌胃后10 min冰片开始出现促透作用):用湿纱布擦试大鼠颈背部皮肤,剪去背毛暴露皮肤。两耳连线剪一横切口(1.5 cm左右),在其中点向尾侧沿皮下剪开2 cm,将皮分离两侧,扩大视野。紧贴大鼠头骨依次逐层剪切各肌层,并断端依次拉向尾侧扩大视野。接近颈后黄韧带时,小心地分离附盖的肌肉,暴露寰枕膜。用微量进样器水平刺入蛛网膜下腔,固定针体,缓慢抽取脑脊液放置在离心管中,-80 ℃保存。断头取大鼠缺血侧皮层脑组织,按每约100 mg组织加入700 μL裂解液于冰上研磨,于低温高速离心机中12 000 r·min-1离心30 min,取上清液,-20 ℃保存。
2.5 UPLC-MS/MS检测梓醇、葛根素含量[18-19]
2.5.1 色谱条件 I-Class色谱柱(2.1 mm×100 mm,1.7 μm);流动相10 mmol·L-1甲酸胺水溶液-乙腈,梯度洗脱,洗脱条件见表1。
2.5.2 质谱条件 毛细管电压2.7 kV,脱溶剂气流速700 L·h-1,锥气流速50 L·h-1, ESI正离子模式。质谱条件见表2。
2.6 Western blot法测定缺血侧皮层脑组织中β2受体、eNOS含量
采用BCA法测定样品蛋白含量,计算得到每孔总蛋白上样量为50 μg。样品蛋白加入Loading Buffer后涡旋混匀,用PCR仪进行蛋白处理(95 ℃,5 min);再配制5%浓积胶和10%分离胶,经上样、电泳、转膜、切膜后条带用TBST配制的5% BSA 4 ℃封闭过夜,继而进行一抗孵育[37 ℃,90 min;兔抗eNOS(1∶300)、兔抗β2-AR(1∶300)];TBST清洗条带后二抗孵育[室温、90 min;小鼠抗GAPDH(1∶5 000)];最后得到的蛋白表达条带用TBST洗后采用化学发光成像分析系统显影并进行图像分析。
2.7 Griess法检测脑组织NO表达
按试剂盒说明操作,检测NO表达。取一块96孔板,依次加入S组、M组、ZG组、ZGB组、ZB组、GB模型组、BTX+ZG组、BTX+ZGB组样品液100 μL,各孔再分别加入Griess reagent 100 μL,室温反应15 min后用酶标仪检测吸光度,检测波长为490 nm。以吸光度大小衡量NO表达。
2.8 统计处理方法
试验数据用SPSS 17.0软件进行分析,GraphPad Prism 5.0作图,统计结果以±s表示。
3 结果
3.1 模型成功判定结果及分组差异性检验
造模后大鼠精神萎靡,饮水、摄食状况差,部分大鼠在造模后死亡。进行局灶性脑缺血造模的大鼠共120只,术中及术后死亡共16只,术后苏醒进入存活率观察的大鼠共104只。造模5 d后,除假手术组外,各组造模大鼠神经功能评分在5分以上者76只,造模成功率为63.3%。去除造模后饮水、摄食状况差所致的体重过轻、健康状况过差的大鼠6只,按照随机表将70只造模成功的大鼠分成7组,每组10只,各组大鼠神经功能得分均值均在5分以上,与假手术组对照具有显著差异(P<0.05),显示造模成功。除假手术组外,经单因素方差分析,给药前各组的神经功能评分均无显著性差异,见表3。
3.2 冰片显著升高局灶性脑缺血模型大鼠脑脊液中梓醇、葛根素含量
给药10 min后,ZG组大鼠脑脊液中梓醇质量分数为(26.673±0.936) μg·L-1、葛根素含量在检测限以下,无法检出;与ZG组相比,在合用冰片后,ZGB组脑脊液中梓醇质量分数为(43.087±7.637) μg·L-1,葛根素质量分数为(75.554±3.555) μg·L-1;ZB组脑脊液中梓醇质量分数为(40.652±1.900) μg·L-1;GB组脑脊液中葛根素质量分数为(72.049±2.074) μg·L-1,ZGB组、ZB组、GB组脑脊液中梓醇或葛根素含量都显著增加(P<0.05),显示冰片能显著促进梓醇、葛根素透过局灶性脑缺血大鼠血脑屏障,见表4。
3.3β2受体阻断剂显著抑制冰片对梓醇、葛根素的促透作用
在给药前30 min用布他沙明预处理之后,与ZG组相比,BTX+ZG组脑脊液中梓醇和葛根素含量无显著变化;与ZGB组相比,BTX+ZGB组脑脊液中梓醇和葛根素质量分数分别为(32.826±1.813),(47.820±2.574)μg·L-1,均顯著降低(P<0.05),说明阻断β2肾上腺素受体能显著降低冰片对梓醇、葛根素的促透作用,见表4。
3.4 冰片配伍梓醇、葛根素后显著促进局灶性脑缺血模型大鼠脑内eNOS表达与NO含量升高
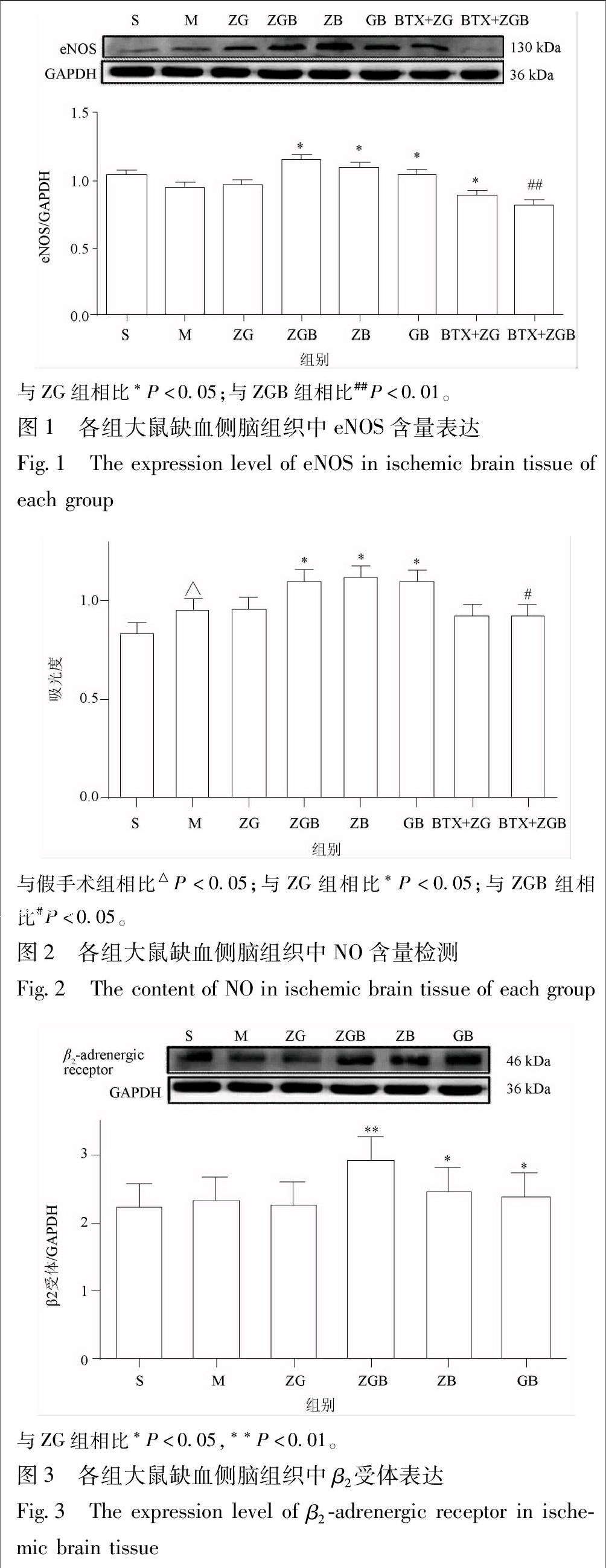
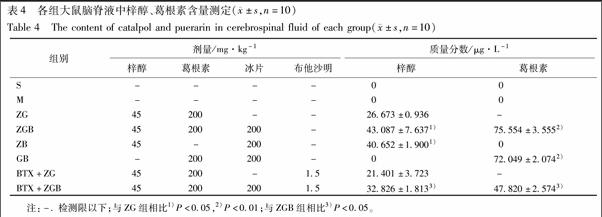
与假手术组相比,模型组大鼠eNOS表达量无显著变化,NO含量显著提高(P<0.05);与模型组相比,ZG组eNOS表达和NO含量无显著变化;而与ZG组相比,ZGB组、ZB组和GB组eNOS表达和NO含量都显著升高(P<0.05),说明冰片配伍梓醇、葛根素后能显著促进脑内eNOS与NO的水平,见图1,2。
3.5 β2受体阻断剂显著抑制冰片配伍梓醇、葛根素后上调eNOS表达和NO含量作用
与ZG组相比,BTX+ZG组eNOS表达和NO含量均没有显著变化,说明在没有合用冰片条件下β2受体阻断剂布他沙明对eNOS表达和NO含量没有影响;但是与ZGB组相比,给药前30 min用β2受体阻断剂布他沙明预处理之后,BTX+ZGB组的eNOS表达量显著下降(P<0.01)、NO含量显著降低(P<0.05),说明β2受体阻断剂能抑制冰片对eNOS表达和NO含量的促进作用,见图1,2。
3.6 冰片配伍梓醇、葛根素后显著上调局灶性脑缺血模型大鼠脑内β2受体表达
与假手术组相比,模型组β2受体表达无显著变化;与模型组相比,ZG组β2受体表达无显著变化;与ZG组相比,ZGB组β2受体表达量极显著上升(P<0.01),同时ZB组、GB组β2受体表达量也显著上升(P<0.05),说明冰片配伍梓醇、葛根素后能显著上调局灶性脑缺血模型大鼠脑内β2受体表达,见图3。
4 讨论
4.1 冰片“通窍引经”功效的生物学作用验证
冰片引药上行的作用自古就有记载。《本草纲目》称其能“通诸窍、散郁火”, 而《本草衍义》总结出的其作用特点“独行则势弱, 佐使则有功”。后世冰片多作为中医方剂配伍之佐使药, 以引经直达病所[20]。曾有研究表明,冰片内服后可经胃肠道迅速吸收,5 min后即可通过血脑屏障进入脑组织,说明能够快速打开血脑屏障[21-22]。本实验通过配伍研究发现,在给药10 min后,配伍了冰片的给药组比单纯使用梓醇或葛根素的组别脑脊液中梓醇或葛根素的含量均显著提高,说明冰片能够显著促进梓醇和葛根素透过血脑屏障。这一实验结果从生物学作用的角度,印证了冰片“通窍引经”及“佐使有功”的传统功效记载。
4.2 eNOS来源的NO具有血脑屏障保护作用
NO是血脑屏障通透性的重要调节分子,由nNOS,eNOS,iNOS 3种一氧化氮合成酶催化合成。在脑缺血的发展过程中,不同细胞中不同类型的酶催化合成的NO及其量的多少、氧化或还原状态不同则会产生不同的生物学作用。脑缺血发生后,nNOS产生的NO介导早期谷氨酸兴奋毒性并导致缺血初期的神经损伤[23-25]。亚急性期之后,iNOS在有充足底物和协同因子的条件下可持续由神经元、星形胶质细胞、内皮细胞等组织细胞大量表达[26-27],并由其主要介导病理性损伤过程,产生过量NO,导致迟发性神经损伤和促使微血管通透性增加诱发脑水肿,通过级联反应促进半暗带区进展为梗塞灶[28-32]。有研究使用同源重组技术发现,nNOS及iNOS基因敲除小鼠在脑缺血后的梗死灶减小,证实nNOS和iNOS在脑缺血后的表达具有毒性作用[33-34],使用nNOS和iNOS阻断剂可以分别减少脑缺血早期或晚期所诱导的神经毒性和组织损伤[23-25,35-37];而eNOS基因缺陷小鼠在脑缺血后的梗死灶较野生型大, 提示eNOS源性NO在脑缺血中具有保护性作用[38]。但eNOS主要通过扩张血管、抑制血小板聚集、减少白细胞黏附增强侧支循环而改善缺血后脑血流的神经保护作用很快就会被iNOS介导的毒性作用所取代[38-39]。所以抑制iNOS的表达或促进eNOS的表达是脑缺血的一种良好治疗策略。
4.3 冰片通过升高eNOS表达增加NO的含量
本研究结果显示,模型组大鼠脑组织中NO含量相比假手术组显著升高,可能与病理条件下iNOS表达上调从而生成NO增多有关;与梓醇+葛根素组相比,梓醇+葛根素+冰片组eNOS表达和NO含量进一步上升,提示冰片可进一步促进eNOS的表达,从而促使eNOS源性的NO增多,对血脑屏障的开放增强。并且有研究显示,冰片能够抑制iNOS的表达及其活性,减少iNOS源性的NO过度产生[40-42];将iNOS源性NO导致血脑屏障损伤性病理性开放转变为eNOS源性的NO对血脑屏障可逆性生理性的开放。冰片的这种血脑屏障促透作用与病理性血脑屏障扩张不同,不会损伤或加重血脑屏障损伤,具有显著的脑和血脑屏障保护作用[40,42-44]。
4.4 冰片通过上调β2肾上腺素受体升高eNOS表达
曾有研究显示,通过介导β2受体能促进eNOS表达[45-48],并使其磷酸化水平增强[49],且这种作用能够被β2受体阻断剂所抑制[50]。这引起了作者思考:冰片能否通过介导β2肾上腺素受体上调eNOS表达、增加NO含量进而促进血脑屏障开放。本研究结果首次证实,冰片能显著上调局灶性脑缺血模型大鼠脑内β2受體表达;在使用β2受体阻断剂布他沙明预处理后,eNOS表达和NO含量比未予阻断组显著减少,脑脊液中梓醇和葛根素含量也显著降低,说明通过阻断β2受体能显著抑制冰片对eNOS表达和NO含量的上调作用,进而抑制冰片对血脑屏障的开放作用。这提示冰片可能通过上调β2肾上腺素受体进而上调eNOS表达和增加NO含量,促进血脑屏障的开放。这一实验结果为冰片“通窍引经”的传统功效提供了生物学作用信号通路的依据。但是冰片对β2肾上腺素受体的调控是如何具体实现的,有待进一步深入研究。
[参考文献]
[1]刘庆华,刘彦辰.实用植物本草[M].天津:天津科学技术出版社,1998:256.
[2]中国药典.一部[S]. 2015:146.
[3]蔡瑞宏,姚宏,张亚锋,等. 芦荟冰片烧伤膏的生肌、镇痛及抗炎作用[J]. 中国医院药学杂志,2007,27(2):170.
[4]黄晓敏,廖玲军,曾松荣,等. 梅花冰片3种剂型体外抗菌活性研究[J]. 江西中医药大学学报, 2005,17(1):63.
[5]孙晓萍,欧立娟,宓穗卿,等. 冰片抗炎镇痛作用的实验研究[J]. 中药新药与临床药理, 2007,18(5):353.
[6]肖玉强,张良玉,唐海涛,等. 冰片促进砷剂透过血脑屏障实验研究[J].中华神经外科疾病研究杂志, 2007,6(3):244.
[7]刘启德,梁美蓉,陈芝喜,等.冰片对庆大霉素透血脑屏障的影响[J]. 广州中医学院学报,1994,11(1):37.
[8]Liu Y, Xue Q, Li X, et al. Amelioration of stroke-induced neurological deficiency by lyophilized powder of catapol and puerarin[J]. Int J Biol Sci,2014,10(4):448.
[9]杨盛,张飞燕,何然,等. 梓葛冻干粉针抗血栓作用实验研究[J]. 中国药理学通报, 2016, 32(5):737.
[10]尚远宏,汪宏锦,田金凤,等. 梓葛冻干粉针对大鼠急性脑微循环障碍的改善作用[J]. 中国中药杂志,2014,39(4):733.
[11]薛强,肖亚平,陈玉宝,等. 梓葛冻干粉针抗脑神经血管单元炎症及氧化损伤[J]. 中国药理学通报,2016,32(3):442.
[12]刘海朋,胡永波,张小东,等. 电凝法制作大鼠脑卒中模型的改良研究[J]. 第三军医大学学报,2011,33(17):1798.
[13]Tamura A,Graham D I,Mcculloch J,et al. Focal cerebral ischaemia in the rat: 1.Description of technique and early neuropathological consequences following middle cerebral artery occlusion[J]. J Cereb Blood Flow Metab,1981, 1(1):53.
[14]Chen J, Li Y, Wang L, et al. Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats[J]. Stroke, 2001, 32(4):1005.
[15]Borlongan C V, Randall T S, Cahill D W, et al. Asymmetrical motor behavior in rats with unilateral striatal excitotoxic lesions as revealed by the elevated body swing test[J].Brain Res, 1995,676(1):231.
[16]芮云云.去甲肾上腺素能β2受体参与慢性异源性应激诱导的内脏痛觉过敏[D].苏州:苏州大学, 2014.
[17]Pei Y P, Bai X G, Dong H, et al.β2-adrenergic receptor antagonist butoxamine partly abolishes the protection of 100% oxygen treatment against zymosan-induced generalized inflammation in mice[J].Shock,2011, 36(3):272.
[18]王琴. 梓葛冻干粉針的药代动力学及改善血脑屏障通透性的机制研究[D]. 重庆:西南大学, 2012.
[19]王琴, 邢茂, 唐勤,等. 梓葛冻干粉针中葛根素在正常大鼠和脑缺血大鼠的药代动力学比较研究[J].中国药学杂志, 2014, 49(7):583.
[20]魏楚蓉. 冰片的药理作用及其机制研究进展[J]. 国际病理科学与临床杂志,2010, 30(5):447.
[21]梁美蓉, 刘启德, 黄天来,等. 冰片在大鼠血清和脑组织中的药代动力学特征[J]. 中药新药与临床药理, 1993,4(4):38.
[22]吕旭潇, 孙明江, 孙凤志. 冰片促进药物透过血脑屏障的研究进展[J]. 中国中药杂志, 2012, 37(7):878.
[23]Izumi Y, Benz A M, Katsuki H, et al. Endogenous monocarboxylates sustain hippocampal synaptic function and morphological integrity during energy deprivation[J]. J Neurosci, 1997,17(24): 9448.
[24]Shibata M, Araki N, Hamada J, et al. Brain nitrite production during global ischemia and reperfusion: an in vivo microdialysis study[J]. Brain Res, 1996,734(1): 86.
[25]Iadecola C. Bright and dark sides of nitric oxide in ischemic brain injury[J]. Trends Neurosci, 1997, 20(3):132.
[26]Nathan C. Inducible nitric oxide synthase: what difference does it make[J]. J Clin Invest, 1997,100(10): 2417.
[27]O′Neill M J, Murray T K, Mccarty D R, et al. ARL 17477, a selective nitric oxide synthase inhibitor, with neuroprotective effects in animal models of global and focal cerebral ischaemia[J]. Brain Res, 2000,871(2):234.
[28]Sanovich E, Bartus R T, Friden P M, et al. Pathway across blood-brain barrier opened by the bradykinin agonist, RMP-7[J]. Brain Res, 1995, 705(1):125.
[29]劉辉. 一氧化氮, 一氧化氮合酶与脑缺血损伤[J]. 国外医学·生理病理科学与临床分册, 1999,19(2): 121.
[30]Bonfoco E, Krainc D, Ankarcrona M, et al. Apoptosis and necrosis: two distinct events induced, respectively, by mild and intense insults withN-methyl-D-aspartate or nitric oxide/superoxide in cortical cell cultures[J]. Proc Natl Acad Sci USA, 1995, 92(16): 7162.
[31]Kawase M, Kinouchi H, Kato I, et al. Inducible nitric oxide synthase following hypoxia in rat cultured glial cells[J]. Brain Res, 1996, 738(2): 319.
[32]Montague P R, Gancayco C D, Winn M J, et al. Role of NO production in NMDA receptor-mediated neurotransmitter release in cerebral cortex[J]. Science, 1994, 263(5149): 973.
[33]Huang Z, Huang P L, Panahian N, et al. Effects of cerebral ischemia in mice deficient in neuronal nitric oxide synthase[J].Science,1994, 265(5180):1883.
[34]Iadecola C, Zhang F, Casey R, et al. Knockout mice lacking the inducible nitric oxide synthase gene are resistant to cerebral ischemia[J]. Soc Neurosci Abstr, 1996, 22: 1693.
[35]Mori K, Togashi H, Ueno K, et al. Aminoguanidine prevented the impairment of learning behavior and hippocampal long-term potentiation following transient cerebral ischemia[J]. Behav Brain Res, 2001, 120(2):159.
[36]Cárdenas A, De Alba J, Moro M A, et al. Protective effect of N-(3-(aminomethyl)benzyl) acetamidine,an inducible nitric oxide synthase inhibitor, in brain slicesexposed to oxygen-glucose deprivation[J]. Eur J Pharmacol,1998,354(2/3):161.
[37]Liu R, Gao M, Yang Z H, et al. Pinocembrin protects rat brainagainst oxidation and apoptosis induced by ischemia-reperfusionbothin vivo and in vitro[J]. Brain Res,2008,1216:104.
[38]Huang Z, Huang P L, Ma J, et al. Enlarged infarcts in endothelial nitric oxide synthase knockout mice are attenuated by nitro-L-arginine[J]. J Cerebr Blood F Met, 1996, 16(5): 981.
[39]Fagni L, Olivier M, Lafon-Cazal M, et al. Involvement of divalent ions in the nitric oxide-induced blockade ofN-methyl-D-aspartate receptors in cerebellar granule cells[J]. Mol Pharmacol, 1995, 47(6): 1239.
[40]趙保胜,刘启德. 冰片促血脑屏障开放与病理性开放的比较[J]. 中药新药与临床药理, 2002,13(5):287.
[41]Liu R, Zhang L, Lan X, et al. Protection by borneol on cortical neurons against oxygen-glucose deprivation/reperfusion: involvement of anti-oxidation and anti-inflammation through nuclear transcription factor kappaB signaling pathway[J]. Neuroscience, 2011,176: 408.
[42]赵保胜, 董淑云, 宓穗卿,等.冰片对脑外伤脑血管内皮细胞iNOS表达的影响[J]. 中国药理学通报, 2002,18(5):590.
[43]赵保胜. Ca2+、NO、ICAM-1对冰片促血脑屏障开放作用的影响[D].广州:广州中医药大学,2001.
[44]赵保胜, 徐勤, 宓穗卿,等. 冰片促血脑屏障开放与一氧化氮含量改变的关系初探[J]. 脑与神经疾病杂志, 2001,9(4):207.
[45]Su K H, Shyue S K, Kou Y R, et al.β Common receptor integrates the erythropoietin signaling in activation of endothelial nitric oxide synthase[J]. J Cell Physiol, 2011, 226(12): 3330.
[46]Calvert J W, Lefer D J. Role ofβ-adrenergic receptors and nitric oxide signaling in exercise-mediated cardioprotection[J]. Physiology, 2013, 28(4): 216.
[47]Bhushan S, Kondo K, Predmore B L, et al. Selectiveβ2-adrenoreceptor stimulation attenuates myocardial cell death and preserves cardiac function after ischemia-reperfusion injury[J]. Arteriosci Throm Vas, 2012, 32(8): 1865.
[48]Ju H, Venema V J, Marrero M B, et al. Inhibitory interactions of the bradykininβ2 receptor with endothelial nitric-oxide synthase[J]. J Biol Chem, 1998, 273(37): 24025.
[49]Yao K, Biao X U, Liu Y P. Effects ofβ-adrenoceptor stimulation on endothelial nitric-oxide synthase phosphorylation of human umbilical vein endothelial cells[J]. Acta Pharmacol Sin, 2003, 24(3):219.
[50]Jayachandran M, Hayashi T, Sumi D, et al. Up-regulation of endothelial nitric oxide synthase throughβ2-adrenergic receptor—the role of aβ-blocker with NO-releasing action[J]. Biochem Bioph Res Co, 2001, 280(3): 589.
[责任编辑 陈玲]