异丙酚抑制高糖诱导的脐静脉内皮细胞黏附分子表达
游 莉 姜 辉 朱敏敏
(复旦大学附属肿瘤医院麻醉科 上海 200032)
异丙酚抑制高糖诱导的脐静脉内皮细胞黏附分子表达
游 莉▲姜 辉▲朱敏敏△
(复旦大学附属肿瘤医院麻醉科 上海 200032)
目的 研究异丙酚抑制高糖诱导的脐静脉内皮细胞黏附分子的表达并探讨其可能的机制。方法 采用Histopaque-1077溶液提取人外周血单核细胞。采用一氧化氮(NO)试剂盒检测脐静脉内皮细胞NO生成。采用Western blot检测内皮细胞黏附分子、内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)(总蛋白,单体及双体)、eNOS磷酸化水平及caveolin-1表达。结果 高糖上调血管内皮细胞黏附分子1(vascular cell adhesion molecule,VCAM-1)的表达,促进单核细胞-内皮黏附,并减少NO生成。异丙酚改善高糖环境下NO生成,并抑制VCAM-1表达及单核细胞-内皮黏附。异丙酚的作用可被eNOS抑制剂L-NAME所拮抗。异丙酚能上调高糖环境下eNOS-Ser1177磷酸化水平及双体/单体比值,下调高糖环境下eNOS-Thr495磷酸化水平及caveolin-1表达。结论 异丙酚通过调节高糖环境下eNOS的磷酸化水平、单体/双体比值及caveolin-1表达,改善内皮细胞NO生成,进而抑制内皮细胞黏附分子的表达及单核细胞-内皮细胞的黏附。
丙泊酚; 高糖; 脐静脉; 内皮细胞; 黏附分子
围术期常见高血糖,主要由围术期的生理性应激反应及糖输注过多引起[1-2]。高糖可上调血管内皮细胞黏附分子(vascular cell adhesion molecule,VCAM)的表达[3-5],如VCAM-1。黏附分子表达增加诱导单核细胞-内皮黏附[3],从而导致内皮损伤。对于围术期高血糖患者,抑制VCAM表达可改善内皮损伤,从而改善高血糖患者预后。
一氧化氮(NO)是调节内皮功能重要信号分子,在维持血管内皮功能中发挥关键作用。高糖环境下内皮细胞生成NO的功能受损。研究表明NO生成减少可导致VCAM大量表达并促进单核细胞-内皮黏附,诱导内皮损伤[6-7],而改善NO生成可使VCAM的表达减少[8]。异丙酚能改善缺氧再灌注诱导的VCAM表达[9],但其是否能改善高糖诱导的VCAM表达尚不明确。本文旨在研究异丙酚是否能改善高糖诱导的VCAM表达,并探讨其可能的调节机制(图1)。
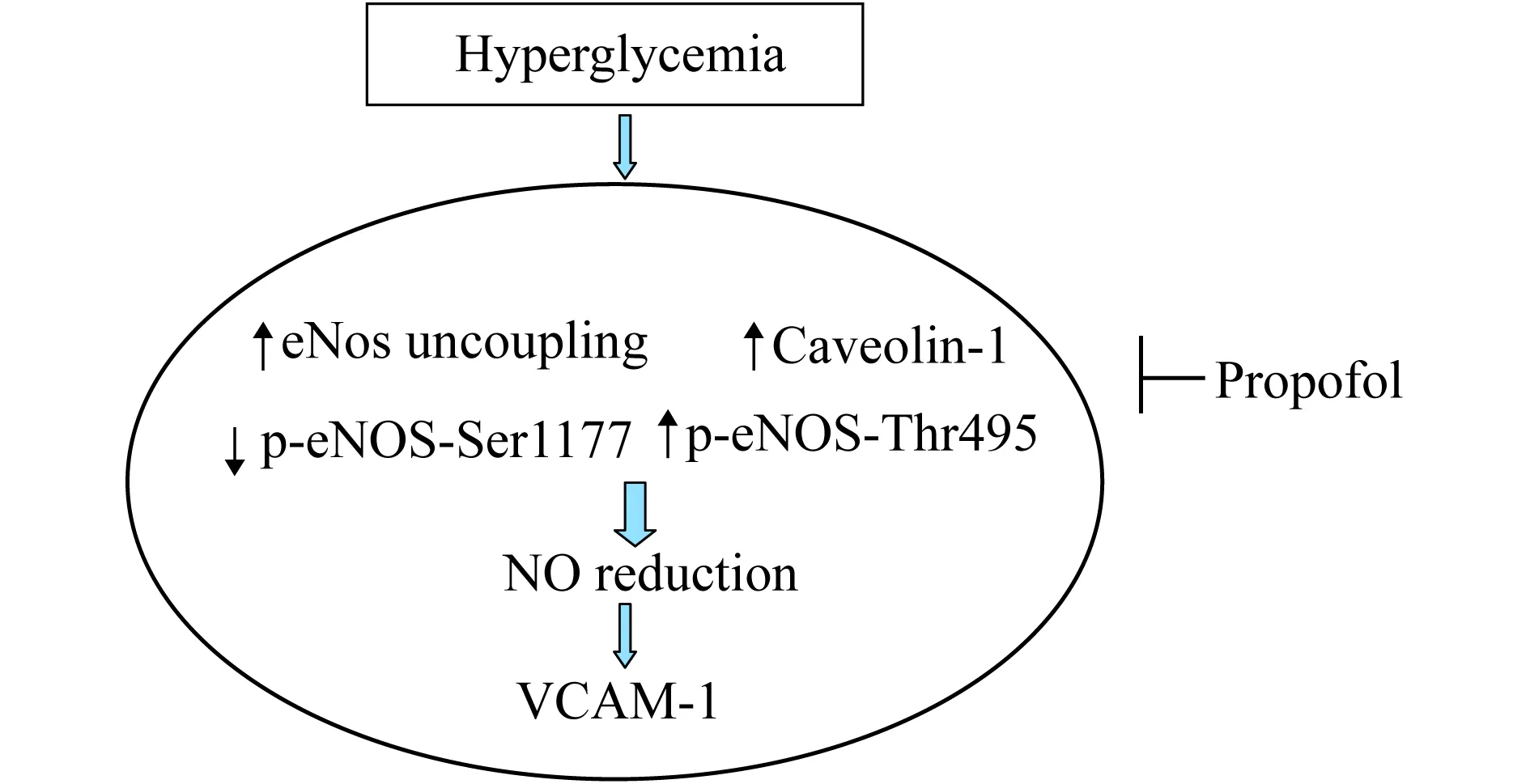
图1 科学假说示意图:异丙酚调节高糖诱导的VCAM表达
材料和分组 将脐静脉内皮细胞分为5组:第1组(对照组)用5mmol/L葡萄糖培养细胞4 h;第2组(高糖组)用30 mmol/L葡萄糖培养细胞4 h;第3组(丙泊酚+高糖组)用5μmol/L丙泊酚预处理细胞30 min,再用30 mmol/L葡萄糖培养细胞4 h;第4组[丙泊酚+内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)抑制剂+高糖组]用5μmol/L丙泊酚、eNOS抑制剂L-NAME 100μmol/L预处理细胞30 min,再用30 mmol/L葡萄糖培养细胞4 h;第5组(eNOS抑制剂对照组)用L-NAME 100μmol/L预处理细胞30 min,再用5 mmol/L葡萄糖培养细胞4 h。
单核细胞-内皮细胞黏附实验 用Histopaque-1077 (美国Sigma公司)试剂分离单核细胞。将5 mL含有单核细胞的肝素化血液转移到含有Histopaque-1077 (5 mL)的离心管中,室温下400×g离心30 min,吸出单核细胞并用PBS清洗,离心后用DEMN培养基重悬单核细胞。将单核细胞悬液加入各处理组含内皮细胞的培养皿中,37 ℃孵育30 min。细胞用PBS清洗3遍,去除未与内皮细胞发生黏附的单核细胞,显微镜下观察并计数。
NO生成检测 采用NO试剂盒(南京建成生物工程研究所)检测脐静脉内皮细胞中NO的生成。
Western blot检测 提取细胞蛋白,等量蛋白经6% SDS-PAGE胶分离,转移到PVDF膜上。室温下用含5%脱脂奶粉的TBST溶液封闭1 h,加入相应的一抗,4 ℃孵育过夜。一抗分别为VCAM-1、p-eNOS-Ser1177、p-eNOS-Thr495、eNOS、caveolin-1和β-actin。次日用TBST溶液于室温下洗膜3次,每次10 min,加入相应的二抗室温孵育1h,再用TBST洗膜3次,每次10 min,最后曝光显影。二抗分别为鼠二抗和兔二抗。各组对应蛋白条带的密度使用scan-gel-it软件进行分析,β-actin作为内参。对照组中目的蛋白与β-actin蛋白条带密度的比值设定为1。
结 果
高糖促进单核细胞-内皮细胞的黏附(P<0.000 1),其作用可被异丙酚所抑制,并与异丙酚浓度存在剂量依赖关系(图2A)。高糖可诱导内皮细胞表面VCAM-1表达(P =0.000 2),其作用可被异丙酚预处理所抑制,并同异丙酚预处理的浓度存在剂量依赖关系(图2B、2C)。5 μmol/L异丙酚预处理可抑制高糖诱导单核细胞-内皮细胞的黏附(P<0.000 1)及VCAM-1表达(P=0.001 3)。
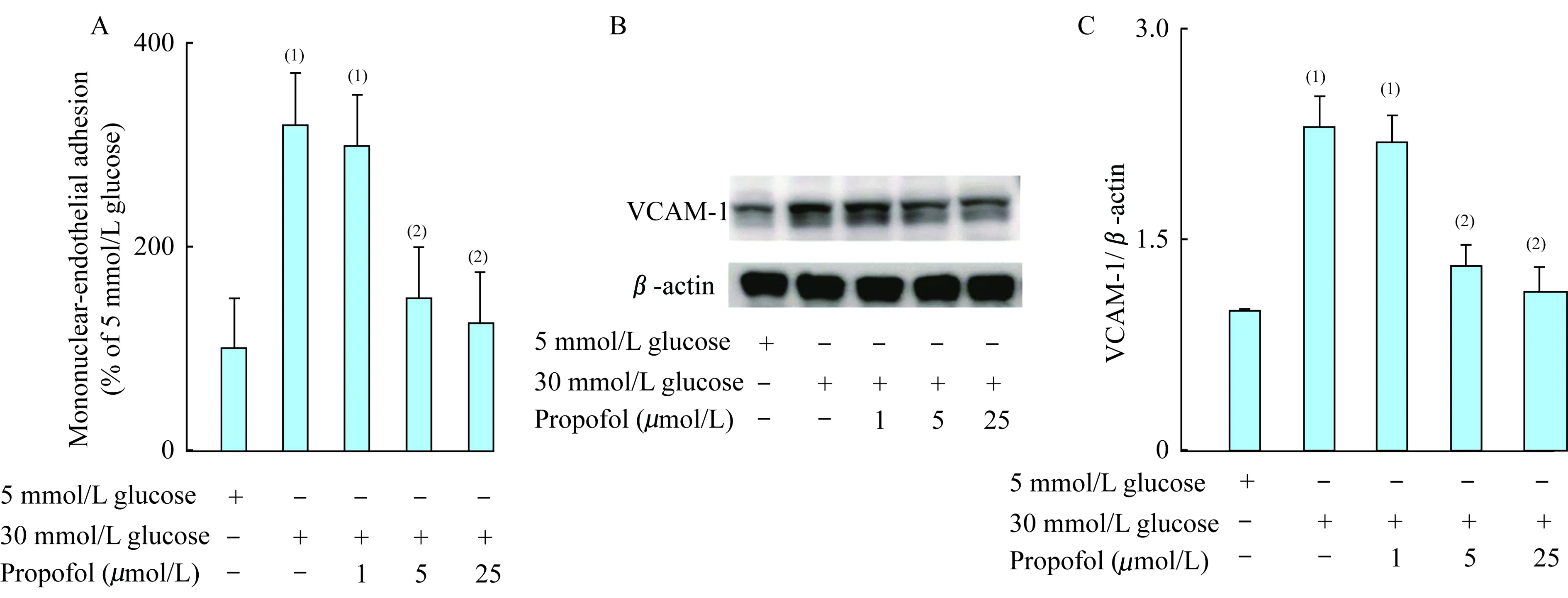
(1)5mmol/L glucose;(2)30 mmol/L glucose.
图2 异丙酚抑制高糖诱导的单核细胞-内皮黏附及VCAM-1表达
Fig 2 Propofol inhibited high glucose induced monocyte endothelial adhesion and VCAM-1 expression
与对照相比,高糖抑制内皮细胞NO生成(P<0.001)。与高糖处理组相比,异丙酚预处理可以改善NO生成,并与异丙酚的预处理浓度存在剂量依赖关系(图3)。5μmol/L异丙酚预处理可以改善高糖诱导的NO生成减少(P<0.000 1)。

(1)5 mmol/L glucose;(2)30 mmol/L glucose.
图3 异丙酚改善高糖环境下脐静脉内皮细胞NO生成
Fig 3 Propofol improved NO production in umbilical vein endothelial cell with high glucose
相比于5 mmol/L葡萄糖,30 mmol/L高糖可诱导内皮细胞表面VCAM-1的表达。异丙酚预处理可抑制高糖环境下VCAM-1表达,其作用可被eNOS抑制剂L-NAME所拮抗(P=0.002 9,图4A、4B)。
相比于5mmol/L葡萄糖,30 mmol/L高糖抑制p-eNOS-Ser1177磷酸化水平(P<0.000 1)、上调p-eNOS-Thr495磷酸化水平(P=0.0005)及eNOS表达(P=0.000 4,图5A、5B)、下调eNOS双体/单体(P<0.000 1,图5A、5C)、上调caveolin-1表达(P<0.000 1,图5A、5D)。5μmol/L异丙酚预处理可以上调高糖环境下p-eNOS-Ser1177磷酸化水平(P=0.001 4)、下调p-eNOS-Thr495磷酸化水平(P=0.001 3,图5A、5B)、上调eNOS双体/单体(P=0.000 4,图5A、5C)、下调caveolin-1表达(P=0.000 3,图5A、5D)、对eNOS总体表达无影响(P=0.480 8,图5A、5B)。
讨 论
以上研究结果表明30 mmol/L高糖处理上调脐静脉内皮细胞黏附分子表达,增加单核细胞-内皮细胞的黏附。5μmol/L异丙酚的预处理通过改善高糖环境下内皮细胞NO生成,抑制高糖诱导的内皮黏附分子表达及单核细胞-内皮细胞的黏附。高糖环境下,5μmol/L异丙酚通过调节内皮细胞eNOS的磷酸化水平、单体/双体比值及抑制caveolin-1表达来改善NO生成。
以上实验结果支持了高糖上调内皮黏附分子表达,从而促进单核细胞与内皮细胞的黏附,诱导内皮损伤[3-5];内皮细胞NO生成减少可诱导黏附分子的表达[6-7];改善NO生成可以抑制黏附分子的表达,且可被eNOS抑制剂L-NAME所阻断[8];高糖通过抑制内皮细胞NO生成,上调黏附分子的表达并促进单核细胞-内皮细胞的黏附,诱导内皮损伤。
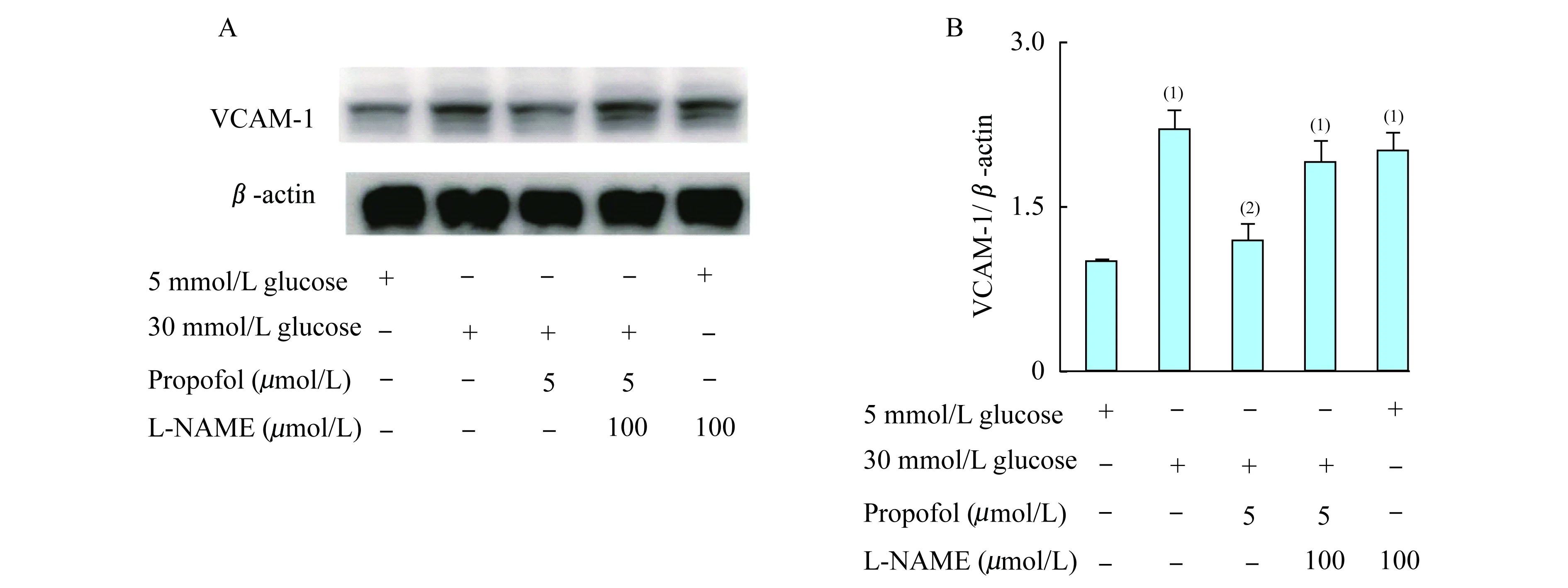
(1)5 mmol/L glucose;(2)30 mmol/L glucose.
图 4 eNOS抑制剂L-NAME拮抗异丙酚的作用
Fig 4 Effect of propofol converted by the eNOS inhibitor of L-NAME

(1)5 mmol/L glucose;(2)30 mmol/L glucose.
图5 异丙酚对高糖环境下eNOS磷酸化水平、双体/单体比值、总表达及caveolin-1表达的影响
Fig 5 Effects of propofol on eNOS phpsphorylation level,morphom/disome ratio,expressions of total eNOS and caveolin-1
eNOS是内皮细胞生成NO的主要来源。eNOS的功能主要由eNOS的表达[10]、磷酸化水平[11]、单体/双体比值[12]及caveolin-1[13]调节。本研究发现高糖虽然上调eNOS的表达,但其可以抑制eNOS正性调节位点Ser1177磷酸化水平,上调抑制性磷酸化位点Thr495磷酸化水平,增加eNOS单体/双体的比值,并上调caveolin-1的表达。eNOS主要以双体形式存在,生成NO而发挥正常的生理功能;但在高糖环境下eNOS发生脱偶联,此时eNOS不再生产NO,而生成超氧阴离子[14-15]。以上实验研究一方面表明高糖可影响eNOS的磷酸化水平而减少内皮细胞NO的生成;另一方面,在内皮细胞中大量存在eNOS大量富集的caveolae结构,调控并保持适当的NO水平,在I型糖尿病中caveolin-1表达上调减少NO生成[13],caveolin-1是eNOS上游的负调控因子,与eNOS形成复合物,此时eNOS失去了催化NO产生活性的能力。
异丙酚是临床上常用的静脉全麻药,除镇静、催眠外,还具有抗氧化、抗凋亡、抗炎等作用。本研究发现异丙酚具有改善高糖环境下内皮细胞生成NO的作用,而该作用主要通过改善eNOS的功能来实现。首先,5μmol/L异丙酚能改善高糖环境下eNOS的磷酸化水平及单体/双体比值。一方面支持高糖激活内皮细胞PKC-βⅡ,上调抑制性磷酸化位点eNOS-Thr495的磷酸化水平[16];另一方面支持高糖可以激活PP2A,下调正性磷酸化位点eNOS-Ser1177的磷酸化水平[17];同时支持异丙酚可以抑制PKC-βⅡ及PP2A的活性[18],从而改善高糖环境下eNOS的磷酸化水平。高糖环境下生成的过氧亚硝基阴离子可诱导eNOS发生脱偶联,异丙酚是强大的过氧亚硝基阴离子清除剂[19],可改善高糖诱导的eNOS脱偶联。其次,5μmol/L异丙酚能抑制高糖环境下caveolin-1的表达,在平滑肌细胞中异丙酚对eNOS/caveolin-1信号通路有调节作用,能促进NO生成[20]。本研究发现,5μmol/L异丙酚在脐静脉内皮细胞中对eNOS/caveolin-1信号通路也有调节作用,并能促进NO生成。因此,5μmol/L异丙酚通过调节高糖环境下eNOS的磷酸化水平、单体/双体比值及caveolin-1表达,改善内皮细胞NO生成,进而抑制VCAM-1的表达及单核细胞-内皮细胞的黏附。虽然eNOS是内皮细胞生成NO的重要来源之一,但是既往研究表明异丙酚不影响高糖环境下eNOS的表达及偶联状态[21]。
本研究的不足之处在于,在人脐静脉内皮细胞中进行的体外实验不同于体内实验,尤其是药物有效性和毒性,且未观察丙泊酚和高糖对单核细胞的影响。因此,需要进一步确定丙泊酚抑制高糖诱导的单核-内皮细胞黏附作用可否通过单核细胞起作用。
[1] WERB MR,ZINMAN B,TEASDALE SJ,etal.Hormonal and metabolic responses during coronary artery bypass surgery:role of infused glucose[J].JClinEndocrinolMetab,1989,69(5):1010-1018.
[2] WALTS LF,MILLER J,DAVIDSON MB,etal.Perioperative management of diabetes mellitus[J].Anesthesiology,1981,55(2):104-109.
[3] MORIGI M,ANGIOLETTI S,IMBERTI B,etal.Leukocyte-endothelial interaction is augmented by high glucose concentrations and hyperglycemia in a NF-kB-dependent fashion[J].JClinInvest,1998,101(9):1905-1915.
[4] MARLELLA R,ESPOSITO K,GIUNTA R,etal.Circulating adhesion molecules in humans: role of hyperglycemia and hyperinsulinemia[J].Circulation,2000,101(19):2247-2251.
[5] BAUMGARTNER-PARZER SM,WAGNER L,PETTERMANN M,etal.Modulation by high glucose of adhesion molecule expression in cultured endothelial cells[J].Diabetologia,1995,38(11):1367-1370.
[6] DE CATERINA R,LIBBY P,PENG HB,etal.Nitric oxide decreases cytokine-induced endothelial activation.Nitric oxide selectively reduces endothelial expression of adhesion molecules and proinflammatory cytokines[J].JClinInvest,1995,96(1):60-68.
[7] CARTWRIGHT JE,WHITLEY GS,JOHNSTONE AP.Endothelial cell adhesion molecule expression and lymphocyte adhesion to endothelial cells: effect of nitricoxide[J].ExpCellRes,1997,235(2):431-434.
[8] XIE H,RAY PE,SHORT BL.Rho-kinase contributes to hypoxia/reoxygenation-induced cerebral endothelial dysfunction[J].JCardiovascPharmacol,2006;48(1):814-819.
[9] CORCORAN TB,ENGEL A,SHORTEN GD.The influence of propofol on the expression of intercellular adhesion molecule 1 (ICAM-1) and vascular cell adhesion molecule 1 (VCAM-1) in reoxygenated human umbilical vein endothelial cells[J].EurJAnaesthesiol,2006,23(11):942-947.
[10] GRUMBACH IM,CHEN W,MERTENS SA,etal.A negative feedback mechanism involving nitric oxide and nuclear factor kappa-B modulates endothelial nitric oxide synthase transcription[J].JMolCellCardiol,2005,39(4):595-603.
[11] MICHELL BJ,CHEN ZP,TIGANIS T,etal.Coordinated control of endothelial nitric-oxide synthase phosphorylation by protein kinase C and the cAMP-dependent protein kinase[J].JBiolChem,2001,276(21): 17625-17628.
[12] RODRIGUEZ-CRESPO I,GERBER NC,ORTIZ DE MONTELLANO PR.Endothelial nitric-oxide synthase expression in Escherichia coli,spectroscopic characterization,and role of tetrahydrobiopterin in dimerformation[J].JBiolChem,1996,271(19):11462-11467.
[13] XU L,WENJUAN X,YANG W,etal.Upregulation of caveolin-1 contributes to aggravated high-salt diet-induced endothelial dysfunction and hypertension in type 1 diabeticrats[J].LifeSci,2014,113(1-2): 31-39.
[14] XIA Y,TSAI AL,BERKA V,etal.Superoxide generation from endothelial nitric-oxide synthase: a Ca2+/calmodulin-dependent and tetrahydrobiopterin regulatory process[J].JBiolChem,1998,273(40):25804-25808.
[15] VASQUEZ-VIVAR J,KALYANARAMAN B,MARTASEK P,etal.Superoxide generation by endothelial nitric oxide synthase: the influence of cofactors[J].ProcNatlAcadSciUSA,1998,95(16):9220-9225.
[16] PANENI F1,MOCHARLA P,AKHMEDOV A,etal.Gene silencing of the mitochondrial adaptor p66(Shc) suppresses vascular hyperglycemic memory in diabetes[J].CircRes, 2012,111(3):278-289.
[17] MICHELL BJ,CHEN Z,TIGANIS T,etal.Coordinated control of endothelial nitric-oxide synthase phosphorylation by protein kinase C and the cAMP-dependent protein kinase[J].JBiolChem, 2001,276(21):17625-17628.
[18] ZHU M,CHEN J,WEN M,etal.Propofol protects against angiotensin II-induced mouse hippocampal HT22 cells apoptosis via inhibition of p66Shc mitochondrial translocation[J].NeuromolecularMed,2014,16(4):772-781.
[19] MATHY-HARTERT M,MOUITHYS-MICKALAD A,KOHNEN S,etal.Effects of propofol on endothelial cells subjected to a peroxynitrite donor (SIN-1) [J].Anaesthesia,2000,55(11):1066-1071.
[20] GRIM KJ,ABCEJO AJ,BARNES A,etal.Caveolae and propofol effects on airway smooth muscle[J].BrJAnaesth,2012,109(3): 444-453.
[21] ZHU M,CHEN J,TAN Z,etal.Propofolprotects against high glucose-induced endothelial dysfunction in human umbilical vein endothelial cells[J].AnesthAnalg,2012,114(2):303-309.
Propofol inhibits high glucose induced expression of endothelial adhesion molecule in umbilical vein endothelial cells
YOU Li▲, JIANG Hui▲, ZHU Min-min△
(DepartmentofAnesthesiology,ShanghaiCancerCenter,FudanUniversity,Shanghai200032,China)
Objective To study high glucose induced expressiont of endothelial adhesion molecule inhibited by propofol in umbilical vein endothelial cells,and to investigate its mechanism. Methods Human peripheral mononuclear cells were prepared with Histopaque-1077 solution.Nitric oxide (NO) production was measured with an assay kit.Vascular cell adhesion molecule 1 (VCAM-1) expression,endothelial nitric oxide synthase (eNOS) total protein,dimer and monomer expression,eNOS phosphorylation and caveolin-1 were measured by Western blot. Results High glucose induced VCAM-1 expression,increased mononuclear-endothelial adhesion and reduced NO production.Propofol improved NO level,and inhibited VCAM-1 expression and mononuclear-endothelial adhesion.The protective effect of propofol would be blocked by an eNOS inhibitor of L-NAME.Propofol increased high glucose-mediated eNOS-Ser1177phosphrylation and dimmer/monomer ratio,and attenuated high glucose-induced eNOS-Thr495phosphrylation and caveolin-1 expression. Conclusions Propofol improved high glucose mediated eNOS phosphrylation,dimer/monomer ratio and caveolin-1 expression,so that NO production was improved and VCAM-1 expression and mononuclear-endothelial interaction were inhibited.
propofol; high glucose; umbilical vein; endithelial cell; adhesion molecule
R34,R614.1
A
10.3969/j.issn.1672-8467.2017.01.013
2016-01-18;编辑:段佳)
▲YOU Li and JIANG Hui contributed equally to this article
△Corresponding author E-mail:zhu_mm@126.com

