徐州地区116株MRSA耐药性分析与分子流行病学调查
纵 帅,徐萍萍,顾 兵,郝婷婷,寇艳波,徐银海
(1 徐州医科大学附属医院, 江苏 徐州 221002; 2 徐州市中心医院,江苏 徐州 221002; 3 徐州医科大学感染与免疫实验室,江苏 徐州 221004)
·论著·
徐州地区116株MRSA耐药性分析与分子流行病学调查
纵 帅1,徐萍萍2,顾 兵1,郝婷婷1,寇艳波3,徐银海1
(1 徐州医科大学附属医院, 江苏 徐州 221002; 2 徐州市中心医院,江苏 徐州 221002; 3 徐州医科大学感染与免疫实验室,江苏 徐州 221004)
目的 了解耐甲氧西林金黄色葡萄球菌(MRSA)感染现状和耐药机制,为临床合理用药提供依据。方法 收集徐州地区2012—2015年各类标本中分离的金黄色葡萄球菌(SA),用头孢西丁纸片扩散法初筛MRSA菌株,扩增mecA基因进行确认,K-B法检测MRSA对药物的敏感性,E-test法测定万古霉素的最低抑菌浓度(MIC),采用多重PCR进行葡萄球菌染色体mec(SCCmec)基因分型。结果 2012—2015年210株SA共检出MRSA 116株,其中mecA基因阳性114株,MRSA总检出率为55.24%。MRSA对万古霉素、奎奴普丁/达福普汀、替考拉宁和利奈唑胺的敏感率均为100%,对氯霉素和呋喃妥因的耐药率最低,分别为15.52%、1.72%,MRSA对10种抗菌药物的耐药率>80%;MRSA对青霉素类、氨基糖苷类、红霉素、喹诺酮类、磺胺类、利福平、四环素、克林霉素的耐药率高于甲氧西林敏感金黄色葡萄球菌(MSSA)。2012—2015年万古霉素对MRSA的MIC均为1.0 μg/mL,MIC90均为1.5 μg/mL,2015年发现1株MRSA的万古霉素MIC为2.0 μg/mL。116株MRSA分型结果显示,SCCmecII型11株(9.48%),SCCmecIII型85株(73.28%),SCCmecIV型4株(IVa和IVb型各2株,均为1.72%),未分型MRSA 16株(13.79%),未检出SCCmecI和V型。结论 MRSA呈严重的多重耐药,对万古霉素MIC无漂移,临床MRSA分离株以SCCmecIII型为主,临床应采取感染控制措施,控制MRSA感染。
耐甲氧西林金黄色葡萄球菌; MRSA; 耐药性; 最低抑菌浓度; MIC; 葡萄球菌染色体mec盒; SCCmec
[Chin J Infect Control,2017,16(2):104-108]
耐甲氧西林金黄色葡萄球菌(methicillin-resistantStaphylococcusaureu, MRSA)是目前引起医院感染最重要的革兰阳性菌之一,文献[1]报道,甲氧西林敏感金黄色葡萄球菌(methicillin-sensitiveStaphylococcusaureus,MSSA)获得外源性mecA产生耐药成为MRSA,存在于葡萄球菌染色体mec盒(SCCmec)的mecA基因编码新的青霉素结合蛋白PBP2a,降低其与β-内酰胺类抗生素的亲合力,而产生耐药。SCCmec还可携带除mecA基因外的其他耐药基因,造成多药耐药(multidrug-resistance, MDR)。SCCmec目前主要分为8型,基因型与MRSA的流行背景有关,不同SCCmec型别的菌株结构、耐药性和流行特点不同,不同地区的SCCmec基因型分布可能不同。本研究对徐州地区的MRSA进行相关实验,明确本地区MRSA的耐药表型和分子流行病学特征,为临床提供相关依据。
1 对象与方法
1.1 菌株来源 210株金黄色葡萄球菌(SA)分离自本地区4所三级综合性医院2012—2015年临床送检的痰、血和分泌物等标本,经培养、分纯和微生物全自动鉴定系统鉴定,除去同一患者分离的重复菌株,初步鉴定为MRSA后-80 ℃保存。质控菌株金黄色葡萄球菌ATCC 29213,购自国家卫生计生委临床检验中心,MRSA阳性对照菌株为北京大学人民医院王辉教授馈赠。
1.2 主要试剂与仪器 VITEK 2 Compact全自动细菌鉴定分析系统为法国生物梅里埃公司产品,MyCycler PCR热循环仪、电泳仪和凝胶成像系统均为美国伯乐(Bio-Rad)公司产品,TaKaRa PCR Amplification Kit和琼脂糖购自宝生物工程(大连)有限公司,GelGreen核酸染料和DL2000 Plus DNA Marker购自南京诺唯赞生物科技有限公司,所有药敏纸片为英国OXOID公司产品,E-test试纸条为法国生物梅里埃公司产品,引物由生工生物工程(上海)股份有限公司合成。
1.3 药敏试验 纸片扩散法(K-B法)检测MRSA对临床常用的19种抗菌药物的敏感性,检测抗菌药物为青霉素、苯唑西林、阿莫西林、氧氟沙星、诺氟沙星、左氧氟沙星、环丙沙星、红霉素、克林霉素、庆大霉素、四环素、磺胺甲口恶唑、复方磺胺甲口恶唑、氯霉素、利福平、呋喃妥因、奎奴普丁/达福普汀、替考拉宁和利奈唑胺。所有折点判断采用美国临床实验室标准化协会(CLSI)2015标准。
1.4 初步鉴定 采用CLSI 2015版标准推荐的头孢西丁(30 μg/片)K-B法,纸片抑菌环直径≤21 mm判定为MRSA。
1.5 万古霉素MIC检测 选用万古霉素E-test试剂条对初步鉴定的MRSA进行MIC测定。根据MIC测定结果,分别统计出MIC几何均值、MIC50、MIC90和MIC范围。
1.6 MRSA确认试验 初步鉴定的菌株采用煮沸法提取基因组DNA,利用核酸蛋白测定仪测定其浓度和纯度,用PCR扩增mecA基因。PCR反应体系为25 μL,内含2.5 mmol/L dNTP Mixture 2 μL、250 nmol/L上下游引物各0.5 μL、5 U/μL TakaRa-Taq酶0.25 μL、100 ng DNA模板0.5 μL、10×PCR缓冲液(pH8.3)2.5 μL,余用灭菌蒸馏水补齐。PCR反应条件:94℃10 min预变性;94℃ 30 s,54℃退火45 s,72℃延伸1 min,30个循环;最后72℃再延伸5 min。PCR产物在1.0%琼脂糖凝胶(含1%GelGreen)中电泳,电压5 V/cm,电泳30 min,在凝胶成像系统成像。引物见表1。
1.7 SCCmec基因分型 用多重PCR进行SCCmec基因分型,参照Zhang等[2]的方法进行。PCR反应体积为50 μL,包括2.5 mmol/L dNTP Mixture 4 μL,250 nmol/L上下游引物各0.5 μL,5 U/μL TakaRa-Taq酶 0.5 μL,DNA模板各1 μL,10×PCR缓冲液(pH 8.3)5 μL,余用灭菌蒸馏水补齐。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,52 ℃退火45 s,72 ℃延伸1 min,30个循环;最后72 ℃再延伸10 min。PCR产物在琼脂糖凝胶中电泳,电泳条件同mecA基因。引物见表1。
表1mecA 及SCCmec基因PCR扩增引物及其产物大小
Table 1 PCR amplification primer and size of products ofmecA and SCCmecgenes

目的基因引物序列(5’-3’)产物长度(bp)mecAF:GTAGAAATGACTGAACGTCCGATAA310R:CCAATTCCATGTTTCGGTCTAASCCmecIF:GCTTTAAAGAGTGTCGTTACAGG613R:GTTCTCTCATAGTATGACGTCCSCCmecIIF:CGTTGAAGATGATGAAGCG398R:CGAAATCAATGGTTAATGGACCSCCmecIIIF:CCATATTGTGTACGATGCG280R:CCTTAGTTGTCGTAACAGATCGSCCmecIVaF:GCCTTATTCGAAGAAACCG776R:CTACTCTTCTGAAAAGCGTCGSCCmecIVbF:TCTGGAATTACTTCAGCTGC493R:AAACAATATTGCTCTCCCTCSCCmecIVcF:ACAATATTTGTATTATCGGAGAGC200R:TTGGTATGAGGTATTGCTGGSCCmecIVdF:CTCAAAATACGGACCCCAATACA881R:TGCTCCAGTAATTGCTAAAGSCCmecVF:GAACATTGTTACTTAAATGAGCG325R:TGAAAGTTGTACCCTTGACACC内标基因mecA147F:GTGAAGATATACCAAGTGATT147R:ATGCGCTATAGATTGAAAGGAT
1.8 统计学方法 应用WHONET 5.6软件和SPSS 11.5软件对数据进行分析,率的比较采用χ2检验,MIC均值比较采用方差分析。
2 结果
2.1 MRSA检出率 经头孢西丁纸片初筛试验,2012—2015年210株SA共检出116株MRSA,检出率为55.24%;4年分别检出MRSA 23、25、33、35株,检出率分别为57.50%、52.08%、56.90%、54.69%,4年间检出率比较,差异无统计学意义(χ2=0.35,P=0.95)。见表2。
表2 2012—2015年分离的SA中MRSA检出情况
Table 2 Detection of MRSA among SA isolated in 2012-2015
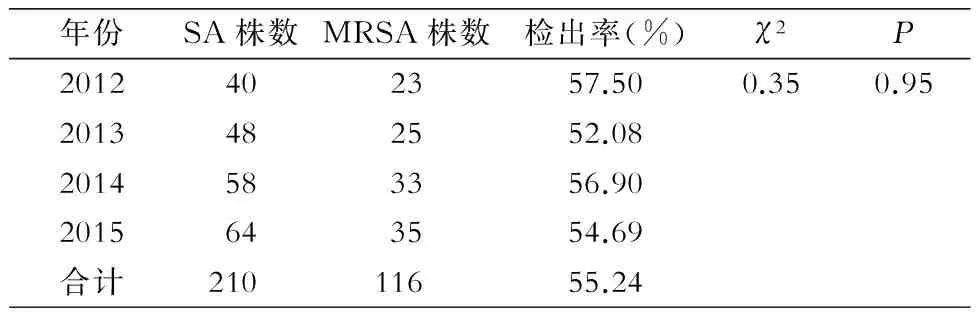
年份SA株数MRSA株数检出率(%)χ2P2012402357.500.350.952013482552.082014583356.902015643554.69合计21011655.24
2.2 药敏试验结果 MRSA对万古霉素、奎奴普丁/达福普汀、替考拉宁和利奈唑胺的敏感率为100%;MRSA对氯霉素和呋喃妥因的耐药率最低,分别为15.52%和1.72%,MRSA对检测的10种抗菌药物的耐药率>80%。MRSA对青霉素类、氨基糖苷类、红霉素、喹诺酮类、磺胺类、利福平、四环素、克林霉素的耐药率高于MSSA,差异均有统计学意义(均P<0.01)。见表3。
表3 MRSA和MSSA对20种抗菌药物的耐药率(%)
Table 3 Resistance rates of MRSA and MSSA to 20 kinds of antimicrobial agents(%)

抗菌药物MRSA(n=116)MSSA(n=94)χ2P青霉素100.0081.9122.830.00苯唑西林100.000.00210.000.00阿莫西林94.8315.96134.060.00庆大霉素85.3411.70112.890.00万古霉素0.000.00--替考拉宁0.000.00--奎奴普丁/达福普汀0.000.00--利奈唑胺0.000.00--四环素82.7625.5369.440.00氯霉素15.528.512.350.13红霉素87.0747.8737.650.00克林霉素69.8339.3619.580.00环丙沙星88.7921.2897.540.00氧氟沙星93.9712.77140.200.00诺氟沙星90.5214.89120.930.00左氧氟沙星88.795.32144.840.00呋喃妥因1.720.00-0.50*复方磺胺甲口恶唑60.3428.7220.890.00磺胺甲口恶唑56.9029.7915.430.00利福平38.796.3829.660.00
*:采用Fisher 精确概率法
2.3 万古霉素对MRSA的MIC 2012—2015年万古霉素对MRSA 的MIC50均为1.0 μg/mL,MIC90均为1.5 μg/mL;2012—2014年MIC 范围为(0.5~1.5)μg/mL,2015年MIC 范围为(0.5~2.0)μg/mL。2015年发现1株MRSA的万古霉素MIC为2.0 μg/mL;2012—2015年万古霉素对MRSA的MIC几何均值分别为1.15、1.09、1.24和1.26 μg/mL,4年几何均值总体比较,差异无统计学意义(F=2.35,P=0.18)。见表4。
表4 2012—2015年万古霉素对MRSA的MIC(μg/mL)
Table 4 MICs of vancomycin to MRSA strains in 2012-2015(μg/mL)

年份MIC范围MIC的几何平均值MIC50MIC9020120.5~1.51.151.01.520130.5~1.51.091.01.520140.5~1.51.241.01.520150.5~2.01.261.01.5
2.4 MRSA确认试验 116株头孢西丁检测为MRSA,其中114株菌mecA基因PCR扩增为阳性,在310 bp有目的条带。见图1。
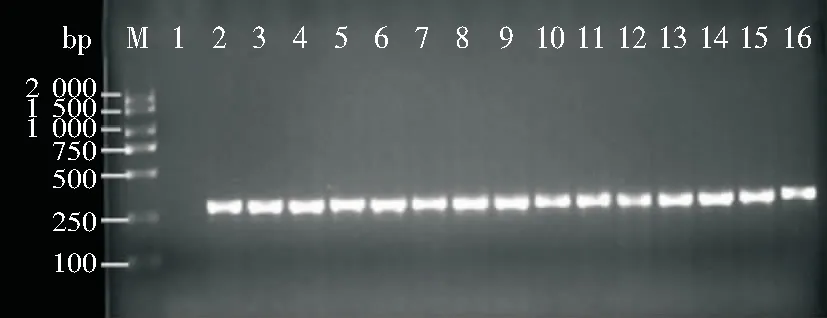
M:DL2000 DNA Marke;1:阴性对照;2:阳性对照;3—16:临床菌株mecA基因阳性
图1 MRSAmecA基因PCR产物电泳图
Figure 1 PCR product electrophoresis map of MRSAmecA gene
2.5 SCCmec分型结果 116株MRSA多重PCR分型结果显示,SCCmecII型11株(9.48%),SCCmecIII型85株(73.28%),SCCmecIV型4株(IVa和IVb型各2株,均为1.72%),仅内标基因阳性的未分型MRSA 16株(13.79%),未检出SCCmecI和SCCmecV型。见图2。

M:DL2000 DNA Marker; 1:阴性对照;2—3:未分型;4—5:SCCmecII型;6—7:SCCmecIII型;8—9:SCCmecIVa型;10—11:SCCmecIVb型
图2 MRSA SCCmec多重PCR产物琼脂糖凝胶电泳图
Figure 2 Agarose gel electrophoresis map of multiplex PCR product of MRSA SCCmec
3 讨论
MRSA是目前世界性医院感染的重要病原菌,多呈多重耐药,MRSA感染的治疗是临床十分棘手的难题。本研究210株SA检出116株MRSA,检出率为55.24%,2012—2015年检出率比较,差异无统计学意义,在国内外处于较高水平[3-4],高检出率除与规范化送检有关外,还提示该地区MRSA感染情况较严重。研究[5]表明,地区性的持续性协同预防和数据监测可以有效阻断MRSA传播。
药敏试验结果显示,MRSA对氯霉素和呋喃妥因的耐药率最低,分别为15.52%、1.72%,MRSA对检测的10种抗菌药物的耐药率>80%,说明多重耐药情况严重。MRSA对万古霉素、奎奴普丁/达福普汀、替考拉宁和利奈唑胺的敏感率为100%,未发现耐药株,可作为MRSA感染初次治疗的首选药物。本研究中MRSA耐药率高于MSSA,表明MRSA的耐药情况总体比MSSA更严重,且MRSA感染可导致更高的病死率和更长的住院时间[6],MRSA形成机制使其更易发生医院感染,因此临床治疗MRSA感染时要重视药敏试验,根据药敏结果合理选用抗菌药物,同时根据患者感染情况制定差异化治疗方案[7],防止或延缓强耐药株的出现。
万古霉素仍是目前临床治疗MRSA的最重要抗菌药物,临床上将万古霉素对MRSA仍敏感但其MIC逐年上升的现象称 “MIC漂移”。 本研究发现本地区2012—2015年万古霉素MIC未发生漂移,但随着万古霉素使用剂量、时间、强度和频度的增加,万古霉素对MRSA耐药压力选择增加,不能排除本地区对MRSA的敏感性有下降趋势。万古霉素MIC≥1.5 μg/mL称为高MIC。研究[8]表明,高MIC与MRSA感染患者治疗失败率和病死率密切相关,高MIC存在潜在的治疗失败风险。台湾地区对123例MRSA感染患者的研究[9]结果表明,万古霉素MIC为2 μg/mL的患者平均住院时间、医疗费用和病死率均高于MIC<2 μg/mL的患者,因此应监控高MIC MRSA感染者,尤其是万古霉素MIC为2 μg/mL的,降低其感染病死率。
SA获得外源性基因mecA成为MRSA,因此把mecA基因作为MRSA的分子标志,作为鉴定MRSA的“金标准”[10]。近年发现,MRSA形成除与mecA基因有关外,某些MRSA还表达mecA同源性基因mecB和mecC[1,11],MRSA形成机制复杂。本研究经头孢西丁纸片扩散法116 株SA鉴定为MRSA,其中114株携带mecA基因,两种方法符合率为98.28%,另2株经头孢西丁纸片扩散法(K-B法)、苯唑西林MIC法和PBP2α胶乳凝集法检测均鉴定为MRSA,提示 MRSA存在除mecA外的其他耐药机制。
SCCmec是一种携带mecA基因的可移动遗传元件,根据其复合体组成不同可将SCCmec分为11个亚型[12],其中SCCmecI—V型是常见的类型。本研究根据SCCmec各亚型的特异性片段设置引物,通过多重PCR扩增常见的5种SCCmec基因型,多重PCR产物电泳结果除内标基因外,每株细菌仅扩增出一个特异性片段,提示本研究所有分型菌株均只携带SCCmec的1个亚型,其中SCCmecIII型占73.28%,为最主要型别,SCCmecII基因型占9.48%,另有4株为SCCmecIV。116株MRSA菌株中100株(86.21%)属SCCmecII-IV型,与国内某些地区研究[13]结果相似,但基因型存在明显的地区性差异,如杭州地区SCCmec基因分型以Ⅱ型为主,III型次之[14]。有研究发现,SCCmecII型基因和SCCmecIII型基因分子结构长,携带多种耐药基因[11],与多重耐药相关,是主要的MRSA型别。本组MRSA对多数抗菌药物耐药率均>50%,除氯霉素和呋喃妥因外,MRSA耐药率均高于MSSA(均P<0.01),进一步提示MRSA严重的多重耐药可能与携带mecA及其他耐药基因相关。
本组研究检测了徐州地区MRSA的耐药表型,万古霉素MIC漂移情况和SCCmec基因型,对确定本地区MRSA优势菌株的分子流行病学特征、临床治疗和感染控制均具有重要意义。
[1] Hiramatsu K, Ito T, Tsubakishita S, et al. Genomic basis for methicillin resistance inStaphylococcusaureus[J]. Infect Chemother, 2013, 45(2): 117-136.
[2] Zhang K, McClure JA, Elsayed S, et al. Novel multiplex PCR assay for characterization and concomitant subtyping of staphylococcal cassette chromosomemectypes I to V in methicillin-resistantStaphylococcusaureus[J]. J Clin Microbiol, 2005, 43(10): 5026-5033.
[3] 申桂娟,陆军,祝进,等.耐甲氧西林金黄色葡萄球菌的临床分布与耐药性分析[J].中华医院感染学杂志,2014,24(2): 282-284.
[4] Grema H, Geidam Y, Gadzama G, et al. Methicillin resistantStaphyloccusaureus(MRSA): a review[J]. Adv Anim Vet Sci, 2015, 3(2): 79-98.
[5] Jurke A, Kock R, Becker K, et al. Reduction of the nosocomial methicillin-resistantStaphylococcusaureusincidence density by a region-wide search and follow-strategy in forty German hospitals of the EUREGIO, 2009 to 2011[J]. Euro Surveill, 2013, 18(36): pii=20579.
[6] de Kraker ME, Wolkewitz M, Davey PG, et al. Clinical impact of antimicrobial resistance in European hospitals: excess mortality and length of hospital stay related to methicillin-resistantStaphylococcusaureusbloodstream infections[J]. Antimicrob Agents Chemother, 2011, 55(4): 1598-1605.
[7] Gould IM, David MZ, Esposito S, et al. New insights into methicillin-resistantStaphylococcusaureus(MRSA) pathogenesis, treatment and resistance[J]. Int J Antimicrob Agents, 2012, 39(2): 96-104.
[8] Jacob JT, DiazGranados CA. High vancomycin minimum inhibitory concentration and clinical outcomes in adults with methicillin-resistantStaphylococcusaureusinfections: a meta-analysis[J]. Int J Infect Dis, 2012, 17(2): e93-e100.
[9] Wang JL, Wang JT, Sheng WH, et al. Nosocomial methicillin-resistantStaphylococcusaureus(MRSA) bacteremia in Taiwan: mortality analyses and the impact of vancomycin, MIC = 2 mg/L, by the broth microdilution method[J]. BMC Infect Dis, 2010, 10: 159.
[10] Chowdhury D, Jhora ST, Paul S, et al. Comparison of cefoxitin and oxacillin disc diffusion test for the detection ofmecA mediated methicillin resistance inStaphylococcusaureus[J]. Bangladesh J Med Microbiol, 2013, 7(1): 7-10.
[11] Paterson GK, Harrison EM, Holmes MA. The emergence ofmecC methicillin-resistantStaphylococcusaureus[J]. Trends Microbiol, 2014, 22(1): 42-47.
[12] 杨延成,程航,周人杰,等. SCCmec遗传元件及其在耐甲氧西林金黄色葡萄球菌分子分型中的应用[J]. 遗传,2015,37(5): 442-451.
[13] 赵彩芸,吕媛,李耘,等.耐甲氧西林金黄色葡萄球菌SCCmec分型与耐药性研究[J].中华医院感染学杂志,2011,21(15): 3102-3105.
[14] 杨永刚,陈瑜,陈晓,等.耐甲氧西林金黄色葡萄球菌分型及流行现状[J].微生物学通报,2015,42(1): 110-116.
(本文编辑:豆清娅)
Antimicrobial resistance and molecular epidemiology of 116 strains of methicillin-resistantStaphylococcusaureuin Xuzhou area
ZONGShuai1,XUPing-ping2,GUBing1,HAOTing-ting1,KOUYan-bo3,XUYin-hai1
(1TheAffiliatedHospitalofXuzhouMedicalUniversity,Xuzhou221002,China; 2XuzhouCentralHospital,Xuzhou221002,China; 3InfectionandImmunityLaboratoryofXuzhouMedicalUniversity,Xuzhou221004,China)
Objective To investigate infection status and antimicrobial resistance mechanism of methicillin-resistantStaphylococcusaureus(MRSA),and provide reference for the rational antimicrobial use in clinic. MethodsStaphylococcusaureus(SA) isolated from various specimens in Xuzhou area in 2012-2015 were collected, MRSA strains were preliminarily screened by cefoxitin disk diffusion method, and confirmed by amplification ofmecA gene, antimicrobial resistance of MRSA was determined by Kirby-Bauer method, minimal inhibitory concentration (MIC) was measured by E-test method, genotypes of staphylococcal chromosomal cassettemec(SCCmec) were determined by multiplex PCR. Results A total of 116 strains of MRSA were identified among 210 SA strains in 2012-2015,114 of which were positive formecA gene, the total detection rate of MRSA was 55.24%. Susceptibility rates of MRSA to vancomycin, quinupristin/ dalfopristin, and linezolid were all 100%, resistance rates of MRSA to chloramphenicol and furantoin were both low, which were 15.52% and 1.72% respectively, resistance rates of MRSA to 10 kinds of antimicrobial agents were all>80%; resistance rates of MRSA to penicillins, aminoglycosides, macrolides, quinolones, sulfanilamide, rifampicin, tetracycline, and clindamycin were all higher than methicillin-sensitiveStaphylococcusaureus(MSSA). MICs of vancomycin to MRSA in 2012-2015 were all 1.0 μg/mL,MIC90were all 1.5 μg/mL, one MRSA isolate was with a vancomycin MIC of 2.0 μg/mL in 2015. MRSA typing results of 116 MRSA isolates showed that SCCmecII, SCCmecIII, and SCCmecIV accounted for 9.48%(n=11), 73.28%(n=85),and 1.72%(Iva,n=2; IVb,n=2) respectively, 13.79%(n=16) of MRSA isolates were nontypeable, SCCmecI and SCCmecV type strains were not found. Conclusion MRSA is seriously multidrug-resistant,the drift has not been discovered in MIC value of vancomycin against MRSA, the major SCCmecgenotype of MRSA is SCCmecIII, infection control measures should be taken to control MRSA infection.
methicillin-resistantStaphylococcusaureus; MRSA; drug resistance; minimal inhibitory concentration; MIC; staphylococcal chromosomal cassettemec; SCCmec
2016-05-30
徐州市科技局资助项目(KC14SH116)
纵帅(1981-),男(汉族),江苏省徐州市人,主管检验师,主要从事临床微生物检验和细菌耐药机制研究。
徐银海 E-mail:1755789156@qq.com
10.3969/j.issn.1671-9638.2017.02.002
R181.3+2 R378.1+1
A
1671-9638(2017)02-0104-05

