微流控芯片-质谱联用细胞分析方法研究进展
林雪霞,刘 斌,孙向英,林金明
(1.华侨大学 化工学院,福建 厦门 361021;2.华侨大学 材料科学与工程学院,福建 厦门 361021;3.微量分析测试和仪器研制北京重点实验室,清华大学 化学系,北京 100084)
微流控芯片-质谱联用细胞分析方法研究进展
林雪霞1,刘 斌2,孙向英2,林金明3*
(1.华侨大学 化工学院,福建 厦门 361021;2.华侨大学 材料科学与工程学院,福建 厦门 361021;3.微量分析测试和仪器研制北京重点实验室,清华大学 化学系,北京 100084)
细胞分析和代谢物分析在生物系统中起着重要的作用。微流控技术已成为细胞生物学研究的一个重要工具。该文总结了最近微流控芯片在细胞和代谢物的分析,尤其是微流控芯片与质谱联用技术的应用。同时对微流控芯片上细胞的生物学研究提出了见解和看法,希望能对感兴趣者提供一些启发。
微流控芯片;质谱分析;细胞分析;细胞代谢物分析
代谢在生物系统中发挥着重要的作用。它是生命体得以正常运转的基础,为生命体提供了多种生物成分(如蛋白质,RNA,DNA和细胞壁),提供了代谢的中间体,也为生命代谢提供了各种各样的必需品(如ATP的能量释放),并调节和监管了细胞间的信号通路。通过分析细胞代谢物,可以了解生物系统中生理和病理下的反应机制以及细胞间信息的传递[1-2]。同时将细胞代谢物的分析与细胞的形态变化、增殖与迁移相结合,将为生命活动规律的探索,药物的筛选,疾病的诊断与治疗提供有力的依据。由于细胞尺寸微小,难以操纵,且细胞内基质复杂。另外,由于与疾病相关的代谢物(如肿瘤标志物)在体内的含量极低,因此对代谢物的研究需要灵敏度更高、选择性更好的分析方法。
质谱检测涵盖了大部分的生物小分子、多肽、蛋白质、酶和核酸等,该方法不仅能够快速地识别目标分子,一次性检测出多种化合物,而且能够进行代谢物的溯源分析,已发展成为生物分析中最重要的检测手段之一[3-4]。 此外,由于细胞所处体内微环境的变化将引起代谢物种类和含量的变化,甚至引起代谢物的紊乱,而近年快速发展起来的微流控芯片技术可以较好地模拟细胞的生理环境;同时,微型化的通道不会过度稀释细胞分泌物,是研究细胞间相互作用以及细胞药物代谢和递送的理想平台[5]。本文主要从以下3个方面介绍了微流控芯片,以及微流控芯片-质谱联用技术在细胞分析和代谢物分析方面的应用和发展:①微流控芯片上细胞微环境的模拟[6];②微流控芯片-质谱用于细胞的药物代谢分析[7-8];③微流控芯片-质谱用于细胞分泌物如蛋白质、生长因子等的分析[9]。
1 微流控芯片上的细胞分析
1.1 微流控芯片上细胞微环境的模拟
微流控芯片(Microfluidic chip)又称微全分析系统或芯片实验室(Lab on a chip,LOC),在20世纪90年代初首次被提出,是指在一块几平方厘米(甚至更小)的芯片上可以集成或基本集成化学和生物等领域所涉及的样品制备、反应、分离、检测等基本操作单元,以微通道形成网络,贯穿整个系统,用以取代常规化学或生物实验室的各种功能的一种技术平台[10]。与传统的培养瓶、培养皿以及孔板用于细胞培养相比,微流控芯片用于细胞培养具有明显的优势。芯片设计的自由性为细胞微环境的模拟提供了良好的工具。

图1 微流控技术用于细胞微环境的模拟[14,16]Fig.1 The application of microfluidic technology for simulation of cell microenvironment[14,16]
细胞在体内并不是单独存在的,而是与周围的环境互为一体。细胞的迁移、分化、增殖和凋亡等行为与机体生命活动中的胚胎发育、免疫防御、损伤修复、血管新生以及肿瘤转移等许多重要生理和病理过程密切相关。而细胞的这些行为在很大程度上受到其所处微环境的调控。胞外基质的理化性质、周围细胞的生长情况、各种生化因子的浓度及浓度梯度以及细胞所受应力均会对细胞活动产生影响。因此,微流控芯片上细胞微环境需要包含上述生物化学微环境和生物物理微环境。为了模拟体内生化因子的浓度梯度,研究者们在微流控芯片上从最初简单的T型梯度发生器[11],发展到树状梯度发生器[10],以及后来衍生出的一系列浓度梯度发生器[12]。研究者通过设计不同的通道长度和利用PDMS的微透气性获得了不同含量溶解氧。同时,将两种不同的细胞共培养在一个芯片,通过对细胞代谢物的分析研究不同氧含量在肿瘤发生、发展中的作用。细胞外基质的模拟,主要以两种方式进行:一种是将多种细胞进行共培养,来达到模拟体内基质的目的,如魏慧斌等[13]通过对芯片进行设计,将PC12细胞和GH3 细胞进行共培养,通过利用ESI-Mass对多巴胺刺激下的代谢产物进行监测,考察了细胞与细胞间的信号通路以及药物递送的情况。介明沙等[14]通过设计多层通道,在芯片上进行了3种细胞的共培养,并通过质谱对药物代谢的产物进行分析,模拟了药物在体内的经过肝代谢、肠吸收后作用于脑肿瘤部位(图1A)。另一种方法是利用各种不同的胶如琼脂糖、聚乙二醇、海藻酸钠等材料合成的基质胶来模拟体外基质的软硬度,如吴静等[15]利用琼脂糖,水凝胶模拟细胞体内的基质,将细胞培养在特殊设计的芯片上,很好地实现了细胞的3D培养,构建了体内微血管结构,并实现了量子点对细胞毒性的分析。此外,为了更接近体内的基质,最近研究者常利用各种胶来模拟周边基质的软硬度,同时将多种细胞共培养,以此达到不仅维持自身正常的生理活动,而且增加细胞间的相互作用、细胞与微环境间营养物质交换和相互作用等,从而实现体内微环境的模拟。陈秋水等[16]利用海藻酸钠与钙离子的交联合成对温度、酸度响应的胶,并利用这种合成的胶实现了肝细胞HepG2和纤维细胞NIH-3T3的三维共培养,以模拟小鼠的肝器官(图1B)。Taubenberger等[17]则通过合成聚乙二醇高聚物水凝胶,采用MALDI-TOF对合成胶的性质进行考察,并利用合成的水凝胶实现了乳腺癌细胞(MCF-7)和人前列腺癌细胞(PC-3,LNCaP)的三维共培养,以及肿瘤血管新生、肿瘤浸润等过程的研究。
1.2 微流控芯片-质谱用于细胞的药物代谢分析

图2 微流控芯片-质谱联用用于细胞的分析[18]Fig.2 Microfluidic technology with mass spectrometry for cell analysis[18]
随着分析技术手段的不断进步以及微流控技术的发展,采用微流控芯片对细胞代谢物的分析应用,已由最初的已知或特定的一种或几种目标分子的检测,逐渐发展到对未知物的识别和判断以及后来的定性定量分析。分析手段也不再仅仅依赖紫外可见光、荧光和电化学检测技术,质谱、表面增强拉曼以及核磁共振等检测技术也得到了快速发展。而质谱检测由于能够同时进行多种化合物的定性和定量分析,被广泛地用于细胞代谢物的分析。结合微流控芯片的不断发展,微流控芯片与质谱技术的联用使从分子层面上解析细胞的生化信息转化和调控成为可能。陈秋水等[18]通过在芯片上集成多个功能单元,如培养细胞,药物刺激,并集成了固相萃取小柱对细胞的药物代谢产物进行富集,在线洗脱后用ESI-Q-TOF质谱进行检测,建立了用于药物筛选的良好的芯片-质谱联用平台(图2)。同时,针对质谱检测只能半定量的缺点,该作者还发展了同位素内标法,扩大了芯片上质谱检测的线性范围,提高了线性指数,真正实现了芯片-质谱联用对细胞代谢物的定性、定量检测。
理论上,微流控芯片-质谱技术能够很好地实现高通量分析,但是高通量的质谱进样是目前微流控芯片-质谱发展的一个重要难点。为了在质谱上实现多种样品的自动进样和分析。林金明课题组[19-21]引进了Inkjet喷墨技术,将微流控芯片与Inkjet喷墨装置相结合(图3A),并将芯片通道上的样品引入到喷墨设备的多个通道中,然后通过电脑软件控制喷墨通道的顺序和时间实现多个样品的快速分析。陈凤明等[19]利用此技术结合毛细管电泳分离技术对细胞和基质进行了初步分离,最后通过ESI-TOF质谱技术对细胞的脂质进行分析(图3B)。但该装置需将喷墨设备与芯片通道进行实时连接,容易出现漏液、堵塞等现象。为了改善这种现象,林金明课题组[22]发展了一种间歇式质谱进样装置,即在每个通道上分别组装上一个接触采样口,通过控制采样顺序进行样品的质谱进样和分析,以用于蛋白质间相互作用的研究(图4)。此装置的发展不仅解决了多个通道样品快速以及顺序分析的问题,还可与质谱检测器实现良好衔接,以用于代谢物的分析。此技术通过将质谱的进样接口与芯片的通道集成在一个芯片上,相比于喷墨技术,该技术减少了芯片通道与喷墨装置的连接,从而减少了连接口可能带来的堵塞、漏液等现象。刘武等[23]利用此技术检测了不同细胞的乳酸外排,以及在缺氧条件下连续监测药物α-氰-4-羟基肉桂酸二乙胺盐对不同的细胞种类乳酸外排的抑制,从而考察了药物的效用。因此,在芯片-质谱中引入接触采样口,不仅可以实现自动化,还可以进行细胞代谢物的检测以及细胞药物的筛选。

图3 Inkjet 喷墨进样技术与质谱联用用于细胞在微流控芯片上的分析[19-21]Fig.3 Inkjet technology and mass spectrometry for cell analysis based on microfluidic chip[19-21]
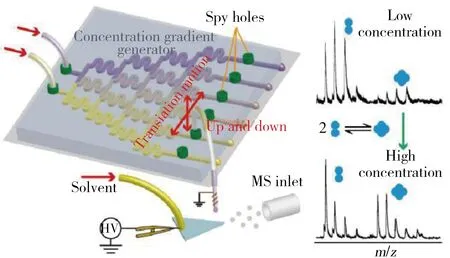
图4 多通道微流控芯片-质谱联用用于蛋白质间相互作用的研究[23]Fig.4 Online multi-channel microfluidic chip-mass spectrometry and its application for quantifying non-covalent protein-protein interaction[23]
1.3 微流控芯片-质谱用于细胞分泌物的分析
对细胞代谢物的分析,可以了解生物系统在生理和病理下的反应机制以及细胞间信息的传递。同时,将细胞代谢物的分析与细胞的形态变化、增殖与迁移的观察相结合,将有助于人们探索生命活动规律,从而为疾病的诊断与治疗提供有力的依据。由于质谱所具有的高通量、高分辨的优秀性能,因此,常将此技术用于各种已知和未知物的检测。将高分辨的质谱与微流控芯片的分离功能相结合用于细胞代谢物中细胞因子等分泌物的分析,不仅有利于肿瘤标志物的查找和建立,也有利于对疾病治疗进程的监控。 Fortier等[24]在芯片上集成模拟纳米液相色谱用于细胞分泌物的分离以及电裂解后,通过质谱对分泌物中的蛋白质进行高分辨检测。最终实现了将所建立的方法用于鼠血浆样品中胰岛素生长因子的分析以及相关标志物的鉴别。Konry等[25]利用液滴微流控芯片技术实现了单细胞分泌物中白介素10(IL-10)的分析,并监测了 CD4+和CD25+调控下单细胞分泌物中白介素10(IL-10)的分泌。但由于与疾病相关的代谢物含量很少,即使采用高灵敏的质谱,也很难能够对低丰度的蛋白质、生长因子等分泌物进行分析。因此,灵敏度问题仍然是细胞水平的代谢物分析的难点。何子怡等[26]为了降低分析的检测限,将质谱技术与寡核苷酸的放大技术联用。此技术主要通过在抗体尾部结合一段寡核苷酸。当抗体与目标物结合后,尾部的寡核苷酸也被固定在目标物上。此时,再利用滚环扩增技术对连接的寡核苷酸进行拷贝。最后,利用MADLI-Mass对拷贝的寡核苷酸进行检测,从而实现了细胞表面糖蛋白的高灵敏分析(图5)。

图5 寡核苷酸和质谱联用用于细胞表面蛋白质的分析[26]Fig.5 Assay of cell surface protein based on oligonucleotide and mass spectrometry technologies[26]
2 微流控芯片-质谱用于细胞分析的挑战
微流控芯片-质谱技术用于细胞和细胞代谢物的分析具有多种显著的优势,也有其独特之处。首先,从微流控芯片方面考虑,在细胞微环境的模拟中,虽然微流控芯片能够进行一些生理环境的模拟,但是由于对于细胞所处的体内真正的生理环境还不够清楚,使得模拟的微环境仍需不断的完善。其次,芯片制作的材料和不同材料的接触面和比表面积[27],微量的细胞培养基以及不同条件下细胞的培养,培养基的更换方式等均将影响细胞的生长及代谢[28-30]。传统的细胞培养装置材料一般是聚苯乙烯材料。而目前芯片制作的主要材料是PDMS。据报道,细胞在PDMS制备的微流控芯片装置上培养时,细胞的黏附力和增殖与传统的培养方法有较大的不同。对于成纤维细胞3T3而言,未处理的PDMS将降低细胞的黏附力,促进细胞死亡[31]。表面积与细胞培养基的体积比值(Surface area-to-volume,SA/V)的改变也将影响细胞的生长[32-34],如传统的96孔板的SA/V大约为0.5 mm2/μL,而微流控芯片的SA/V则高达30 mm2/μL[35]。SA/V的急剧变化将极大地影响细胞的行为和生长。如果再次提高此比例,则将影响到细胞的代谢、凋亡等基本功能。此外,与传统的细胞培养方式相比,微流控芯片上培养的细胞所感受到的氧含量[36-37]、渗透压[38-39]、pH值[40-41]以及营养消耗的速度[42-43]均可能不同。而这些微流控芯片的设计以及大量参数变化(如培养材料的变化、系统的透气性等)可能会导致细胞在微流控芯片装置中的特殊反应[44-45],从而影响到细胞的各种行为。另外,在芯片上进行细胞的流动培养时,流体的剪切力对细胞和细胞代谢物的影响也需要加以关注[46-48]。
在质谱检测方面,细胞产生的小分子代谢产物(<500 Da)有可能吸附在PDMS上,从而导致含量的降低,增加了质谱检测的难度,同时这些吸附的产物还可能会进一步影响到细胞的生长和凋亡、分化等[49-51]。其次,将微流控芯片用于细胞生理环境的模拟,增加了样品的基质,这也将给质谱分析带来新的挑战,对质谱的分辨率和灵敏度提出更高的要求。最后,在芯片-质谱联用中,由于质谱检测范围的限制,常需要对小分子和大分子的代谢物分离后进行检测,而无法一次完成检测。因此,需要发展检测范围更宽、灵敏度更高的质谱检测技术用于细胞和细胞代谢物的分析。
3 总结与展望
由于微流控装置具有设计灵活,易于微型化、自动化等优点,微流控芯片的细胞和代谢物分析已经取得了巨大的进展,为细胞生物学以及细胞生物化学等研究提供了新的思路。而质谱优异的定性功能和多组分分析,使得细胞的分析得到更快速的发展。微流控芯片-质谱联用在细胞研究中的应用仍然吸引着众多研究者的关注。我们相信随着微流控芯片中细胞培养技术的逐渐成熟,用于细胞研究的标准化微流控芯片设计和制备将逐步实现。同时,新的芯片设计将更加简单有效。其次,为了获得更加可靠的细胞研究数据,微流控芯片上进行体内微环境的模拟将得到更加快速的发展,各种不同的信号通路将得到更加深入的研究。而能反映细胞或组织在生理或病理下特定响应的细胞代谢物分析,将获得人们越来越多的关注。因此,虽然将微流控芯片-质谱联用技术用于细胞的研究仍存在一些挑战,但其相对于传统细胞生物学研究的优势,使其仍将继续得到更加深入的开发与研究,并被真正地应用于生物医学、制药研究、药物发现和临床诊断等方面。
[1] Bruggeman F J,Westerhoff H V.TrendsMicrobiol.,2007,15:45-50.
[2] De Preter V.MethodsMol.Boil.(Clifton,N.J.),2015,1277:245-255.
[3] Li H F,Zhang Y,Lin J M.Sci.ChinaChem.(中国科学:化学),2014,44 :777-783.
[4] Wu J,He Z,Chen Q S,Lin J M.Trac-Trend.Anal.Chem.,2016,80:213-231.
[5] Lin X X,Sun X Y,Luo S D,Liu B,Yang C X.Trac-Trend.Anal.Chem.,2016,80:132-148.
[6] Zhang Q,Liu T J,Qin J H.LabChip,2012,12:2837-2842.
[7] Mao S F,Zhang J,Li H F,Lin J M.Anal.Chem.,2012,85:868-876.
[8] Mao S F,Gao D,Liu W,Wei H B,Lin J M.LabChip,2012,12:219-226.
[9] He X W,Chen Q S,Zhang Y D,Lin J M.Trac-TrendAnal.Chem.,2014,53:84-97.
[10] Hung P J,Lee P J,Sabounchi P,Lin R,Lee L P.Biotechnol.Bioeng.,2005,89:1-8.
[11] Kamholz A E,Weigl B H,Finlayson B A,Yager P.Anal.Chem.,1999,71:5340-5347.
[12] Velve-Casquillas G,Le Berre M,Piel M,Tran P T.NanoToday,2010,5:28-47.
[13] Wei H B,Li H F,Mao S F,Lin J M.Anal.Chem.,2011,83:9306-9313.
[14] Jie M S,Li H F,Lin L,Zhang J,Lin J M.RSCAdv.,2016,6:54564-54572.
[15] Wu J,Chen Q S,Liu W,Zhang Y D,Lin J M.LabChip,2012,12:3474-3480.
[16] Chen Q S,Utech S,Chen D,Prodanovic R,Lin J M,Weitz D A.LabChip,2016,16:1346-1349.
[17] Taubenberger A V,Bray L J,Hallera B,Shaposhnykov A,Binner M,Freudenberg U,Guck J,Werner C.ActaBiomater.,2016,36:73-85.
[18] Chen Q S,Wu J,Zhang Y D,Lin J M.Anal.Chem.,2012,84:1695-1701.
[19] Chen F M,Lin L,Zhang J,He Z Y,Uchiyama K,Lin J M.Anal.Chem.,2016,88:4354-4360.
[20] Chen F M,Mao S F,Zeng H L,Xue S H,Yang J M,Nakajima H,Lin J M,Uchiyama K.Anal.Chem.,2013,85:7413-7418.
[21] Chen F M,Lin Z,Zheng Y Z,Zeng H L,Nakajima H,Uchiyama K,Lin J M.Anal.Chim.A,2012,739:77-82.
[22] Liu W,Chen Q S,Lin X X,Lin J M.Analyst,2015,140:1551-1554.
[23] Liu W,Lin J M.ACSSensor,2016,1:344-347.
[24] Fortier M H,Bonneil E,Goodley P,Thibault P.Anal.Chem.,2005,77:1631-1640.
[25] Konry T,Dominguez-Villar M,Baecher-Allan C,Hafler D A,Yarmush M L.Biosens.Bioelectron.,2011,26:2707-2710.
[26] He Z Y,Chen Q S,Chen F M,Zhang J,Li H F,Lin J M.Chem.Sci.,2016,7:5448-5452.
[27] Sackmann E K,Fulton A L,Beebe D J.Nature,2014,507:181-189.
[28] Tseng P,Judy J W,Di Carlo D.Nat.Methods,2012,9:1113-1119.
[29] Ramadan Q,Jafarpoorchekab H,Huang C,Silacci P,Carrara S,Koklü G,Ghaye J,Ramsden J,Ruffert C,Vergeres G,Gijs M A M.LabChip,2013,13:196-203.
[30] Su X J,Theberge A B,January C T,Beebe D J.Anal.Chem.,2013,85:1562-1570.
[31] Lee J N,Jiang X,Ryan D,Whitesides G M.Langmuir,2004,20:11684-11691.
[32] Paguirigan A L,Beebe D J.Integr.Biol.,2009,1:182-195.
[33] Atencia J,Beebe D J.Nature,2005,437:648-655.
[34] El-Ali J,Sorger P K,Jensen K F.Nature,2006,442:403-411.
[35] Halldorsson S,Lucumi E,Gómez-Sjöberg R,Fleming R M.Biosens.Bioelectron.,2015,63:218-231.
[36] Mehta G,Mehta K,Sud D,Song J W,Bersano-Begey T,Futai N,HeoY S,Mycek M A,Linderman J J,Takayama S.Biomed.Microdevices,2007,9:123-134.
[37] Dittrich P S,Manz A.Nat.Rev.DrugDiscov.,2006,5:210-218.
[38] Takano A,Tanaka M,Futai N.Microfluid.Nanofluid.,2012,12:907-915.
[39] Jang K J,Suh K Y.LabChip,2010,10:36-42.
[40] Magnusson E B,Halldorsson S,Fleming R M,Leosson K.Biomed.Opt.Express,2013,4:1749-1758.
[41] Weltin A,Slotwinski K,Kieninger J,Moser I,Jobst G,Wego M,Ehret R,Urbana G A.LabChip,2014,14:138-146.
[42] Mehling M,Tay S.Curr.Opin.Biotechnol.,2014,25:95-102.
[43] Wang B L,Ghaderi A,Zhou H,Agresti J,Weitz D A,Fink G R,Stephanopoulos G.Nat.Biotechnol.,2014,32:473-478.
[44] Shiwa T,Uchida H,Tsukada K.Am.J.Biomed.Eng.,2012,2:175-180.
[45] Funamoto K,Zervantonakis I K,Liu Y,Ochs C J,Kim C,Kamm R D.LabChip,2012,12:4855-4863.
[46] Soe A K,Nahavandi S,Khoshmanesh K.Biosens.Bioelectron.,2012,35:1-13.
[47] Vedel S,Tay S,Johnston D M,Bruus H,Quake S R P.Natl.Acad.Sci.,2013,110:129-134.
[48] Robertson G,Bushell T J,Zagnoni M.Integr.Biol.,2014,6:636-644.
[49] Regehr K J,Domenech M,Koepsel J T,Carver K C C,Ellison-Zelski S J,Murphy W L,Schuler L A,Alarid E T,Beebea D J.LabChip,2009,9:2132-2139.
[50] Lee W C,Lim C H Y,Shi H,Tang L A L,Wang Y,Lim C T,Lim C T,Loh K P.ACSNano,2011,5:7334-7341.
[51] Jabart E,Rangarajan S,Lieu C,Hack J,Conboy I,Sohn L L.Microfluid.Nanofluid.,2015,18:955-966.
Recent Advances of Microfluidic Technology Coupled with Mass Spectrometry in Cell Analysis
LIN Xue-xia1,LIU Bin2,SUN Xiang-ying2,LIN Jin-ming3﹡
(1.College of Chemical Engineering,Huaqiao University,Xiamen 361021,China;2.College of Materials Science and Engineering,Huaqiao University,Xiamen 361021,China;3.Department of Chemistry,Beijing Key Laboratory of Microanalytical Methods and Instrumentation,Tsinghua University,Beijing 100084,China)
Analyses of cell and cell metabolites are important in biological systems.Microfluidic technology is a powerful tool for their studies.In this paper,the recent advances of microfluidic technology,especially its combination with mass spectrometry in cell analysis and cell metabolite's assay,are summarized.Some insights for researchers interested in developing novel,robust microfluidic platforms for cell-biology research,are provided.
microfluidic chip;mass spectrometry;cell analysis;cell metabolite assay
2016-09-21;
2016-10-07
国家自然科学基金资助项目(81373373,21575044,21621003);福建省自然科学基金(2015J01054,2016J01062);华侨大学科学资助项目(15BS407)
10.3969/j.issn.1004-4957.2017.02.005
O657.63
A
1004-4957(2017)02-0184-06
*通讯作者:林金明,教授,研究方向:微流控芯片-质谱联用细胞代谢物分析,Tel:010-62792343,E-mail:jmlin@mail.tsinghua.edu.cn

