瘦素对鸭成肌细胞增殖与分化的影响
甘 伟,赵阳玫,张宁宁,宋 奇,熊祥平,李 亮
(四川农业大学畜禽遗传资源发掘与创新利用四川省重点实验室,四川成都 611130)
瘦素对鸭成肌细胞增殖与分化的影响
甘 伟,赵阳玫,张宁宁,宋 奇,熊祥平,李 亮*
(四川农业大学畜禽遗传资源发掘与创新利用四川省重点实验室,四川成都 611130)
瘦素是一种重要的能量调控因子,存在于人体骨骼肌细胞,而瘦素在鸭肌肉生长和发育过程中的作用还不十分清楚。本实验采用离体培养鸭成肌细胞、CCK-8、荧光定量PCR等技术,探索瘦素调控鸭成肌细胞的增殖和分化机理。结果表明:1 ng/mL瘦素促进鸭成肌细胞生长,而10 ng/mL和100 ng/mL显著抑制成肌细胞生长(P<0.05);瘦素处理24 h后,1 ng/mL 组的Myf5和MyoD的表达量最高,10 ng/mL组的Myf5和100 ng/mL组的MyoD的表达量最低(P<0.05);而MRF4和MyoG在各个浓度处理组的表达量均显著下降(P<0.05);1 ng/mL瘦素处理24 h后,AMPK和PI3K的表达量也显著升高(P<0.05),即AMPK和PI3K参与瘦素调控鸭成肌细胞生长发育过程;分别抑制AMPK和PI3K信号通路后,瘦素诱导Myf5和MyoD表达被减弱(P<0.05),而MRF4和MyoG的表达上升仅在AMPK被抑制组(P<0.05)。以上数据表明,瘦素可通过激活AMPK和PI3K信号通路调控鸭成肌细胞增殖和分化,但是AMPK信号通路作用性应大于PI3K信号通路。
瘦素;鸭成肌细胞;AMPK;PI3K;生肌调节因子家族(MRFs)
瘦素是 Leptin 基因编码的脂源性内分泌激素,人 Leptin 基因位于第7号染色体上,具有3个外显子和2个内含子,编码167个氨基酸,分子量为16 ku[1]。前人研究已表明,瘦素可在脑中大量表达,对机体能量代谢和内环境稳态中起重要调控作用[2]。Shi等[3]发现,瘦素可促进神经干细胞增殖,并具有浓度依赖性。瘦素处理人成骨细胞后,骨桥蛋白和骨唾液酸蛋白(成骨细胞生长发育标志蛋白)表达显著升高[4]。
AMP激活的蛋白激酶(AMPK)和磷脂酰肌醇3激酶(PI3K)信号通路广泛参与细胞增殖、凋亡、分化、氧化应激及新陈代谢过程。瘦素处理血管平滑肌细胞后,p-AMPKα的表达量上升而细胞分化程度降低[5]。Chen等[6]研究表明,白藜芦醇可通过磷酸化AMPK激活线粒体凋亡信号通路和Caspase3基因诱导小鼠3T3L1脂肪细胞系凋亡,随后利用siRAN干扰AMPK表达后,白藜芦醇诱导细胞凋亡的程度被减弱。乌索酸可激活PI3K-Akt信号通路促进U937细胞分化,而添加LY294002(PI3K抑制剂)后,细胞分化程度明显降低[7]。近年来,AMPK和PI3K在瘦素调控过程中的机理已受到广泛关注。利用LY294002抑制PI3K活性后,瘦素促进鹅颗粒细胞增殖的作用被减弱[8]。然而,AMPK和PI3K在瘦素调控鸭肌细胞发育过程中的机理还不够明确。因此,本研究旨在探索瘦素与AMPK和PI3K信号通路在鸭成肌细胞生长发育过程的调控机理。
1 材料与方法
1.1 实验材料 本实验所用鸭胚由四川农业大学家禽育种场提供。所有胚蛋在相同的环境条件(温度,湿度)下进行,选用13胚龄雏鸭腿肌用于成肌细胞的培养。所有实验程序获得四川农业大学实验动物操作规范与福利管理委员会同意。
1.2 试剂 氯仿、异丙醇、无水乙醇、氢氧化钠、氯化钠、乙二胺四乙酸(EDTA)等为国产分析纯,由瑞进特试剂耗材公司提供;DEPC、琼脂糖、DNA Marker DL2000等购买于大连宝生物(TaKaRa)公司;RNA抽提试剂Trizol(Invitrogen)购于成都奥克生物;胎牛血清、DMEM/F12培养基、氨苄青霉素贮存液、5 mL移液枪头、200目过滤器、400目过滤器、Ι型胶原酶、Dorsomorphin 2HCl(AMPK抑制剂)、2×Taq PCR Master Mix、PBS粉末和DH5α感受态细胞等购于成都温江索莱宝科技有限公司;SYBR Rremix Ex×TaqTM(TaKaRa)购于成都天泰生物技术有限公司;胰蛋白酶、AICAR(AMPK激活剂)购于碧云天生物技术研究所。
1.3 细胞培养和RT-qPCR 选用孵化期13胚龄雏鸭腿肌,采用混合酶法分离成肌细胞,具体步骤参照Liu等[9]。定量引物序列见表1。荧光定量反应总体积为25 μL:模板 cDNA 8.5 μL,上、下游引物各2 μL,SYBR®Rremix Ex TaqTM12.5 μL。反应条件为95℃ 10 s;95℃ 5 s;退火温度参见表1,退火30 s;39个循环。每个试验重复3次,并以不加模板cDNA为阴性对照。
1.4 总RNA提取 取鸭腿肌肌肉组织样,置于液氮中冷冻并进行研磨。取100 mg研磨好的样品用Trizol法提取鸭腿肌的总RNA。采用Prime Scrip RT reagent Kit的mRNA反转录试剂盒,将提取的总RNA反转录成单链cDNA,-20℃保存。
1.5 细胞活性检测 细胞活性检测参照Wang等[10]。首先,在96孔板中加入100 mL的细胞悬液后置于培养箱(37℃,5%CO2)预培养24 h。然后,向培养孔中分别加入瘦素(ProSpecTany TechnoGene Ltd., Rehovot, Israel),使其最终浓度分别为1、10、100 ng/mL,置于培养箱孵育。待培养时间到后向每孔加入10 mL CCK-8溶液,再将培养板放入培养箱内孵育1.5 h。最后,用酶标仪(Bio-Rad Model 680, Richmond, CA, USA)测定在450 nm处的吸光度。
1.6 统计分析 根据目的基因的Ct值,采用2-ΔΔCt方法计算,并以内参基因GADPH和β-actin进行标准化校正。使用SAS 9.2软件UNIVARIATE NORMAL程序验证是否符合正态分布,GLM程序进行正态显著性比较,结果均以平均值±标准误形式表示,* 或不同小写字母表示在P<0.05时差异显著。
2 结 果
2.1 鸭成肌细胞的离体培养及RNA的提取 离体培养的鸭成肌细胞如图1所示。刚刚分离纯化的成肌细胞为圆形(A),之后成肌细胞开始贴壁,大多数为圆形,少部分伸展为椭圆形,12 h后(B)大部分细胞完全贴壁,大多数伸展为梭形,部分为圆形,而后逐渐都变为梭形细胞。
收集不同时期的细胞样,按照Trizol 法提取总RNA,并进行琼脂糖凝胶电泳检测。由图2可看出。28 S和18 S条带较清晰,而 5 S条带几乎没有,因此,所提取的总RNA结构完整,可用于下一步荧光定量检测。

表1 定量PCR引物

图1 离体培养的鸭成肌细胞
图2 鸭成肌细胞总 RNA 电泳
2.2 瘦素对鸭成肌细胞增殖和分化的影响 为了检测瘦素在鸭成肌细胞增殖中的作用,本实验利用不同浓度的外源性瘦素(1、10、100 ng/mL)处理细胞24 h。CCK-8检测结果显示,1 ng/mL组显著高于对照组(P<0.05),表明其促进成肌细胞的增殖;而10、100 ng/mL组显著低于对照组(P<0.05),说明其抑制成肌细胞增殖(图3)。RT-qPCR检测瘦素调节鸭成肌细胞增殖与分化关键基因(图4)。1 ng/mL组MyoD和Myf5表达量显著高于对照组(P<0.05),而10、100 ng/mL组显著抑制MyoD和Myf5的表达。瘦素所有浓度处理组MoyG和MRF4 mRNA表达量均显著低于对照组(P<0.05),且1 ng/mL组显著高于10、100 ng/mL组(P<0.05),10 ng/mL与100 ng/mL组间均没有显著差异。因此,瘦素可促进鸭成肌细胞增殖而抑制分化,且具有浓度依赖性,且将1 ng/mL作为后续实验的处理浓度。
2.3 瘦素激活AMPK和PI3K信号通路 由图5可知,1 ng/mL瘦素处理鸭成肌细胞24 h后,AMPK和PI3K的表达量显著上升(P<0.05),即AMPK和PI3K参与瘦素调控鸭成肌细胞发育过程。
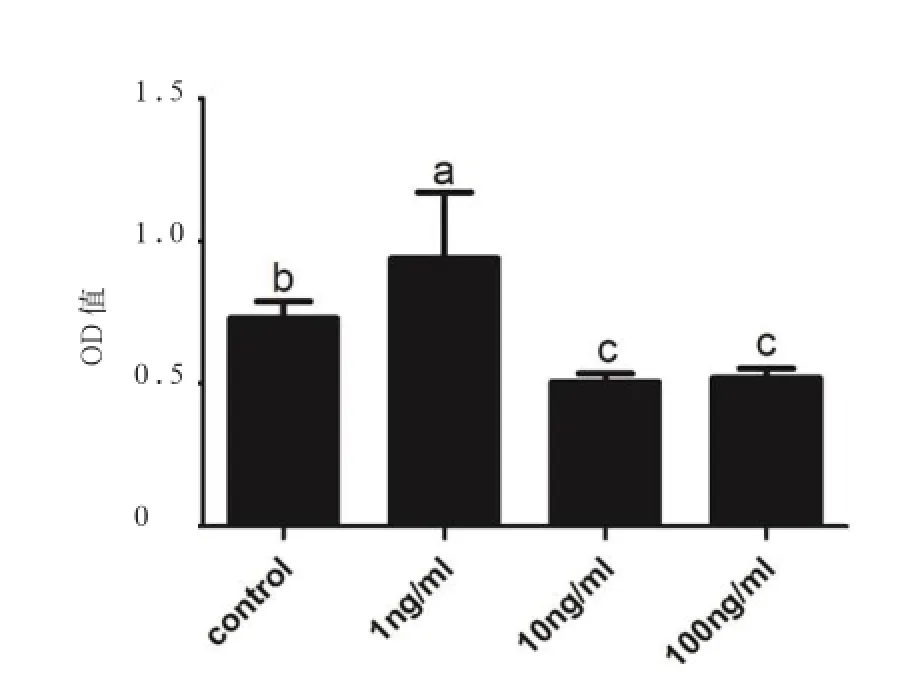
图3 不同浓度瘦素处理24 h鸭成肌细胞活性

图4 不同浓度瘦素对鸭成肌细胞增殖与分化关键基因表达的影响
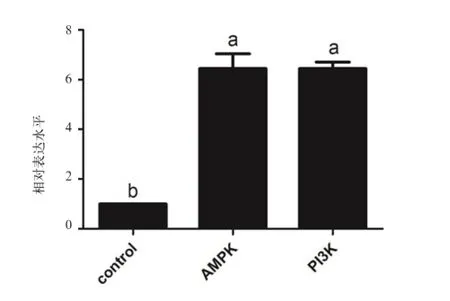
图5 瘦素激活AMPK和PI3K信号通路
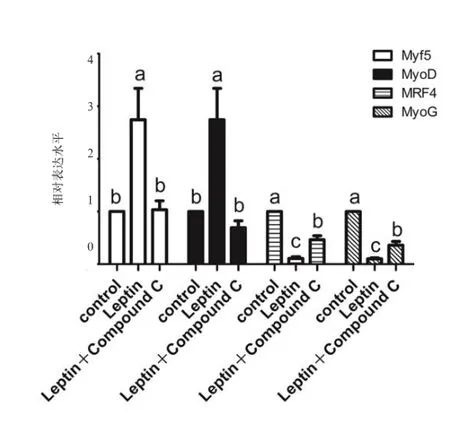
图6 Compound C对瘦素调控Myf5、MyoD、MyoG和MRF4表达的影响
2.4 抑制AMPK信号通路后瘦素对鸭成肌细胞增殖与分化的影响 利用AMPK信号通路的特异性抑制剂Compound C(10 μmol/L)与Leptin(1ng/mL)共同处理生长中的鸭成肌细胞,处理时间为24 h(图6)。荧光定量检测结果显示,阻断AMPK后,MyoD和Myf5的表达量均发生下降,且显著低于Leptin处理组(P<0.05)。相反,MyoG和MRF4表达量显著上升且高于Leptin处理组(P<0.05)。
2.5 抑制PI3K信号通路后瘦素对鸭成肌细胞增殖与分化的影响 如图7所示,利用LY294002(20 μmol/L)和瘦素共同处理鸭成肌细胞后,Myf5 和MyoD的表达量显著降低(P<0.05)。与AMPK抑制后不同,MyoG和MRF4表达在瘦素组和瘦素与LY294002共处理组间无明显差异。

图7 LY294002对瘦素调控Myf5、MyoD、MyoG和MRF4表达的影响
3 讨 论
成肌细胞作为骨骼肌肌纤维的前体细胞,首先经过大量的增殖后,逐渐融合并形成肌管,最终分化形成肌纤维。成肌细胞的增殖与分化是胚胎期骨骼肌发育的源动力。医学研究中,成肌细胞被作为基因治疗的理想型细胞,特别是在骨骼肌萎缩治疗方面已有较多的临床研究。鉴于成肌细胞形成肌管的过程可制约着整个肌肉的发育过程,因此被广泛用于肌肉发育的基础研究。于太永等[11]在猪骨骼肌成肌细胞中添加瘦素后,MyoD的表达量显著升高,促进细胞的增殖,且随着瘦素的浓度增高促进效果更佳明显,细胞增殖速度加快。本实验利用外源瘦素处理成肌细胞,在此基础上检测细胞的增殖情况,CCK结果显示1 ng/mL组的活细胞数量最多且显著高于对照组,说明1 ng/mL 瘦素对成肌细胞具有促进增殖的作用。10 ng/mL和100 ng/mL组的活细胞显著低于对照组和1 ng/mL组,这说明随着处理浓度的增加瘦素对成肌细胞的增殖作用受到了抑制,这可能是因为瘦素过高的浓度影响。而在瘦素对猪成肌细胞研究中发现,分别用10、20、40 ng/mL的瘦素处理后,细胞的数量呈线性增长[11]。与本实验结果有所相同,猜测可能是由于实验动物种类的差异造成的。为了更进一步分析瘦素对鸭成肌细胞增殖的影响,本实验分别检测了不同浓度瘦素处理对MyoD、Myf5的表达情况。结果同样显示,1 ng/mL瘦素处理对MyoD、Myf5表达量有显著促进作用,与CCK检测相似,10 ng/mL和100 ng/mL组反而抑制其表达。因此,低浓度瘦素(1 ng/mL )对促进鸭成肌细胞增殖,而高浓度瘦素(10、100 ng/mL)起抑制作用。
鸟类的肌纤维总数在出雏前就已经确定,出生后肌肉的生长是蛋白质合成的增加,卫星细胞与肌纤维融合,导致肌纤维增大或肥大。因此,胚胎时期的肌肉发育将直接影响出生后产肉性能,且具体研究分化过程中的关键环节、了解肌肉的生长发育的机制对家畜产肉性能的提升是必不可少的。其中MoyG与MRF4主要在成肌细胞分化融合过程中发挥作用。研究表明,MyoG在对成肌细胞融会成肌管这一过程中有着不可替代的作用,而且MyoG在所有骨骼肌细胞中都可以表达,这在MRFs家族中是唯一的,因此它在肌肉发育过程中具有重要的地位。缺失MyoG基因的小鼠虽然仍有正常数量的成肌细胞,却因为严重缺乏肌纤维在出生时死亡[12]。MRF4在人类体内主要功能是参与肌管的形成和终端分化,维持生肌细胞功能的作用,如果MRF4的基因序列发生突变或缺失,导致MRF4蛋白结构发生改变,就可能会引起肌肉组织病变,出现肌肉功能障碍[13]。所以,研究骨骼肌细胞时,MoyG与MRF4被定义为成肌细胞分化的关键基因。本实验使用胚牛血清分化诱导鸭成肌细胞,利用瘦素处理,检测分化标志性基因MoyG、MRF4的表达情况,结果显示1、10、100 ng/mL浓度的瘦素对MoyG、MRF4均有显著影响,表达量显著低于对照组。说明瘦素在鸭成肌细胞分化中具有抑制作用。
AMPK作为生物体内的细胞能量调节器,与细胞的生长发育、分泌代谢及抗应激等生理过程紧密关联。应激条件下,如缺氧、缺血、缺糖、运动、热应激等均可导致AMP/ATP比例显著性升高或ATP的量减少,进而激活细胞AMPK。瘦素能够直接作用于肌肉组织,活化AMPKα2,增加肌细胞PPARα表达,调节骨骼肌脂肪酸氧化[14]。本实验通过抑制AMPK,并利用瘦素处理,探究瘦素是否通过AMPK调节成肌细胞的增殖与分化。结果显示,当抑制AMPK时瘦素对MyoD和Myf5的促进作用显著降低,表达量显著低于瘦素组;而MoyG和MRF4的表达显著升高且高于瘦素组,这表明瘦素调控鸭成肌细胞增殖与分化可通过AMPK实现,且瘦素诱导的鸭成肌细胞变化可被AMPK抑制剂所抑制。
PI3K信号通路在细胞的信号转导过程中发挥着重要的作用,广泛参与细胞增殖、凋亡、分化、新陈代谢等生理过程。PI3K作为一种细胞生长的重要诱导因子,瘦素处理大鼠血管平滑肌细胞后,PI3K-Akt信号通路被激活,细胞增殖速度明显加快[15]。添加LY294002后,PI3K-Akt信号通路被抑制,瘦素诱导的细胞生长被减弱[15]。Maroni等[16]用瘦素处理鼠骨骼肌细胞10 min后,PI3K的活性开始显著增强,细胞生长速度也明显加快。本研究发现,当PI3K信号通路受到抑制时瘦素促进Myf5和MyoD表达量上升的趋势被减弱;瘦素处理分化期成肌细胞,当PI3K信号通路受到抑制时MoyG、 MRF4的表达量无显著变化,所以PI3K信号通路不参与瘦素调控鸭成肌细胞分化过程。
4 结 论
综上可以得出,低浓度瘦素(1 ng/mL)对鸭成肌细胞具有促进增殖的作用,而高浓度瘦素(10、100 ng/mL)无此作用特征。结果表明各浓度瘦素均抑制鸭成肌细胞的分化。另外,本实验结果还表明,AMPK和PI3K信号通路参与瘦素诱导的鸭成肌细胞增殖过程,而在分化过程仅AMPK作用明显。
[1] Isse N, Ogawa Y, Tamura N, et al. Structural organization and chromosomal assignment of the human obese gene[J]. J Biol Chem,1995, 270(46): 27728-27733.
[2] Münzberg H, Morrison C D. Structure, production and signaling of leptin[J]. Metabolism, 2015, 64(1): 13-23.
[3] Shi W Z, Miao Y L, Guo W Z, et al. Leptin reverses corticosterone-induced inhibition of neural stem cell proliferation through activating the NR2B subunits of NMDA receptors[J]. Biochem Bioph Res Co, 2014, 447(1): 95-100.
[4] Zeadin M G, Butcher M K, Shaughnessy S G, et al. Leptin promotes osteoblast differentiation and mineralization of primary cultures of vascular smooth muscle cells by inhibiting glycogen synthase kinase (GSK)-3β[J]. Biochem Bioph Res Co, 2012, 425(4): 924-930.
[5] Zhan J K, Wang Y J, Wang Y, et al. Adiponectin attenuates the osteoblastic di ff erentiation of vascular smooth muscle cells through the AMPK/mTOR pathway[J]. Exp Cell Res, 2014, 323(2): 352-358.
[6] Chen S F, Zhou N M, Zhang Z L, et al. Resveratrol induces cell apoptosis in adipocytes via AMPK activation[J]. Biochem Bioph Res Co, 2015, 457(4): 608-613.
[7] Deng L, Zhang R, Tang F, et al. Ursolic acid induces U937 cells differentiation by PI3K/Akt pathway activation [J]. CJNM, 2014, 12(1): 0015-0019.
[8] Wen R, Hu S Q, Xiao Q H, et al.Leptin exerts proliferative and anti-apoptotic e ff ects on goose granulosa cells through the PI3K/Akt/mTOR signaling pathway[J]. J Steroid Biochem Mol Biol, 2015, 149: 70-79.
[9] Liu H H, Li L, Chen X, et al.Characterization of in vitro cultured myoblasts isolated from duck (Anas platyrhynchos) embryo[J]. Cytotechnology, 2011, 63(4): 399-406.
[10] Wang J X, Zhang Y Y, Yu X M, et al. Role of centromere protein H and Ki67 in relapse-free survival of patientsprimary surgery for hypopharyngeal cancer[J]. Asian Pac J Cancer Prev, 2012, 13(3): 821-825.
[11] 于太永. 脂肪细胞因子leptin和TNF-a对猪骨骼肌成肌细胞增殖分化的影响及其机制 [D]. 杨凌:西北农林科技大学, 2007.
[12] Hasty P, Bradley A, Morris J H, et al. Muscle deficiency and neonatal death in mice with a targeted mutation in the myogenin gene[J]. Nature, 1993, 364(6437): 501-506.
[13] Zhu Z, Miller J B. MRF4 can substitute for myogenin during early stages of Myogenesis. Developmental dynamics [J]. Dev Dyn, 1997, 209(2): 233-241.
[14] Dagon Y, Hur E, Zheng B, et al. p70S6 kinase phosphorylates AMPK on serine 491 to mediate leptin's effect on food intake[J]. Cell Metabolism, 2012, 16(1): 104-112.
[15] Zeidan A, Paylor B, Steinho ff K F, et al. Actin cytoskeleton dynamics promotes leptin-induced vascular smooth muscle hypertrophy via RhoA/ROCK- and Phosphatidylinositol 3-Kinase/Protein Kinase B-Dependent pathways[J]. J Pharmacol Exp Ther, 2007, 322(3): 1110-1116.
[16] Maroni P, Bendinelli P, Piccoletti R. Early intracellular events induced by invivo leptin treatment in mouse skeletal muscle[J]. Mol Cell Endocrinol, 2003, 201(1-2): 109-121.
E ff ect of Leptin on Proliferation and Di ff erentiation of Duck Myoblasts
GAN Wei, ZHAO Yang-ping, ZHANG Ning-ning, SONG Qi, XIONG Xiang-ping, LI Liang*
(Farm Animal Genetic Resources Exploration and Innovation Key Laboratory of Sichuan Province, Sichuan Agricultural University, Sichuan Chengdu 611130, China)
Leptin, a major regulator of energy, was present in human skeletal muscle. But the role of leptin in muscle growth and development is not well understood in duck. In this experiment, the regulation mechanism of leptin on the duck myoblasts proliferation and di ff erentiation were investigated using in vitro cultured myoblasts, CCK-8, fl uorescence quantitative PCR technology. Our results showed that 1 ng/mL leptin could promote the cell growth but 10 ng/mL and 100 ng/mL inhibit(P<0.05). The expression of Myf5, MyoD signi fi cantly increased at 1 ng/mL for 24 h, decreased at 10ng/ mL (Myf5) and 100ng/mL (MyoD) (P<0.05). However, leptin outstandingly reduced the expression of MRF4 and MyoG in all treatment concentrations(P<0.05). Here, we also found the increase of AMPK and PI3K expression at 1ng/mL for 24 h(P<0.05). In addition, suppressing the AMPK and PI3K attenuated the expression of Myf5 and MyoD by leptin induced(P<0.05). However, the expression increased of MRF4 and MyoG were found only after inhibited the AMPK in leptin+Compound C group compared the leptin group(P<0.05). Summing up, these data implied that leptin regulate duck myoblasts proliferation and di ff erentiation through activating the AMPK and PI3K, however, the AMPK may enjoy more important role than PI3K signal pathway.
Leptin; Duck myoblasts; AMPK; PI3K; Myogenic rEgulatory factors (MRFs)
S834.4
:A
:10.19556/j.0258-7033.2017-02-050
2016-08-19;
2016-09-21
四川省畜禽雨中攻关项目(20161NYZ0044)
甘伟(1991-),男,河南信阳人,硕士,主要从事动物遗传育种与繁殖研究,E-mail:571937541@qq.com
⋆ 通讯作者:李亮,E-mail:liliang@sicau.edu.cn

