中药化学成分对UGT1A1表达调控及活性作用研究进展
辛红+徐巍
[摘要]尿苷二磷酸葡萄糖醛酸转移酶1A1(UGT1A1)是一种重要的Ⅱ相代谢酶,不仅介导了大量临床药物、非药外源物的代谢清除,同时还在维系机体内源性物质代谢平衡中发挥着至关重要的作用。UGT1A1表达/功能的改变不仅会引起药物/中药-药物相互作用,还可导致内源性物质的代谢紊乱,引发高胆红素血症、胆红素脑病及肝损伤等毒副作用。目前已发现多种临床药物及中药成分等外源物可调控UGT1A1的活性。该文结合国内外在药物代谢及毒理学相关领域新近研究进展,综述了不同类型中药化学成分(如黄酮类、香豆素类、生物碱类等)对UGT1A1表达调控及活性作用,包括中药化学成分对UGT1A1酶活性的抑制作用和中药化学成分对UGT1A1酶的诱导作用。该文能够为UGT1A1介导的中药-药物相互作用提供深入的理解和一定的参考,有助于未来指导临床上中药制剂的合理使用。
[关键词]尿苷二磷酸葡萄糖醛酸转移酶1A1(UGT1A1); 中药成分; 抑制; 诱导
[Abstract]Uridine 5′-diphosphate-glucuronosyltransferase1A1(UGT1A1) is a major phase Ⅱ metabolism enzyme, responsible for glucuronidation and elimination of drugs and endogenous compounds, playing a vital role in sustaining endogenous metabolism balance. Therefore, changes in UGT1A1 expression/functional can not only cause adverse clinical drug/herbs-drug interactions, but also lead to metabolic disorder of endogenous substances, causing high blood bilirubin, bilirubin encephalopathy and liver injury, as well as other side effects. To date, many studies have found that a variety of clinical medicines and medicinal ingredients can regulate UGT1A1 activity. This article would summarize the advances in research on drug metabolism and toxicology in domestic and foreign literature, and investigate the regulatory effects of different types of traditional Chinese medicine(TCM) ingredients(such as flavonoids, coumarins, alkaloids) on UGT1A1 expression and activity, including inhibitory effect of TCM chemical ingredients on UGT1A1 and effect of TCM chemical ingredients on UGT1A1. It is hoped that this review could provide depth understanding and certain reference for the interaction between chemical ingredients of TCM and UGT1A1, which is of great significance to guide the rational clinical use in future.
[Key words]UGT1A1; chemical ingredients of traditional Chinese medicine; inhibition; induction
尿苷二磷酸葡萄糖醛酸轉移酶(UDP-glucuronosyltransferases,UGTs)可将许多内源性物质及外源性致癌物、药物、微量元素等转化成葡萄糖醛酸化代谢产物,随胆汁和尿液排出体外[1]。基于氨基酸序列的同源性和基因结构的相似性,人体UGTs通常分为4个家族,UGT1,UGT2,UGT3,UGT8,其中UGT1,UGT2 2个家族是最重要的参与结合反应的药物代谢酶[2]。众多UGTs亚型中,UGT1A1在代谢防御体系和内源性物质稳态中都扮演着非常重要的角色,代谢许多临床“高频”药物(如对乙酰氨基酚,丁丙诺啡,恩他卡朋,依托泊甙,伊力替康等)、“高频”非药外源物(如中草药成分、食品化学成分、致癌物质、环境毒物等)及机体“高危”内源性物质(如胆红素,雌二醇,甾体激素,炎症介质及胆汁酸等)。因此UGT1A1表达、活性及功能的改变不仅能够导致UGT1A1代谢的临床药物在人体内的血浆药物浓度降低或升高进而导致药效的缺失/减少或毒性作用的产生引起临床上不良的药物/中药-药物相互作用,还能够导致内源性物质的代谢紊乱,引发高胆红素血症、胆红素脑病及肝损伤等毒副作用[3-6]。目前已发现多种临床用药(如利喘平、茚地那韦、索拉菲尼等)及中药成分(如补骨脂中主要活性成分、黄酮类及人参皂苷类等)等外源物可抑制或诱导UGT1A1进而调控其活性。美国食品药物管理局(FDA)在药物-药物相互作用研究指南中明确指出,在研究药物-药物之间相互作用时必须明确药物与UGT1A1之间的作用关系。
在我国,中药的应用有几千年历史,临床上常与多种中药配伍使用或与西药联合应用治疗疾病。而中药的使用在西方国家也变得非常普遍,如在美国约18.4%的病人在使用处方药的同时服用中药[7]。鉴于中药成分复杂,中药-药物之间发生相互作用存在许多可能的机制,其中之一就是通过药物代谢酶活性的调节介导的。在过去的几十年里,人们对于中药-药物之间相互作用的研究主要集中在中药化学成分对细胞色素氧化酶P450(CYP)的影响,而关于中药化学成分对UGTs酶影响的研究相对较少。近年来,随着人们对药物代谢酶研究的不断深入,中药化学成分与UGTs酶相互作用关系的研究逐渐成为研究熱点。鉴于UTG1A1介导的代谢具有较高的临床意义,本文将中药成分对UGT1A1的表达及活性影响做一综述,对于避免临床上发生中药-药物之间相互作用起到重要作用。
1 中药化学成分对UGT1A1活性的抑制作用
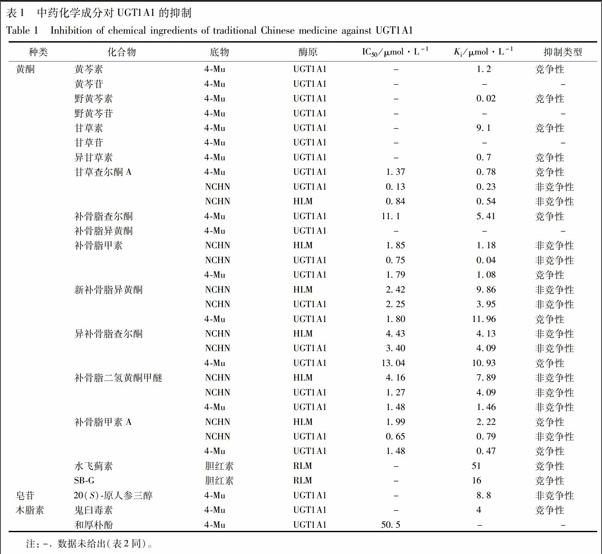
目前临床上中药/药物-药物相互作用引发的不良反应主要是通过抑制CYP酶活性,从而影响药物在体内的生物利用度以及对人产生不良影响。目前有关西药通过抑制UGT1A1的活性而产生不良影响也有相关报道,如临床用于治疗艾滋病的常用药茚地那韦可以通过抑制UGT1A1酶的活性,影响胆红素的代谢,从而引起高胆红素血症[8]。有关中药化学成分通过抑制UGT1A1引起高胆红素血症则鲜有报道,因此总结出影响UGT1A1酶活性的中药成分,以期为临床用药起到指导作用(表1)。
1.1 黄酮类化合物 黄酮类化合物广泛存在于水果、蔬菜、药用植物中,且含量丰富,具有抗氧化、抗炎、抗病毒、抗肿瘤等多种药理作用[9]。Teng等[10]以4-Mu为底物考察黄芩素和黄芩苷对UGT的抑制情况,结果表明黄芩素对UGT的抑制作用明显强于黄芩苷,且竞争性抑制UGT1A1,Ki=1.2 μmol·L-1。表明黄芩苷的去糖基化过程对其提高抑制UGTs的能力起到重要作用。还有研究发现野黄芩素对UGT的抑制作用明显强于野黄芩苷,且竞争性抑制UGT1A1,Ki=0.02 μmol·L-1[11]。这种现象还存在于甘草苷和甘草素中,甘草苷去糖基化后生成的甘草素对UGT1A1的抑制作用明显增强,且Ki=9.1 μmol·L-1[12]。Wang等[13]分别以NCHN和4-Mu为探针底物,考察从中药补骨脂中提取的5种化合物对UGT1A1的抑制作用。结果发现,补骨脂甲素、新补骨脂异黄酮、异补骨脂查尔酮、补骨脂二氢黄酮甲醚、补骨脂甲素A均可非竞争性抑制HLM,UGT1A1催化NCHN葡萄糖醛酸化的活性,在HLM中5种化合物的抑制常数Ki分别为1.18,9.86
,4.13,7.89,1.46 μmol·L-1;在UGT1A1中Ki分别为0.04,3.95,4.09,4.09,0.79 μmol·L-1。当以4-Mu为底物时,5种化合物对UGT1A1的抑制类型呈竞争性抑制,Ki分别为1.08,11.96,10.93,2.22,0.47 μmol·L-1。前期试验研究发现甘草查尔酮A对12种UGT单酶均有较强的抑制作用,对UGT1A1的抑制作用呈底物依赖性。以4-Mu为底物,甘草查尔酮A对UGT1A1表现出竞争性抑制,Ki=0.78 μmol·L-1。当以NCHN为底物,其对UGT1A1以及HLM均呈非竞争性抑制,Ki分别为0.23,0.54 μmol·L-1[14]。NCHN是一类4-羟基-1,8-萘酰亚胺衍生物,具有1个羧基基团不含有苯酚基团,而4-Mu是具有香豆素类骨架的简单酚类化合物。由于这2个底物化学结构上的不同,导致其与UGT1A1的结合位点也不相同,这可能是导致这些化合物对2个探针底物的葡萄糖醛酸化过程表现出不同抑制类型的原因。还有研究发现甘草中另一类黄酮类化合物异甘草素可竞争抑制UGT1A1催化的4-Mu葡萄糖醛酸化过程,Ki=0.7 μmol·L-1[15]。此外,通过比较补骨脂查尔酮和补骨脂宁对6种人重组UGT单酶的抑制作用,结果发现补骨脂查尔酮对多种UGT的抑制作用均明显强于补骨脂宁,其中对UGT1A1和UGT1A7的抑制作用最为明显,Ki为5.41,4.51 μmol·L-1。这种抑制作用可能与化合物苯环上的羟基数目有关,羟基数目越多对UGTs的抑制作用越明显[16]。水飞蓟素是临床常用的抗肝炎药物,其主要成分水飞蓟宾以及水飞蓟宾的葡萄糖醛酸化产物(SB-G)对UGT1A1呈中等强度的抑制作用,Ki分别为51,16 mg·L-1。由于葡萄糖醛酸化产物主要是在内质网内产生,因此SB-G更容易与底物竞争UGT1A1的结合位点,这可能是导致SB-G抑制作用强于水飞蓟宾的主要原因[17]。
1.2 三萜类化合物 人参皂苷为人参的主要活性成分,根据苷元的不同主要分为2类:20S-原人参二醇(20S-protopanaxadiol,PPD)和20S-原人参三醇(20S-protopanaxatriol,PPT)[18],研究发现20S-原人参三醇对UGT1A1呈中等强度的抑制作用,Ki为8.8 μmol·L-1[19]。提示由于人参皂苷对UGT1A1有抑制作用,与UGT1A1底物/抑制剂合用时,很可能因为抑制UGT1A1活性影响药物疗效以及发生不良反应。
1.3 木脂素类化合物 鬼臼毒素(podophyllotoxin)是一种天然活性的木脂素类化合物,主要存在于小檗科桃儿七属、山荷叶属及足叶草属植物中,近年来许多研究表明鬼臼毒素及其衍生物具有很强的抗肿瘤及抗病毒活性[20]。研究发现,鬼臼毒素对UGT1A1有明显的抑制作用,Ki=4 μmol·L-1[21]。Jeong等[22]以雌二醇为探针底物考察和厚朴酚对UGT1A1的抑制作用,结果发现该化合物对UGT1A1的抑制作用较弱(IC50=50.5 μmol·L-1)。提示臨床上使用含有鬼臼毒素的药物制剂时应该引起注意,避免发生中药-药物的不良反应,鉴于和厚朴酚对UGT1A1的抑制作用较弱,与UGT1A1代谢的药物合用时不会因为抑制该酶而影响药物疗效。
2 中药化学成分对UGT1A1活性的诱导作用
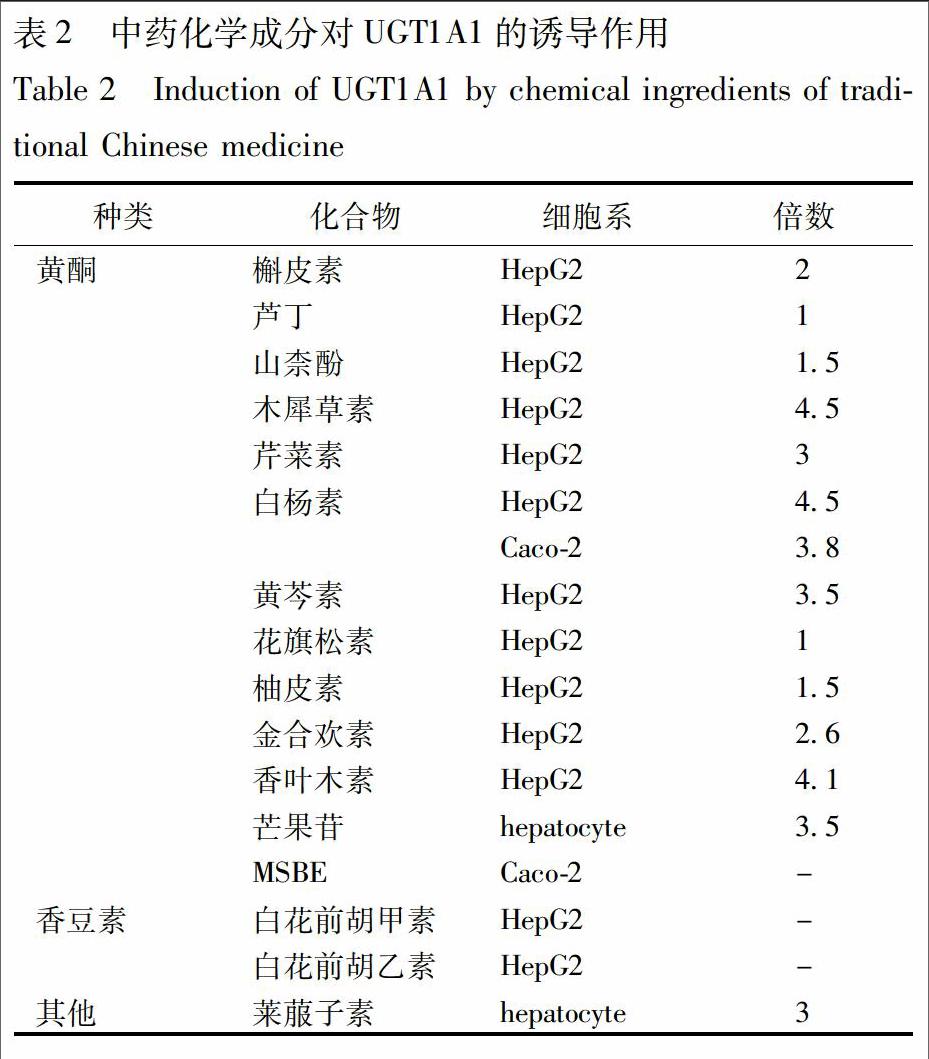
研究发现肠道中UGT1A1表达的缺失与结肠癌的发生有直接关系,而UGT1A1表达升高可以使结肠致癌物2-氨基-N-甲基-5-苯基咪唑[4,5-b]吡啶(N-hydroxy-2-amino-1-methyl-6-phenylimidazo-[4,5b])的清除速率加快[23],从而降低致癌物的致癌作用,保护正常组织。因此,明确中药成分对UGT1A1诱导作用,对临床合理用药及疾病预防和治疗起到重要作用。UGT1A1的诱导剂,有望在临床上用于治疗UGT1A1缺陷导致的非结合型高胆红素血症、新生儿黄疸或者用于预防致癌物质及抗癌药物的毒性(表2)。
2.1 黄酮类成分 Sugatani等[24]考察了几种黄酮类化合物在HepG2细胞中对UGT1A1活性的影响,结果表明在同等浓度(25 μmol·L-1)下,槲皮素、芦丁、山柰酚、木犀草素、芹菜素、白杨素、黄芩素、花旗松素、柚皮素均可通过激活UGT1A1 290bp 启动子转录使UGT1A1活性提高1~4.5倍。Galigatovic等[25]研究发现白杨素及槲皮素还可以诱导Caco-2细胞中UGT1A1 mRNA及蛋白水平的表达,并可使白杨素的葡萄糖醛酸化水平分别提高达3.8,2倍。这一结果表明白杨素及槲皮素能够诱导肠道中UGT1A1表达,并对许多致癌物、药物等的生物利用度产生重要影响。此外,Walle等[26]以白杨素为底物考察了22种黄酮类化合物在Hep G2细胞中对UGT1A1的影响,结果表明仅金合欢素、芹菜素、白杨素、香叶木素对白杨素的葡萄糖醛酸化有诱导作用,可诱导2.6~4.1倍,并认为诱导作用与B环上5,7-二羟黄酮的取代基不同有关。芒果苷(mangiferin)又称知母宁,是一种多酚类化合物,是芒果(Mangifera indica L.)树皮的主要化学成分,具有抗炎,抗病毒,抗肿瘤等多种活性[27]。Rodeiro等[28]研究表明,在同等质量浓度(250 mg·L-1)条件下,芒果树皮提取物(MSBE)和芒果苷均可明显诱导人肝细胞中UGT1A1 mRNA水平的表达,并可使其活性提高3~3.5倍。
2.2 香豆素类成分 中药前胡具有疏散风热、降气化痰等功效,其主要活性成分白花前胡甲素(praeruptorin A)以及白花前胡丙素(praeruptorin C),属于香豆素类化合物。周许年等[29]利用RT-PCR及Western blot方法考察白花前胡甲素及白花前胡丙素对HepG2细胞中UGT1A1表达的影响,结果表明白花前胡甲素及白花前胡丙素均可以上调HepG2细胞中UGT1A1的mRNA和蛋白水平表达。而在组成型雄烷受体(CAR)低表达的HepG2细胞中,白花前胡甲素、白花前胡丙素诱导UGT1A1蛋白和mRNA的表达作用明显减弱,并认为白花前胡甲素、白花前胡丙素是通过CAR通路诱导UGT1A1的表达。
2.3 其他类 莱菔子素(sulforaphane)是目前在蔬菜中发现的抗癌活性最强的植物成分,主要存在于十字花科植物萝卜的干燥成熟种子中,大量试验表明莱菔子素具有抗肿瘤活性[30]。王敏等[31]用RT-PCR以及Western blot技术考察莱菔子素对结肠癌Caco-2细胞中UGT1A1的表达作用,结果表明莱菔子素可以诱导Caco-2细胞中UGT1A1 mRNA及蛋白的表达,并认为莱菔子素可能是通过核转录因子Nrf2的转位而激活UGT1A1基因的表达。
3 小结与展望
随着中药的广泛使用,明确中药成分对UGT1A1介导的中药-药物相互作用提供深入的理解和一定的参考,有助于未来指导临床上中药制剂的合理使用。一方面可以将抑制UGT1A1的中药成分或含这些成分的中药与经该酶代谢但生物利用度低的药物合用,提高该药物的疗效,延长药物的作用时间,进而提高生物利用度。另一方面,对于黄疸患者,可以在治疗的同时联合使用能够诱导UGT1A1活性的中药成分及含这些成分的中药,加速胆红素的代谢,改善黄疸的症状。
总而言之,明确中药成分与UGT1A1的作用关系,有助于阐明中药药理作用的分子机制、与药物相互作用的机制,避免配伍使用过程中药物成分间相互作用引起的不良反应甚至毒副作用,为临床安全、合理地使用中药提供理论依据,填补我国系统研究中药有效成分对药物代谢酶影响的空白,推动我国中药研究的现代化。
[参考文献]
[1]Kiang T K, Ensom M H, Chang T K. UDP-glucuronosyltransferases and clinical drug-drug interactions [J]. Pharmacol Ther, 2005, 106 (1): 97.
[2]Rowland A, Miners J O, MacKenzie P I. The UDP-glucuronosyltransferases: their role in drug metabolism and detoxification [J]. Int J Biochem Cell Biol, 2013, 45 (6): 1121.
[3]Sting J C, Bartels H, Viviani R, et al. Relevance of UDP-glucuronosyltransferase polymorphisms for drug dosing: a quantitative systematic review [J]. Pharmacol Ther, 2014, 141(1): 92.
[4]O′Dwyer P J, Catalano R B. Uridinediphosphateglucuronosyltransferase (UGT) 1A1 and irinotecan: practical pharmacogenomics arrives in cancer therapy [J]. J Clin Oncol, 2006, 24 (48): 4534.
[5]Singer J B, Shou Y, Giles F, et al. UGT1A1 promoter polymorphism increases risk of nilotinib-induced hyperbilirubinemia [J]. Leukemia, 2007, 21(11): 2311.
[6]Strassburg C P, Manns M P, Tukey R H. Differential down-regulation of the UDP-glucuronosyltransferase 1A locus is an early event in human liver and biliary cancer [J]. Cancer Res, 1997, 57 (14): 2979.
[7]Goon C P, Wong F C, Thuya W L, et al. UGT1A1 mediated drug interactions and its clinical relevance [J]. Curr Drug Metab, 2016, 17 (2):100.
[8]Zucker S D, Qin X, Rouster S D, et al. Mechanism of indinavir-induced hyperbilirubinemia [J]. Proc Natl Acad Sci USA, 2001, 98 (22):12671.
[9]曹緯国, 刘志勤, 邵云, 等. 黄酮类化合物药理作用研究进展 [J]. 西北植物学报, 2003, 23 (12): 2241.
[10]Teng Y, Nian H, Zhao H, et al. Biotransformation of baicalin to baicalein significantly strengthens the inhibition potential towards UDP-glucuronosyltransferases (UGTs) isoforms [J]. Pharmazie, 2013, 68 (9): 763.
[11]Ma G Y, Cao Y F, Hu C M, et al. Comparison of inhibition capability of scutellarein and scutellarin towards importanr liver UDP-glucuronosyltransferase (UGT) isoforms [J]. Phytother Res, 2014, 28 (3): 382.
[12]Guo B, Fan X R, Fang Z Z, et al. Deglycosylation of liquiritin strongly enhances its inhibitory potential towards UDP-glucuronosyltransferase (UGT) isoforms [J]. Phytother Res, 2013, 27 (8): 1232.
[13]Wang X X, Lv X, Li S Y, et al. Identification and characterization of naturally occurring inhibitors against UDP-glucuronosyltransferase 1A1 in Fructus Psoraleae (Bu-gu-zhi) [J]. Toxicol Appl Pharmacol, 2015, 289 (1):70.
[14]Xin H, Qi X Y, Wu J J, et al. Assessment of the inhibition potential of licochalcone A against human UDP-glucuronosyltransferases [J]. Food Chem Toxicol, 2016, 90: 112.
[15]Lu H, Fang Z Z, Cao Y F, et al. Isoliquiritigenin showed strong inhibitory effects towards multiple UDP-glucuronosyltransferase (UGT) isoform-catalyzed 4-methylumbelliferone (4-MU) glucuronidation [J]. Fitoterapia, 2013, 84: 208.
[16]Shang L, Yang S, Zhang G, et al. Comparison of the inhibitory potential of bavachalcone and corylin against UDP-glucuronosyltransferases [J]. Evid Based Complement Alternat Med, 2014, 2014: 958937.
[17]D′Andrea V, Pe′rez L M, Pozzi E J S. Inhibition of rat liver UDP-glucuronosyltransferase by silymarin and the metabolite silibinin-glucuronide [J]. Life Sci, 2005, 77 (6): 683.
[18]Fang Z Z, Cao Y F, Hu C M, et al. Structure-inhibition relationship of ginsenosides towards UDP-glucuronosyltransferases (UGTs) [J]. Toxicol Appl Pharmacol, 2013, 267 (2): 149.
[19]He Y J, Fang Z Z, Ge G B, et al. The inhibitory of effect of 20(S)-protopanaxatriol (ppt) towards UGT1A1 and UGT2B7 [J]. Phytother Res, 2013, 27 (4): 628.
[20]楊显志, 邵华, 张玲琪, 等. 鬼臼毒素资源研究现状[J]. 中草药, 2001, 32 (11):1042.
[21]Qi J Q, Cao Y F, Hong M, et al. Structure-inhibition relationship of podophyllotoxin (PT) analogues towards UDP-glucuronosyltransferase (UGT) isoforms [J]. Pharmazie, 2015, 70 (4): 239.
[22]Jeong H U, Kong T Y, Kwon S S, et al. Effect of honokiol on cytochrome P450 and UDP-glucuronosyltransferase enzyme activities in human liver microsomes [J]. Molecules, 2013, 18 (9): 10681.
[23]Malfatti M A, Felton J S. N-glucuronidation of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine (PhIP) and N-hydroxy-PhIP by specific human UDP-glucuronosyltransferases [J]. Carcinogenesis, 2001, 22 (7): 1087.
[24]Sugatani J, Yamakawa K, Tonda E, et al. The induction of human UDP-glucuronosyltransferase 1A1 mediated through a distal enhancer module by flavonoids and xenobiotics [J]. Biochem Pharmacol, 2004, 67 (5): 989.
[25]Galijatovic A, Walle U K, Walle T. Induction of UDP-glucuronosyltransferase by the flavonoids chrysin and quercetin in Caco-2 cells [J]. Pharm Res, 2000, 17 (1): 21.
[26]Walle U K, Walle T. Induction of human UDP-glucuronosyltransferase UGT1A1 by flavonoid-structural requirements [J]. Drug Metab Dispos, 2002, 30 (5): 564.
[27]姚风艳, 孙连娜. 芒果苷药理作用及其结构修饰的研究进展[J]. 中国实验方剂学杂志, 2014, 20 (12): 248.
[28]Rodeiro I, José Gómez-Lechón M, Perez G, et al. Mangifera indica L. extract and mangiferin modulate cytochrome P450 and UDP-glucuronosyltransferase enzymes in primary cultures of human hepatocytes [J]. Phytother Res, 2013, 27 (5): 745.
[29]周许年, 毕惠嫦, 金晶, 等. 白花前胡甲素及丙素经hCAR通路诱导UGT1A1的表达[J]. 药学学报, 2013, 48 (5): 794.
[30]Gamet-Payrastre L, Li P, Lumeau S, et al. Sulforaphane, a naturally occurring isothiocyanate, induces cell cycle arrest and apoptosis in HT29 human colon cancer cells [J]. Cancer Res, 2000, 60 (5): 1426.
[31]王敏, 李延青, 钟宁, 等. 莱菔子素诱导结肠癌Caco-2细胞株葡萄糖醛酸转移酶1A的表达及其机制[J]. 中华医学杂志, 2005, 85 (12): 819.
[责任编辑 曹阳阳]
——α-葡萄糖醛酸酶的研究进展*

