Qrr1对溶藻弧菌不同生理功能及毒力的调控研究
刘 欢, 杨金芳, 张姗姗, 刘 望, 陈雪峰, 张谷芬
(1.陕西科技大学 食品与生物工程学院, 陕西 西安 710021; 2.第四军医大学唐都医院 全军感染病诊疗中心, 陕西 西安 710038)
Qrr1对溶藻弧菌不同生理功能及毒力的调控研究
刘 欢1, 杨金芳1, 张姗姗1, 刘 望1, 陈雪峰1, 张谷芬2
(1.陕西科技大学 食品与生物工程学院, 陕西 西安 710021; 2.第四军医大学唐都医院 全军感染病诊疗中心, 陕西 西安 710038)
溶藻弧菌是我国海水产养殖鱼类的重要病原菌,造成水产养殖业严重的经济损失.利用生物信息学手段,在溶藻弧菌体内筛选得到群体感应调控sRNA分子,即Qrr1,并对其进行了克隆和无标记框内突变株的构建,鉴定其在溶藻弧菌生理功能中所发挥的作用.实验结果表明:Qrr1对溶藻弧菌对数生长期及稳定期的生长具有显著的促进作用.此外,Δqrr1缺失株的运动性几乎完全丧失,生物被膜形成能力下降,胞外蛋白酶产量降低,可见,Qrr1对溶藻弧菌的毒力亦具有重要的调控作用.
Qrr1; 溶藻弧菌; 生理功能; 毒力
0 引言
溶藻弧菌(Vibrioalginolyticus)是一种重要的水产养殖病原菌,广泛存在于世界各地,可感染多种鱼类和贝类,因其感染所导致的细菌性败血症给水产养殖业带来了巨大的经济损失[1,2].此外,溶藻弧菌还能感染人类,通过受污染的海鲜类食品的食用而导致肠胃炎的发生,亦可通过皮肤和耳朵感染,危害人类健康.深入研究溶藻弧菌致病性分子调控机理对于其预防和控制显得尤为必要.
溶藻弧菌的毒力因子包括胞外蛋白酶、生物被膜、运动性等,主要受群体感应系统及sRNA分子伴侣蛋白Hfq的调控[3-8].Hfq最初是作为噬菌体在大肠杆菌中进行复制所必需的内源性宿主蛋白被鉴定的.随后对Hfq进行缺失分析发现,该蛋白参与大肠杆菌的生长、细胞分裂、渗透压的响应等生理调控[9].随后,在多种细菌体内均鉴定到Hfq蛋白,并作为转录后全局调控因子对细菌的生理功能发挥调控作用[10].Hfq主要作为一类非编码的sRNA分子伴侣蛋白发挥其调控作用.sRNA是广泛存在于细菌体内的一类非编码的起调控作用的RNA,大小为60~300个碱基.sRNA能够被快速合成,在分子伴侣蛋白Hfq的协同作用下,通过碱基互补配对作用与不同的靶标mRNA分子结合,影响其稳定性或翻译活性,实现基因表达的快速调控.Hfq形成炸面圈状的六聚体结构,具有两个独立的RNA结合位点表面,一个位于远端面用于Poly(A)尾巴的结合,另一个位于近端面用于AU富集区的结合.因此,Hfq为RNA分子提供停泊平台,促进非编码sRNA与靶标mRNA分子之间的相互作用[11-13].目前越来越多的研究发现Hfq及sRNAs对于许多细菌的多种生理功能,如生长特征、环境应激以及毒力等都具有至关重要的影响,当Hfq表达受损时,霍乱弧菌、流血嗜血杆菌和小肠结肠炎耶尔森氏菌等都显著减毒[14-18].
本研究通过生物信息学手段,在溶藻弧菌基因组中筛选得到群体感应调控sRNA分子,即Qrr1,继而通过无标记框内缺失手段从基因组中缺失qrr1基因,获得其缺失株并对其生物学特性进行研究.
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
大肠杆菌DH5α、CC118λpir、SM10λpir、溶藻弧菌野生型菌株MVP01、自杀质粒pDM4 、互补质粒pMMB206均由本实验室保存.pMD18T购自TaKaRa公司.
1.1.2 主要仪器和试剂
恒温培养箱购自上海一恒科学仪器有限公司;摇床购自太仓市仪器设备厂;PCR仪和核酸电泳仪购自伯乐生命医学产品有限公司;凝胶成像系统购自上海复日科技有限公司.
LB培养基购自上海生工生物工程有限公司;TaqDNA聚合酶、Pfu高保真聚合酶、DNA分子标准量Marker、DNA回收试剂盒及质粒抽提试剂盒购自北京天根生化科技有限公司;T4DNA连接酶及限制性内切酶购自TaKaRa公司.
1.1.3 引物
表1为本研究中使用的引物,参照GenBank上公布的基因序列设计,由上海捷瑞生物工程有限公司合成.

表1 实验中所使用的引物
1.2 方法
1.2.1qrr1基因的克隆与分析
根据已公布的溶藻弧菌12G01基因组和霍乱弧菌以及哈氏弧菌中的qrr基因序列,利用生物信息学手段对其进行比对分析,筛选溶藻弧菌中的群体感应调控sRNA,Qrr1,并利用Mfold对其进行二级结构预测分析(http://unafold.rna.albany.edu/?q=mfold).在此基础上,设计特异性引物对qrr1基因进行克隆.
1.2.2Δqrr1突变株的构建
以溶藻弧菌MVP01基因组为模板,以引物qrr1upF和qrr1upR、qrr1doF和qrr1doR分别扩增获得上下游同源臂片段qrr1up和qrr1do.PCR产物经回收后,再以qrr1upF和qrr1doR为引物经overlap PCR将上下游同源臂片段qrr1up和qrr1do连接起来,得到Δqrr1片段.随后通过双酶切与自杀质粒pDM4连接重组,并转化大肠杆菌CC118λpir,挑选阳性克隆并验证.随后从正确的阳性克隆株中提取重组质粒并转化大肠杆菌SM10λpir,并挑选含有重组质粒的阳性克隆株,作为供体菌株,与受体菌株溶藻弧菌MVP01进行接合,分别利用氨苄青霉素和氯霉素的双抗正向选择标记及蔗糖方向选择标记,经过两轮同源重组,获得经PCR及测序验证正确的框内缺失突变株Δqrr1.
1.2.3 互补菌株qrr1+的构建
以MVP01基因组为模板,用引物对qrr1comF和qrr1comR进行PCR反应,扩增得到含有完整qrr1基因ORF区域及启动子的DNA片段后,克隆至pDM19-T载体中.对克隆片段进行测序验证确保没有发生基因突变.对其进行质粒提取后,通过限制性内切酶酶切后与互补质粒pMMB206连接,并转化入宿主菌株大肠杆菌CC118λpir中,菌落PCR验证得到阳性克隆.抽提回补质粒pMMB-qrr1,转化至大肠杆菌SM10λpir中,验证得到阳性克隆,并以之作为接合供体菌株,将其互补质粒pMMB-qrr1接合至受体菌Δqrr1中,得到互补菌株qrr1+.
1.2.4 生长曲线的测定
将保存于-80 ℃甘油管中的菌株接种至LBS液体培养基中,30 ℃摇床中200 r/min过夜复苏培养.将各菌液用新鲜LBS液体培养基稀释至OD600为1.0,按1% (v/v)接种至含有50 ml LBS液体培养基的三角瓶中,于30 ℃摇床中200 r/min培养,每1 h取样并测定其OD600值,绘制各菌株的生长曲线,考察生长特性.
1.2.5 生物被膜检测
将过夜培养的菌株用新鲜的LBS液体培养基稀释至相同的OD600值.随后将各菌株接种至含有10 ml LBS液体培养基的干净无菌的玻璃试管中,于30 ℃培养箱中静置培养48 h.每管培养液中添加2% (w/v)结晶紫溶液,染色5 min后,将培养物全部倒出,自来水冲洗,每管中添加33% (v/v)冰醋酸溶液,检测其在570 nm处的吸光值.
1.2.6 运动性分析
分别用含有0.3% (w/v)(软平板)和1.5% (w/v)(硬平板)琼脂粉的LBS平板测定各菌株的游动性和泳动性.将活化后的溶藻弧菌MVP01野生型菌株、Δqrr1突变株和qrr1+互补菌株用新鲜LBS液体培养基稀释,至OD600=1.0,吸取2μL菌液,滴加于平板上,软平板正置于30 ℃培养箱中,硬平板则倒置培养,至菌落生长至合适大小后,取出对其进行拍照.
1.2.7 胞外蛋白酶活性分析
定性测定采用脱脂牛奶平板:将在75 ℃下灭菌15 min的10% (w/v)脱脂奶粉溶液添加至LBS固体培养基中,使其终浓度为1%.将各活化后的菌种稀释至OD600=1.0,取2μL滴加于牛奶平板上,小心晾干后在30 ℃培养箱中倒置培养,测量菌落外透明圈的直径大小.
定量分析方法是测定添加的天蓝色皮粉(Hide powder azure,HPA)底物被酶解后释放的可溶性天蓝色染料的量.将各菌株在LBS液体培养基中于30 ℃摇床培养10 h后,离心收集上清液,用0.22μm孔径的一次性无菌过滤器过滤上清.取出1 mL已过滤的上清液加入到血清瓶中,再加入1 mL PBS (pH=7.2)以及10 mg HPA,于37 ℃摇床中200 r/min培养2 h.在各管中添加2 mL 10% (w/v) TCA溶液终止反应,12 000 g离心5 min后,取适量上清液测定其在600 nm处的吸光值.
2 结果与讨论
2.1qrr1序列克隆与分析
利用生物信息学手段,将霍乱弧菌和哈氏弧菌中的qrr1基因序列与已公布的溶藻弧菌12G01全基因组序列进行比对,筛得qrr1基因序列,并以此设计引物,以溶藻弧菌MVP01的基因组为模板扩增得到qrr1序列.测序结果表明,qrr1基因序列长度为121 bp,且与哈氏弧菌、副溶血弧菌、霍乱弧菌中qrr1基因序列保持较高同源性.利用Mfold在线分析工具对其转录RNA进行二级结构预测发现,Qrr1具有典型的茎环结构,在其3′端为多具U尾巴,同时在茎环结构间含有伴侣蛋白Hfq假定的结合位点AU富含区(如图1所示).
2.2Δqrr1突变株的构建
在克隆得到qrr1基因序列的基础上,进一步根据同源交换的原理利用自杀质粒得到缺失qrr1基因7-121 位共115 bp的突变株Δqrr1.首先采用菌落PCR的方法,利用位于突变株构建片段外侧的引物进行验证.结果表明,Δqrr1突变株中扩增获得的目的片段比野生型中的片段减少了115 bp (如图2所示).进一步将筛得的突变株进行基因组抽提,采用相同引物进行测序分析.测序结果证明,该突变株中qrr1基因开放阅读框7-121 位碱基的内部核苷酸序列被缺失掉.

图1 Qrr1二级结构预测图

图2 Δqrr1突变株PCR验证电泳图
2.3qrr1+互补株的构建
在突变株的基础上,利用启动子预测软件Promoter 2.0对qrr1基因上游序列进行分析,将互补片段连接至pMMB206质粒中,并接合至Δqrr1突变株中.以引物qrr1comF和qrr1comR对得到的菌株进行PCR验证.结果表明,在qrr1+互补株中可扩增得到相差115 bp的大小两条片段,即Δqrr1突变株基因组中框内缺失片段以及由pMMB206质粒上携带的带有启动子区域的完整的回补片段,证明携带有目的片段的回补质粒pMMB-qrr1成功接合转移至Δqrr1突变株中(如图3所示).随后进行质粒提取并进行测序分析,进一步确证了qrr1+互补株的成功构建.
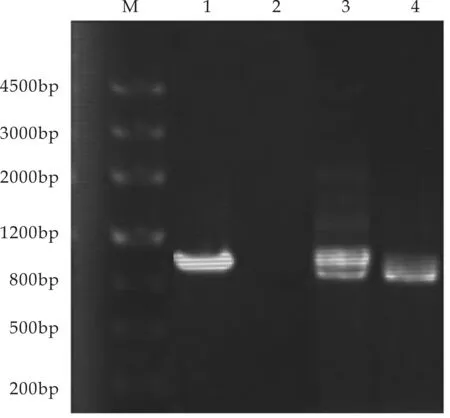
图3 qrr1+回补菌株PCR验证电泳图
2.4 Qrr1对溶藻弧菌生长的影响
为了考察Qrr1在溶藻弧菌生长过程中所发挥的作用,分别对溶藻弧菌野生型菌株和突变株、互补株进行生长曲线的测定.实验结果表明:三者都表现出非常短的停滞期,在接种至新鲜培养基2 h后便进入对数生长期;野生株在对数生长期中生长最为迅速,稳定期菌体密度达到OD600 nm=6.0.在对数生长期内,突变株与互补株的生长相比野生型有较明显的下降;当菌株生长至12 h后便进入稳定期,而在进入稳定期后,突变株的生长达到与互补株相当的水平,野生型保持较高菌浓(如图4所示).可见,qrr1基因的缺失对溶藻弧菌的整个生长周期都有影响,对对数生长期的影响最大.同时,qrr1+互补株在对数生长期内较突变株生长有所提高,间接验证了互补株构建的成功.然而,互补株的生长水平并未能达到野生型菌株的水平,可能回补质粒较高水平的表达反而对其自身的表达存在一定的抑制作用.
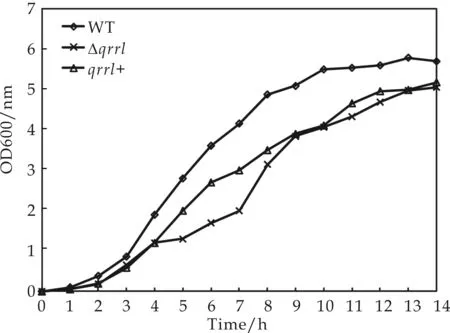
图4 不同菌株的生长曲线
2.5 Qrr1对溶藻弧菌运动性的调控
为了研究Qrr1对溶藻弧菌运动性的调控作用,本实验采用含有0.3%和1.5%琼脂的LBS软硬平板对游动性和爬动性分别进行测定.从图5可以看出,野生型菌株在30 ℃培养12 h后,在硬平板上具有较为明显的爬动能力,以点样处为中心向四周一圈圈地爬动扩散.而Δqrr1突变株的爬动能力基本丧失,只是在点样处进行生长繁殖,未出现菌落扩散的现象.野生型菌株在30 ℃ 培养12 h后,在软平板上显示出较为明显的游动能力,基本已经铺满整个平板.而Δqrr1菌株的游动能力几乎完全丧失,qrr1+互补株表现出较好的回补效果,游动能力较突变株有较明显的提高.可见,Hfq对于溶藻弧菌的游动能力的正向调控作用主要通过Qrr1的作用来实现.
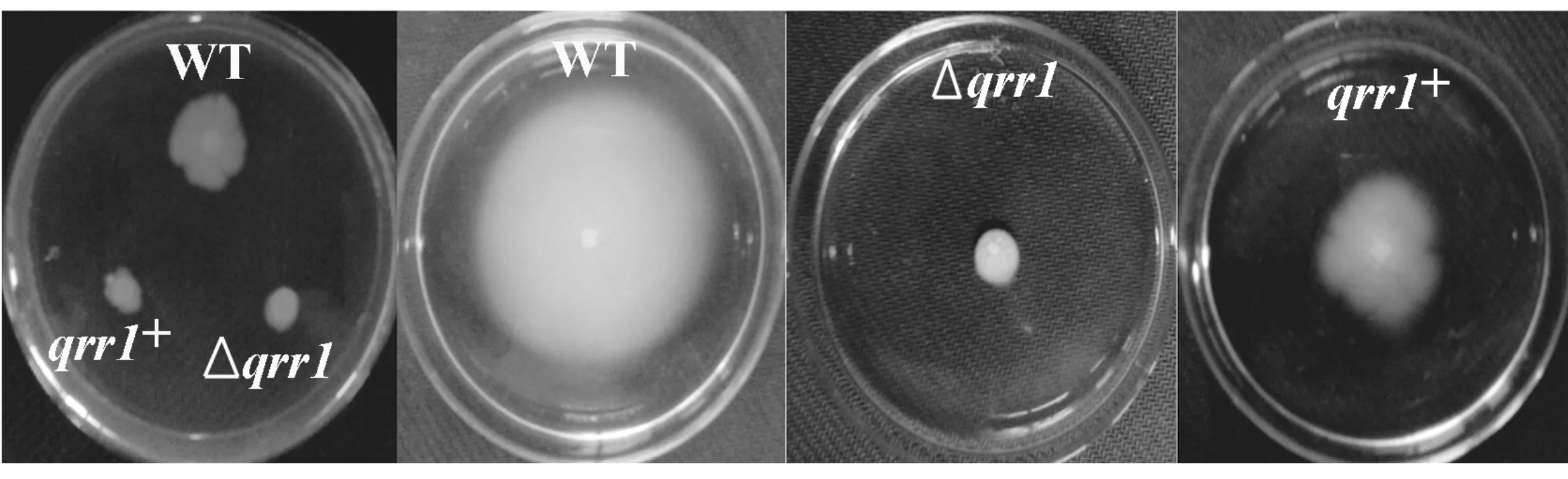
图5 Qrr1对溶藻弧菌运动性的影响
2.6 Qrr1对溶藻弧菌生物被膜形成的影响
通过对不同菌株生物被膜的检测发现:溶藻弧菌野生型在试管中静置培养48 h后,在试管壁与LBS液体培养基接触表面可形成肉眼可见的、较厚实的生物被膜.Δqrr1突变株在相同的培养条件下在固液接触表面形成的生物被膜则有所减少,而qrr1+互补株生物被膜的形成量虽未能达到野生型水平,但较突变株有明显提高.通过结晶紫染色分析发现Δqrr1突变株生物被膜形成量较野生型减少了近50%(如图6所示).可见,Qrr1对溶藻弧菌生物被膜的形成具有正调控作用.

图6 Qrr1对溶藻弧菌生物被膜形成能力的影响
2.7 Qrr1对溶藻弧菌胞外蛋白酶生成的影响
胞外蛋白酶是溶藻弧菌主要毒力因子,分别通过脱脂牛奶平板和HPA显色法对不同菌株胞外蛋白酶活性进行定性和定量分析.结果表明,野生型菌株在脱脂牛奶平板上可在其菌落四周形成明显的透明圈,且透明圈直径和透明度均最大.而Δqrr1突变株在脱脂牛奶平板上形成的透明圈直径及透明度均减小;当具有完整基因开放阅读框序列回补至突变株中后,其胞外蛋白酶的活性得到一定的提高(如图7(a)所示).HPA显色反应结果与牛奶平板相符,野生型胞外蛋白酶产量最高,两个阴性对照菌株asp-和ΔluxR突变株几乎合成胞外蛋白酶.Qrr1表达受损时其胞外蛋白酶产量降低,而其互补菌株的产量则基本与野生型相当(如图7(b)和7(c)所示).由此可见,Qrr1对溶藻弧菌胞外蛋白酶的产生具有一定的促进作用.

(a)牛奶平板检测分析

(b)HPA显色分析

(c)HPA显色定量分析图7 Qrr1对溶藻弧菌胞外蛋白酶合成的调控
3 结论
溶藻弧菌是水产养殖鱼类重要的病原菌,每年因其感染所爆发的弧菌并给世界海水养殖业造成了巨大的经济损失.溶藻弧菌的主要毒力因子为胞外蛋白酶,生物被膜及运动性等.前期研究发现,在溶藻弧菌体内存在sRNA分子伴侣蛋白Hfq,该蛋白对溶藻弧菌的环境应激能力,运动性,生物被膜,胞外蛋白酶活性,宿主体内存活以及毒力等均具有重要的调控作用[6].Hfq作为一个重要的转录后全局调控因子,主要通过协助不同的sRNA分子与靶标mRNA分子相互作用而发挥功能.在大肠杆菌中,Hfq通过SgrS和CsrA两个sRNA分子进行营养代谢的调控[19,20];通过OxyS抑制fhlA和rpoS基因的转录进行氧化应激适应[21].在霍乱弧菌中,Hfq主要通过Qrr分子对群体感应关键元件LuxR和AphA的影响来实现对其毒力的调控[13].
本文通过生物信息学手段在溶藻弧菌12G01基因组中筛查到群体感应调控sRNA分子,即Qrr1.通过同源重组构建了缺失其7-121位碱基的无标记基因框内缺失突变株,通过对比其与野生型菌株和互补株的不同生理特性发现:Qrr1对溶藻弧菌胞外蛋白酶的合成都具有一定的促进作用,而前期研究发现,当Hfq缺失后,其胞外蛋白酶的产量显著上升,且通过对群体感应元件LuxR的转录后抑制作用实现对胞外蛋白酶的下调作用.可见,在溶藻弧菌中,Hfq主要通过其它一个或多个sRNA而非Qrr1进行胞外蛋白酶表达的影响.而当Qrr1缺失后,溶藻弧菌的运动性完全受损,与Hfq缺失株表型一致,表明Hfq对于溶藻弧菌运动性的调控作用主要通过Qrr1来实现.此外,Qrr1转录受损时,溶藻弧菌在对数生长期和稳定期的菌体浓度明显低于野生型菌株,而当Hfq表达受损时,其仅在对数生长期较野生型菌体浓度有所下降,到达稳定期后即达到野生型水平,表明Hfq通过Qrr1及其他未知的sRNA分子的协同调控作用进行溶藻弧菌生长代谢的调控.
通过本论文的研究工作,在溶藻弧菌体内鉴定了与其生长及毒力相关的sRNA分子,即Qrr1,为深入研究溶藻弧菌Hfq对其毒力及其他生理功能的调控机理提供了线索.同时,研究结果也表明了Hfq对溶藻弧菌毒力调控机制的复杂性,尚有大量未知的参与溶藻弧菌不同生理功能的sRNA分子有待进一步地鉴定,今后将深入研究Qrr1与Hfq协同作用的机理,进一步探明溶藻弧菌的致病机制.
[1] Liu C H,Cheng W,Hsu J P,et al.Vibrio alginolyticus infection in the white shrimp litopenaeus vannamei confirmed by polymerase chain reaction and 16 S rDNA sequencing[J].Dis Aqua Organ,2004,61:169-174.
[2] Ma Q,Zhang Y.Characterization of the vibrio alginolyticus fur gene and localization of essential amino acid sites in fur by sitedirected mutagenesis[J].J Mol Microbiol Biotechnol,2007,13:15-21.
[3] Wang Q,Liu Q,Ma Y,et al.LuxO controls extracellular protease,haemolytic activities and siderophore production in fish pathogen vibrio alginolyticus[J].J Appl Microbiol,2007,103(5):1 525-1 534.
[4] Rui H,Liu Q,Ma Y,et al.Roles of LuxR in regulating extracellular alkaline serine protease A,extracellular polysaccharide and mobility of vibrio alginolyticus[J].Fems Microbiol Lett,2008,285(2):155-162.
[5] Tian Y,Wang Q,Liu Q,et al.Involvement of LuxS in the regulation of motility and flagella biogenesis in vibrio alginolyticus[J].Biosci Biotechnol Biochem,2008,72(4):1 063-1 071.
[6] Liu H,Wang Q,Liu Q,et al.Roles of Hfq in the stress adaptation and virulence in fish pathogen vibrio alginolyticus and its potential application as a target for live attenuated vaccine[J].Appl Microbiol Biotechnol,2011,91(2):353-364.
[7] Deng Y,Chen C,Zhao Z,et al.The RNA chaperon Hfq is involved in colony morphology,nutrient utilization and oxidative and envelop stress response in vibrio alginolyticus[EB/OL].http://dx.doi.org/10.1371/journal.pone.0163689,2016-09-29.
[8] Gu D,Liu H,Yang Z,et al.Chromatin innunoprecipitation sequencing technology reveals global regulatory roles of low-cell-density quorum-sensing regulator AphA in the pathogen vibrio alginolyticus[J].J Bacteriol,2016,198(21):2 985-2 999.
[9] Tsui H C T,Leung H C E,Winkler M E.Characterization of broadly pleiotropic phenotypes caused by an hfq insertion mutation in escherichia coli K-12[J].Mol Microbiol,1994,13(1):35-49.
[10] Chao Y,Vogel J.The role of Hfq in bacterial pathogens[J].Curr Opin Microbiol,2010,13(1):24-33.
[11] Mikulecky P J,Kaw M K,Brescia C C,et al.Escherichia coli Hfq has distinct interaction surfaces for DsrA,rpoS and poly (A) RNAs[J].Nat Struct Mol Biol,2004,11(12):1 206-1 214.
[12] Schu D J,Zhang A,Gottesman S,et al.Alternative Hfq-sRNA interaction modes dictate alternative mRNA recognition[J].EMBO J,2015,34(20):2 557-2 573.
[13] Shao Yi,Bassler B L.Quorum-sensing noncoding small RNAs use unique pairing regions to differentially control mRNA targets[J].Mol Microbiol,2012,83(3):599-611.
[14] Lenz D H,Mok K C,Lilley B N,et al.The small RNA chaperon Hfq and multiple small RNAs conrol quorum sensing in vibrio harveyi and Vibrio cholerae[J].Cell,2004,118(1):69-82.
[15] Hempei R J,Morton D J,Seale T W,et al.The role of RNA chaperon Hfq in haemophilus influenza pathogenesis[J].BMC Microbiol,2013,13:134-136.
[16] Hunter G A,Keener J P.Mechanisms underlying the additive and redundant Qrr phenotypes in vibrio harveyi and vibrio cholerae[J].J Theor Biol,2014,340:38-49.
[17] Kakoschke T,Kakoschke S,Magistro G,et al.The RNA chaperon Hfq impacts growth,metabolism and production of virulence factors in yersinia enterocolitica[EB/OL].http://dx.doi.org/10.1371/journal.pone.0086113,2014-01-15.
[18] Feliciano J R,Grilo A M,Guerreiro S I,et al.Hfq:A multifaceted RNA chaperon involved in virulence[J].Future Microbiol,2016,11(1):137-151.
[19] Papenfort K,Sun Y,Miyakoshi M,et al.Regulation of glucose homeostasis by small RNA mediated activation of sugar phosphatase mRNA[J].Cell,2013,153(2):426-437.
[20] Wang X,Dubey A K,Suzuki K,et al.CsrA post-transcriptionally represses pgaABCD,responsible for synthesis of a biofilm polysaccharide adhesion of escherichia coli[J].Mol Microbiol,2005,56(6):1 648-1 663.
[21] Updegrove T B,Wartell R M.The influence of escherichia coli Hfq mutation on RNA binding and sRNA mRNA duplex formation in rpoS ribo regulation[J].BBA-Gene Regul Mec,2011,1 809(10):532-540.
【责任编辑:陈 佳】
Regulation of Qrr1 on various physiological functions and virulence ofVibrioalginolyticus
LIU Huan1, YANG Jin-fang1, ZHANG Shan-shan1, LIU Wang1, CHEN Xue-feng1, ZHANG Gu-fen2
(1.School of Food and Biological Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China; 2.Department of Infectious Disease, Tangdu Hospital, The Forth Military Medical University, Xi′an 710038, China)
Vibrioalginolyticusis one of the important fish pathogen in China,bringing about serious economic loss to aquaculture.A quorum sensing regulatory sRNA,Qrr1,was screened utilizing the bioinformatics methods and then cloned.Besides,the in-frame deletion mutant strain of Qrr1 was constructed and the roles of this gene in different physiological functions ofVibrioalginolyticuswere characterized.The results demonstrated that Qrr1 obviously promoted the growth ofVibrioalginolyticusduring exponential and stationary stage.Moreover,the ability of mobility was almost absent,the biofilm formation and extracellular protease production were all impaired in theΔqrr1 mutant strain,contrast to the wild-type strain,which means Qrr1 participates in the virulence regulation as an important regulator inVibrioalginolyticus.
Qrr1;Vibrioalginolyticus; physiological functions; virulence
2016-12-27 基金项目:国家自然科学基金项目(31301059); 陕西省科技厅自然科学基础研究青年基金项目(2013JQ3011); 陕西科技大学博士科研启动基金项目(BJ12-24)
刘 欢(1983-),女,陕西西安人,讲师,博士,研究方向:食源性病原微生物
1000-5811(2017)02-0114-07
S917.1
A

