铜螯合亲和层析分离抗氧化活性蚕豆蛋白酶解物
李雪芬 韩 涛 夏晓楠 丁 轲 卞 科
(北京农学院食品科学与工程学院1,北京 102206)
(河南工业大学2,郑州 450052)
铜螯合亲和层析分离抗氧化活性蚕豆蛋白酶解物
李雪芬1韩 涛1夏晓楠1丁 轲1卞 科2
(北京农学院食品科学与工程学院1,北京 102206)
(河南工业大学2,郑州 450052)
采用铜离子螯合亲和层析柱对不同铜螯合能力的蚕豆蛋白酶解物组分进行分离,并探讨其抗氧化活性机制与铜螯合能力之间的关系。结果表明,金属亲和层析的最优条件为:平衡缓冲液为pH 5.0,浓度为0.05 mol/L的NaAc-HAc;上样量为20 mg/mL的蚕豆蛋白酶解物1 mL;洗脱剂为0.04 mol/L咪唑。洗脱得到不能螯合铜的蚕豆蛋白酶解物组分F1及能螯合铜的组分F2,测定其总还原力、抑制羟自由基能力与铜螯合量,发现抗氧化活性的关系为F2>蚕豆蛋白酶解物>F1(P<0.05),铜螯合量的关系也为F2>蚕豆蛋白酶解物(未经分离)>F1(P<0.05),表明蚕豆蛋白酶解物的铜螯合活性越高,其抗氧化活性越高。
蚕豆蛋白 酶解物 铜螯合能力 抗氧化 铜离子螯合亲和层析柱
蚕豆是一种重要的植物蛋白资源,其蛋白质质量分数约25%~35%。我国是世界上蚕豆栽培面积最大且总产量最多的国家,但主要用作蔬菜和饲料[1]。目前食品加工业主要利用蚕豆生产粉丝,而其中含量丰富的蛋白质并未得到有效利用。先前的研究表明,蚕豆肽具有抗氧化活性[2]。
体内金属离子如铜和铁离子均含有未配对电子,作为Fenton反应的主要催化剂,是产生自由基的重要来源,因此能够结合铜和铁离子的食物成分可阻断自由基的产生,实现抗氧化[3]。近年来的研究表明,蛋白质及其体外酶解得到的肽段具有金属离子螯合能力,如酪蛋白磷酸肽能螯合钙离子[4]、鹰嘴豆蛋白酶解物具有螯合铜离子的能力并可抑制β-胡萝卜素的氧化[5]。其他如大豆蛋白[6]、猪血蛋白[7]、阿拉斯加鳕鱼皮[8]、芝麻蛋白[9]等水解物等都被证明具有金属螯合能力。大量研究证明金属螯合肽通常富含组氨酸、谷氨酸、天冬氨酸、亮氨酸。这些氨基酸能提供吲哚基、咪唑基、巯基以及羧基等功能集团与金属离子螯合,同时能提供如N、O或S等能参与螯合的原子[10-14]。蚕豆蛋白中组氨酸质量分数为2.24%~2.71%,谷氨酸15.80%~19.41%,天门冬氨酸12.36%~14.36%[15],有螯合金属离子的可能性。但目前有关蚕豆的研究多集中在蚕豆蛋白的提取及其酶解工艺的确定上[1,2,15-16],从蚕豆中提取分离铜螯合肽并测定其抗氧活性的研究鲜见报道。
金属离子螯合亲合层析(Immobilized Metal Affinity Chromatography,IMAC)是一种很好的蛋白质和多肽纯化技术,其高选择性可有效地将金属离子螯合能力不同的肽段分开,已得到广泛应用[17]。本文采用金属离子螯合亲合层析,将不同铜螯合能力的蚕豆肽进行分离,并探究其铜螯合能力与抗氧化活性之间的关系。
1 材料与方法
1.1 材料与试剂
干蚕豆:市售;碱性蛋白酶(活性≥20 000 U/g):北京奥博星生物有限责任公司;FLF01 Folin-酚蛋白定量试剂盒:北京鼎国昌盛生物技术有限责任公司;Ni-琼脂糖凝胶6FF:柱层析用,恒辉公司;羟自由基测定试剂盒:南京建成生物工程研究所;其他试剂均为化学纯。
1.2 仪器与设备
SJ-5 pH计:上海雷磁;LGJ-18型冷冻冷冻干燥机:北京四环科学仪器厂;Anke TDL-40B离心机:上海安亭科学仪器厂;T6新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司;B260-恒温水浴锅:上海亚荣生化仪器厂;HL-2S恒流泵:上海沪西分析仪器厂。
1.3 试验方法
1.3.1 样品制备
称取一定量的干蚕豆,清水浸泡12 h,去壳,用0.5%的Na2SO3和0.01%的NaOH混合溶液浸泡12~16 h,45℃干燥,粉碎,过60目筛。称取适量蚕豆粉,按固液比(g/mL)1∶15加入蒸馏水,搅拌,用2 mol/L NaOH溶液调节至pH 8.0,50℃浸提60 min,浸提液经4 000 r/min、10 min离心,用2 mol/L HCl调至蚕豆蛋白等电点4.2,静置0.5 h,搅拌均匀,3 000 r/min离心15 min,收集沉淀物,水洗2遍,将溶液调至中性,搅拌溶解,冷冻干燥即为蚕豆蛋白。把蚕豆蛋白按照3%(m/V)的比例溶于水中,将pH用2 mol/L NaOH(或HCl调节)调至9.0,温度调至65℃,加入碱性蛋白酶(酶底比:16 000 U/g)在此温度下水解4 h,待反应结束后,在100℃水浴中灭酶10 min。冷却到室温,离心(3 000 r/min,20 min)收集上清液即为蚕豆蛋白酶解物,真空冷冻干燥得到冻干粉备用[16]。
1.3.2 肽含量测定
采用Folin-酚蛋白定量试剂盒进行测定,肽含量以蛋白含量计,以牛血清白蛋白(BSA)作标准。
1.3.3 抗氧化活性指标的测定
1.3.3.1 总还原力测定
取样品液2 mL,加入2 mol/L pH 6.6的磷酸盐缓冲溶液混合,再加入2 mL 1%的铁氰化钾充分混合。混合物在50℃下加热20 min。再加入2 mL 10%的TCA,混合。混合物离心(3 000 r,10 min)。取上层清液2 mL加入2 mL蒸馏水和0.4 mL 0.1%的FeCl3,三者充分混合。反应10 min后,于700 nm下测定吸光值。以蒸馏水为对照,蚕豆肽的还原能力以U(样品的吸光值—对照的吸光值)表示[18]。
1.3.3.2 羟自由基清除活性
采用羟自由基试剂盒测定各样品的羟自由基清除活性,其主要依据的为产生羟自由基的Fenton反应,H2O2的量和Fenton反应产生的OH·量成正比,当给予电子受体后,用griess试剂显色,形成红色物质,其呈色与OH·的多少量成正比关系。
1.3.4 金属离子螯合亲和层析
将IDA-Sepharose 6B(25 mL)装入柱(2.6 cm× 10 cm)中,加入40 mL 0.2 mol/L CuSO4螯合铜离子30 min[铜螯合量为(93.5±2.2)μmol/mL湿胶,(467.6±3.6)μmol/g干胶]。柱子经8~9倍床体积的去离子水清洗,平衡缓冲液平衡。蚕豆蛋白酶解物冻干粉20 mg溶解在1 mL平衡缓冲溶液,上样,静止30 min。平衡缓冲液洗脱,收集洗脱液体命名为未吸附的组分F1。结合到铜柱上的蚕豆肽分别采用不同的洗脱剂洗脱,收集洗脱液命名为F2。洗脱过程流速为1 mL/min,紫外检测仪检测吸光值,室温。柱子的再生:5~10倍柱床体积的0.05 mol/L的EDTA洗柱,后用纯净水流洗5~10个柱床体积,流速为1 mL/min。
1.3.4.1 不同pH平衡缓冲液对蚕豆肽吸附能力的影响
蚕豆肽吸附试验所用的缓冲液:(A)缓冲液为0.05 mol/L的NaAc-HAc、pH 5.0;(B)缓冲液为0.05 mol/L的NaAc-HAc,pH 5.5;(C)0.05 mol/L的2-吗啉乙磺酸[(2-(4-Morpholino)ethanesulfonic acid,MES)],用NaOH调整到pH 6.0;(D)0. 05mol/L的2-吗啉乙磺酸[(2-(4-Morpholino)ethanesulfonic acid,MES)],用NaOH调整到pH 6. 5;(E)0.05 mol/L的Tris-HCl,pH 7.5。
1.3.4.2 不同上样量对蚕豆肽吸附能力的影响
蚕豆蛋白酶解物吸附试验所用的上样量分别为:10、20、30、40 mg/mL。上样体积为1 mL。
1.3.4.3 不同洗脱剂对吸附到亲和层析柱上蚕豆蛋白酶解物洗脱效果
使用的洗脱剂为:(F)0.02 mol/L磷酸氢二钠(Na2HPO4);(G)0.02 mol/L磷酸二氢钠(NaH2PO4);(H)0.02 mol/L的咪唑;(I)0.02 mol/L的氯化铵(NH4Cl);(J)0.04 mol/L的咪唑。
1.3.5 铜螯合能力的测定
采用平衡透析法及原子吸收测定样品中的铜含量。取冻干的蚕豆蛋白酶解物,用pH 7.4、0.01 mol/L的Tris-HCl缓冲液配制浓度为10 mg/mL的蚕豆蛋白酶解物溶液,取2 mL与0.5 mL 60 mmol/L的CuSO4混合震荡,反应半小时,离心,取上清液,放入500 u透析袋中,于500 mL、pH 7.4、0.01 mol/L的Tris-HCl缓冲液中透析24 h,每4 h更换透析液。对照为不含蚕豆蛋白酶解物,仅加入等量CuSO4的Tris-HCl缓冲液。透析结束,取透析袋溶液,测定肽的量及铜含量。试验设置3个平行。
透析袋处理方法:将透析袋置于含有2%的NaHCO3和1 mol/L EDTA的溶液中煮沸10 min,去离子水冲洗,再使用1 mol/L EDTA溶液煮沸10 min后,去离子水冲洗2遍。
1.3.6 数据处理
所有试验均重复3遍,数据均表示为平均值±标准差(SD)。采用SPSS16.0的one-way(ANOVA)进行方差分析,Duncan多重检验确定数据间的显著性差异。
2 结果与分析
2.1 不同pH的平衡缓冲液、上样量及洗脱剂对蚕豆蛋白酶解物在铜离子亲和层析柱上吸附行为的影响
为确定铜螯合柱分离蚕豆蛋白酶解物的最佳条件,研究了不同pH缓冲液、上样量及洗脱剂对蚕豆蛋白酶解物在铜离子亲和层析柱上吸附行为的影响。
当选用上样浓度为20 mg/mL、上样体积为1 mL的蚕豆蛋白酶解物进行上样时,分别用不同pH的平衡缓冲液对柱子进行洗脱,洗脱60 min后,得到各平衡缓冲液对应未吸附组分的峰面积如表1所示。

表1 不同pH平衡缓冲液对应未吸附组分的峰面积
用平衡缓冲液洗脱下来的即为不能够吸附在铜柱上的蚕豆蛋白酶解物,峰面积越大,表示不能吸附在铜柱上的蚕豆蛋白酶解物越多。表1表明,随着pH的提高,不能吸附在铜柱上的蚕豆蛋白酶解物增加,表明相应的蚕豆蛋白酶解物与铜离子的亲和力下降。有研究显示,蛋白质与金属间螯合配体间的作用主要包括配位作用和静电作用,其中以静电作用为主,而静电作用的大小取决于金属螯合配体和蛋白质所带的电荷,两者差异越大,静电作用越强[19]。金属螯合配体和蛋白质所带电荷与溶液pH有关。通常弱酸和碱性介质中,金属螯合配体带负电荷,而蛋白质所带电荷的正负性随pI和溶液pH改变。无论是pH大于或小于pI,随着pH的增加,两者所带电荷差异都会缩小,导致静电作用减弱,蛋白质与金属螯合配体间总的作用力减弱,蛋白质在金属柱上的吸附能力降低[20]。蚕豆蛋白酶解物在铜柱上吸附的量随pH的变化可能也是基于此原因。为让更多的蚕豆蛋白酶解物吸附在铜柱上,选择pH 5.0NaAc-HAc为平衡缓冲液。
确立了pH 5.0 NaAc-HAc为平衡缓冲液后,对金属亲和层析的条件进一步的优化,探索最优上样量。选择10、20、30、40 mg/mL 4个上样量,上样体积为1 mL。使用平衡缓冲液洗脱,其对应的样品洗脱液峰面积如表2所示。

表2 不同上样量对应未吸附组分的峰面积
一根铜柱上能够螯合的蚕豆蛋白酶解物是有限的,当上样量超过一定量时,不能吸附在铜柱上的蚕豆蛋白酶解物就会被平衡缓冲液洗脱下来。表2表明,当上样量由10 mg/mL增加到20 mg/mL,其峰面积增加了约1.5倍,而当上样量由20 mg/mL增加到30 mg/mL时,峰面积增加了约2倍,未吸附组分峰面积的增加速率开始大于上样浓度的增加速率,说明当上样量为20 mg时,吸附在铜柱上的蚕豆蛋白酶解物已呈饱和状态,多余的蚕豆蛋白酶解物都被平衡缓冲液洗脱下来,导致峰面积增加速率加快。最后选定上样量为20 mg/mL的蚕豆蛋白酶解物1 mL。
上样量确定后,进一步对洗脱剂进行选择。图1为所选用的4种洗脱剂对应洗脱效果图,浓度均为0.02 mol/L。

图1 不同洗脱剂对应的洗脱效果
由图1可以看出,NaH2PO4、NH4Cl洗脱效果不明显,NaH2PO4、咪唑有一定的洗脱效果。咪唑的峰波动大于NaH2PO4,但是峰面积仍较小。选用0.04 mol/L咪唑进行洗脱,与0.02 mol/L的咪唑洗脱效果进行对比得到图2。
图2表明当咪唑浓度为0.04 mol/L时,出峰明显,洗脱得到的蚕豆蛋白酶解物量较多。表3列出了不同洗脱剂洗脱液的对应峰面积。由此可看出0.04 mol/L的咪唑洗脱效果最好。
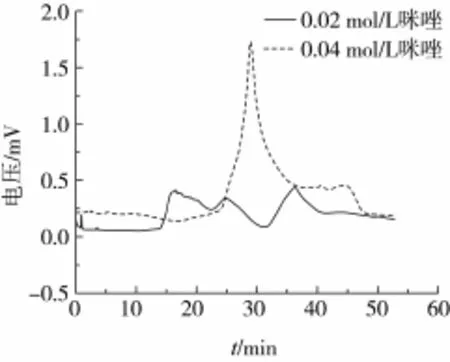
图2 不同浓度咪唑作为洗脱剂得到的洗脱液效果

表3 不同洗脱剂对应洗脱液的峰面积
根据结果,pH 5.0 NaAc-HAc为平衡缓冲液、上样量为20 mg/L的蚕豆蛋白酶解物1 mL、0.04 mol/L的咪唑作为洗脱剂将不同铜结合能力的蚕豆蛋白酶解物组分进行分离,得到了不能吸附在铜柱上被平衡缓冲液洗脱下来的组分,记为F1;能吸附在铜柱上被洗脱液洗脱下来的组分,记为F2。收集一次洗脱后一根铜柱上所得的F1、F2,并测定它们及上样蚕豆蛋白酶解物肽的量得到表4。

表4 各组分中肽的量
由表4可知F1及F2的肽的质量合计为14.81 mg,占上样蚕豆蛋白酶解物肽量的93.73%,即经过平衡缓冲液与0.04 mol/L咪唑的洗脱后,铜柱上几乎不再残有蚕豆蛋白酶解物。表4中F1与F2的肽的量比例与表2和表3呈现的未吸附组分与吸附组分的比例存在一定差异,主要因为使用Folin-酚蛋白定量试剂盒只能测定肽键的含量,而在金属亲和层析的过程中,使用紫外吸收检测仪测定的是220 nm下肽的吸收,由于很多物质在此波长下也会有一定的吸收,其中就包括从铜柱上带下来的部分铜离子,因此导致测定峰面积比真实的只有肽的情况下的值较大,所以导致前后比例有了些许差异。最后采用0.04 mol/L的咪唑为洗脱剂。
图1表明NaH2PO4、NH4Cl几乎不具有洗脱与铜结合的蚕豆蛋白酶解物的能力,咪唑、Na2HPO4具备一定的洗脱能力,这说明洗脱剂种类及溶液pH值都是影响洗脱效果的重要因素。可能因为磷酸基团并不能削弱蚕豆蛋白酶解物与铜离子的结合,导致NaH2PO4不具备洗脱能力,而能够提供氨基的咪唑则因为能够与蚕豆蛋白酶解物形成对铜离子螯合的竞争,从而实现对蚕豆蛋白酶解物的洗脱。报道表明含有20%~30%组氨酸的鹰嘴豆多肽具有很强的铜螯合能力[6],这更证明,蚕豆蛋白酶解物与铜离子的结合位点大部分可能为氨基。同样含有磷酸基团的Na2HPO4却具备一定的洗脱能力,这可能与Na2HPO4溶液呈碱性有关。有研究表明,洗脱液的pH值会影响蛋白与金属螯合体间的作用力,随着洗脱液pH值的升高,两者之间的作用力减弱,蛋白更易被洗脱下来[20],因此,由于能够提供氨基的NH4Cl溶液呈酸性,因而无法将蚕豆蛋白酶解物从铜柱上洗脱。
2.2 蚕豆蛋白酶解物及F1、F2的铜螯合能力及抗氧化能力比较
根据确定的金属亲和层析条件,收集F1、F2组分,测定上样蚕豆蛋白酶解物及F1、F2的抗氧化活性及铜螯合量,得到结果如表5。

表5 各组分抗氧化活性
采用测定总还原力及抑制羟自由基能力2种方法评价蚕豆蛋白酶解物及F1、F2的抗氧化活性。F2的总还原力为(145.34±1.63)U/g显著高于蚕豆蛋白酶解物(30.72±0.30)U/g及F1(14.9±0.22)U/g(P<0.05),蚕豆蛋白酶解物与F1之间也存在显著差异。F2的抑制羟自由基能力为(445.99±3.46)U/mg,显著高于蚕豆蛋白酶解物(234.23±1.48)U/mg及F1(131.02±1.50)U/mg(P<0.05),三者的抗氧化活性之间的关系皆为F2>蚕豆蛋白酶解物>F1。同时,在铜螯合量方面,F2为(16.42±0.10)μg/mg,显著高于蚕豆蛋白酶解物(5.88±0.29)μg/mg及F1(2.58±0.15)μg/mg(P<0.05)。这也说明铜螯合活性越高的组分,其抗氧化活性也越高。因此,经过金属亲和层析分离的几乎不具备铜螯合能力的组分F1的总还原力及抑制羟自由基能力都显著低于蚕豆蛋白酶解物及F2。而经过金属亲和层析分离的具有铜螯合能力的组分F2,其每毫克肽的总还原力及抑制羟自由基能力也显著高于未经分离纯化的上样蚕豆蛋白酶解物。
吕莹等[21]在研究核桃肽的抗氧化机制时发现,核桃蛋白质酶解物具有与铁螯合的能力,且铁结合能力越强抗氧化活性越高。采用铜离子亲和层析柱分离纯化后的鹰嘴豆蛋白酶解物及向日葵蛋白酶解物的抗氧化活性随着铜螯合活性的提高而得到了进一步的提高[22]。近年来的研究表明,体内游离的金属离子如铜离子和铁离子是机体产生自由基的重要来源,众多抗氧化活性肽正是因为能够结合这些金属离子,阻断自由基的生成,实现抗氧化的作用[23]。综上,可以表明蚕豆蛋白酶解物的抗氧化活性与其铜结合能力有一定的关系。
3 结论
采用铜离子螯合亲和层析柱对不同铜螯合能力的蚕豆蛋白酶解物进行分离,确定金属螯合亲和层析的最优条件为:平衡缓冲液为pH 5.0,浓度为0.05 mol/L的NaAc-HAc;上样量为20 mg/mL的蚕豆肽1 mL;洗脱剂为0.04 mol/L咪唑,得到了不能螯合铜离子的蚕豆蛋白酶解物组分F1及能够螯合铜离子的蚕豆蛋白酶解物组分F2,比较两组分及未经分离的蚕豆蛋白酶解物的抗氧化活性,发现铜螯合活性高的组分抗氧化活性也高,因此可以推测蚕豆蛋白酶酶解物的抗氧化活性与其铜螯合能力有关。本研究为进一步从蚕豆中提取铜螯合肽并研究其抗氧化机制提供参考,下一步可考虑利用反相-高效液相色谱对具有铜螯合能力的组分F2进一步分离纯化,然后利用质谱等方法对其氨基酸组成及结构进行鉴定分析。
[1]王春明,刘洋.蚕豆组成及加工利用进展[J].农业机械,2011(17):91-93 Wang C M,Liu Y.The composition and the processing progress of broad bean[J].Journal of Agricultural Machinery,2011(17):91-93
[2]刘淳,张海英,韩涛,等.Alcalase碱性蛋白酶酶解蚕豆蛋白的研究[J].中国粮油学报,2011,26(12):29-33 Liu C,Zhang H Y,Han T,et al.Study on hydrolyzing of protein from broad bean by alcalase protease[J].Joumal of the Chinese Cereals and Oils Association,2011,26(12):29-33
[3]李建喜,杨志强,王学智.活性氧自由基在动物机体内的生物学作用[J].动物医学进展,2006,27(10):33-36 Li J X,Yang Z Q,Wang X Z.Biological function of reactive Oxygen free radicals in Animals[J].Journal of Progress in Veterinary Medicine,2006,27(10):33-36
[4]Sato R,Noguchi T,Naito H.Casein phosphopeptides(CPP)enhances calcium absorption from the ligated segment of ratsmall intestine[J].Journal of Nutritional Science and Vitaminology,1986,32(1):67-76
[5]Megías M,Pedroche J,Yust M M,et al.Affinity purification of copper chelating peptides from chickpea protein hydrolysates[J].Journal of Agricultural Food and Chemistry,2007,55:3949-3954
[6]Lü Y,Liu Q,Bao X,et al.Identification and characteristics of iron-chelating peptides from soybean protein hydrolysates using IMAC-Fe3+[J].Journal of Agricultural and Food Chemistry,2009,57(11):4593-4597
[7]Lee S H,Song K B.Article isolation of a calcium-binding peptide from enzymatic hydrolysates of porcine blood plasma protein[J].Journal of the Korean Society for Applied Biological Chemistry,2009,52(3):290-294
[8]Guo L,Hou H,Li B,et al.Preparation,isolation and identification of iron-chelating peptides derived from Alaska pollock skin[J].Journal of Process Biochemistry,2013,48(5):988-993
[9]汪婵,陈敏,李博.芝麻蛋白制备金属螯合肽的酶解工艺研究[J].食品科技,2011,36(9):184-189 Wang C,Chen M,Li B.Preparation of metal(Fe2+,Zn2+)chelating peptides from sesame protein by enzymatic hydrolysis[J].Journal of Food Science and Technology,2011,36(9):184-189
[10]Glahn R P,Van Campen D R.Iron uptake is enhanced in Caco-2 cell monolayers by cysteine and reduced cysteinyl glycine[J].The Journal of Nutrition,1997,127(4):642-647
[11]Torres-Fuentes C,Alaiz M,Vioque J.Affinity purification and characterisation of chelating peptides from chickpea protein hydrolysates[J].Food Chemistry,2011,129(2):485-490
[12]Lee S H,Song K B.Purification of an iron-binding nona -peptide from hydrolysates of porcine blood plasma protein[J].Process Biochemistry,2009,44(3):378-381
[13]Storcksdieck S,Bonsmann G,Hurrell R.Iron-binding properties,amino acid composition,and structure of muscle tissue peptides from in vitro digestion of different meat sources[J].Journal of Food Science,2007,72(1):S019-S029
[14]Huang G,Ren L,Jiang J.Purification of a histidine-containing peptide with calcium binding activity from shrimp processing byproducts hydrolysate[J].European Food Research and Technology,2011,232(2):281-287
[15]宗绪晓.蚕豆蛋白的营养特点加工技术及利用途径[J].中国粮油学报,1993(8):51-54 Zong X X.Nutritional characteristics、processing technology and the utilization way of broad bean[J].Journal of the Chinese Cereals and Oils Association,1993,8:51-54
[16]苏海玲,张海英,李红卫,等.蚕豆蛋白酶解工艺及响应面法的优化[J].中国食品学报,2013(5):39-46 Su H L,Zhang H Y,Li H W,et al.Study on enzymatic hydrolysis of broad bean with papain and alkaline proteinase[J]Journal of Chinese Institute of Food Science and Technology,2013(5):39-46
[17]孙旭东,李红旗,隋洪艳,等.金属螯合亲和层析分离蛋白质的研究[J].生物工程学报,2000,16(4):495-499 Sung X D,Li H Q,Sui H Y,et al.Study on protein separat ion using immobilized metal ion affinity chromatography[J].Chinese Journal of Biotechnology,2000,16(4):495-499
[18]Hwang J Y,Shyu Y S,Wang Y T,et al.Antioxidative properties of protein hydrolysate from defatted peanut kernelstreated with esperase[J].LWT-Food Science and Technology,2010,43(2):285-290
[19]李蓉,邸泽梅,陈国亮.金属螯合亲和色谱中固定金属与蛋白质的作用[J].分析化学,2002,30(5):552-555 Li R,Di Z M,Chen G L.Interaction between immobilized metal and protein in metal chelate affinity chromatography[J].Chinese Journal of Analytical Chemistry,2002,30(5):552-555
[20]蒋加庆,蔡海波,胡爽,等.pH值和盐浓度对金属螯合亲和层析分离人胰高血糖素样肽-1融合蛋白的影响[J].中国生物制品学杂志,2010,23(9):999-1004 Jiang J Q,Cai H B,Hu S,et al.Effects of pH value and salt concentration on purification of human glucagonlike peptide-1 fusion protein by immobilized metal ion affinity chromatography[J].Chinese Journal of Biologicals,2010,23(9):999-1004
[21]吕莹,刘静,陈湘宁.铁离子螯合亲和层析分离抗氧化活性核桃肽[J].中国粮油学报,2013,28(1):65-69 Lü Y,Liu J,Chen X N.Separation of antioxidant walnut peptides with immobilized metal affinity chromatography[J].Joumal of the Chinese Cereals and Oils Association,2013,28(1):65-69
[22]Megías M,Pedroche J,Yust M M,et al.Production of copper-chelating peptides after hydrolysis of sunflower proteins with pepsin and pancreatin[J].LWT-Food Science and Technology,2008,41(10):1973-1977
[23]张君慧,张晖,王兴国,等.抗氧化活性肽的研究进展[J].中国粮油学报,2008,23(6):227-233 Zhang J H,Zhang H,Wang X G,et al.Advancement of research on antioxidant peptide[J].Journal of the Chinese Cereals and Oils Association,2008,23(6):227-233.
Separation of Antioxidant Hydrolysates from Broad Bean Protein with Immobilized Metal Affinity Chromatography(IMAC)
Li Xuefen1Han Tao1Xia Xiaonan1Ding Ke1Bian Ke2
(College of Food Science and Engineering,Beijing University of Agriculture1,Beijing 102206)
(Henan University of Technology2,Zhengzhou 450052)
Immobilized metal affinity chromatography(IMAC)was used to separate broad bean protein hydrolysates with different copper binding ability,the relationship between antioxidant activity and the copper binding ability of broad bean protein hydrolysates was discussed as well.The results showed that the optimal conditions for metal affinity chromatography were balance buffer,0.05 mol/L sodium acetate-acetic acid(NaAc-HAc)buffer at pH 5.0,loading sample:1 mL of broad bean protein hydrolysate solution(20 mg/mL),elution buffers,0.04 mol/L imidazole.After being eluted,F1(the broad bean hydrolysates component not binding to copper column)and F2(component binding to copper column)were separated.Furthermore,copper binding abilities and antioxidant activities of broad bean protein hydrolysates,F1 and F2 were investigated.The results were shown F2>the broad bean protein hydrolysates>F1(P<0.05)in both copper binding abilities and antioxidant activities.These results presented that the stronger copper binding ability of the broad bean protein hydrolysate,the higher antioxidant activities.
broad bean,protein hydrolysates,copper binding ability,antioxidant,IMAC
TS214
A
1003-0174(2017)01-0119-06
果蔬贮藏加工营养安全研究(KCT2014025),农产品加工及贮藏工程-北京市重点建设学科资助(PXM 2014-014207-000029)
2015-05-26
李雪芬,女,1990年出生,硕士,农产品加工及贮藏
韩涛,男,1963年出生,教授,功能食品

