SUMO-β-抑制蛋白2融合基因的克隆、表达与蛋白纯化
张耀方,许艳玲,黄治强,杜莉,陈曦,付裕,李明刚
SUMO-β-抑制蛋白2融合基因的克隆、表达与蛋白纯化
张耀方1,许艳玲1,黄治强1,杜莉1,陈曦1,付裕1,李明刚2,通信作者
(1. 天津农学院基础科学学院,天津 300384;2. 南开大学生命科学学院,天津 300071)
2型糖尿病是一种常见的慢性疾病,其发生与胰岛素的耐受相关。β-抑制蛋白2 (β-arrestin2)的缺失或功能紊乱,会导致胰岛素抵抗和2型糖尿病的发生。而使用β-arrestin2进行治疗可明显缓解葡萄糖不耐受及胰岛素抵抗。本研究通过重组PCR方法,将小分子泛素相关修饰物(small ubiquitin-related modifier,与基因融合,再将融合基因插入原核表达载体pET22b中,成功构建了pET22b-表达载体,将重组表达载体转入大肠杆菌Rosetta Blue(DE3)宿主细胞,使用IPTG在温度为20 ℃诱导表达,再将诱导表达后的蛋白经Ni-NTA进行纯化,成功获得SUMO-β-arrestin2蛋白,为后续β-arrestin2药效学的研究奠定基础。
β-抑制蛋白2;糖尿病;表达;纯化
β-arrestin2是G蛋白偶联受体(GPCRs)的负调控因子,广泛地存在于动物的肝脏与肌肉中,可以阻断G蛋白信号的转导[1]。在终止GPCRs信号的同时,β-arrestin2作为一种重要的支架蛋白,可将GPCRs激活信号与多个重要的胞内信号复合物联系起来,吸引并活化其他信号通路[2]。研究发现[3],多重功能的信号蛋白β-arrestin2能与胰岛素受体形成信号转导复合体,将上游的胰岛素受体和下游的激酶信号分子偶联起来,从而促进机体对胰岛素的敏感性。而β-arrestin2水平的降低或功能缺失,可使该信号复合体不能正常形成,直接导致胰岛素抵抗和2型糖尿病的发生[4]。β-arrestin2除调控机体抗紫外应答、调控自身免疫过激反应外,还身兼一项重任——降血糖。因此,β-arrestin2蛋白及β-arrestin2蛋白/胰岛素受体复合体有望成为研发胰岛素抵抗相关的代谢性疾病治疗药物的新靶点。
研究发现,在2型糖尿病病人和小鼠的血液中,β-arrestin2均有明显的下调[4],这就暗示它的缺失很可能与糖尿病的发生密切相关;基因敲除小鼠在胰岛素的功能和糖代谢方面都存在明显缺陷,而通过静脉注射表达β-arrestin2的重组腺病毒对基因敲除小鼠进行治疗,可以有效改善胰岛素的耐受症状。本研究通过基因工程手段,将基因与基因融合,克隆至pET22b表达载体上,在大肠杆菌中进行表达,获得大量的SUMO-β-arrestin2融合蛋白,为以后β-arrestin2在2型糖尿病防治及药效学的研究奠定基础。
1 材料与试剂
1.1 菌株和质粒
大肠杆菌DH5α、大肠杆菌Rosetta Blue(DE3)、pMD18-T(含有片段和片段)、pET22b(+)由南开大学生物技术与新药实验室提供。
1.2 试剂和酶
限制性核酸内切酶、T4 DNA连接酶(购自TaKaRa公司);pfuDNA聚合酶(购自北京鼎国生物工程有限公司);Ni-NTA(购自Pharmacia 公司);引物(由生物工程有限公司合成),引物设计列于表1。

表1 引物设计
2 方法
2.1 重组原核表达载体pET22b的构建
2.1.1的PCR扩增
以基因为模版,分别以上游和为上下游引物扩增-基因。PCR产物经琼脂糖凝胶电泳进行鉴定。
2.1.2 -的PCR扩增
以-基因为模板,分别以和下游为上下游引物扩增-基因,PCR产物经琼脂糖凝胶电泳进行鉴定。
2.1.3的PCR扩增
以-基因和-基因为模板,分别以上游和下游作为上下游引物扩增融合基因。PCR产物经琼脂糖凝胶电泳进行鉴定。
2.1.4 重组pET22b载体的构建
将的PCR扩增产物和pET22b载体分别用Ⅰ和HⅠ双酶切,纯化回收目的基因片段和载体片段,用T4连接酶16 ℃连接4 h,转化大肠杆菌DH5α,接种于含Amp(100 μg/mL)的LB平板上培养过夜,挑取单克隆,提取质粒,以上游和下游为引物进行PCR鉴定,用Ⅰ和HⅠ双酶切鉴定,将鉴定正确的质粒进行测序,阳性质粒命名为pET22b。
2.2 SUMO-β-arrestin2融合蛋白的表达及鉴定
将测序正确的重组质粒pET22b转化入大肠杆菌Rosetta Blue(DE3)过夜培养,挑取单克隆菌落,接种于LB液体培养基(含100 mg/L 氨苄青霉素)中,37 ℃振荡培养过夜。再将菌液接种于新鲜LB液体培养基中,37 ℃振荡培养至600值约为0.6~0.8,加入IPTG终浓度为0.8 mmol/L,20 ℃振荡培养12 h。4 ℃离心后收集菌体。取诱导前的菌体做对照,进行SDS-PAGE分析。再用Tris-HCl重悬菌体,超声破碎,离心,取上清和沉淀进行SDS-PAGE分析。
2.3 SUMO-β-arrestin2融合蛋白的分离与纯化
先以10倍柱体积(Colume volume, CV)的Tris-HCl洗柱后上样,用2~5倍CV的Tris-HCl平衡柱体,再用2~5倍柱体积含有30 mmol/ L咪唑的Tris-HCl缓冲液液(pH 8.0)洗脱杂蛋白,最后用含有200 mmol/L咪唑的Tris-HCl缓冲液(pH 8.0)洗脱SUMO-β-arrestin2蛋白,用12%SDS-PAGE 电泳进行检测。
3 结果及分析
3.1的PCR扩增
以基因和基因为模板,分别以上游和下游作为上下游引物扩增融合基因,PCR产物经1%的琼脂糖凝胶电泳分析后,可见一条约为1 600 bp特异性DNA片段(图1),与预期片段大小(1 545 bp)相符,表明已成功获得基因。
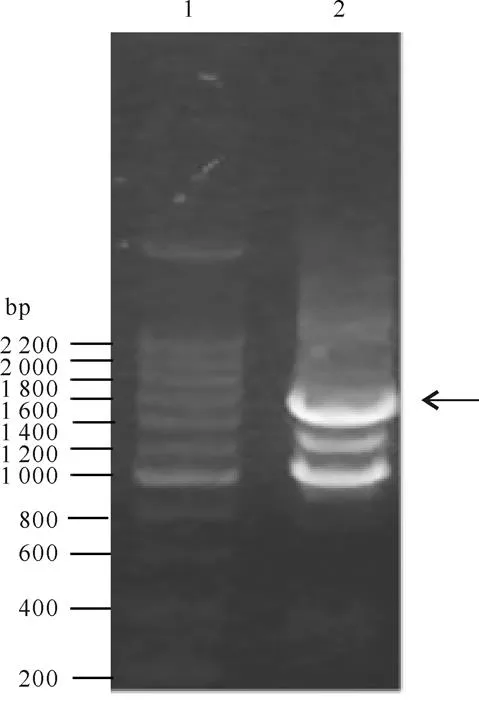
图1 PCR扩增产物
(注:泳道 1:200 bp DNA Ladder Marker;泳道 2:基因)
3.2 重组表达载体的构建
将基因连接至pET22b表达载体中,构建重组表达载体pET22b-,小量提取质粒后用Ⅰ和HⅠ双酶切鉴定,在1 600 bp处可见片段(图2),与理论预期大小(1 545 bp)基本一致,表明已成功构建重组表达载体。将重组表达质粒测序,结果证实其序列与理论序列一致。
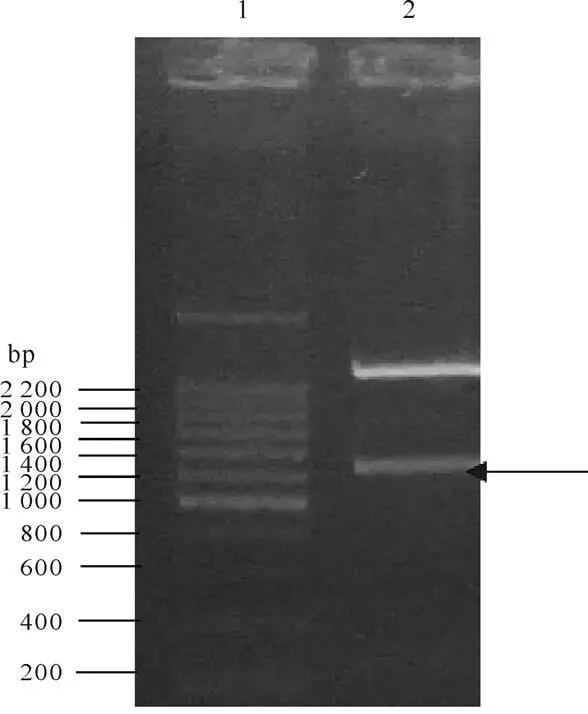
图2 重组表达载体pET22b-SUMO-β-arrestin2的双酶切鉴定
(注:泳道 1:200 bp DNA Ladder Marker;泳道2:酶切后的片段)
3.3 重组蛋白的表达及可溶性分析
将重组质粒pET22b-转化入大肠杆菌Rosetta Blue(DE3)中,用0.8 mmol/L IPTG于20 ℃诱导12 h,将表达菌体超声破碎后,12 000 r/min离心30 min,收集上清及沉淀,沉淀用等体积的裂解液溶解,经12% SDS-PAGE分析显示,在IPTG诱导后表达产物、沉淀液和上清液中均可见到目的蛋白,其相对分子质量约为58 kDa,与预期大小相符(图3)。由于在超声破碎后的上清和沉淀中均有目的蛋白出现,所以此蛋白为部分可溶。
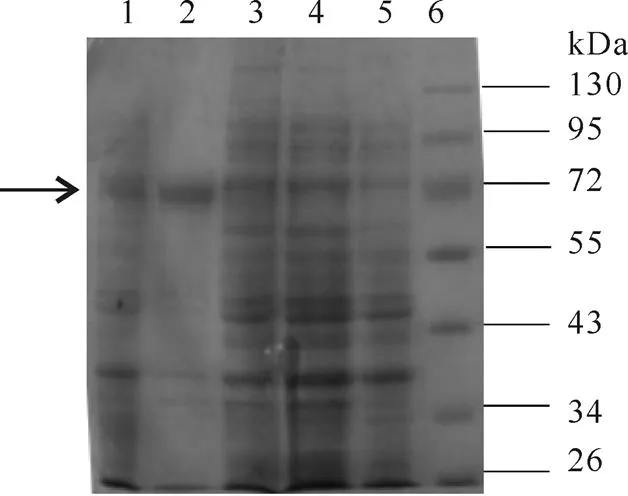
图 3 重组蛋白的表达产物的SDS-PAGE电泳分析
(注:泳道 1:IPTG诱导后表达产物;泳道 2:沉淀液;泳道 3,4:上清液;泳道5:诱导前;泳道 6:蛋白Marker)
3.4 SUMO-β-arrestin2重组蛋白的纯化
将诱导表达后破碎的上清液经Ni离子亲和层析纯化,使用200 mmol/ L咪唑洗脱目的蛋白,经12% SDS-PAGE电泳检测,可见纯度较高的目的蛋白(图4)。

图4 SDS-PAGE 电泳分析纯化后的SUMO- β-arrestin2蛋白
(注:泳道 1:诱导前;泳道 2:上清液;泳道 3:纯化后的SUMO-β-arrestin2蛋白;泳道4:蛋白Marker)
4 讨论
胰岛素抵抗会引发2型糖尿病的发生[5],β-arrestin2可以促进机体对胰岛素的敏性,β-arrestin2蛋白及β-arrestin2蛋白/胰岛素受体复合体可以缓解胰岛素抵抗及2型糖尿病发生。
本研究将基因直接连入pET22b 载体中进行诱导表达,未见表达产物。大肠杆菌表达系统是目前最常用的蛋白表达系统之一,但是在外源基因表达的过程中,常常会遇到表达效率不高和产率较低的问题。影响外源基因表达因素有很多,如cDNA密码子的选用,mRNA的一、二级结构和表达产物的后加工处理等等[6]。本试验中不表达可能与cDNA密码子的选用有关。使用大肠杆菌中表达外源蛋白时最好选用大肠杆菌偏爱的密码子。因为在不同种类的生物中各种tRNA的含量有很大差别,由于密码子偏爱性不同,会因为缺乏某种或某几种 tRNA,直接导致翻译终止或错误。tRNA不足会造成翻译停顿、早期翻译停止、移码突变和氨基酸错掺等问题[6]。但是由于基因片段较长,如果将密码子都换成大肠杆菌偏爱密码子成本较高。因此,本试验通过重组PCR方法,将基因与基因进行融合,获得了融合基因,在低温诱导下表达产物为部分可溶。
SUMO作为一种小分子泛素肽,将其与靶蛋白的N端结合,不但可以帮助其正确运转和折叠,还可以提高靶蛋白的表达量和可溶性。目前,已用SUMO融合体系成功表达了多种难以表达的蛋白[7-10]。此外,SUMO标签易于切割,SUMO蛋白酶能够准确识别SUMO的三级结构,从而特异性切割目的蛋白与SUMO之间的肽键[11],而且SUMO蛋白及SUMO蛋白酶的N末端均带有6个His标签,可以与Ni-NTA极性特异性的吸附,有利于蛋白的纯化。因此,这一表达策略的建立,为β-arrestin2作为一种抗糖尿病药物的研究奠定了基础。
[1] Dewire S M,Ahn S,Lefkowitz R J,et al.Beta-arrestins and cell signaling[J].,2007,69:483-510.
[2] McDonaldP H,Chow C W,Miller W E,et al.Beta-arrestin 2:a receptor-regulated MAPK scaffold for the activation of JNK3[J].,2000,290(5496):1574-1577.
[3] Luan B,Zhao J,Wu H,et al.Deficiency of a β-arrestin-2 signal complex contributes to insulin resistance[J].,2010,457(7233):1146-1149.
[4] 裴刚.β-arrestin2 在Ⅱ型糖尿病致病机理中的作用[J].中国基础科学,2010,12(1):3-5.
[5] Lenhard J M,Gottschalk W K.Preclinical developments in type 2 diabetes[J].,2002,54(9):1199-1212.
[6] 陈冠军,邢金良,商彭,等.外源基因在大肠杆菌中表达效率的影响因素[J].世界最新医学信息文摘,2004, 3(3):1121-1124.
[7] Su Z,Huang Y,Zhou Q,et al.High-level expression and purification of human epidermal growth factor with SUMO fusion in[J].,2006,13(8):785-792.
[8] Zuo X,Mattern M R,Tan R,et al. Expression and purification of SARS coronavirus proteins using SUMO fusions[J].,2005,42(1):100-110.
[9] Malakhov M P,Mattern M R,Malakhova O A,et al.SUMO fusion and SUMO-specific protease for efficient expression and purification of proteins[J].,2004,5(1/2):75-86.
[10] Butt T R,Edavettal S C,Hall J P,et al.SUMO fusion technology for difficult-to-expression proteins[J].,2005,43(1):1-9.
[11] Marblestone J G,Edanettal S C,Lim Y,et al.Comparison of SUMO fusion technology with traditional gene fusion systems: Enhanced expression and solubility with SUMO[J].,2006,15(1):182-89.
责任编辑:宗淑萍
Cloning and Expression of SUMO-β-arrestin2 Fusion Gene and Purification of Recombinant Protein
ZHANG Yao-fang1, XU Yan-ling1, HUANG Zhi-qiang1, DU Li1, CHEN Xi1, FU yu1, LI Ming-gang2,Corresponding Author
(1. College of Basic Science, Tianjin Agricultural University, Tianjin 300384, China; 2. College of Life Science, Nankai University, Tianjin 300071, China)
Type 2 diabetes is acommon chronic disease, and it is associated with insulin resistance. Loss or dysfunction of β-arrestin2 results in the development of insulin resistance and progression of type 2 diabetes. However, administration of β-arrestin2 significantly amend glucose intolerance and insulin resistance. In this article, We fused SUMO andgene with recombinant PCR methods, and then inserted it into pET22b vector, and constructed a expression vector pET22b-successfully. A recombinant expression plasmid was expressed in Rosetta Blue(DE3)line of.with IPTG at the temperature of 20 ℃. The SUMO-β-arrestin2 fusion protein was purified with Ni-NTA successfully. Lay the foundation for subsequent pharmacodynamic research of β-arrestin2.
β-arrestin2; diabetic; expression; purify
1008-5394(2017)01-0048-04
Q813
A
2016-06-29
南开大学药物化学生物学国家重点实验室开放基金项目“重组胰高血糖素样肽-1纳米控释体的研究”(20163001);国家自然科学基金青年项目“具有开关功能胰岛素载体的制备及葡萄糖响应性的研究”(21404082);天津农学院大学生创新创业训练计划项目“多拷贝功能互补型双元促胰岛素的构建及其降糖活性的研究”(201610061074)
张耀方(1984-),女,吉林白山人,讲师,博士,主要从事生物制药方面的研究。E-mail: zhangyaofangff@126.com。
李明刚(1959-),男,山东高密人,教授,博士,主要从事生物技术与新药方面的研究。E-mail:mgl@nankai.edu.cn。

